m6A去甲基化酶FTO通过MCM3介导的细胞周期进展和HIF-1α激活稳定LINK-A发挥致癌作用

食管癌是一种高度恶性的肿瘤,2020年在全球范围内发病率排名第七,死亡率排名第六。食管鳞状细胞癌(ESCC)是食管癌最常见的组织学亚型,预后较差。化疗是食管癌的一线治疗,尤其是对于无手术指征的局部晚期食管癌患者。然而由于化疗耐药,食管癌患者的5年生存率不足20%。因此,探索关键的致癌驱动基因和阐明潜在的相关分子机制,以确定食管鳞癌有前景的治疗靶点是值得的。N6-甲基腺苷(m6A)修饰是真核生物中最丰富的内部RNA修饰,主要发生于mRNA。非编码RNA(ncRNA)的m6A修饰也在包括癌症发生在内的各种生理和病理生物过程中发挥重要作用。新证据表明,m6A修饰可在不同情况下发挥致癌或肿瘤抑制作用。然而,在癌症进展过程中,m6A修饰调控ncRNA的确切机制仍然非常模糊。缺氧诱导因子1(HIF-1)是一种氧感知转录因子。氧反应性HIF-1α亚基和组成性表达的HIF-1β亚基相互作用形成异二聚体HIF-1转录因子,在细胞对低氧的应答中起关键作用。HIF-1α的积累以及HIF-1α介导的葡萄糖转运蛋白和葡萄糖代谢限速酶的激活降低了氧化磷酸化的效率,促进了糖酵解。虽然有报道称HIF-1α的转录激活可导致癌症代谢重编程和治疗抵抗,但lncRNA在食管鳞癌中调节HIF-1α激活的机制仍不清楚。该研究发表在《Cell Reports》,IF:9.995。
技术路线

主要研究结果
1. FTO稳定LINK-A并与化疗耐药相关
为了研究在食管鳞癌化疗耐药背景下关键lncRNA的m6A修饰,研究者收集了34例接受新辅助化疗的食管鳞癌患者的基线样本(17例化疗耐药和17例化疗敏感),然后测定了两种主要的m6A去甲基化酶FTO和ALKBH5的mRNA表达水平。与化学敏感样本相比,在化学耐药样本中显著上调(图1A,B)。此外,研究者测定了FTO在先前建立的亲本和化疗耐药ESCC细胞系中的蛋白水平与相应亲本细胞相比,FTO蛋白表达在两个化学耐药细胞系中上调(图1C)。与化疗耐药细胞中FTO表达上调一致,m6A斑点杂交实验结果显示,与亲本细胞相比,化疗耐药细胞中m6A的总体水平降低(图1D)。随后,为了进一步识别FTO调控的lncRNA,研究者在两个食管鳞癌细胞系中沉默和过表达FTO,然后测量了14个注释的ncRNA的表达水平,这些ncRNA先前在化疗耐药的食管鳞癌细胞系中显著高于相应的亲本细胞系4个ncRNA(TTLL3、LINC00663、PRSS30P、CETN4P)的表达低于实时荧光定量pcr的检测限。在其余的10个ncRNA中,只有LINK-A在KYSE30和KYSE450细胞中在FTO敲低后显著下调,在FTO过表达后显著上调(图1E,F)。
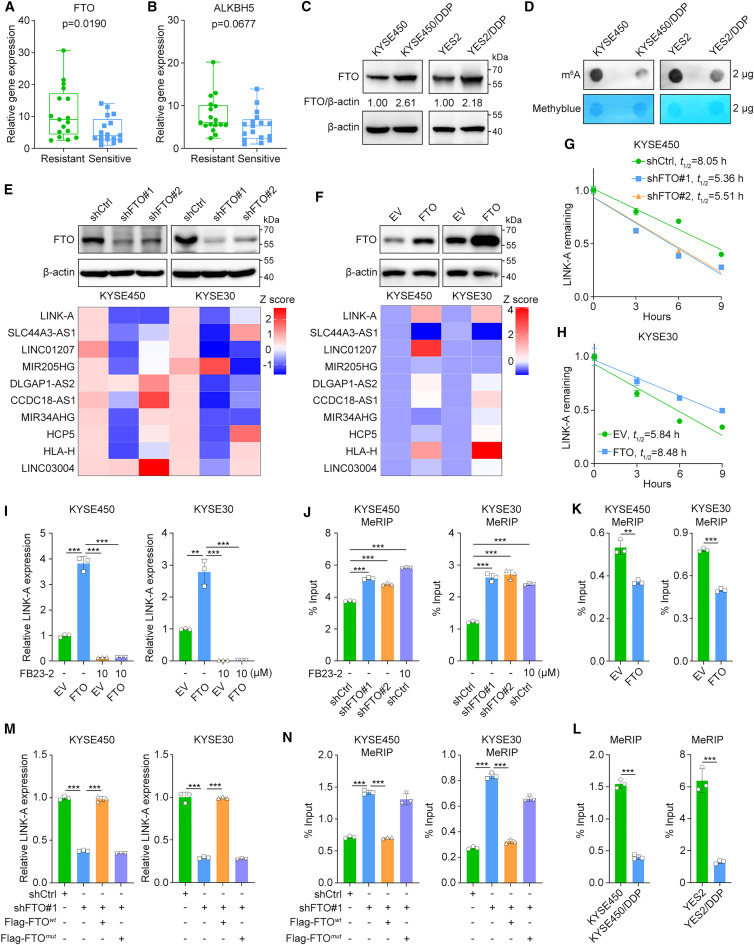
图1 FTO稳定LINK-A并与化疗耐药相关
接下来,研究者进行了RNA稳定性分析,发现FTO敲低显著缩短了LINK-A的半衰期,而FTO过表达稳定了LINK-A(图1G,H)。随后,研究者用FTO抑制剂FB23-2处理对照组和过表达FTO的KYSE30和KYSE450细胞。FTO过表达显著增加了LINK-A的表达水平,而FB23-2处理则减弱了这一作用(图1I)。此外,研究者还确定了FTO对LINK-A的稳定是否依赖于其去甲基化酶活性。甲基化RNA免疫沉淀(MeRIP)-qPCR结果表明,FTO敲低和FB23-2处理均显著增加,但FTO过表达降低了LINK-A的m6A水平(图1J,K)。与这一发现一致,MeRIP-qPCR结果显示,与亲本细胞相比,化疗耐药细胞中LINK-A的m6A水平显著降低(图1L)。实时qPCR结果表明,在KYSE30和KYSE450细胞中,野生型但未突变的FTO逆转了FTO敲低引起的LINK-A表达下降(图1M)。此外,MeRIP-qPCR结果表明,在FTO沉默的KYSE30和KYSE450细胞中,野生型FTO转导导致LINK-A甲基化水平显著降低,而这种去甲基化在FTO突变体转导后未发生(图1N)。这些结果表明FTO以m6a依赖的方式稳定LINK-A的表达。
2. LINK-A在食管鳞癌中具有致癌作用
为了研究LINK-A在食管鳞癌中的作用,研究者通过原位杂交分析了LINK-A在食管鳞癌患者队列中的表达。生存分析表明,高LINK-A表达与不良预后强相关(图2A)。此外,LINK-A在癌组织中的表达显著高于正常组织(图2B)。此外,在GEO数据库中验证了LINK-A在癌组织中的显著上调(图2C)。为了进一步评估LINK-A作为食管鳞癌治疗靶点的潜力,研究者使用了体外化疗耐药模型。研究者测定了长期诱导化疗耐药的食管鳞癌细胞(KYSE450/DDP和YES2/DDP)和相应亲本细胞(KYSE450和YES2)中的LINK-A表达水平,发现与亲本细胞相比,化疗耐药细胞中的LINK-A表达显著上调(2~5倍)(图2D)。为了确定LINK-A在药物短期暴露反应中的变化,研究者用顺铂(DDP)处理ESCC细胞不同时间(0、6、12和24 h)。随着DDP处理时间的增加,LINK-A的表达显著增加,尤其是在处理24 h后(图2E)。这些结果表明,LINK-A可能在化疗耐药的获得和维持中起着至关重要的作用。
最后,异种移植实验表明,在KYSE450/DDP和KYSE450细胞中沉默LINK-A显著延缓了肿瘤生长并诱导了化疗敏感性,而在KYSE150细胞中过表达LINK-A显著促进了肿瘤生长和对细胞毒性化疗的耐药性(图2F-K)。综上所述,这些结果表明,LINK-A在食管鳞癌中起着致癌作用。

图2 LINK-A在食管鳞癌中发挥致癌作用
3. LINK-A通过促进MCM3与CDK1的相互作用促进MCM3磷酸化
为了进一步阐明LINK-A致癌的下游调控机制,研究者通过质谱分析鉴定了KYSE450和YES2细胞中LINK-A沉淀的蛋白质。在KYSE450和YES2细胞中分别鉴定出43和14种LINK-A相互作用蛋白,并且在两个细胞系中均鉴定出其中7种相互作用蛋白(图3A)。在这7个重叠蛋白中,MCM3已被报道在细胞周期进程和DNA复制中发挥重要作用,但其在食管鳞癌中的详细分子机制,特别是介导癌细胞增殖和化疗耐药的机制尚不清楚。接下来,研究者进行了RNA pull-down和蛋白质印迹,以确认MCM3和LINK-A的义链而不是反义链之间的特异性相互作用(图3B)。此外,研究者通过RIP-qPCR在KYSE30和KYSE450细胞中验证了这种相互作用(图3C)。接下来,研究者探究了LINK-A对其相互作用蛋白MCM3表达的影响。敲低或过表达LINK-A均不影响MCM3的mRNA或蛋白水平(图3D,E)。值得注意的是,蛋白质印迹分析表明,LINK-A显著促进MCM3在Ser112的磷酸化(图3D,E)。此外,在瞬时LINK-A过表达后,MCM3 Ser112的磷酸化水平以剂量依赖的方式增加(图3F,G)。
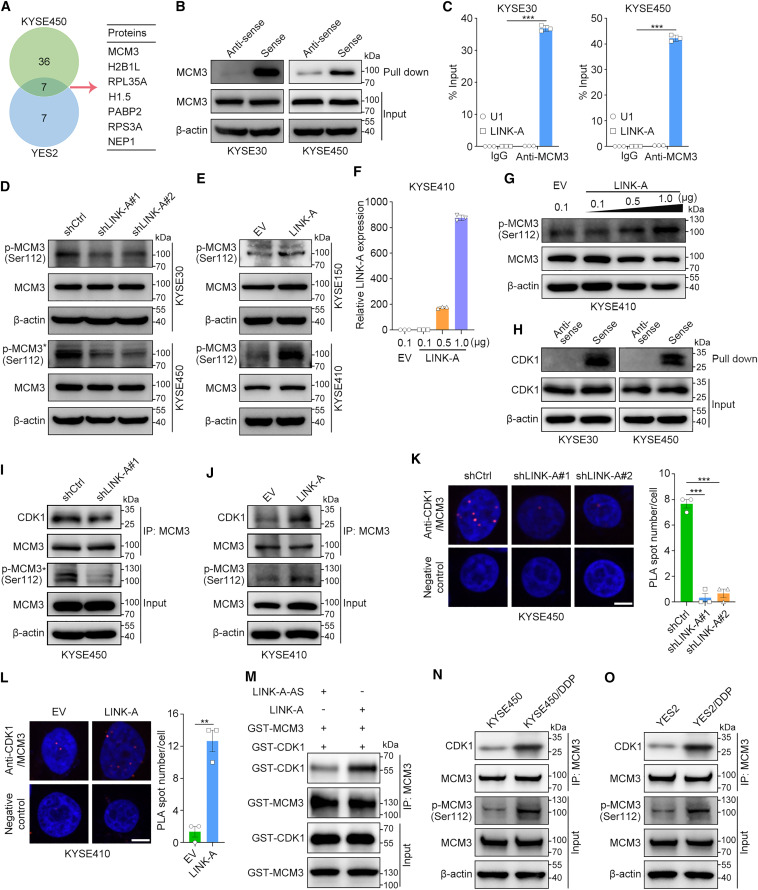
图3 LINK-A通过促进MCM3与CDK1的相互作用促进MCM3磷酸化
先前的研究报道,CDK1在112位丝氨酸磷酸化MCM3,并介导MCM2-7复合物的组装和染色质装载然后研究者确定了LINK-A是否通过作为CDK1和MCM3的支架来促进MCM3的磷酸化。RNA pull down和随后的蛋白质印迹结果证实了KYSE30和KYSE450细胞中LINK-A和CDK1之间的相互作用(图3H)。接下来,免疫共沉淀(coIP)实验的结果表明,敲低LINK-A显著抑制和过表达LINK-A增加了CDK1和MCM3之间的相互作用(图3I,J)。邻近连接实验结果证实,在体内,LINK-A促进了CDK1和MCM3之间的相互作用(图3K,L)。此外,研究者使用纯化的MCM3和CDK1蛋白在含有LINK-A有义或反义链的缓冲液中进行了体外pull-down实验。结果表明,LINK-A有义链而非反义链的存在促进了MCM3和CDK1的体外相互作用(图3M)。与此一致的是,与相应的亲本细胞系相比,MCM3在Ser112的磷酸化以及CDK1和MCM3之间的相互作用在两种耐药细胞系中都增加了(图3N,O)。
4. 磷酸化MCM3介导了LINK-A的致癌作用
为了确定LINK-A介导的MCM3磷酸化是否促进MCM复合物的组装和随后的染色质加载,研究者进行了细胞分离,然后通过蛋白质印迹分析检测染色质结合蛋白。在ESCC细胞中,敲低LINK-A显著降低MCM2、MCM3、MCM4、MCM5、MCM6和MCM7蛋白的染色质负荷,而过表达LINK-A促进MCM2-7复合体的染色质负荷(图4A,B)。接下来,研究者构建了MCM3的Ser112位点突变体(MCM3S112A;Ser112突变为丙氨酸),并将野生型MCM3和MCM3S112A转染至去除内源性MCM3的细胞中。由LINK-A介导的MCM2-7复合物的染色质负荷增加被Ser112突变所消除,表明这一过程依赖于MCM3的磷酸化(图4C)。为了确定MCM3是否介导了LINK-A对细胞周期进展的促进作用,研究者进行了挽救试验,发现野生型MCM3的过表达完全挽救了LINK-A沉默介导的G0/G1期阻滞,而MCM3S112A没有(图4D)。相反,在LINK-A过表达的KYSE410细胞中沉默MCM3可抑制LINK-A介导的细胞周期进展(图4E)。此外,IncuCyte活细胞成像分析表明,野生型MCM3而不是MCM3S112A介导了LINK-A对细胞增殖的促进作用(图4F,G)。为了进一步证明体内MCM3和LINK-A之间的功能关系,研究者使用KYSE150细胞进行了异种移植实验。过表达LINK-A显著促进细胞增殖和化疗耐药性,而沉默MCM3则消除了这些作用(图4H,I)。综上所述,这些结果表明,LINK-A通过增加MCM3磷酸化来促进MCM2-7复合体的组装和随后的染色质加载,从而发挥致癌作用。

图4 磷酸化的MCM3介导了LINK-A的致癌作用
5. LINK-A通过从MCM3中分离HIF-1α来诱导HIF-1α转录活性
为了进一步研究LINK-A/MCM3轴导致细胞毒性化疗耐药性的机制,研究者在LINK-A沉默的KYSE450细胞中进行了RNA测序分析。引人注目的是,基因集富集分析表明,与由两个独立的短发夹RNA序列中的任何一个介导的LINK-A敲低的细胞相比,糖酵解途径在对照细胞中显著富集(图5A)。鉴于之前一项研究观察到MCM3通过直接与HIF-1α相互作用负调控HIF-1α转录活性,研究者试图确定LINK-A是否激活HIF-1α以促进肿瘤糖酵解。首先,研究者在常氧条件下,通过在LINK-A沉默的KYSE450细胞和LINK-A过表达的KYSE410细胞中进行IP实验,确定LINK-A是否影响MCM3和HIF-1α的相互作用。结果表明,沉默LINK-A显著增加MCM3与HIF-1α的相互作用,而过表达LINK-A则抑制MCM3与HIF-1α的相互作用(图5B)。此外,研究者通过GST pull-down纯化了MCM3和HIF-1α蛋白,然后在含有LINK-A的有义或反义链的缓冲液中进行了体外coIP实验。在体外,LINK-A有义链而非反义链的存在抑制了MCM3和HIF-1α之间的相互作用(图5C)。沉默LINK-A显著抑制了缺氧反应元件驱动的荧光素酶活性,而过表达LINK-A增强了低氧反应元件驱动的荧光素酶活性(图5D,E)。此外,实时荧光定量PCR结果表明,在常氧和低氧条件下,LINK-A显著促进了HIF-1α靶基因的表达,包括SLC2A1、PDK1、HK2、LDHA和血管内皮生长因子(图5F,G)。值得注意的是,与常氧条件相比,在低氧条件下,LINK-A和HIF-1α靶基因的表达显著上调(图5F,G),进一步证实了LINK-A和HIF-1α转录活性之间的功能相关性。
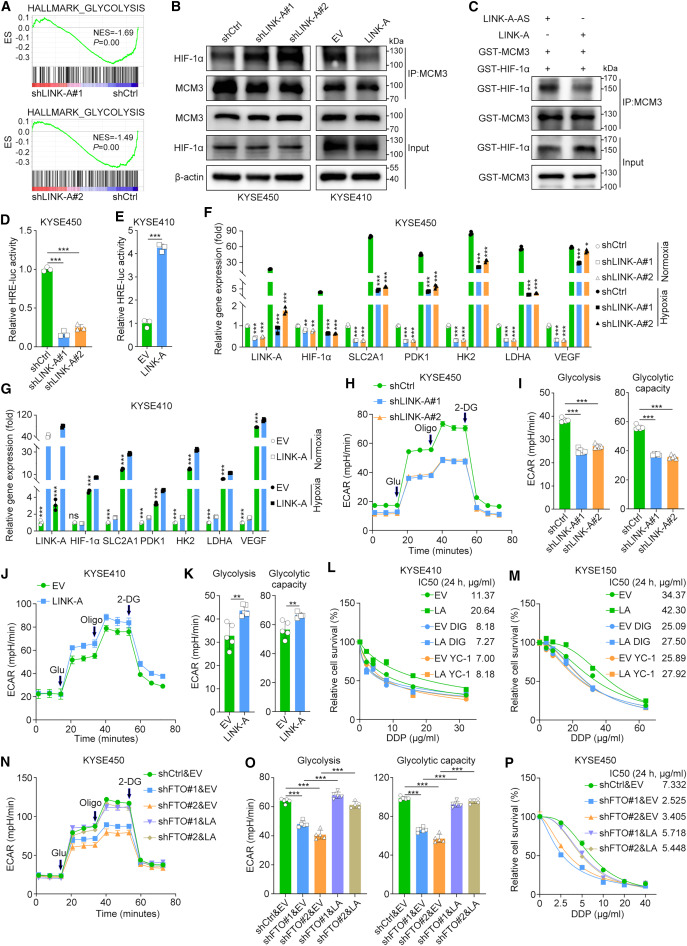
图5 LINK-A通过将HIF-1α从MCM3中分离来诱导HIF-1α转录激活
鉴于HIF-1α在癌症代谢重编程中的重要作用,研究者进行了Seahorse实验来确定LINK-A对肿瘤糖酵解的影响。敲低LINK-A显著降低了细胞外酸化率(ECAR),但适度增加了氧消耗率(OCR)(图5H,I)。同样,LINK-A过表达增加了ECAR,但降低了OCR(图5J,K)。进一步研究HIF-1α是否介导LINK-A在食管鳞癌化疗耐药中的作用。细胞活力测定结果表明,HIF-1α抑制剂lificiguat(YC-1)和Digoxin处理显著抑制了KYSE410和KYSE150细胞中LINK-A的致癌作用(图5L,M)。综上所述,这些结果表明,LINK-A通过消除MCM3介导的HIF-1α转录抑制来激活HIF-1α,进而促进糖酵解和化疗耐药。Seahorse检测的结果显示,FTO敲低后糖酵解活性显著降低,随后在LINK-A过表达后观察到这种降低的逆转(图5N,O)。与这一发现一致,在FTO沉默细胞中过表达LINK-A恢复了增殖减少和化疗耐药性降低的表型(图5P)。
6. 靶向LINK-A可使食管鳞癌对细胞毒性化疗增敏
为了确定靶向LINK-A是否为食管鳞癌有前景的治疗策略,研究者建立了3个PDX模型。腺相关病毒介导的LINK-A沉默显著增加了ESCC pdx对DDP的敏感性(图6A-F)。最后,研究者在图1A所示的相同基线样本中测定了LINK-A的转录水平。结果表明,与化疗敏感样本相比,化疗耐药样本中LINK-A的表达水平显著上调(图6G)。进一步的相关性分析显示,在这些样本中,LINK-A的表达与FTO的表达呈正相关(图6H),进一步证实了在ESCC化疗耐药过程中FTO对LINK-A的调控作用。综上所述,研究者的研究结果证实了LINK-A是食管鳞癌化疗耐药的罪魁祸首,揭示了LINK-A介导食管鳞癌化疗耐药的潜在机制以及LINK-A在食管鳞癌化疗耐药中的稳定性调节。
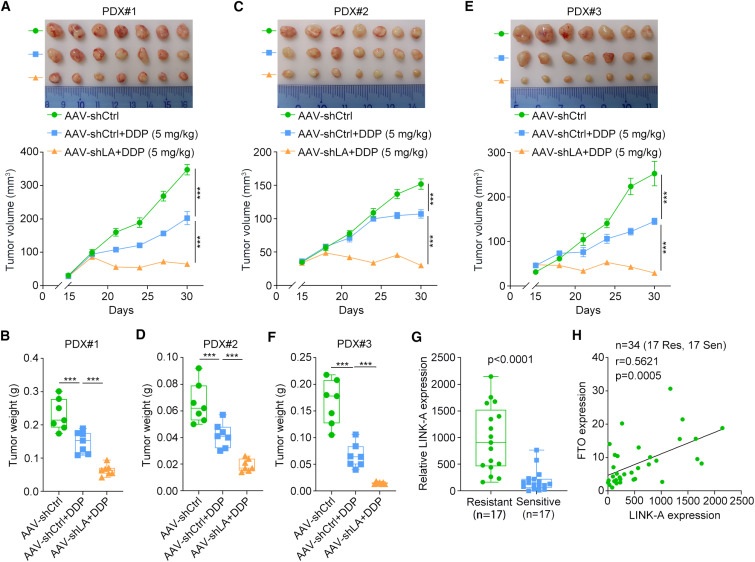
图6 靶向LINK-A使食管鳞癌对细胞毒性化疗增敏
结论
该研究揭示了食管鳞癌细胞中LINK-A的m6A去甲基化的细节。m6A去甲基化酶FTO介导了LINK-A的稳定并支持其致癌作用。LINK-A与MCM3之间的直接相互作用不仅增加了CDK1介导的MCM3 Ser112的磷酸化,从而促进MCM2-7复合体的组装和染色质负载,以及随后的细胞周期进展和细胞增殖,而且还从MCM3介导的转录抑制中释放HIF-1α,从而促进肿瘤代谢重编程和化疗耐药。综上所述,该研究结果提示FTO/LINK-A/MCM3/HIF-1α轴在食管鳞癌的进展中起着至关重要的作用,这一发现为靶向LINK-A在食管鳞癌患者,尤其是LINK-A高表达患者中的治疗提供了潜在的策略。
机制图

实验方法
慢病毒的产生和感染,细胞活力测定,活细胞成像,细胞周期分析,蛋白质印迹,RT-qPCR,m6斑点印迹测定,RNA pull-down,RIP,mRNA稳定性测定,双荧光素酶报告基因检测,FISH,IF染色,海马检测,RNA-seq和数据分析,小鼠实验
参考文献
Nan Y, Liu S, Luo Q, Wu X, Zhao P, Chang W, Zhang R, Li Y, Liu Z. m6A demethylase FTO stabilizes LINK-A to exert oncogenic roles via MCM3-mediated cell-cycle progression and HIF-1α activation. Cell Rep. 2023 Oct 18;42(10):113273. doi: 10.1016/j.celrep.2023.113273.






