骨髓祖细胞中NEK2的高表达抑制多发性骨髓瘤患者的T细胞免疫
多发性骨髓瘤(MM)的生长是由免疫耐受骨髓微环境支持的。在这里,作者发现肿瘤微环境细胞中有丝分裂基因A(NIMA)相关激酶2(NEK2)中Never的缺失与MM生长抑制有关。NEK2的缺失导致肿瘤相关的巨噬细胞(TAMs)和抑制性T细胞的减少。髓系祖细胞中NEK2的表达在MM条件培养基刺激下促进功能性TAMs的产生。在临床上,MM细胞中NEK2的高表达与CD8+ T效应记忆细胞的增加有关,而NEK2的低表达与IFN-γ基因标记和激活的T细胞反应有关。抑制NEK2可上调MM细胞和髓细胞中PD-L1的表达。在小鼠模型中,NEK2抑制剂INH154与PD-L1抑制剂联合使用可有效消除MM细胞并延长生存期。作者的研究结果提供了强有力的证据,证明NEK2抑制可以克服肿瘤免疫逃逸,并支持其进一步的临床开发。本文于2023.10发表于《Cell Reports Medicine》,IF:14.3;Q1。
技术路线

研究机制图
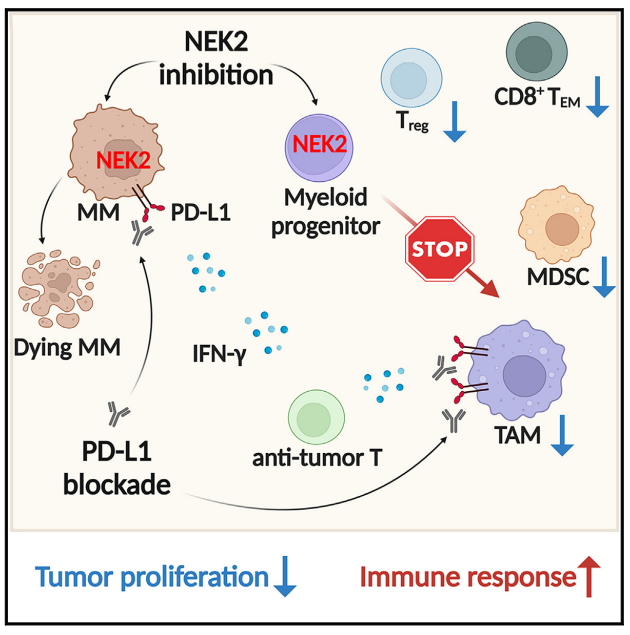
主要实验结果
1、敲除NEK2可提高Eμ-myc小鼠的存活率并诱导T细胞活化
NEK2在B细胞谱系中的过表达影响B细胞的发育。为了确定NEK2缺乏是否会抑制B细胞恶性肿瘤,作者生成了NEK2-/-小鼠。接下来,作者将NEK2-/-小鼠与Eμ-myc转基因小鼠杂交,Eμ-myc转基因小鼠是一种成熟的Myc驱动的B细胞恶性婴儿临床前模型。Eμ-myc/Nek2+/+和Eμ-myc/Nek2+/-小鼠的存活率相似(图1A)。然而,Eμ-myc/NEK2+/-小鼠的存活时间显著延长(图1A),这表明NEK2的两个等位基因的缺失延迟了B细胞淋巴瘤的进展。为了研究这些小鼠B细胞肿瘤发展的早期阶段,作者在小鼠6-8周龄时采集了血液、骨髓和脾脏样本。全血细胞计数分析显示,与Eμ-myc/Nek2+/+小鼠相比,Eμ-myc/Nek2-/-小鼠的循环延迟淋巴细胞数量减少,血小板增加(图1B)。脾脏和胸腺的重量也有所下降(图1C)。BM和脾脏B细胞亚群的流量测定进一步发现,与Nek2+/+小鼠相比,Eμ-myc/Nek2+/+小鼠的pre-B细胞和pro-B细胞增加,但成熟B细胞减少,而Eμ-myc/Nek2-/-小鼠的pre-B细胞和pro-B细胞减少,但成熟B细胞的损失不太明显(图1D)。因此,NEK2的缺失限制了Myc诱导的淋巴瘤发生。
为了比较Eμ-myc/Nek2-/-小鼠与Eμ-myc/Nek2+/+小鼠的转录组特征,作者收集了癌前B细胞并进行了RNA测序(图1E)。有趣的是,免疫相关通路显著上调(图1F),强烈提示缺乏NEK2与免疫激活有关。Cxcl9在抗肿瘤免疫中起关键作用,依赖于IFN-γ的产生,折叠变化最大(log2FC = 10.5)。一些抑制性免疫受体也上调,包括Cd274(编码PD-L1)。为了验证PD-L1的上调是否由于IFN-γ的激活,作者分析了小鼠B细胞中IFN-γ信号的下游靶点。与Eμ-myc/Nek2+/+小鼠相比,Eμ-myc/Nek2-/-小鼠中JAK/STAT1/IRF1信号显著激活(图1G和1H)。最后,为了确定荷瘤和非荷瘤小鼠Nek2+/+和Nek2-/-的T细胞激活状态,作者进行了流式细胞术。与无肿瘤小鼠相比,Eμ-myc/Nek2+/+小鼠的CD8+原始T细胞(TN)受到抑制,但Eμ-myc/Nek2-/-小鼠未观察到这种损失(图1I)。另一方面,CD8+TEM显示相反的情况(图1I)。而PD1在T细胞上的表达无明显变化。这些数据表明,在NEK2敲除的Eμ-myc小鼠中,T细胞反应较少被驱动为效应记忆表型,并且存在针对Myc诱导的B细胞恶性肿瘤的改善的T细胞免疫反应。
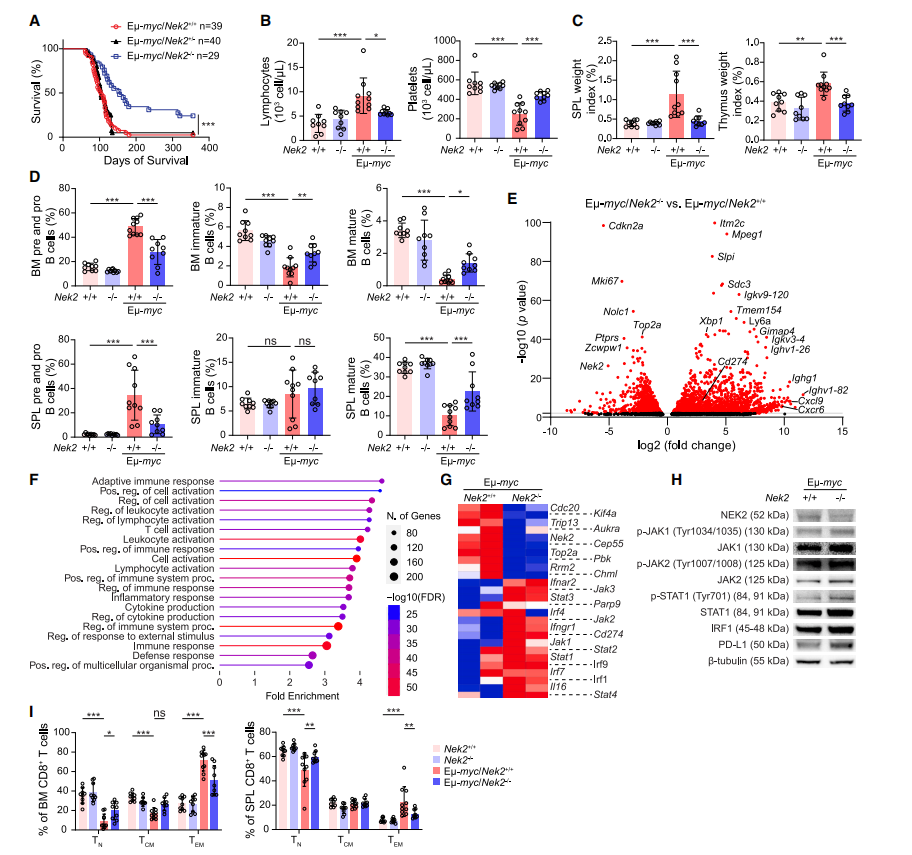
图1 敲除NEK2可提高Em-myc小鼠的存活率并诱导T细胞活化
2、NEK2缺失可减少肿瘤相关巨噬细胞和Tregs
为了确定肿瘤微环境细胞中NEK2的缺乏如何促进肿瘤抑制和免疫调节,作者测试了NEK2-/-小鼠中5TGM1 MM细胞的生长情况,并将其与NEK2+/+窝鼠进行了比较(图2A)。在Nek2-/-小鼠中接种5TGM1 MM细胞可降低血清IgG2b水平,延长存活时间(图2B和2C)。采用单细胞RNA测序(scRNA-seq)技术研究BM细胞的细胞多样性和转录组。使用标准数量控制,作者共分析了30284个BM细胞。将细胞投射到二维均匀流形近似和投影(UMAP)图上,作者发现了17个不同的细胞簇(图2D)。5TGM1 MM细胞通过高表达Sdc1(编码CD138)被鉴定,并且只出现在5TGM1注射小鼠中。通过小鼠血清IgG2b水平测量,scRNA-seq显示5TGM1/Nek2-/-组(40%)与5TGM1/Nek2+/+组(60%)相比,BM中MM细胞的百分比较低(图2D)。在5TGM1 MM细胞注射小鼠中,正常浆细胞和pro-B细胞簇显著减少,表明MM存在正常B细胞发育缺陷。这与最近的一篇报道一致,MM患者显示正常浆细胞百分比降低。骨髓细胞是骨髓中最丰富的免疫细胞。与Nek2+/+小鼠相比,荷瘤Nek2+/+小鼠的巨噬细胞簇增加了3.6倍。
一个有趣的发现是,除了MM细胞和pro-B细胞外,NEK2在骨髓细胞和单细胞簇中表达最丰富(图2E)。为了鉴定巨噬细胞集群中5TGM1/Nek2+/+和5TGM1/Nek2-/-组之间的差异表达基因,共鉴定出56个上调基因和43个下调基因(图2F)。KEGG通路分析显示,5TGM1/Nek2-/-巨噬细胞中的铁凋亡、破骨细胞分化和细胞周期减少(图2G)。作者观察到,与5TGM1/Nek2+/+小鼠相比,5TGM1/Nek2-/-小鼠的微计算机断层扫描(μCT)显示骨病变减少(图2H),TRAP染色显示5TGM1/Nek2-/-小鼠的胫骨破骨细胞数量减少(图2I)。5TGM1/Nek2-/-巨噬细胞在抗原进程和呈递、Fc γ R介导的吞噬、NOD样受体信号通路和趋化因子信号通路中表现出阳性富集(图2J)。为了进一步分析各组间巨噬细胞的表型差异,根据高可变基因的表达,共将740个巨噬细胞投影到UMAP图上,并鉴定出四个巨噬细胞亚群(图2K)。M-1亚群(Cirbp、Nfil3、Mt1、Apoe)、M-2亚群(CD36、Bcl2a1b)、M-3亚群(S100a9、S100a8、Lcn2)主要出现在荷瘤组,而这些基因在5TGM1/Nek2-/-组中被抑制,其特征是被免疫抑制(Apoe、S100a9、S100a8)、巨噬细胞失活(Lcn2)、抗凋亡(Bcl2a1b)相关基因所控制(图1K)。以抗原呈递(Cd74)、巨噬细胞活化(Adgre4、Adgre5)和化疗趋向性(Ccr2、Csf1r、Cx3cr1)相关基因为特征的M-0(Cd74、Ace、Adgre4)亚群在所有组中保持不变(图2K)。NK/T细胞群比较(共627个细胞)显示T-1(CD4, Foxp3, Ctla4)亚群显著增加,其特征是与衰竭相关的基因(Foxp3, Ctla4)和T细胞激活标志物(CD27, Gzmk, Gzma)的缺失(图2L),表明T调节细胞(Tregs)在5TGM1/Nek2+/+组中增加。作者得出结论,抑制NEK2可以减少TAMs和Tregs的积累。
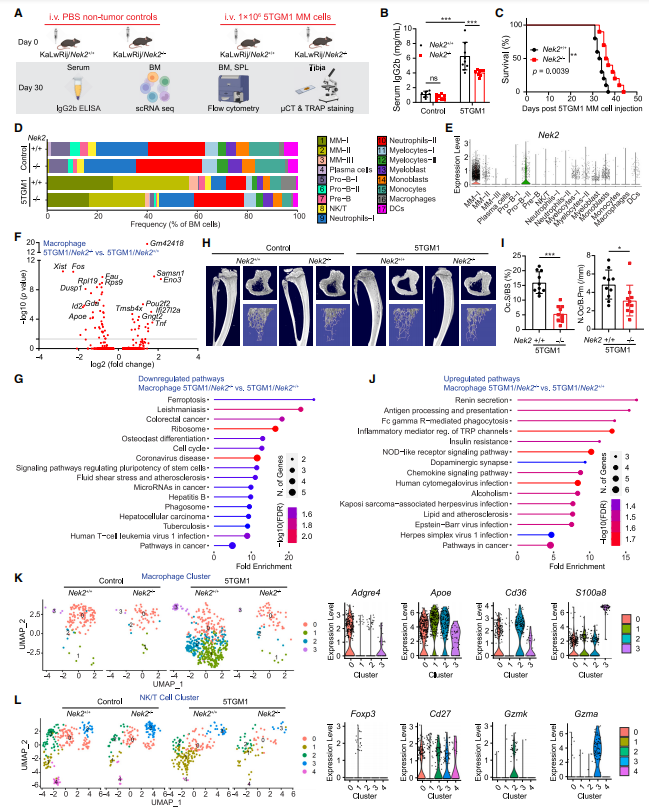
图2 NEK2的缺失会降低肿瘤相关巨噬细胞(TAMs)和Tregs
3、NEK2缺乏降低了TAMs和MDSCs的免疫抑制活性
为了证实作者的scRNA-seq发现,通过流式细胞术定量了小鼠BM和脾脏的免疫细胞群(图3A、3B、S3A和S3B)。与5TGM1/Nek2+/+小鼠相比,作者观察到5TGM1/Nek2-/-小鼠BM和脾脏中注射5TGM1 MM细胞的异常浆细胞(aPCs, CD19 - CD138+)受到抑制(图3A)。与5TGM1/Nek2+/+小鼠相比,5TGM1/Nek2-/-小鼠脾脏中Ly6Chi巨噬细胞(CD11b+ CD11c - F4/80+ Ly6Chi)、MoMDSCs(CD11b+ CD11c - F4/80 - Ly6ChiLy6G -)和G-MDSCs(CD11b+ CD11c - F4/80 - Ly6CintLy6G+)减少(图3A)。然而,在骨髓中没有观察到这些发现,因为原始小鼠骨髓可能含有大量的正常骨髓细胞,这些细胞在表型上与MDSCs无法区分。对于T细胞群,虽然在总T细胞中没有观察到明显的变化,但与5TGM1/Nek2-/-小鼠相比,5TGM1/Nek2+/+小鼠的BM中CD4/CD8细胞比例增加(图3B)。正如预期的那样,与5TGM1/Nek2-/-小鼠相比,CD4和CD8 T细胞在5TGM1/Nek2+/+中PD-1的表达均增加,这表明T细胞具有更强的抑制性(图3B)。与非5TGM1注射组相比,荷瘤组IFN-γ+或颗粒酶B+ CD8 T细胞的百分比均无显著增加,但Nek2+/+和Nek2-/-之间的差异很小或没有(图3B)。这些发现表明,微环境细胞中缺乏NEK2倾向于抑制功能性TAMs和MDSCs的产生,并减少抑制性T细胞群。
鉴于TAMs和MDSCs可以通过细胞因子从原始BM细胞诱导,作者首先在体外测试了NEK2对细胞因子诱导的TAMs和MDSCs生成的影响(图3C)。5TGM1条件培养基(CM)提高了Nek2+/+小鼠来源的巨噬细胞的细胞存活率,而Nek2-/-的巨噬细胞存活率较低(图3D)。已知NEK2调节细胞有丝分裂。作者在巨噬细胞的细胞周期中观察到类似的结果;即5TGM1 CM处理的Nek2+/+巨噬细胞与5TGM1 CM处理的Nek2-/-巨噬细胞相比,具有更高的S和G2/M群(图3E)。与未处理的巨噬细胞相比,5TGM1 CM促进了CD206的表达,而NEK2缺乏则降低了CD206的表达(图3F),表明NEK2促进了TAMs的分化。此外,与Nek2+/+小鼠诱导的TAMs相比,由Nek2-/-小鼠诱导的TAMs促进了T细胞增殖和IFN-γ的产生(图3G)。作者假设NEK2在响应肿瘤分泌因子时影响TAMs的激活。5TGM1 MM细胞与浆细胞差异表达基因的scRNA-seq分析显示Mif和Hmgb1在MM细胞中高表达(图3H)。为了研究NEK2是否能促进宏观噬菌体对MIF-PI3K-AKT30和HMGB1-STAT3信号的反应,作者进行了western blot,结果显示,与未刺激的相关巨噬细胞相比,NEK2 +/+ TAMs中p110α、p110γ、PI3K III类、p-AKT(S473)和p-STAT3 (Y705)水平升高,而这些水平在NEK2-/-TAMs中被阻断(图3I)。Nek2+/+和Nek2-/-小鼠的MDSCs中也观察到类似的结果(图3J - 3L)。这些发现表明NEK2增强了TAMs和MDSCs的免疫抑制功能。
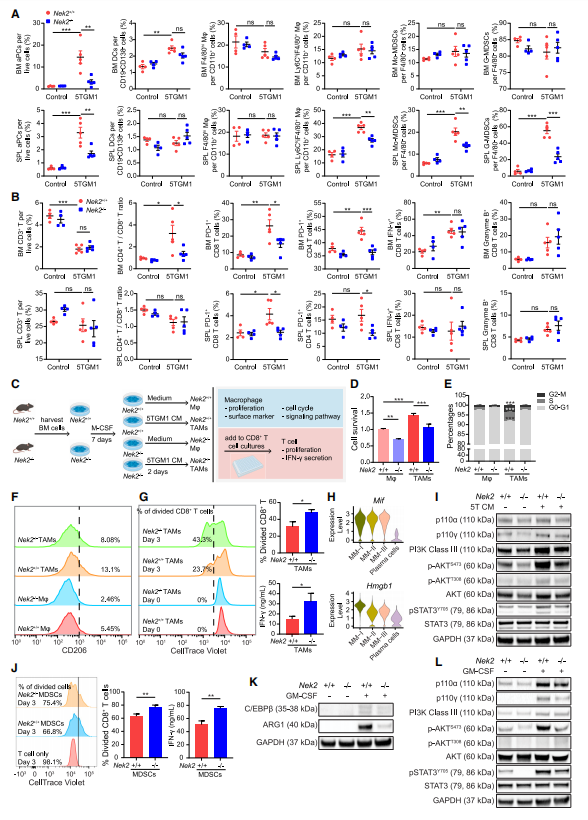
图3 NEK2缺乏降低了TAMs和MDSCs的免疫抑制活性
4、NEK2高表达的MM患者表现出T细胞反应受损
作者研究了来自堪萨斯大学医学科学(UAMS)档案(UAMS- MM)的324个MGUS、303个SMM、1049个NDMM和1066个RRMM的BM衍生的CD138选择浆细胞中NEK2基因的表达模式。与SMM和MGUS相比,NDMM中的NEK2 mRNA水平升高(图4A),RRMM中的NEK2 mRNA水平相对于NDMM进一步升高(图4A)。此外,与GEP70评分定义的低风险(LR)MM相比,HR MM中的NEK2更高(图4A)。根据基因表达模式,MM可分为7个分子亚型,其中NEK2在增殖(PR)亚型中表达最高,在超二倍体(HY)亚型中表达最低(图4B)。在多发性骨髓瘤研究基金会(MMRF)的CoMMpass数据集中,包括606个NDMM样本,证实了不同MM亚型的NEK2差异(图4B)。对UAMS-MM和MMRF CoMMpass数据的Kaplan-Meier分析显示,NEK2高表达的MM患者总生存期(OS)和无进展生存期(PFS)较差(图4C)。
为了确定NEK2表达水平与免疫效应细胞的相关性,作者使用免疫细胞面板进行了细胞计数(CyTOF)。根据NEK2在CD138选择的浆细胞中的表达情况,将BM抽吸样品分为NEK2high组(n = 6)和NEK2low组(n = 6)。为了分析免疫细胞亚型和免疫检查点表达,作者对门控CD45+细胞进行了FlowSOM分析。由于T细胞是MM患者中最丰富的细胞群,并且已报道与患者预后相关,作者进一步分析了T细胞亚群和T细胞激活状态。结果显示,大多数T细胞处于终末活化状态。其中,TEM和TEMRA细胞在CD8+ T细胞中最多,而TEM和TCM (T central memory)细胞在CD4+ T细胞中最多;CD4+和CD8+ T细胞中TN的表达最少(图4D)。NEK2low组CD8+ TEM细胞减少(图4D)。此外,PD1+ CD8+ T细胞的百分比与NEK2表达显著相关(图4E和4F)。在NEK2高表达的MM样品中观察到CD8+ T细胞增殖能力降低(图4G)。此外,CD8+ T细胞产生IFNγ与NEK2表达水平呈负相关,但未观察到TNFα和IL-6的变化(图4H)。这些结果表明NEK2是MM的预后标志物,肿瘤细胞中高NEK2与T细胞功能受损有关。
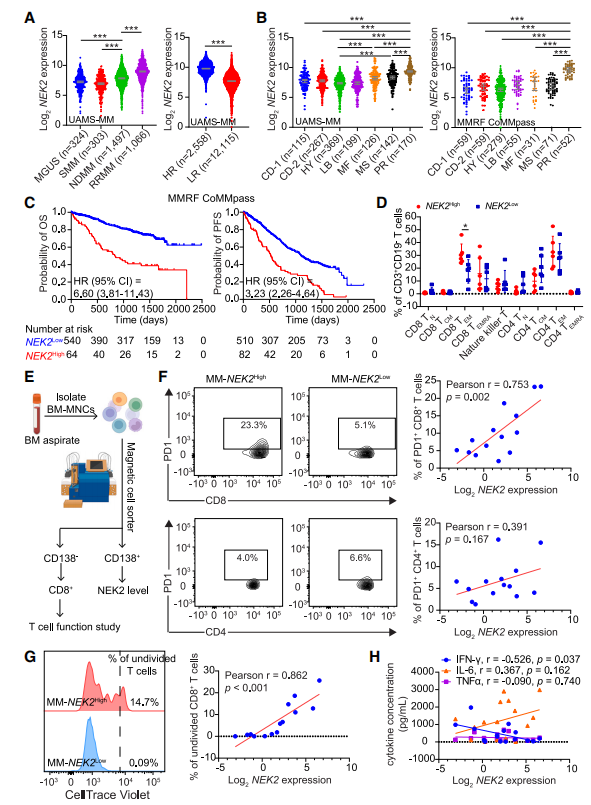
图4 NEK2高表达的MM患者表现出T细胞反应受损
5、NEK2抑制MM患者的IFN-γ/PD-L1信号通路
作者观察到IFN-γ基因特征与CIN基因特征之间呈负相关(图5A)。与作者的动物研究一致(图1G),作者还观察到,在UAMS-MM和MMRF CoMMpass数据集中,IFN-γ诱导基因CD274与NDMM样品中的NEK2表达呈负相关(图5B)。CD274在HY亚型中表达最高,在PR亚型中表达最低(图5C),这与其他研究一致,基于流式细胞检测数据显示PD-L1在超二倍体患者中增加。为了确定NEK2和CD274联合表达是否能更好地预测患者预后,作者将患者分为四组,NEK2highCD274high、NEK2highCD274low、NEK2lowCD274high和NEK2lowCD274low。Kaplan-Meier分析显示NEK2lowCD274high患者的OS和PFS最佳(图5D)。为了验证NEK2和PD-L1表达在蛋白水平上的相关性,作者对50例NDMM活检样本进行了NEK2和PD-L1的免疫组织化学(IHC)分析。绘制PD L1阳性与NEK2阳性细胞的百分比显示,NEK2和PD- L1的蛋白水平呈负相关(图5E)。这些结果表明,IFN-γ/PD-L1信号轴在高NEK2的MM细胞中受到压迫。
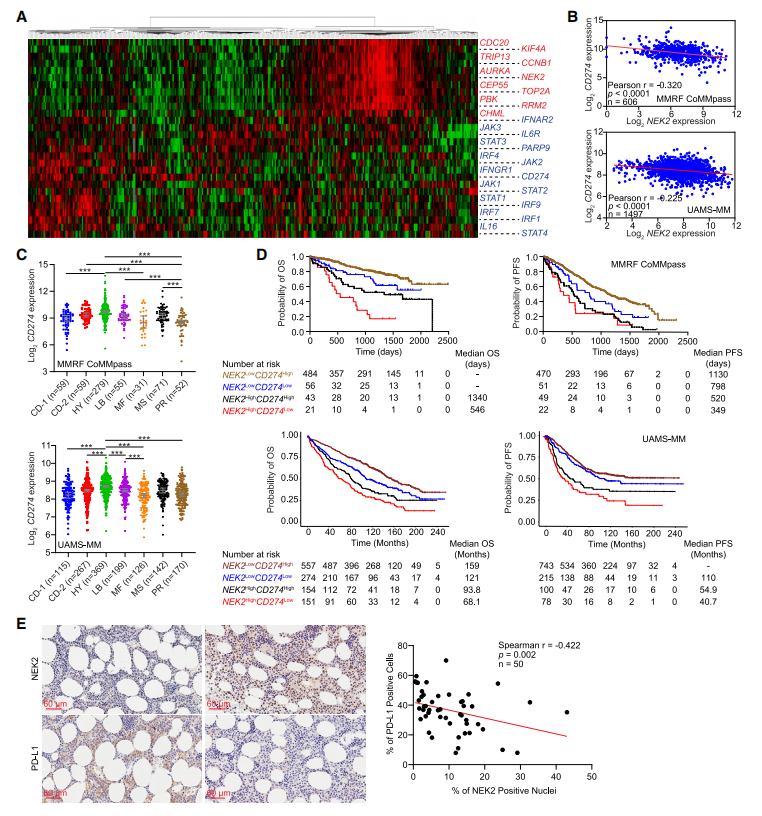
图5 NEK2抑制MM患者的IFN-g/PD-L1信号通路
6、NEK2抑制与抗PD - L1单抗联合治疗可提供治疗益处
基于NEK2抑制损害TAMs和MDSCs功能,同时上调MM细胞中PD-L1表达的发现,作者假设NEK2抑制剂INH154与抗PD-L1单抗联合使用将具有额外的治疗益处。为了验证这一假设,作者对BM-MNCs进行了体外处理(图6A)。INH154处理显著降低了CD138+ MM细胞的百分比(图6B),提示INH154选择性靶向MM细胞可能是由于其相对较高的增殖能力。PD-L1单抗对MM细胞没有明显的杀伤作用,这可能是由于抗体依赖性细胞介导的细胞毒性作用有限。PD-L1单抗可有效阻断INH154处理后MM细胞和髓细胞中PD-L1表达的增加(图6C和6D)。此外,INH154和联合治疗后,总T细胞增加,而CD8+和CD4+ T细胞占总T细胞的百分比无明显变化(图6E)。此外,在INH154和联合治疗后,PD1+ CD8+和CD4+ T细胞的百分比均下降(图6F)。这些数据表明,NEK2阻断选择性地抑制原发性骨髓瘤样本中MM细胞的生长并减少PD1+ T细胞,并且通过阻断MM和单核细胞上的PD-L1表达(NEK2抑制后PD-L1表达增加),与PD-L1单抗联合使用可提供更好的治疗效果。
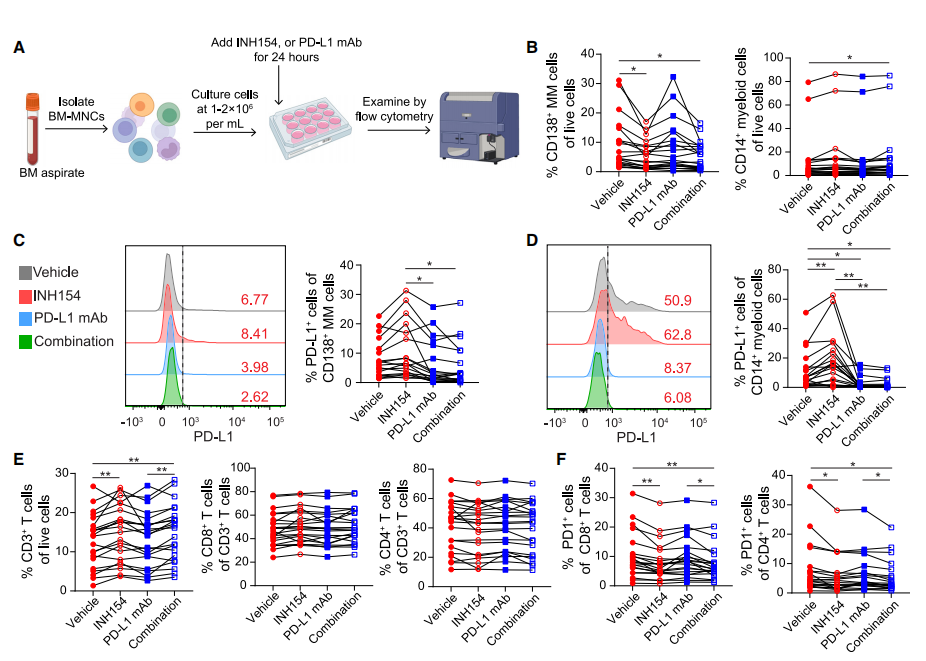
图6 NEK2抑制可提高抗pd - l1单克隆抗体(mAb)抗MM的效力
为了测试联合治疗对well-es-建立的临床前Vk*MYC MM小鼠模型的疗效,在Vk12653 MM细胞注射前1天单独或联合给药INH154和PD-L1 mAb,随后每周两次给药,持续5周(图7A)。单独治疗时,IHN154和PD-L1单抗均可降低Vk12653 MM细胞注射后第35天的血清γ-球蛋白水平,联合治疗时观察到进一步降低(图7B)。此外,Kaplan-Meier生存分析显示,联合治疗组的生存期显著延长(图7C)。INH154和PD-L1单抗处理小鼠的脾脏重量均较低,联合治疗进一步降低(图7D)。流式细胞术分析BM和脾脏中CD138+ B220 - MM细胞百分比及其PD-L1表达水平显示,联合治疗组MM细胞百分比显著降低(图7E、7F)。此外,在INH154处理后,MM细胞上PD-L1的表达略有增加,而在PD-L1单抗处理后,PD-L1的表达几乎完全被阻断(图7E、7F)。这些数据表明抑制剂INH154中的NEK2通过提高PD-L1水平和增强CD8+ T细胞活性,显著增强抗PD-L1单抗的抗肿瘤功效。
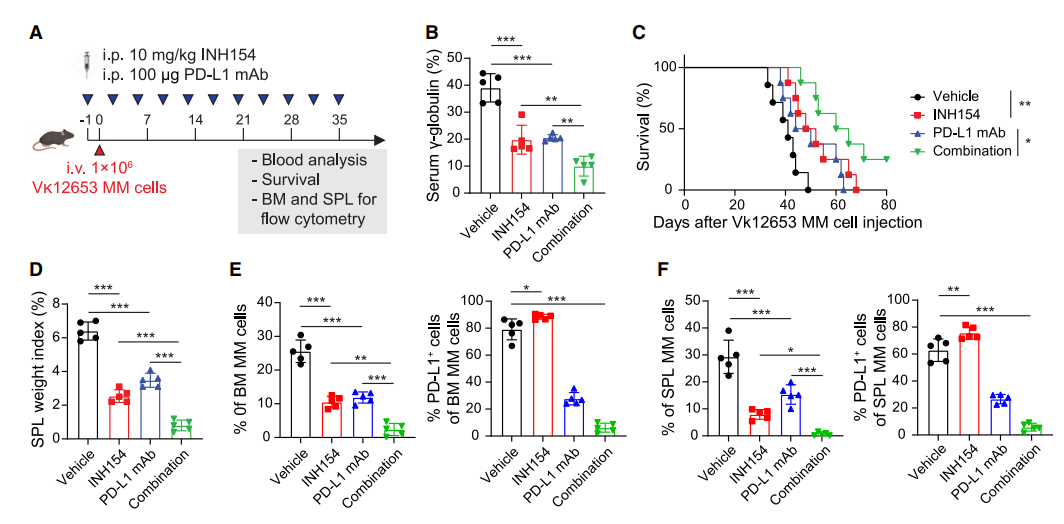
图7 联合NEK2抑制与抗pd - l1单抗治疗在MM小鼠模型中提供治疗效果
结论
研究强烈表明,在环境中阻断NEK2可以通过增强抗肿瘤免疫来延缓MM肿瘤的进展。具体来说,髓系祖细胞中NEK2的缺乏减少了功能性TAMs和MDSCs的产生,从而增强了T细胞的抗肿瘤功能。通过评估NEK2在MM免疫中的临床意义发现较高的NEK2表达与CD8+ TEM细胞频率增加有关,而较低水平的NEK2富集与PD-L1表达升高相关的IFN-γ基因特征。NEK2抑制剂INH154通过提高PD-L1水平和增强CD8+ T细胞活性,显著增强抗PD-L1单抗的抗肿瘤疗效。
实验方法
体内治疗;小鼠血清蛋白电泳;流式细胞术;Bulk RNA序列;单细胞RNA序列(scRNA-seq);生物信息学分析;微计算机断层扫描(μCT);骨组织形态计量学;体外TAMs和MDSCs生成;T细胞与TAMs或MDSCs共培养的功能测定;细胞活力和细胞周期;Western Blot;人骨髓瘤细胞的分离纯化;基因表达谱分析;实时定量PCT;人T细胞功能测定;免疫组化;细胞计数术(CyTOF);原代BM-MNCs的体外处理。
参考文献
Cheng Y, Sun F, Alapat DV, Wanchai V, Mery D, Guo W, Cao H, Zhu Y, Ashby C, Bauer MA, Nookaew I, Siegel ER, Ying J, Chen JR, Gai D, Peng B, Xu H, Bailey C, Al Hadidi S, Schinke C, Thanendrarajan S, Zangari M, Chesi M, Bergsagel PL, van Rhee F, Janz S, Tricot G, Shaughnessy JD Jr, Zhan F. High NEK2 expression in myeloid progenitors suppresses T cell immunity in multiple myeloma. Cell Rep Med. 2023 Oct 17;4(10):101214. doi: 10.1016/j.xcrm.2023.101214. Epub 2023 Oct 3. PMID: 37794587; PMCID: PMC10591052.






