TREM2巨噬细胞是乳腺癌肺转移边界的调节因子
乳腺癌仍然是妇女癌症相关死亡的主要原因之一。乳腺癌的死亡几乎都是肿瘤转移导致的。肺部是乳腺癌最常见的转移部位之一,诊断后中位生存时间不到两年。为解开乳腺癌转移的秘密,作者对免疫微环境的综合分析揭示了转移级联过程中免疫细胞分子状态的关键改变,并阐明了乳腺癌转移不同空间,不同免疫亚群的景观。本文于2023年9月发布在《Cancer Discovery》,IF=28.2。
技术路线
主要研究结果
1、乳腺癌肺转移免疫微环境详细图谱
最近的研究利用scRNA-seq鉴定了原发性乳腺肿瘤的免疫微环境。然而,大多数研究忽视了对转移灶免疫微环境的综合分析。为了确定转移微环境以及转移前生态位的异质性和可塑性的原理,作者开始在时间和空间上解剖转移相关免疫细胞在转移进展过程中的功能亚群。为此,作者利用小鼠自发性肺转移模型,将tdTomato-EO771乳腺癌细胞原位注射到乳腺(图1A)。为了模拟临床环境,手术切除原发肿瘤,随后发生自发性肺转移。作者分离并分析了不同阶段和空间区域的免疫细胞。作者收集了原发乳腺肿瘤切除前小鼠转移前生态位(pre-MET)和明显转移灶小鼠的细胞。然后,在原发肿瘤切除后,每周使用CT监测小鼠的转移情况,并在首次CT检测到转移后不久收集样本。使用tdTomato标记和显微镜检查,作者能够区分含有转移灶的肺组织和远端正常组织。还从未发生转移的小鼠身上收集细胞,归类为无复发。为了解剖和比较不同空间区域的免疫微环境,作者利用光激活GFP (PA-GFP)小鼠作为乳腺肿瘤和自发性转移的受体,从而通过应用NICHE-seq技术进行空间分析。最后,作者从对照PA-GFP小鼠的肺中分离出免疫细胞,并将来自EO771-tdTomato原发肿瘤的免疫细胞纳入图谱。对27只小鼠的63份样本进行scRNA测序。作者鉴定了9个T细胞和NK细胞群(图1B和C),包括naïve CD4和CD8细胞(CD4 Lel1和CD8 Dapl1),活化CD4 (CD4 S100a4)和CD8 (CD8 Gzmk和CD8 Gzma)细胞,功能失调的CD8 (CD8 Lag3)和Treg (Foxp3)细胞。NKs分为NK Ncr1和NK Xcl1两个种群。骨髓细胞包括树突状细胞(DC)、单核细胞、巨噬细胞和中性粒细胞(图1D)。树突状细胞分为cDC1 (Naaa)、cDC2 (CD209a)、迁移DC (migDC、Ccr7)和类浆细胞(Siglech)。单核细胞被分离成经典单核细胞(Mon Ace)和表达纤维连接蛋白(Mon Fn1)或血栓反应蛋白(Mon Thbs1)的单核细胞亚群。巨噬细胞分为肺泡巨噬细胞(Mac Cd9)、肿瘤相关巨噬细胞(Mac Cd81和Mac is20)和巨噬细胞群,作者之前鉴定为巨噬细胞调节细胞(Mregs),它们独特地表达Trem2、Gpnmb和Cd63等基因。通过S100a8表达鉴定的中性粒细胞,通过Ptgs2(编码前列腺素-内过氧化物合成酶,或COX2)、Ifit3、Lcn2和Camp的表达将其分为亚群。
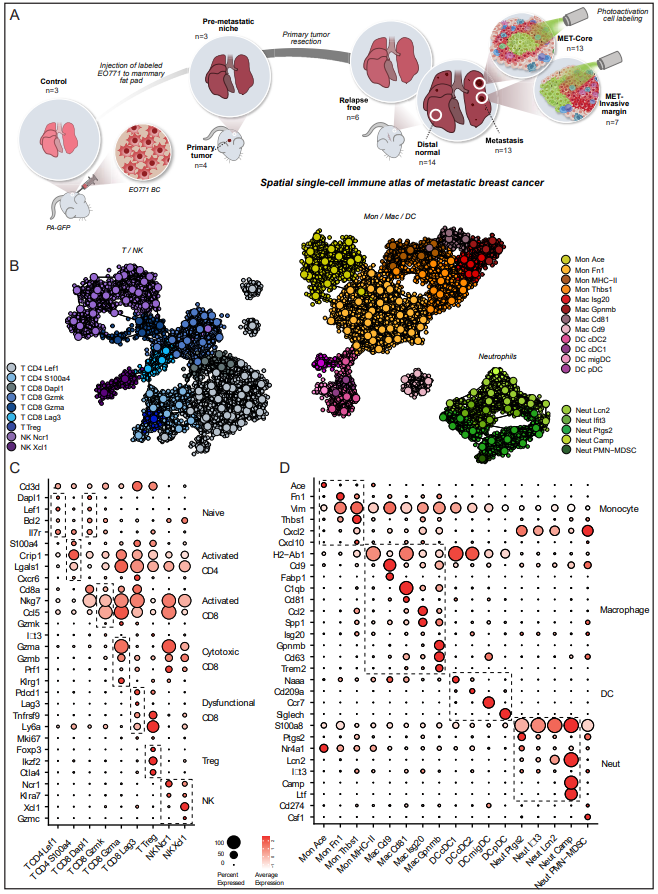
图1. 乳腺癌肺转移免疫微环境详细图谱
2、肺转移瘤和原发性肿瘤表现出不同的免疫景观
作者使用NICHE-Seq标记自发性转移模型中的特异性转移驻留细胞(图2A),比较来自原发乳腺肿瘤和肺转移核心的免疫细胞,而不是平均整个肺组织。为了确保肺组织的光激活不会引起捕获细胞的偏差,作者对对照小鼠肺组织进行了光激活,并对GFP阳性或阴性的CD31CD45+细胞进行了分类。作者在细胞类型和亚群水平上比较了转移瘤和原发肿瘤(PT)的整体免疫组成,发现原发肿瘤和转移核心的免疫景观高度不同(图2B和C)。基于细胞类型和亚群频率的主成分分析显示,这两个位置之间存在明显的差异(图2D),表明原发肿瘤的免疫景观与转移瘤的免疫景观截然不同。具体来说,通过检查主要免疫谱系的差异,作者发现与原发肿瘤相比,NK细胞增加,而B细胞和DC细胞在转移中减少(图2E)。虽然原发肿瘤与Tregs水平升高有关,但转移时活化的CD8 Gzmk细胞、CD8 Gzma、功能失调的CD8 Lag3 T细胞水平升高,活化/naïve T细胞比例总体增加(图2F和G),表明一组不同的信号塑造了转移性微环境。转移瘤和原发瘤的主要单核细胞群都是Mon Thbs1,然而,转移瘤增加了Mon Fn1的比例,减少了抗原呈递Mon MHC-II(图2H和I)。此外,虽然转移瘤被Mac is20和Mregs浸润,但原发瘤中的巨噬细胞主要是Mac Cd81群(图2J),表达补体系统基因(C1qa/b/c, Fcna), MHC-II (H2-Ab1, Cd74, Cd81),Ccl8已被证明在乳腺癌肿瘤相关巨噬细胞(tam)中富集,并支持癌细胞传播(图2K和L)。因此,转移性免疫微环境由不同的细胞亚群、途径和检查点组成,在设计临床前药物开发研究时应仔细考虑这些差异。
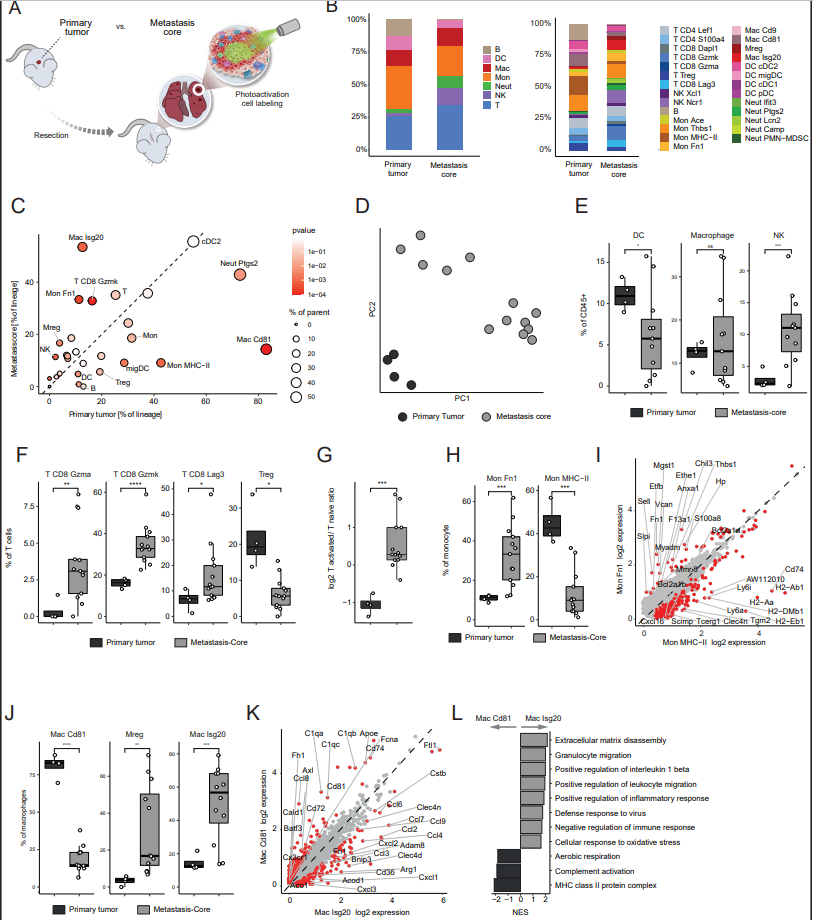
图2. 肺转移瘤和原发性肿瘤表现出不同的免疫景观
3、转移前肺微环境的特征是单核细胞和中性粒细胞的活化
为了研究转移发生前肺部免疫环境的变化,作者比较了在原发肿瘤切除前注射EO771-tdTomato细胞系第20天正常肺和荷瘤小鼠肺的免疫环境(图3)。作者发现荷瘤小鼠在这个转移前阶段就已经有了肺免疫环境的显著改变(图3B)。具体来说,巨噬细胞、B、NK和T细胞减少,而PreMET生态位中的中性粒细胞和单核细胞增加(图3C)。有趣的是,在Pre-MET微环境中,常驻(肺泡)巨噬细胞的比例急剧减少(图3C)。这些发现与先前报道的单核细胞和中性粒细胞在肺转移前转移阶段的扩增一致。为了确保作者的发现不具有模型特异性或小鼠品系特异性,作者在另外一种三阴性乳腺癌小鼠模型中进行了类似的实验。作者向WT (Balb/c)小鼠原位注射4T1-tdTomato细胞系,3周后手术切除原发肿瘤,每周进行CT监测,随访自发性肺转移性复发。值得注意的是,在注射4T1乳腺癌模型的小鼠的Pre-MET肺中,中性粒细胞的增加和T细胞的减少也很明显,这表明这种机制在肺转移生态位的形成中通常很重要。NLR在临床上被用作几种癌症适应症的预后生物标志物,高血液NLR与不良预后相关。作者的研究结果表明,这些变化是在转移级联的早期引起的,并且在转移前阶段已经起作用。除了淋巴细胞的整体减少外,作者还观察到活化的CD8 Gzmk和细胞毒性CD8 Gzma T细胞,表达颗粒酶(Gzma, Gzmb, Gzmk),Ccl4, Ccl5和Klrc1, Klrc2的减少(图3D和E)。这些发现与先前报道的转移前肺中T细胞功能障碍增加的研究一致。这些早期的免疫改变,可能是由原发肿瘤的系统信号引起的,暗示了免疫抑制在转移前生态位的形成中,可能使到达生态位的播散性癌细胞免疫逃避。Pre-MET肺中最丰富的免疫细胞是单核细胞,与对照组相比,单核细胞的增加也最高(图3B和C)。这种明显的变化与单核细胞组成的转变相吻合,其中Pre-MET中经典单核细胞(Mon Ace)被Mon Fn1群体所取代(图3F)。monfn1细胞群的特点是炎症特征,包括趋化因子受体Ccr2和Ccr1的表达增加,促进细胞募集、免疫抑制和肿瘤促进因子,如凝集素(Lgals3/9)和NLRP3炎性小体抑制剂Tmem176b(图3G)。此外,与健康肺部的经典单核细胞Mon Ace相比,Mon Fn1细胞富含细胞外基质相关因子,如Mmp8、Vcan和纤维连接蛋白(Fn1),以及细胞间粘附和脂质代谢过程(如低密度脂蛋白受体Ldlr)。这些分子谱可能表明,ECM重塑和代谢改变先于转移发生(图3H)。与单核细胞类似,在转移前的肺生态位中,中性粒细胞组成从高前列腺素表达的成熟细胞(Neut Ptgs2)转变为促炎细胞(Neut Ifit3和Neut Lcn2)(图3I)。炎症中性粒细胞上调IFN-I信号、中性粒细胞次级颗粒因子(Ngp)和中性粒细胞胞外陷阱(NET)形成所需的Padi4的表达(图3J)。基因集富集分析(GSEA)显示,与正常肺中发现的Neut Ptgs2相比,Pre-MET富集的Neut Lcn2在趋化途径、IL-1β产生和IFN-I中含量较高(图3K)。这些发现表明,中性粒细胞在转移前生态位介导炎症微环境,促进转移进展。为了评估不同免疫群体之间的相互作用,作者接下来使用CellChat算法分析了Pre-MET和对照肺免疫区间的细胞间相互作用。作者发现,除了单核细胞-中性粒细胞相互作用和单核细胞自分泌相互作用外,Pre-Met肺内相互作用强度总体降低(图3L)。具体来说,在转移前肺中上调的相互作用包括Ccl6(单核细胞)-Ccr2(中性粒细胞)信号轴(图3L)。因此,作者假设这些分泌因子可能参与单核细胞和中性粒细胞向转移前肺的募集。为了验证这一点,作者进行了transwell试验。收集对照组和转移前小鼠的肺组织,将其加工成单细胞悬液,并将肺匀浆的非细胞部分用作骨髓源性细胞的化学吸引介质(图3M)。流式细胞术分析骨髓细胞的迁移情况。作者发现,与正常肺的分泌因子相比,来自Pre-met肺的分泌因子显著增强了单核细胞(CD45+ Ly6C+)和粒细胞(CD45+ Ly6G+)的迁移(图3N)。此外,在Pre-MET肺匀浆中,CCL6的功能性抑制显著减少了单核细胞的募集(图3N),这表明该信号轴在免疫转移生态位的形成中具有功能性作用。总之,这些数据表明,在原发性乳腺癌肿瘤存在时,肺免疫环境经历了巨大的重塑,包括单核细胞和中性粒细胞特异性炎症群的涌入,而肺泡巨噬细胞、活化的T细胞和NK细胞群则减少。这些系统性的变化可能有助于形成一个适宜的微环境,有利于播散性癌细胞的播种和扩张。
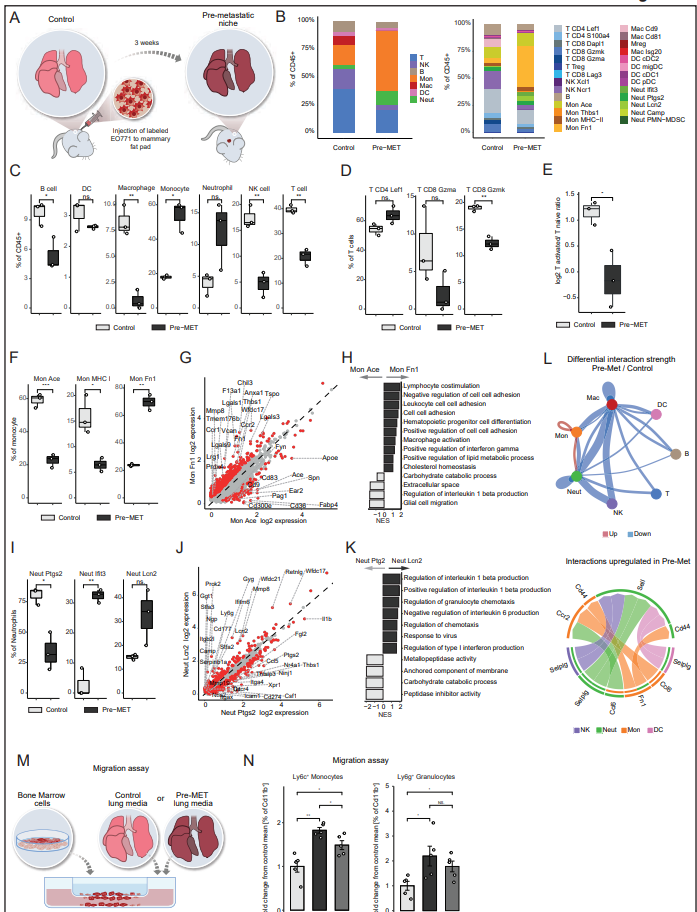
图3. 转移前肺微环境的特征是单核细胞和中性粒细胞的活化
4、不同的免疫群体定义了转移的空间生态位
为了更好地了解转移生态位的组成,作者接下来对免疫mTME生态位本身进行了表征,并分析了来自肺转移病变的细胞与同一肺远端正常组织的比较,并与对照小鼠进行了比较(图4A)。与作者在Pre-met肺中发现的免疫重塑类似,远端正常和转移组织均表现出单核细胞和中性粒细胞的富集,相反,与对照组相比,B细胞、淋巴细胞和nk的丰度较低,这代表了Pre-met表型的持久性(图4B)。有趣的是,从未发生肺转移(无复发)的小鼠肺中的免疫微环境与对照小鼠相似(图4B),进一步表明免疫mTME的重塑对于转移进展至关重要。对转移瘤和远端正常组织主要免疫谱系差异的分析显示,巨噬细胞的富集是最显著的变化(图4B)。为了更好地表征肺转移空间生态位之间的差异,作者比较了免疫亚群频率,并对不同空间区域的细胞组成进行了PCA,确定了三种组织原型(图4C)。一种由来自非肿瘤/转移小鼠的组织组成,即对照样本和无复发部位,富含淋巴细胞和NK细胞(蓝色)。第二组由Pre-met和远端正常组织组成,富含中性粒细胞和单核细胞,特别是Mon Fn1(橙色)。第三种原型由转移组织组成,富含表达IFN-I的单核细胞、巨噬细胞和抑制性Mregs(红色)。为了进一步鉴定分离转移和远端正常组织的细胞模块,作者将不同样本的组织组成进行了关联(图4D)。共识层次聚类揭示了四个单元模块。具体来说,作者确定了一个抑制性细胞模块,由功能失调的CD8 Lag3、Tregs、PMN-MDSCs、Mregs和表达Mon Thbs1和Mac is20亚群的IFN-I组成。该细胞模块仅在转移中发现(图4E)。单核细胞是远端正常组织和转移组织中最丰富的细胞类型(如PreMET),与对照组相比增加最多(图4B)。这种浸润由特定的单核细胞亚群组成。远端正常组织和转移组织都相对缺乏经典的循环单核细胞表型(Mon Ace),取而代之的是Mon Fn1群(Pre-met肺的主要成分)。转移组织也被Mon Thbs1群体高度浸润,远端正常浸润程度较小(图4F)。这种基因表达谱可能表明,转移特异性单核细胞支持初始转移灶中的炎症和血管形成过程。转移中的巨噬细胞有两个特定的转移相关巨噬细胞群,Mac is20和Mreg(图4G)。作者通过流式细胞术从对照组、Pre-MET或转移性肺中分离巨噬细胞(CD45+ F4/80+),并将其与T细胞(从naïve小鼠中分离)共培养。对T细胞增殖能力的分析显示,与从对照组或Pre-MET组织分离的巨噬细胞相比,从转移性肺组织分离的巨噬细胞能减弱T细胞的增殖(图4J)。总之,与对照肺组织相比,转移性免疫微环境的戏剧性重编程表明转移性复发影响整个器官。此外,这一过程的特点是特定区域的改变,以及在转移性肺组织中促进免疫抑制的微生态位的发展。
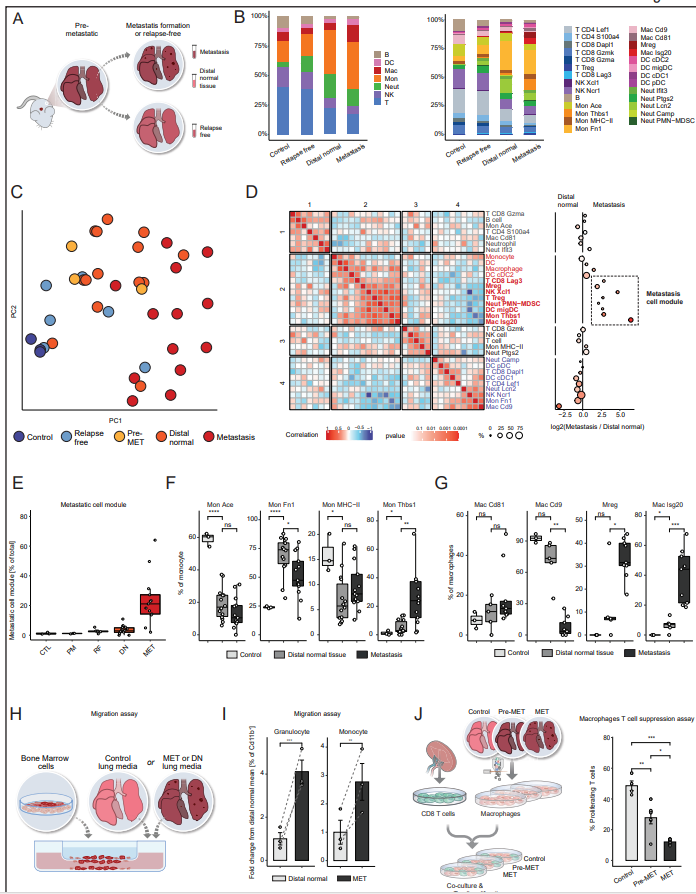
图4. 肺转移的进展与非常规免疫细胞亚型的浸润有关
5、转移性侵袭边缘以抑制TREM2巨噬细胞为特征
在几种癌症类型和小鼠模型中,肿瘤浸润边缘具有不同于肿瘤核心的特定细胞群。因此,作者接下来要问的是,在转移性病变中是否也存在类似的差异。作者的自发转移模型使作者不仅能够标记位于转移灶核心的细胞,还能够标记位于浸润边缘的细胞- tdtomato标记的转移灶周围的区域(图5A和B)。作者发现转移的核心和浸润边缘是不同的生态位,显示不同的免疫组成(图5C和D)。与远端正常组织相比,在转移组织中富集的Tregs和PMN-MDSCs实际上几乎只存在于转移核心,而不存在于浸润边缘,这表明在这些不同的转移壁位中存在独特的信号传导(图5E)。在单核细胞内,monthbs1群体高度集中在转移核心,而monfn1在转移灶浸润边缘占主导地位(图5F)。巨噬细胞亚群在转移核心和边缘之间也存在差异,Mac Isg20群体主导核心,而Mregs群体主导边缘(图5g)。Mac is20的特征是中性粒细胞趋化剂Cxcl1/Cxcl2/Cxcl3的表达,之前与转移形成有关,c型凝集素结构域家族成员Clec4d和Clec4n, Il1b和IFN-I信号基因的表达。作者的分析显示,Mreg巨噬细胞表达强有力的抑制性免疫检查点,包括Trem2、Gpnmb和Cd63(图5H)。与葡萄糖分解代谢导向的Mac is20相比,Mregs偏向于脂质分解代谢,并且在肿瘤相关巨噬细胞中表达组织蛋白酶B、D、K和S的水平升高(图5I)。具体而言,转移核心的单核细胞和巨噬细胞Ccl2、Ccl7和Ccl12的表达增加,与Ccr2表达增加相一致。单核细胞、巨噬细胞和中性粒细胞之间的Ccl6/9/-Ccr1信号轴在转移核中也上调。该轴也可以直接作用于表达Ccr1受体的癌细胞,促进它们在肺部的滞留。为了更好地阐明转移核心和浸润边缘组成的差异,作者进行了细胞模块分析,其中作者将转移核心和浸润边缘细胞的细胞群频率联系起来,揭示了四种细胞模块。模块1由浸润边缘富集cDC1、Mon Fn1、Mac Cd9和Mreg组成。模块2由核心富集的Treg、cDC2、Mon Thbs1和Mac is20组成。IFN-I信号传导对TME中的不同细胞有一系列影响,可以增加抗肿瘤免疫,也可以在信号传导持续的情况下导致免疫功能障碍。值得注意的是,核心富集的细胞模块都具有IFN-I信号基因的上调,这表明这是转移核心的一个主要特征。为了确定肺转移壁龛中空间上不同的细胞群,作者进行了一项分析,比较了转移性组织与远端正常组织的富集,以及核心与浸润边缘的富集。有趣的是,除了Mregs外,细胞群的动态是相关的。换句话说,除了Mregs外,所有转移富集的群体也在转移核心中富集。这一发现表明,Mreg巨噬细胞群位于转移灶周围,而非转移灶核心,是转移灶肺组织的标志(图5J)。有趣的是,最近也观察到Mreg人群对免疫治疗不良反应具有高度预测性。接下来,作者研究了转移性肺组织中巨噬细胞群体的特定空间域是否与它们调节T细胞激活的不同功能有关。因此,作者结合流式细胞术分析蛋白表达和scRNA-seq,使用指数排序来定义一个有效的小组,用于从转移性肺组织中分离Mreg和功能分析。作者发现从转移性肺组织中分离的Mregs显示特异性标志物的共表达,包括CD9、PDPN、TREM2、GPNMB、SPP1和IL7R。相比之下,Mac Isg20细胞没有表现出这种共表达模式(图5K)。为了进一步验证Mreg巨噬细胞在转移中的空间分布,作者使用GPNMB作为Mreg群体的标记物,对EO771乳腺癌肺转移进行了免疫荧光成像(图5M)。事实上,GPNMB+细胞主要在转移灶浸润边缘检测到。进一步验证作者的发现,在距离转移边界一定距离的间隔内定量GPNMB+细胞的百分比,证实Mregs在转移浸润边缘高度富集(图5N)。这些结果与作者之前的研究一致,表明脂肪组织或疾病相关小胶质细胞(DAM)中的TREM2+巨噬细胞存在于病理组织周围,使其免受进一步的免疫损伤。CD9+ TREM2+巨噬细胞表达GPNMB、SPP1、FABP5和CD63,在小鼠和人肺纤维化中被报道,在疤痕边缘富集。综上所述,这些结果强调骨髓间室是区分转移核心和侵袭前沿的免疫环境的主要特征,表明骨髓间室在转移浸润边缘的免疫抑制和ECM重塑中起作用,从而掩盖了转移灶抗肿瘤免疫的作用,促进了转移扩张。最后,作者想知道作者在乳腺癌肺转移模型浸润边缘富集TREM2+ Mregs的发现是否也适用于人类肺转移。为此,作者对包括乳腺癌、黑色素瘤和软组织肉瘤在内的多种癌症转移患者的肺组织切片进行了免疫荧光成像。Mreg染色分析表明,与作者在小鼠肺转移中的发现类似,TREM2+细胞在人肺转移的侵袭边缘积聚(图6A),这表明巨噬细胞亚群的特定生态位空间分布在人免疫转移生态位的形成中也起着关键作用。
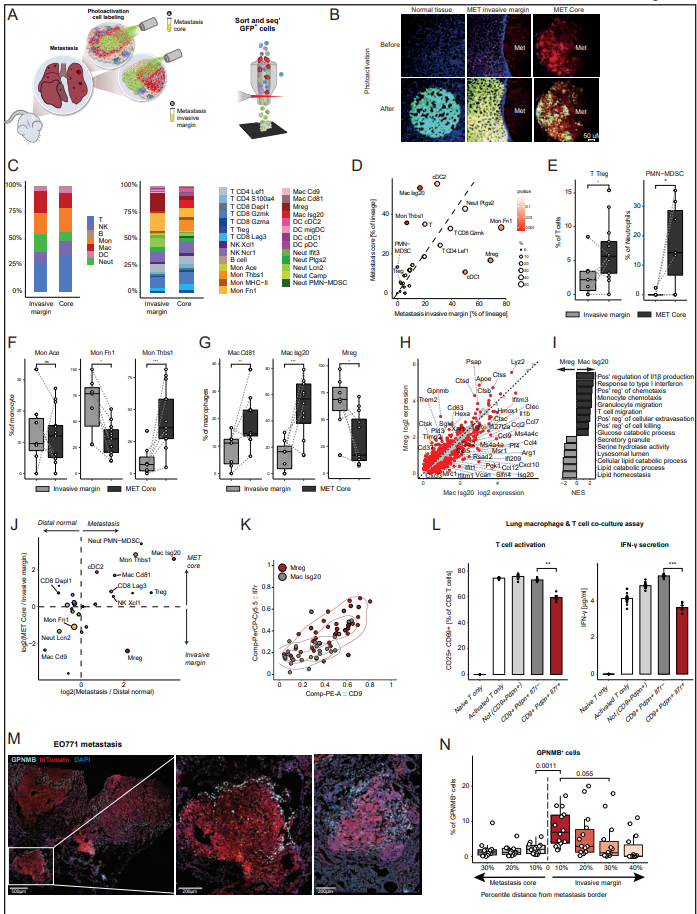
图5. 转移性浸润边缘由抑制性TREM2巨噬细胞填充
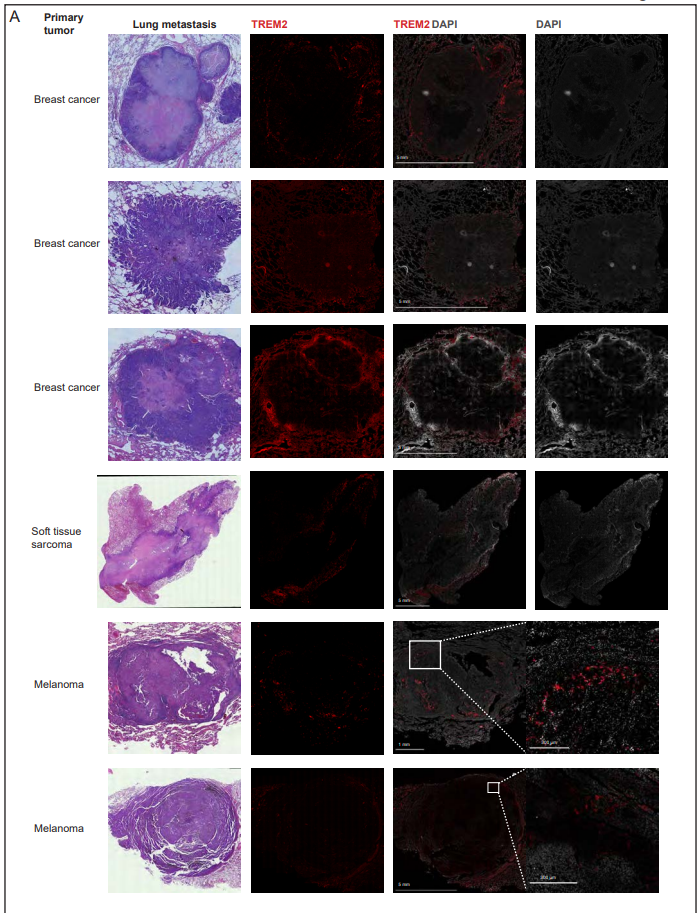
图6. Mregs积聚在人肺转移灶的浸润边缘
结论
总的来说,本研究的结果提供了对转移性肺免疫微环境的更深入了解,并强调了巨噬细胞在促进或抑制肿瘤生长和进展中的重要性。这些发现可能对开发针对转移生态位中特定巨噬细胞群体的新治疗策略具有启示意义。作者的研究结果强调了更好地了解器官特异性免疫变化的重要性,这有助于开发更准确、更有效的免疫疗法来抑制转移性复发。
实验方法
原位肿瘤移植、single-cell RNA-seq、SPID-seq、迁移实验、共培养实验、免疫荧光、生信分析
参考文献
Yofe I, Shami T, Cohen N, Landsberger T, Sheban F, Stoler-Barak L, Yalin A, Phan TS, Li B, Monteran L, Scharff Y, Giladi A, Elbaz M, David E, Gurevich-Shapiro A, Gur C, Shulman Z, Erez N, Amit I. Spatial and temporal mapping of breast cancer lung metastases identify TREM2 macrophages as regulators of the metastatic boundary. Cancer Discov. 2023 Sep 27. doi: 10.1158/2159-8290.CD-23-0299. Epub ahead of print. PMID: 37756565






