胃癌中METTL16乳酸化通过FDX1 mRNA的m6A修饰促进细胞凋亡

铜是生物体必需的微量元素,参与细胞生长和代谢。铜稳态失调与多种肿瘤相关,癌症患者血清铜水平升高与癌症分级和化疗耐药相关。如果铜的浓度超过一定的阈值,就会产生毒性,导致一种新发现的细胞死亡形式,即铜中毒。当铜直接与三羧酸循环的脂基化组分结合时,就会发生铜死亡,导致随后含铁-硫簇的蛋白质丧失、蛋白毒性应激并最终导致细胞死亡。铁氧化还原蛋白1(FDX1)编码一种还原酶,可将Cu2+还原为毒性更强的Cu1+;硫辛酸二氢硫辛酰胺S-乙酰转移酶(DLAT)是铜中毒所必需的酶。然而,细胞凋亡在肿瘤中的启动、传播和执行机制仍不清楚。m6A是真核细胞中最丰富的RNA修饰,在肿瘤发生中起着重要的作用。METTL16在多种肿瘤中以m6A依赖的方式表现出肿瘤发生和促进肿瘤的能力,但控制METTL16活性的调节机制尚不清楚。乳酸源性乳糖化是新近发现的一种翻译后修饰(PTM)。乳酸被肿瘤细胞摄取并转运到线粒体进行氧化提供能量,同时衍生组蛋白赖氨酸残基的乳糖化来刺激基因转录。组蛋白乳糖化修饰已被证明涉及多个病理过程,如巨噬细胞极化和肿瘤发生。细胞中非组蛋白的丰度和特异性仍高于组蛋白。非组蛋白是否存在大量的乳糖化修饰,以及这些乳糖化的非组蛋白如何在肿瘤进展中发挥作用和被调节,这些都亟待探索。该研究发表在《Nature Communications》,IF:16.6。
技术路线

结果
1. 胃癌组织中铜含量较高,且与肿瘤进展相关
铜死亡是由铜浓度过高引起的,但铜死亡在肿瘤中的调控机制仍需探索。由于铜主要通过胃和小肠上部吸收,因此胃肠道系统的肿瘤适合研究铜突的发生和传播。研究者分析了48对胃癌组织和癌旁组织中的铜浓度,发现胃癌组织中的铜浓度高于正常胃组织(图1a)。进一步分析发现,ⅲ期胃癌患者的相对铜含量高于ⅰ期和ⅱ期胃癌患者(图1b),表明铜含量与肿瘤进展相关。此外,铜含量与胃癌患者的总生存期(OS)和无病生存期(DFS)呈负相关(图1c, d)。同时,铜含量与细胞增殖指标Ki-67表达呈正相关(图1e)。同样,铜含量与患者血清标本中的血小板/淋巴细胞和中性粒细胞/淋巴细胞比值呈正相关,两者都是与炎症相关的胃癌侵袭性恶性肿瘤的预后生物标志物(图1f, g)。这些结果表明,铜的高含量参与了气相色谱的发生和发展。
此外,研究者还检测了铜在不同GC类型中的浓度差异,尤其是在恶性肿瘤中。有趣的是,研究者发现黏液腺癌中的铜浓度高于整个胃肿瘤(图1h)。黏液腺癌是胃癌的一种罕见组织学亚型,与非黏液腺癌相比,黏液腺癌的分期更晚,5年OS和DFS更差。黏液腺癌作为一种难治性胃癌,具有放化疗抵抗的特点,迫切需要更有效的治疗方法。
最近,研究人员发现,细胞内的高铜浓度触发了还原酶FDX1,将Cu2+还原为毒性更强的Cu1+,导致铜死亡。研究者发现FDX1在胃癌中的蛋白水平高于正常胃组织(图1k)。由于FDX1蛋白水平和铜含量在GC中都较高,因此可能更容易触发铜突。这为胃癌尤其是恶性肿瘤——黏液腺癌提供了潜在的治疗策略。
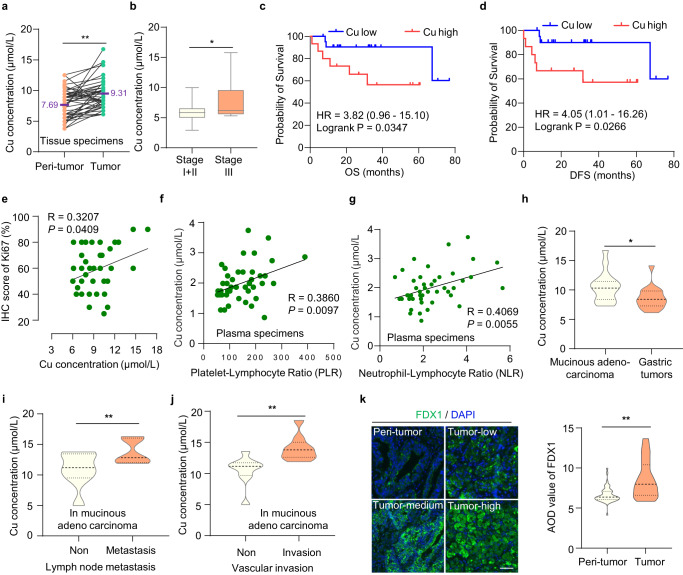
图1 胃癌组织中铜含量较高,且与肿瘤进展相关
2. METTL16是铜死亡的关键介导因子
有研究表明,与良性胃病患者和健康对照患者相比,胃癌患者的总m6A水平显著升高,并促进胃癌的发生、生长、侵袭、上皮间质转化、转移甚至多药耐药的过程。此外,m6A修饰还参与多种细胞死亡类型,包括凋亡、坏死性凋亡、铁死亡和焦亡。然而,m6A修饰与铜死亡的关系尚不清楚。有趣的是,研究者发现铜含量与GC组织中总m6A水平呈正相关(图2a)。此外,铜显著上调胃癌细胞中m6A修饰的总水平(图2b)。鉴于甲基转移酶样蛋白(METTL)家族在促进m6A修饰中起主导作用,研究者分析了以1:1的比例用来来洛莫/双硫仑和铜处理METTL敲低的细胞时的活力。结果表明,METTL16敲低导致对来来洛莫/双硫仑-铜处理的耐药性(图2c-e)。此外,在对照组和METTL16敲低的细胞中,四硫钼酸盐处理均抑制了铜绿假单胞菌脱除,表明METTL16参与了铜绿假单胞菌脱除(图2f)。为了进一步验证这些结果,研究者成功构建并验证了METTL16敲除克隆细胞系,观察到与METTL16敲除细胞相似的结果(图2g, h)。这些结果表明,METTL16在铜突病中起着至关重要的作用。
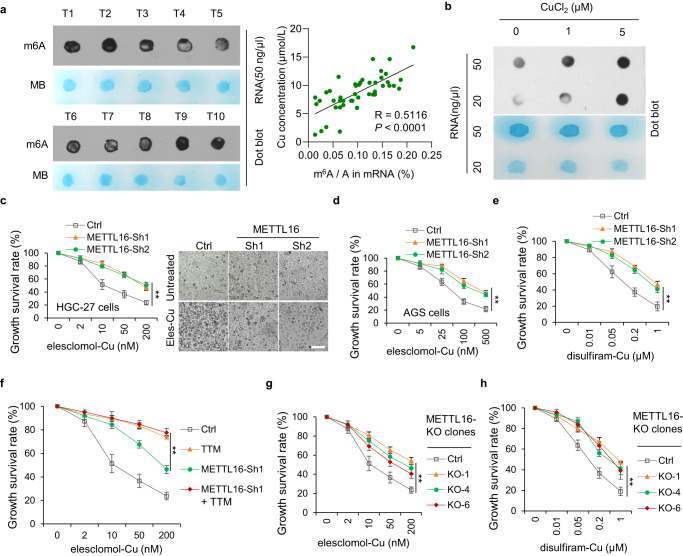
图2 METTL16是铜死亡的关键介导因子
3. METTL16通过靶向FDX1促进铜死亡
METTL16在许多转录本中负责m6A的沉积。因此,研究者在稳定的Ctrl-Sh和METTL16-Sh细胞系中进行了甲基化RNA免疫沉淀(MeRIP)测序(图3a)。使用HOMER软件预测每个样本中潜在的m6A修饰,m6A修饰主要映射到经典的GGAC基序(图3b)。根据MeRIP-seq结果,研究者进一步分析了mRNA的总m6A分布模式,发现m6A峰主要富集在CDS和3'UTR区域。GO富集分析显示METTL16修饰基因富集的前15条通路,其中部分与线粒体通路相关(图3c)。此外,研究者从METTL16-sh组中鉴定出10个典型的与m6A甲基化水平低以及mRNA水平下调相关的因子(图3d)。qPCR分析显示,在METTL16-Sh细胞中,FDX1、MTF1、PDHB、ATP7A和DLD的mRNA水平降低。与对照细胞相比,FDX1在METTL16-sh细胞中表现出最显著的mRNA水平降低(图3e)。此外,在METTL16-Sh或-KO细胞中检测到FDX1的蛋白水平显著降低(图3f, g)。考虑到FDX1是铜离子载体诱导的细胞死亡的关键调节因子,研究者推测METTL16诱导的细胞凋亡是FDX1依赖的。
接下来,研究者评估了METTL16是否通过影响FDX1的表达来调节细胞凋亡。鉴于蛋白质脂化是铜胞嘧啶的关键因素,研究者使用硫辛酸特异性抗体作为DLAT脂化的指标,评估了METTL16敲低是否影响蛋白质脂化。结果表明,如免疫印迹测定的那样,METTL16敲低导致DLAT脂化降低(图3h)。此外,FDX1过表达逆转了在来来洛莫/双硫仑-cu处理后,METTL16敲低和敲除细胞系中铜突亡的拮抗作用(图3i, j)。FDX1敲低可抑制METTL16过表达诱导的铜突(图3k)。综上所述,这些数据表明METTL16通过靶向FDX1促进铜死亡。
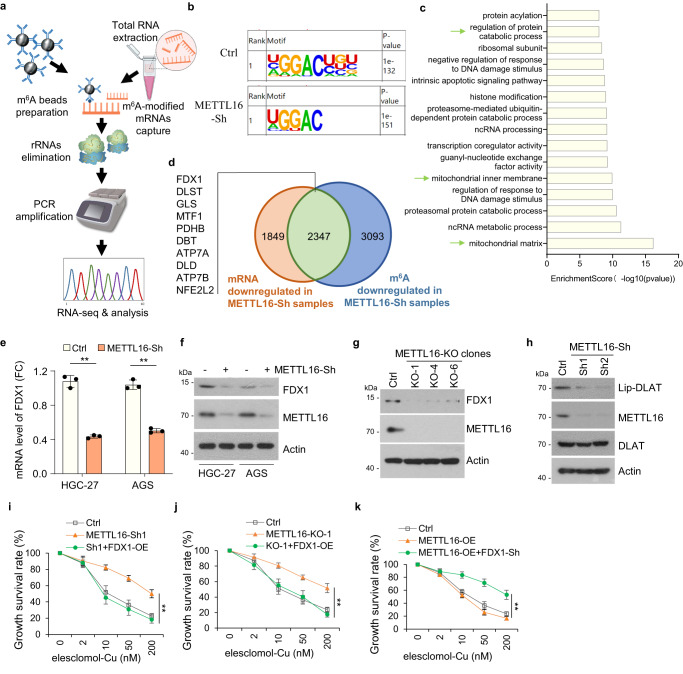
图3 METTL16通过靶向FDX1促进铜突
4. METTL16通过对FDX1 mRNA的m6A修饰促进FDX1的积累
为了进一步探索METTL16如何调控m6A修饰进而影响FDX1 mRNA水平,研究者进行了基因特异性MeRIP-qPCR检测。研究者发现,在METTL16敲低和敲除细胞中,FDX1 mRNA上的m6A水平显著降低,而在转染METTL16过表达质粒的细胞中,FDX1 mRNA上的m6A水平显著升高(图4a, b)。当用ActD停止转录时,METTL16敲低细胞中FDX1 mRNA的衰减速率比对照细胞快(图4c)。这些结果表明,METTL16介导的甲基化导致FDX1 mRNA的稳定性。对FDX1富集的m6A峰的综合基因组学观察(IGV)分析显示,与对照细胞相比,METTL16-sh细胞中的m6A水平降低,表明METTL16可能促进FDX1在CDS或3'UTR区域的m6A修饰(图4d)。因此,研究者将FDX1的部分CDS和3'UTR区融合到pGL3荧光素酶报告基因的下游,构建FDX1-WT荧光素酶报告基因。共转染FDX1荧光素酶报告基因和不同剂量的METTL16-OE质粒,研究者发现METTL16显著促进FDX1荧光素酶的活性(图4e)。
为了进一步研究,研究者使用基于序列的m6A修饰位点预测器SRAMP预测了FDX1 mRNA上可能的m6A修饰位点。综合图4e中的预测结果和数据,研究者确定了两个潜在的m6A修饰位点,它们的置信度非常高:位于CDS区域的位点602a和位于FDX1转录本UTR区域的位点820 A(图4f, g)。接下来用特异性引物进行的MeRIP-qPCR分析证明,FDX1转录本上的602位点是METTL16介导的甲基化的直接底物(图4h)。此外,研究者基于FDX1-WT荧光素酶报告基因,通过将m6A基序中的特异性腺苷(A)替换为胸腺嘧啶(T),设计并构建了FDX1-602-Mut和FDX1-820-Mut荧光素酶报告基因(图4g)。双荧光素酶实验结果表明METTL16不能促进602位点突变的FDX1-CDS/UTR报告载体的荧光素酶活性(图4i)。GEPIA数据库中METTL16和FDX1的表达分析表明,METTL16和FDX1在GC中呈正相关(图4j)。此外,免疫组织化学染色显示,在包含54对胃癌和癌旁正常组织的组织芯片中,METTL16和FDX1的表达呈正相关(图4k)。综上所述,这些结果证实了METTL16介导的FDX1 mRNA的m6A修饰对FDX1 mRNA的稳定性至关重要。
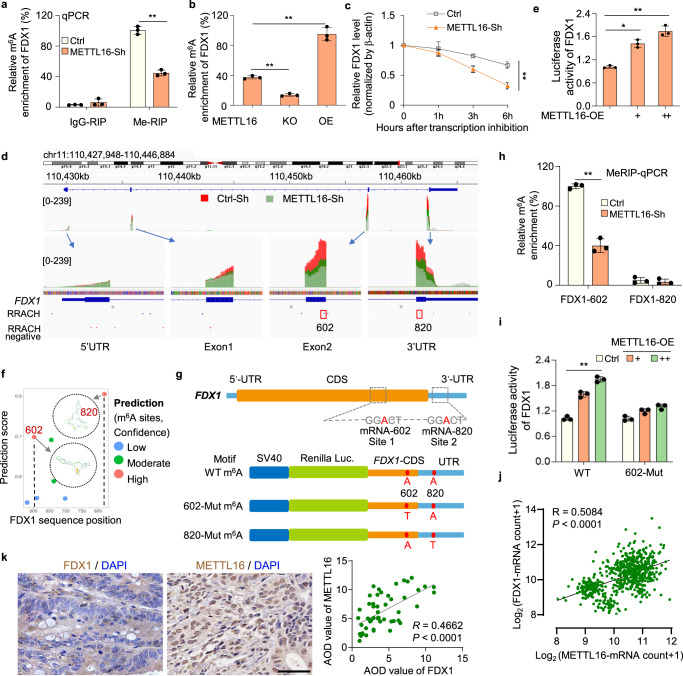
图4 METTL16通过对FDX1 mRNA的m6A修饰促进FDX1的积累
5. 在铜胁迫下,METTL16在K229处发生乳酸化
接下来,研究者评估了METTL16是否对GC中的铜胁迫有响应。在铜处理后,METTL16的mRNA和蛋白水平没有变化,但FDX1的蛋白水平显著增加(图5a, b)。为了验证在铜胁迫下FDX1表达的上调是否依赖于METTL16,研究者检测了在铜存在或不存在的情况下,METTL16敲低或敲除细胞中FDX1蛋白的表达。结果表明,METTL16缺陷消除了铜诱导的FDX1上调(图5c, d)。由于METTL16的mRNA和蛋白水平在铜胁迫下没有变化,研究者随后使用质谱检测了METTL16的PTM的变化。分析显示METTL16蛋白序列上有11个乳糖化位点和2个乙酰化位点(图5e)。在乳酸处理后,6个乳糖化位点的PTM水平显著升高,这意味着这6个位点在肿瘤细胞中可能受到调控。然后,研究者证实了铜胁迫下存在乳糖化或乙酰化反应。结果表明,铜处理显著增加了METTL16的乳糖化水平而不是乙酰化水平(图5f)。为了确定METTL16在铜相关代谢中重要的乳化位点,研究者产生了这6个乳化位点的乳化缺陷突变体(K→R)和K410。研究者发现,只有METTL16-K229R突变体在铜胁迫下显示出乳糖化降低(图5g)。随后,LC-MS/MS分析显示METTL16-K229与其他乳糖化位点的b-y离子匹配图见图5e(图5h)。为了进一步证实铜胁迫下METTL16-K229的乳糖化,研究者制备了METTL16 lacty-K229抗体,并利用lacty-K229肽段和表达METTL16-WT、-K229R或-K229E的细胞验证了其有效性和特异性(图5i, j)。铜和乳酸处理均诱导K229处METTL16的强乳糖化(图5k, l),表明K229是铜相关代谢中必不可少的乳糖化位点。这些结果表明,在铜胁迫下,METTL16在K229发生乳酸化。
在稳定的METTL16挽救细胞系中,FDX1蛋白水平进一步得到保证,其中内源性METTL16被野生型(WT)、乳酸化缺陷型(K229R)或乳酸化模拟型(K229E)取代。结果显示,FDX1蛋白水平在METTL16 -敲低的细胞中降低,在METTL16-WT或-K229E拯救细胞后恢复,但在METTL16-K229R拯救细胞后没有恢复(图5m)。铜胁迫诱导METTL16-K229乳糖化,促进METTL16甲基转移酶活性。
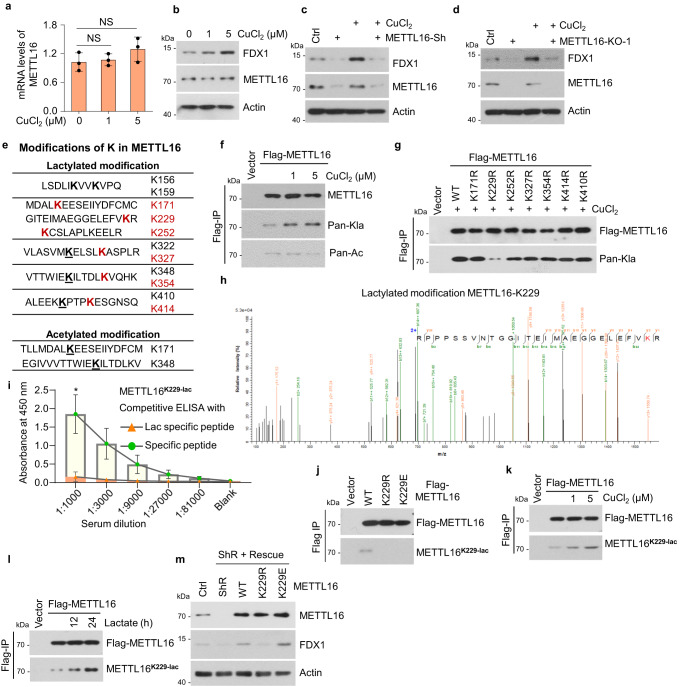
图5 在铜胁迫下,METTL16在K229处发生乳酸化
6. SIRT2使METTL16- k229脱酰化并抑制METTL16活性
上述数据证实铜激活METTL16-K229的乳糖化,但具体参与肿瘤细胞的乳糖化酶和乳糖化转移酶尚不清楚。研究者研究了铜是否介导了对METTL16的乳糖基转移酶或脱乳糖基酶的调节。SIRT2被鉴定为METTL16的结合蛋白,是一种典型的去乙酰化酶,分为主要的脱乙酰酶和乳糖基转移酶组(图6a)。EIF3b也被鉴定为METTL16的结合蛋白,这与之前的研究一致。为了研究和验证METTL16和SIRT2之间的相互作用,研究者在HGC-27细胞中检测到METTL16-SIRT2的结合(图6b)。METTL16-SIRT2的直接关联通过His-pull-down试验得到验证(图6c)。SIRT2过表达显著抑制METTL16-K229的乳糖化(图6d),而SIRT2敲低或SIRT2抑制剂AGK2处理则促进METTL16-K229的乳糖化(图6e)。此外,铜诱导的METTL16-K229的乳糖化被SIRT2过表达抑制,而被SIRT2敲低或AGK2处理增加(图6f, g)。综上所述,这些结果表明SIRT2在K229位点与METTL16相互作用并使其脱酰化。
研究者进一步探索了SIRT2对METTL16的调控作用在稳定的METTL16挽救细胞株中的作用。SIRT2过表达抑制了METTL16- wt细胞中的FDX1 m6A水平,但未抑制METTL16-K229r或-K229E细胞中的FDX1 m6A水平,表明SIRT2通过METTL16-K229的乳糖化抑制了METTL16的活性(图6h, i)。此外,SIRT2过表达抑制FDX1蛋白水平(图6j),而SIRT2敲低和AGK2处理促进FDX1蛋白水平(图6k)。免疫荧光染色结果显示,在胃癌组织芯片中,SIRT2蛋白水平与FDX1蛋白水平呈负相关(图6l)。综上所述,这些结果表明SIRT2通过在K229上去乙酰化来负调控METTL16的活性。
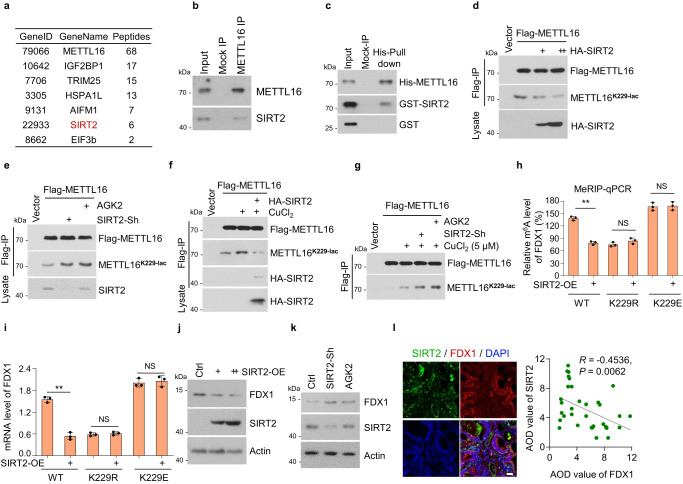
图6 SIRT2使METTL16-K229脱酰化并抑制METTL16活性
7. SIRT2-METTL16-fdx1细胞凋亡轴支持一种有前景的治疗策略
FDX1是铜死亡的重要介质,而铜死亡是癌症的潜在治疗方法。研究者发现,在SIRT2抑制或铜诱导METTL16-K229乳糖化后,FDX1蛋白水平升高。接下来,研究者研究了METTL16-K229乳糖化对铜突细胞的影响。结果表明,在铜胁迫下,METTL16敲低介导的DLAT脂化降低在METTL16-WT/-K229E细胞中被恢复,但在METTL16-k229r细胞中没有恢复(图7a)。此外,在铜存在的情况下,来来洛莫处理可诱导METTL16-WT或-K229E细胞发生铜中毒,但对METTL16-K229R细胞未发生铜中毒(图7b)。此外,SIRT2过表达逆转了在铜胁迫下由METTL16-WT引起的DLAT脂化的增加,而不是由METT16-K229E引起的DLAT脂化的增加,表明SIRT2通过去乙酰化METTL16-K229来抑制铜死亡(图7c)。AGK2处理同样促进了铜胁迫下METTL16-WT细胞的DLAT脂酰化,但对METTL16-K229R细胞没有作用(图7d)。此外,AGK2处理促进了在有来昔洛莫和铜存在的情况下的铜突(图7e)。
研究者进一步评估了METTL16乳糖化是否可以增强接受来来洛莫治疗的小鼠异种移植瘤的治疗反应。将METTL16-WT、-K229R、-K229E细胞分别于裸鼠左右后肢上方皮下注射。在METTL16-WT和-K229E组中,接受来来洛莫治疗的小鼠的肿瘤生长明显受到抑制,而在METTL16-K229R组中,肿瘤的体积和重量减少(图7f-h)。
肿瘤切片中的FDX1染色显示,METTL16-WT和-K229E组的肿瘤切片中FDX1染色高于METTL16-K229R组(图7i)。这些结果表明,METTL16在K229的泌乳状态在决定铜突的发生中起着至关重要的作用。此外,在异种移植瘤中使用来来洛莫和AGK2联合治疗。对肿瘤切片的分析表明,AGK2在体内可致敏来来洛莫治疗,如观察到的肿瘤体积和重量的减少(图7j-l)。这些结果表明,来来洛莫联合AGK2治疗胃癌,尤其是恶性肿瘤黏液腺癌是一种有前景的治疗方法。
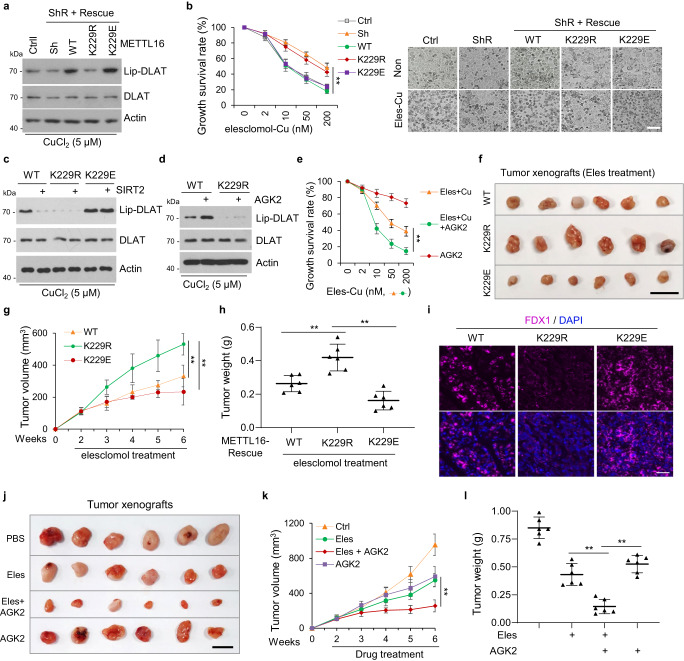
图7 SIRT2 - METTL16 - fdx1细胞凋亡轴支持一种有前景的治疗策略
结论
这些结果表明,METTL16是铜死亡的驱动力。METTL16在K229上的乳化通过对FDX1 mRNA的m6A修饰上调FDX1蛋白的表达,这是铜胁迫下触发铜中毒的途径之一。此外,研究结果表明METTL16在胃癌中是协调葡萄糖和铜代谢的中心枢纽。此外,结果表明METTL16的乳糖化为评价铜离子载体药物的有效性提供了一个潜在的靶点。鉴于胃肿瘤比正常组织具有更高的铜和乳酸浓度,利用铜离子载体结合铜离子和SIRT2特异性抑制剂可能是一种可行的胃癌治疗策略。
实验方法
细胞培养,小鼠异种移植肿瘤实验,m6斑点印迹测定,qRT-PCR,荧光素酶报告基因检测,蛋白质印迹,His-pull-down测定,免疫沉淀,免疫荧光染色,MeRIP-qPCR,RNA稳定性检测,体外乳酸化试验,生物信息学分析
参考文献
Sun L, Zhang Y, Yang B, Sun S, Zhang P, Luo Z, et al. Lactylation of METTL16 promotes cuproptosis via m6A-modification on FDX1 mRNA in gastric cancer. Nat Commun. 2023 Oct 20;14(1):6523. doi: 10.1038/s41467-023-42025-8.






