PKM2调节顺铂诱导的急性肾损伤的线粒体稳态
急性肾损伤(AKI)的一个重要病理生理过程是肾小管上皮细胞线粒体断裂,导致细胞死亡。丙酮酸激酶M2 (PKM2)是一种具有多种生物学功能的活性蛋白,参与调节糖酵解,在调节细胞存活中起关键作用。然而,PKM2在AKI期间调节细胞存活的作用和机制尚不清楚。在这里,我们发现PKM2的磷酸化有助于星孢菌素或顺铂治疗后PKM2二聚体的形成和PKM2转运到线粒体。线粒体PKM2结合MYH9促进DRP1介导的线粒体断裂。在体内和体外实验中,PKM2特异性缺失或调节PKM2活性部分限制线粒体断裂,减轻肾小管损伤和细胞死亡,包括细胞凋亡、坏死和铁死亡。此外,通过抑制MYH9活性,星孢菌素或顺铂诱导的线粒体断裂和细胞死亡在培养细胞中得到逆转。综上所述,我们的研究结果表明,调节PKM2丰度和活性以抑制线粒体易位可能维持线粒体完整性,并为治疗AKI提供新的治疗策略。本文于2023年10月发表于“Cell Death and Disease”(IF=9)上。
技术路线

结果
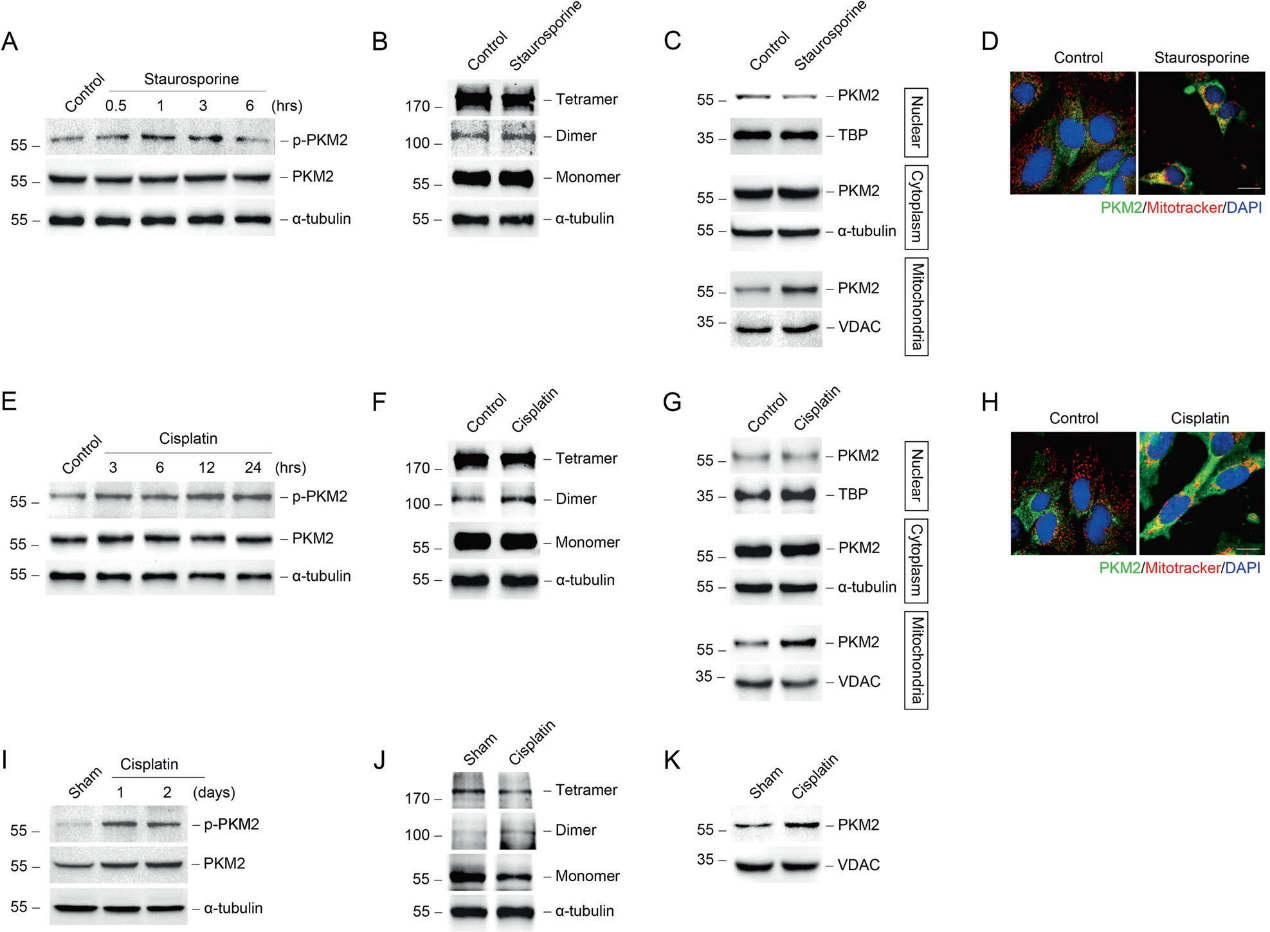
1)顺铂诱导AKI期间小管上皮细胞的线粒体PKM2增加
我们首先检测了AKI期间小管上皮细胞中PKM2的表达。采用顺铂或星孢菌素刺激正常大鼠肾上皮细胞(NRK-52E)诱导急性损伤。如图1A、1E所示,星孢菌素或顺铂刺激后,PKM2磷酸化(p-PKM2)显著增加。在星孢菌素或顺铂刺激后,PKM2在NRK-52E细胞中从四聚体转化为二聚体(图1B、1F)。为了明确PKM2的亚细胞定位,我们从NRK-52E细胞中分离出细胞核、细胞质和线粒体。核内PKM2的表达在星孢菌素或顺铂刺激下没有增加,而似乎略有下降。然而,PKM2在线粒体中的表达显著增加(图1C、1D、1G、1H)。此外,我们分析了PKM2在体内的表达。在注射顺铂后第1天和第2天,肾脏组织中p-PKM2的表达增加(图1I)。与体外研究一致,在顺铂损伤后第1天,肾脏中发现PKM2二聚体(图1J)。线粒体中PKM2和二聚体PKM2的丰度也增加(图1K)。这些数据表明,在顺铂诱导AKI的进展过程中,PKM2被转移到线粒体。
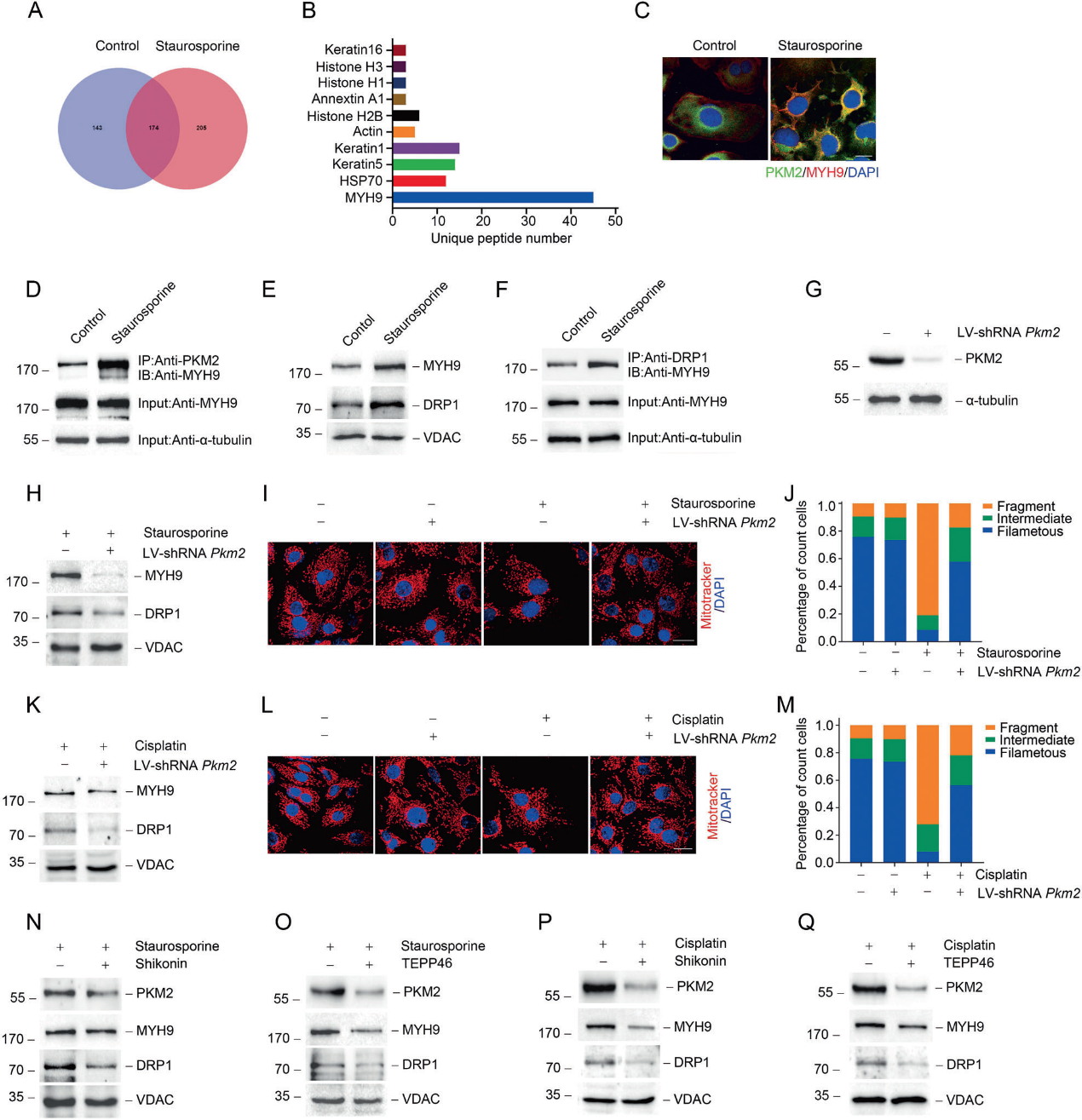
2)在急性损伤反应中,线粒体PKM2结合MYH9促进DRP1介导的线粒体断裂
为了探讨PKM2在线粒体中的作用,我们对星孢菌素处理的NRK-52E细胞中PKM2结合蛋白进行了co-IP实验。利用液相色谱-质谱/质谱(LC-MS/MS)进行的蛋白质组学分析显示,MYH9是与PKM2结合最丰富的蛋白(图2A, 2B)。同时,在星孢菌素处理的NRK-52E细胞中,通过共聚焦免疫荧光观察到PKM2和MYH9的共定位(图2C)。co-IP的western blotting结果显示,经星孢菌素处理后,PKM2与MYH9结合(图2D)。先前的研究发现,MYH9可能通过DRP1介导线粒体裂变。我们的研究结果表明,在星孢菌素刺激下,线粒体中的MYH9和DRP1都增加了(图2E)。此外,通过co-IP在NRK-52E细胞中检测到MYH9与DRP1的相互作用,星孢菌素显著增强了这种相互作用(图2F)。接下来,我们研究了PKM2在调节MYH9和线粒体动态变化中的作用。首先,我们用慢病毒介导的Pkm2 shRNA (LV-shRNA Pkm2)转染NRK-52E细胞,以下调PKM2的表达(图2G)。在星孢菌素或顺铂治疗下,转染Pkm2 shRNA的NRK52E细胞中pDRP1、线粒体MYH9和DRP1的表达降低(图2H、2K)。PKM2表达下调抑制了星孢菌素或顺铂诱导的线粒体断裂(图2I,J, L, M)。
为了探讨PKM2活性在AKI中的可能作用,我们利用紫草素和TEPP46调节PKM2活性。如图2N-2Q所示,紫草素和TEPP46均能抑制顺铂或星孢菌素诱导的p-DRP1、线粒体MYH9和DRP1表达的增加(图2N-2Q)。上述结果表明,在急性损伤期间,线粒体PKM2与MYH9结合,促进DRP1介导的线粒体碎片化。
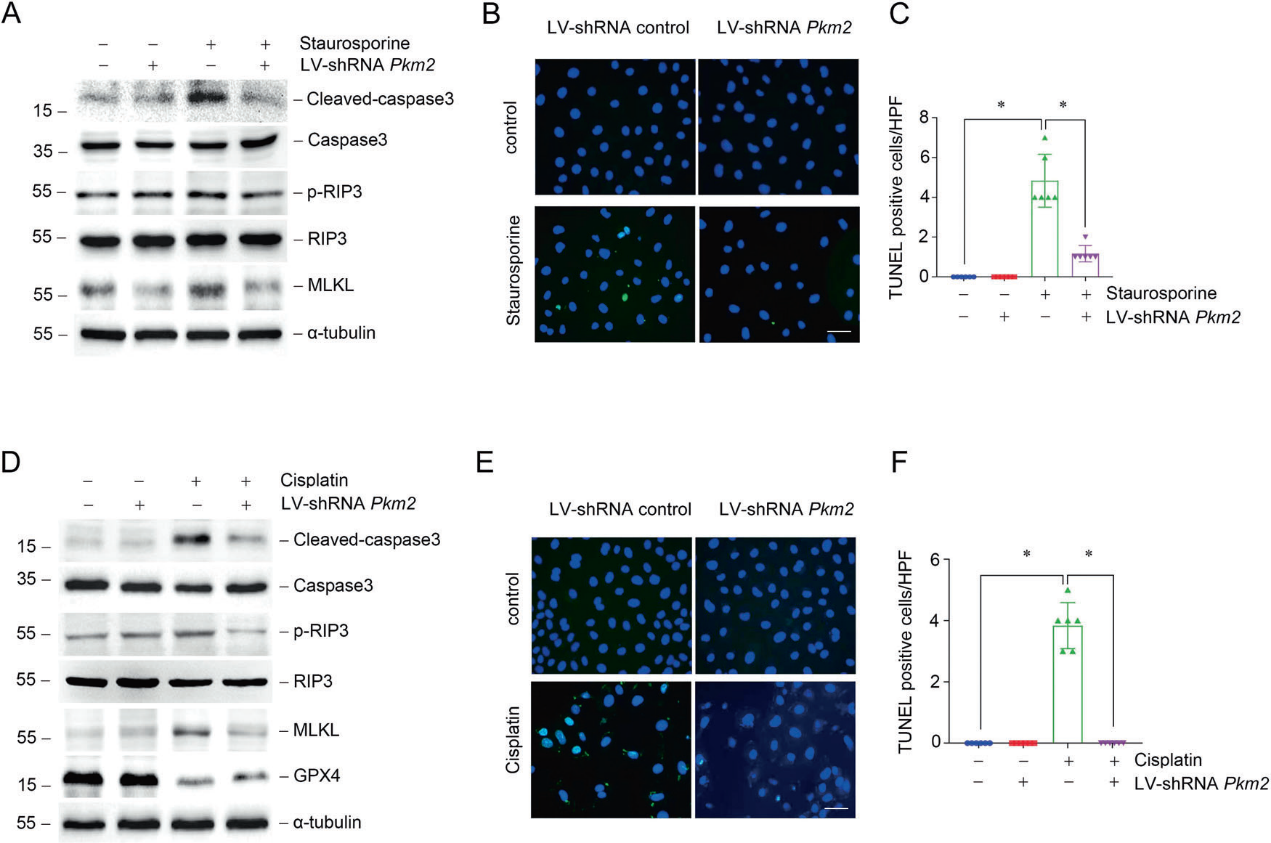
3)下调PKM2表达可减轻体外肾小管细胞死亡
肾小管损伤和细胞死亡是诱发因素;然而,它们也是AKI的结果。我们发现,在星孢菌素处理下,Pkm2敲低组与scramble shRNA组相比,cleaved-caspase3的表达较低,这表明Pkm2的敲低可以抑制星孢菌素诱导的细胞凋亡(图3A)。除了细胞凋亡,我们还发现在星孢菌素处理下NRK-52E细胞中,磷酸化RIP3和MLKL等坏死相关蛋白均上调。Pkm2敲低还可以阻断星孢菌素诱导的磷酸化RIP3和MLKL的上调(图3A)。TUNEL染色分析显示,星孢菌素诱导的细胞死亡可以通过PKM2调控(图3B, 3C)。PKM2的促凋亡作用也在顺铂处理的NRK-52E细胞中得到证实,显示PKM2敲低后,裂解的caspase3、p-RIP3和MLKL的表达较低,TUNEL阳性细胞较少(图3D-3F)。令人惊讶的是,我们发现调节铁死亡的GPX4的丰度在顺铂刺激后降低,而PKM2敲低恢复了其表达(图3D)。
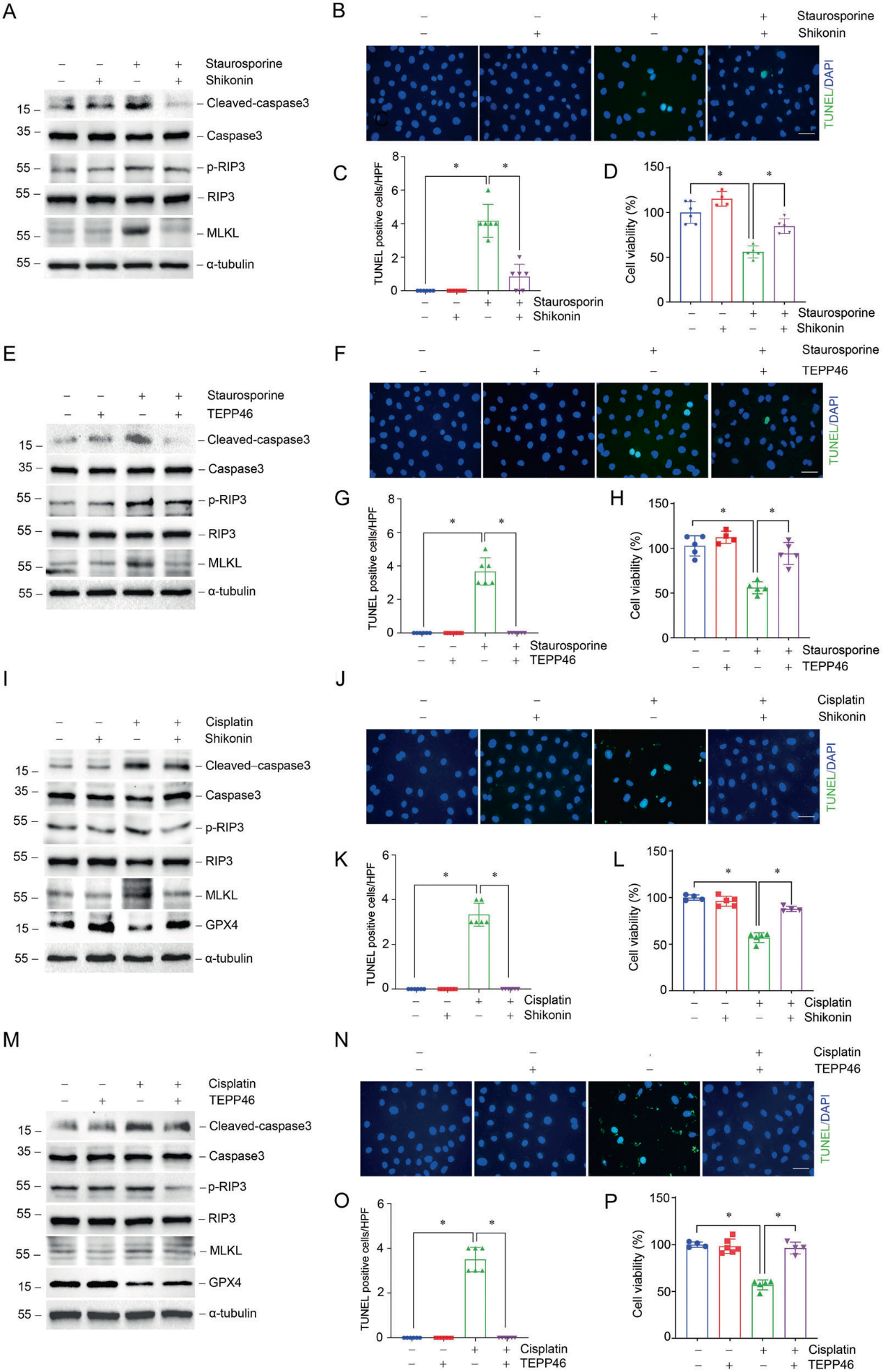
4)调控PKM2活性可减轻星孢菌素或顺铂诱导的NRK-52E细胞死亡
我们分析了调控PKM2活性是否有利于星孢菌素或顺铂治疗后小管上皮细胞的存活。紫草素和TEPP46均能使NRK-52E细胞抵抗星孢菌素诱导的凋亡和坏死(图4A-4H)。此外,顺铂诱导的细胞凋亡、坏死和铁死亡也可以被紫草素或TEPP46阻碍(图4I-4P)。综上所述,降低PKM2表达或抑制PKM2磷酸化或二聚化可促进星孢菌素或顺铂刺激下的细胞存活。
5)PKM2在体内顺铂诱导AKI中的作用
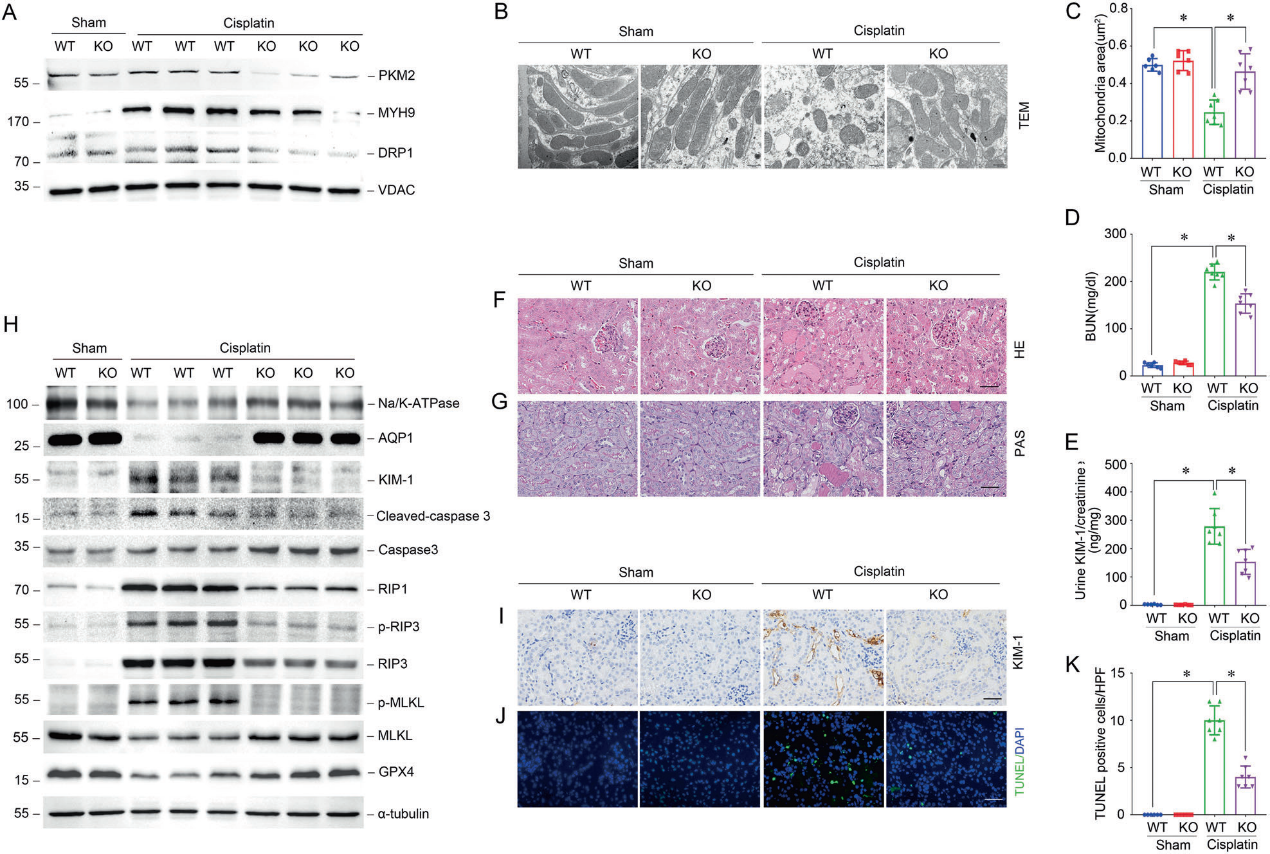
为了进一步确定PKM2对AKI的影响,我们使用Cre-Loxp重组酶技术产生了小管上皮细胞特异性PKM2敲除小鼠。PTCs中PKM2缺失抑制了p-DRP1、线粒体MYH9和DRP1的表达,减轻了顺铂注射诱导的线粒体断裂(图5A)。KO小鼠的PTCs中线粒体面积也得到改善(图5B, 5C)。与WT小鼠相比,KO小鼠的血尿素氮(BUN)和尿肾损伤分子1 (KIM-1)表达水平降低(图5D, 5E)。正如预期的那样,PTCs中Pkm2敲除显著逆转了顺铂诱导的肾小管脱离、刷状边界丢失和管状晶体形成等形态学异常(图5F, 5G)。顺铂注射后,KO小鼠肾组织中KIM-1、cleaved-caspase3、RIP1、pRIP3、RIP3、p-MLKL表达降低,Na/K-ATPase、aquaporin 1 (AQP1)、GPX4表达升高(图5H)。免疫组织化学和免疫荧光染色进一步证实,KO小鼠PTCs中KIM-1阳性细胞和TUNEL阳性细胞较WT小鼠少(图5I-5K)。紫草素和TEPP46可以抑制PKM2易位到线粒体,降低线粒体MHY9和DRP1的表达,抑制顺铂诱导的线粒体断裂、肾小管损伤和细胞死亡(图6)。

结论
本研究不仅确定了PKM2在肾小管上皮细胞存活中的生理功能,而且为保护肾功能和预防AKI提供了潜在的治疗靶点。
实验方法
动物模型构建、CCK-8、TUNEL染色、免疫共沉淀、LC-MS/MS、Western blotting、组织学分析、TEM、线粒体免疫荧光染色。
参考文献
Xie W, He Q, Zhang Y, Xu X, Wen P, Cao H, Zhou Y, Luo J, Yang J, Jiang L. Pyruvate kinase M2 regulates mitochondrial homeostasis in cisplatin-induced acute kidney injury. Cell Death Dis. 2023 Oct 10;14(10):663. doi: 10.1038/s41419-023-06195-z.






