中性粒细胞通过乌头脱羧酶1抵抗铁死亡并促进乳腺癌转移
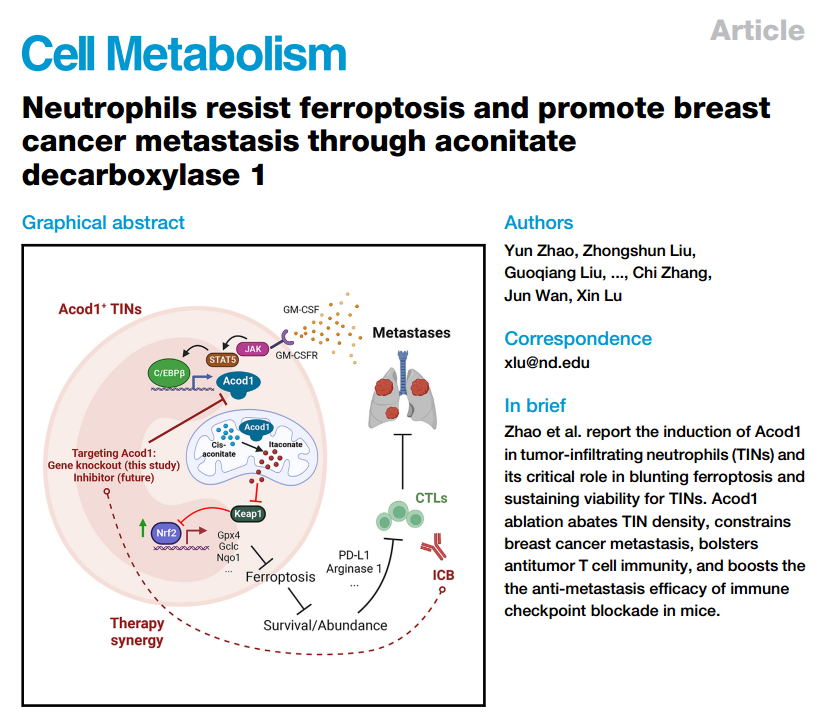
转移是导致乳腺癌相关死亡的原因。肿瘤浸润性中性粒细胞(TINs)造成免疫抑制并促进转移。削弱TINs可能增强免疫疗法,但是寻找在TINs中高表达且在肿瘤外中性粒细胞中被低表达的的治疗靶点,仍然是一个挑战。下图是23年TINs中标项目的题目:

作者的研究说明了研究结果揭示了TINs如何通过Acod1依赖的免疫代谢转换逃脱铁死亡,并将Acod1确定为一个用于抵消免疫抑制并改善免疫疗法抗转移疗效的靶点。该研究于2023年9月发表在《Cell Metabolism》,IF:29。
技术路线

主要研究结果
1.中性粒细胞在乳腺TME表现出有效的免疫抑制和明显的转录组特征
流式细胞术分析乳腺癌模型小鼠中血液、乳腺肿瘤和肺转移瘤中的中性粒细胞群,发现中性粒细胞在乳腺癌模型小鼠中显著富集(图1A)。从无瘤或E0771实体瘤小鼠中分离的aCD3/ acd28刺激的脾脏T细胞亚群并且与中性粒细胞共培养,发现与无瘤小鼠或者荷瘤小鼠的血液中性粒细胞(BNs)相比,来自E0771小鼠的肿瘤浸润性中性粒细胞能有效抑制CD4+和CD8+ T细胞的增殖(图1B)。从py7160小鼠中对血液中性粒细胞(BNs)和肿瘤浸润性中性粒细胞(TINs)进行分类,发现血液中性粒细胞和肿瘤浸润性中性粒细胞显示出不同的转录组活性并且它们属于不同的细胞簇(图1C)。IPA分析发现BNs和TINs之间的差异表达基因在TIN中富集,涉及到的信号途径包括冠状病毒发病机制、IL-6信号、p38 MAPK信号、MIF先天免疫调控和nrf2介导的氧化应激反应。在这些差异表达基因中,TINs细胞中的免疫趋化因子和免疫抑制基因明显上调(图1D和E)。分析代谢酶基因在BNs和TINs中的表达发现TINs上调了包括Ptgs2在内的一系列酶,Ptgs2介导前列腺素E2的产生,从而诱导免疫抑制,并且发现Acod1是上调最明显的基因,后续研究也将围绕Acod1展开(图1F)。
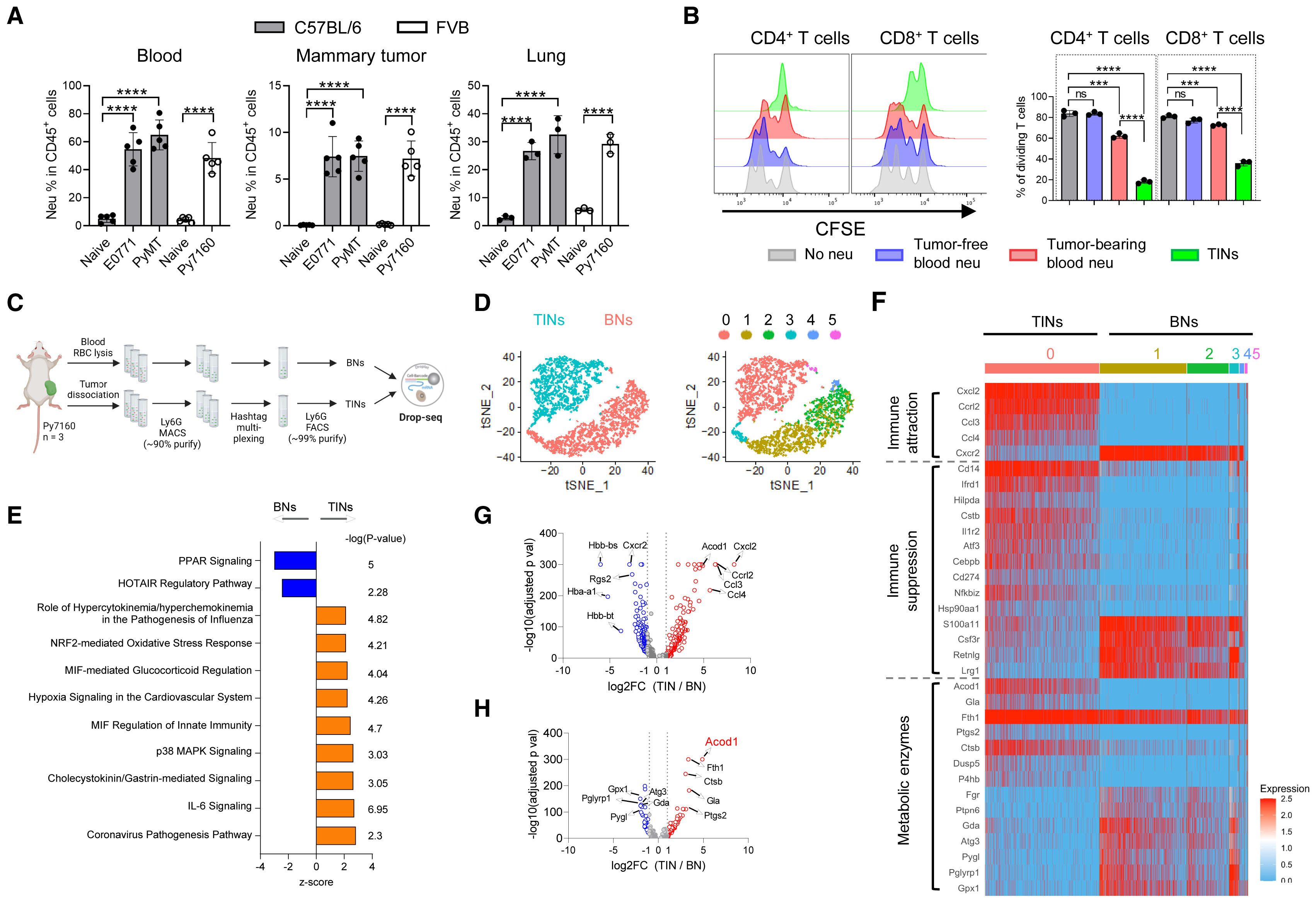
图1.中性粒细胞在乳腺TME表现出有效的免疫抑制和明显的转录组特征
2. Acod1在小鼠和患者原发性和转移性BC的TINs中高度表达
检测Acod1在血液和组织中的表达,发现与携带E0771的小鼠或无瘤小鼠的血液白细胞相比,Acod1在乳腺肿瘤和肺转移中显著升高(图2A)。从荷瘤小鼠的不同身体部位纯化中性粒细胞,并利用qRT-PCR检测Acod1的表达。在三种模型(E0771、Py7160和MMTV-PyMT)中,来自转移性肺肿瘤和原发肿瘤的中性粒细胞的Acod1表达高于骨髓、血液或脾脏中的中性粒细胞,表明荷瘤小鼠中性粒细胞中Acod1表达的升高是由于肿瘤的影响(图2B)。使用免疫荧光(IF)和qRT-PCR,对E0771肿瘤的facs分类免疫亚群进行检测,发现Acod1的表达仅限于髓系细胞并且TINs细胞中Acod1的表达量最高(图2C-2E)。在E0771小鼠肿瘤定殖的肺中,超过80%的Ly6G+细胞表达Acod1,而无瘤肺中未检测到Ly6G+细胞(图2F和G)。使用人原代BC细胞,并将ACOD1与CD15或角蛋白共染色,结果显示ACOD1在85%的CD15+细胞中表达明显(图2H和2I)。分析关于转移性BC的scRNA-seq和转录组学数据库。发现ACOD1主要在各种转移部位的免疫细胞中由中性粒细胞和巨噬细胞表达(图2J)。
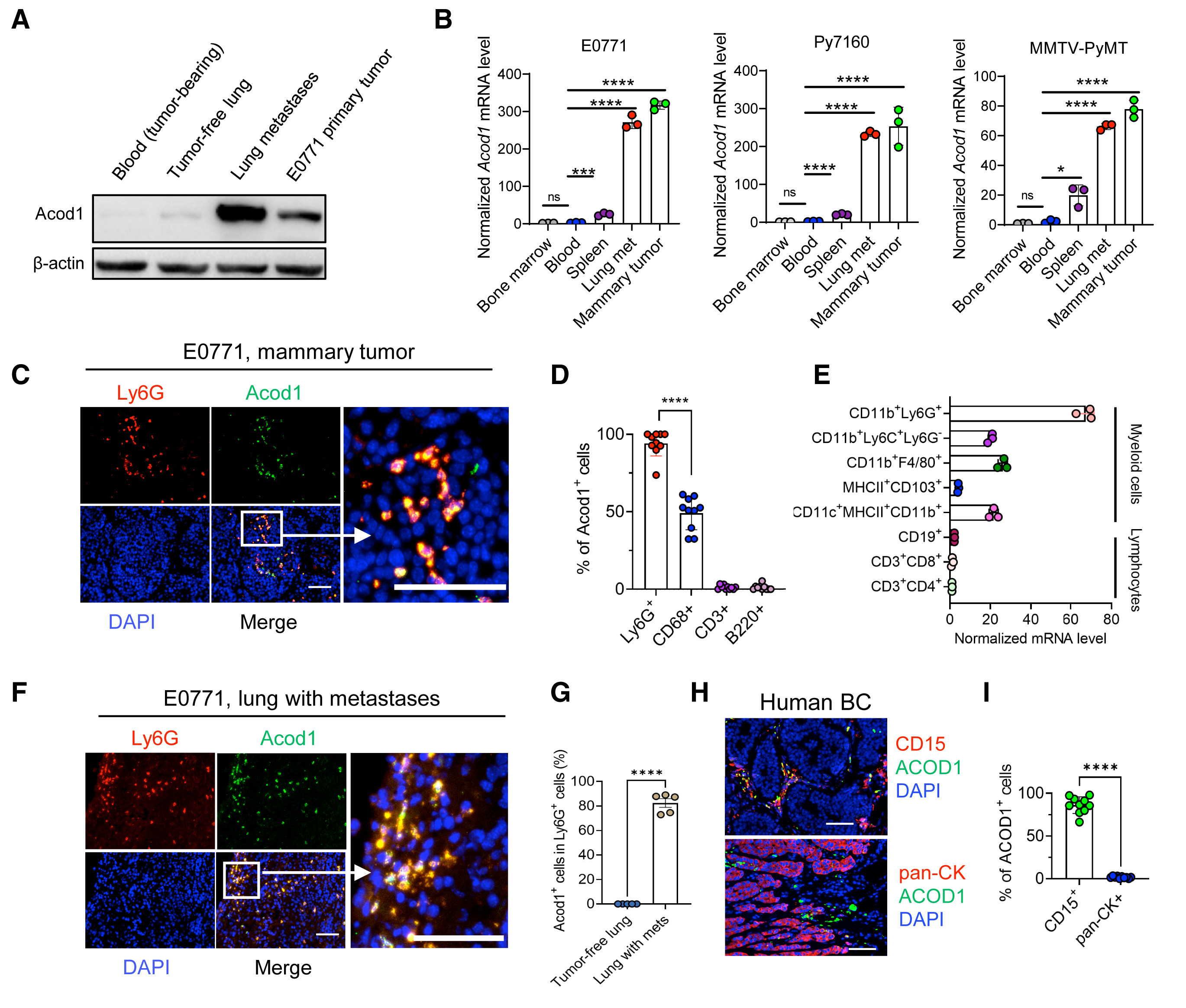
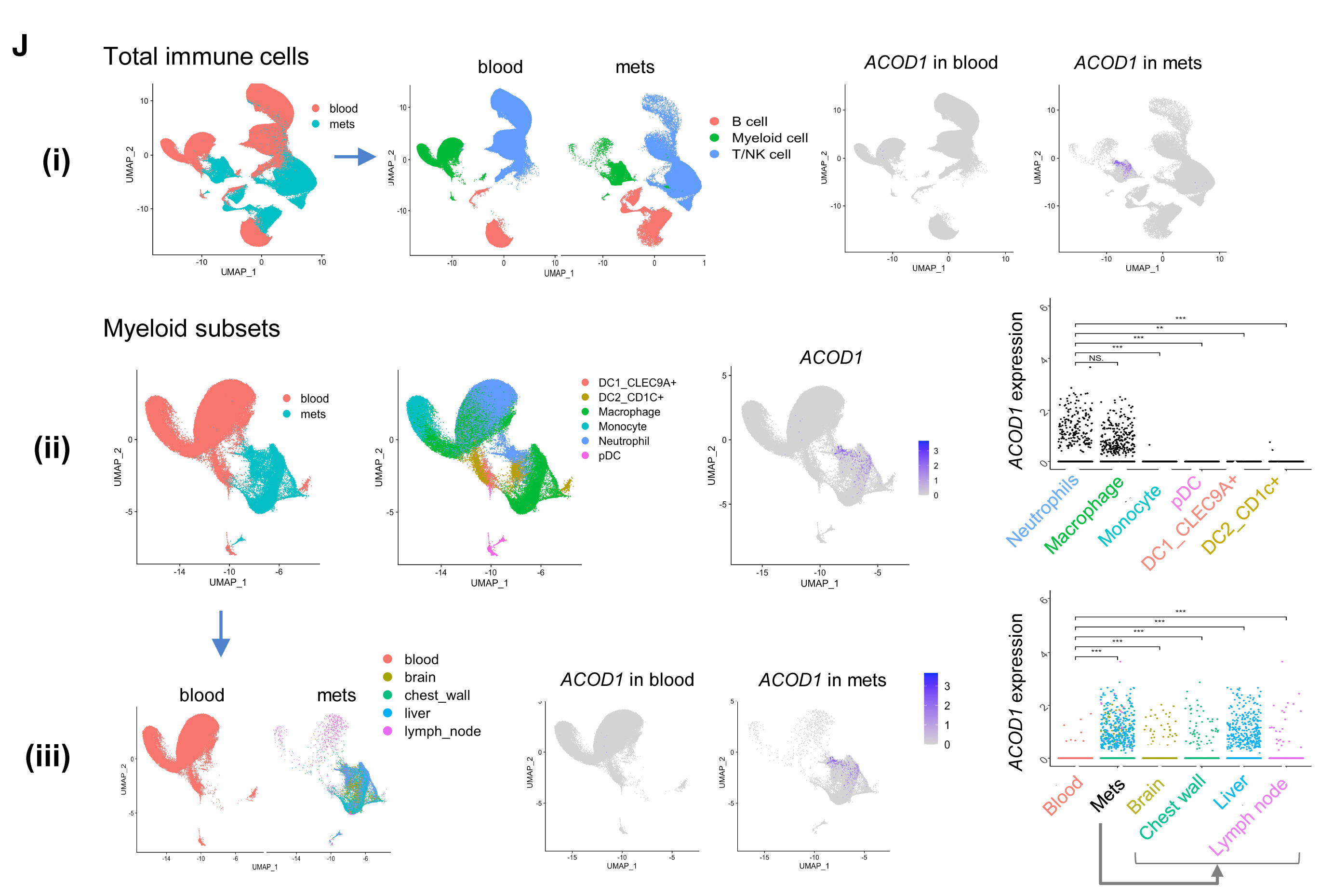
图2. Acod1在小鼠和患者原发性和转移性BC的TINs中高度表达
3.中性粒细胞Acod1促进小鼠BC模型的肺转移
使用标记红色荧光蛋白或TR(tk-GFP-luciferase三重报告基因)的E0771小鼠,评估野生型(WT)和Acod1-/-小鼠的原发肿瘤和肺转移(图3A)。发现原发肿瘤的生长速度相似,但Acod1-/- 小鼠的肺转移负担显著低于WT小鼠(图3B和C),对应着Acod1 -/- 小鼠的生存期延长(图3D)。对静脉注射E0771-TR的WT小鼠进行二甲基已酸盐(DMI)治疗(图3E),DMI促进了肺转移并缩短了生存期(图3F-3H)。接下来,使用中性粒细胞的移植(ACT)进行实验。将来自WT小鼠和Acod1 -/- 小鼠的骨髓细胞在E0771细胞培养液(CM)中培养3天,然后使用αLy6G纯化骨髓源性中性粒细胞(BMDNs)(图3I)。来自WT小鼠的BMDNs显示出CM诱导的Acod1表达,而Acod1 -/- 小鼠的BMDNs则没有(图3J)。接受CM诱导的Acod1 -/- BMDNs的小鼠发展出较少的肺转移(图3K和图3L),并且比接受CM诱导的WT BMDNs的小鼠除存活时间较长(图3M)。相比之下,接受PBS注射的小鼠的肺转移最少,存活时间比两个接受BMDN注射的组都长。使用MMTV-PyMT Acod1 +/+ 和MMTV-PyMT Acod1 -/- 小鼠。与E0771模型小鼠的结果一致,Acod1去除并不影响原发肿瘤的发生,但显著减少了肺转移的数量(图3N和图3O)。为了特异性地去除中性粒细胞中的Acod1表达,将实验分为3组:LysM-Cre + Acod1 f/f、Mrp8-Cre + Acod1 f/f 和Ly6G-Cre + Acod1 f/f。通过分析Ly6G-Cre + tdTomato LSL小鼠的外周血液确认了Ly6G-Cre受限于中性粒细胞。与不同的Acod1敲除效率相一致,LyzM-Cre + Acod1 f/f和Mrp8-Cre + Acod1 f/f 小鼠在静脉注射E0771细胞后发展出较少的肺转移(图3P),并且相比于Acod1 f/f 对照小鼠存活时间更长(图3Q),而Ly6G-Cre + Acod1 f/f小鼠则没有显示出差异。
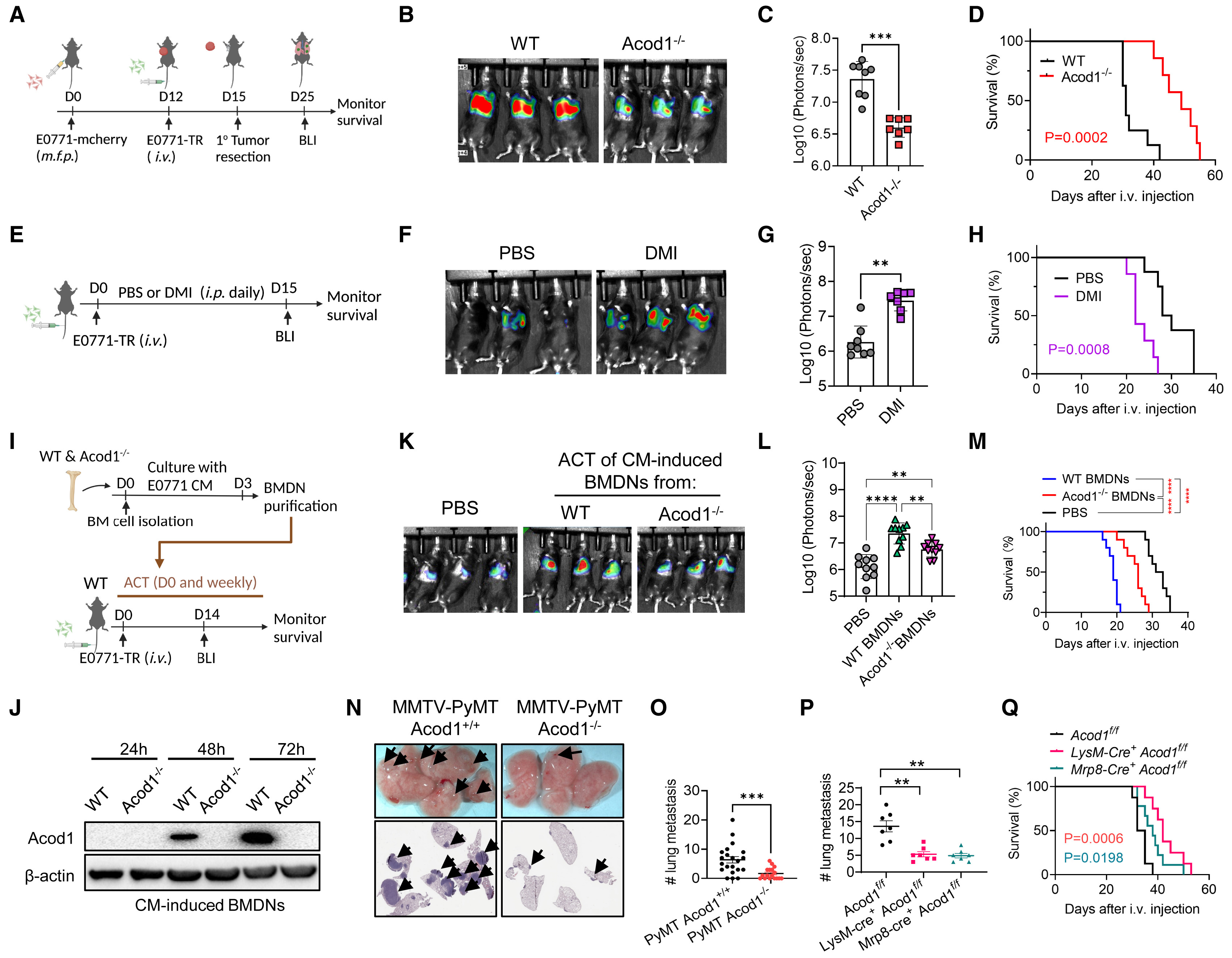
图3.中性粒细胞Acod1促进小鼠BC模型的肺转移
4.肿瘤分泌的GM-CSF通过STAT5-C/EBPβ 轴在中性粒细胞中诱导Acod1的表达
使用CM诱导的骨髓来源的中性粒细胞(BMDNs)和雌激素调控的Hoxb8衍生的中性粒细胞(ER-Hoxb8-DNs)。通过将肿瘤细胞CM添加到ER-Hoxb8-DNs中生成类似TIN的细胞(图4A)。来自4株小鼠乳腺癌细胞系(E0771,Py7160,168FARN和4T1)的CM均能诱导ER-Hoxb8-DNs(图4B)和BMDNs中的Acod1表达。发现了8种细胞因子,包括GM-CSF、G-CSF和TIMP-1以及CCL2、CCL5、CXCL1、CXCL2和CXCL10趋化因子来自这两个细胞系。这些细胞因子经过筛选,只有GM-CSF显著上调了ER-Hoxb8-DNs中的Acod1表达(图4C)。GM-CSF的下游转录因子之一,CCAAT/增强子结合蛋白-β (C/EBPβ),被GM-CSF和肿瘤CM强烈诱导(图4C)。C/EBPβ在紧急粒细胞生成和骨髓来源的MDSC生成中起着重要作用。在Drop-seq中,Acod1和Cebpb都由TINs而非BNs表达(图4D)。在ER-Hoxb8-DNs中使用shRNA敲除Cebpb消除了GM-CSF对Acod1的诱导作用(图4E)。抗GM-CSF治疗降低了E0771-CM诱导的BMDNs中C/EBPβ和Acod1的表达(图4F)。从Csf2敲除的4T1和E0771细胞中诱导的BMDNs中,Acod1的表达减少,表明GM-CSF在诱导中性粒细胞中的Acod1表达中起关键作用。在基于CM的体外实验中,GM-CSF是由肿瘤细胞分泌的,但在肿瘤微环境中,GM-CSF可能由多种细胞类型产生。此外,注射外源重组GM-CSF可显著提高骨髓、肺和脾脏中分离的中性粒细胞中C/EBPβ和Acod1的表达。GM-CSF结合GM-CSF受体并激活中性粒细胞中的JAK-STAT途径,特别是JAK2和STAT3/5。GM-CSF处理引起ER-Hoxb8-DNs中STAT3和STAT5的迅速磷酸化。STAT5抑制剂(STAT5-IN-1),而不是STAT3抑制剂(BP-1-102、WP1066和LLL12),减弱了C/EBPβ和Acod1的表达(图4G)。没有GM-CSF的情况下,无论是哪种抑制剂,ER-Hoxb8-DNs均不表达C/EBPb和Acod1。这些结果揭示了肿瘤分泌的GM-CSF通过STAT5-C/EBPb途径在TINs中诱导Acod1的机制(图4H)。
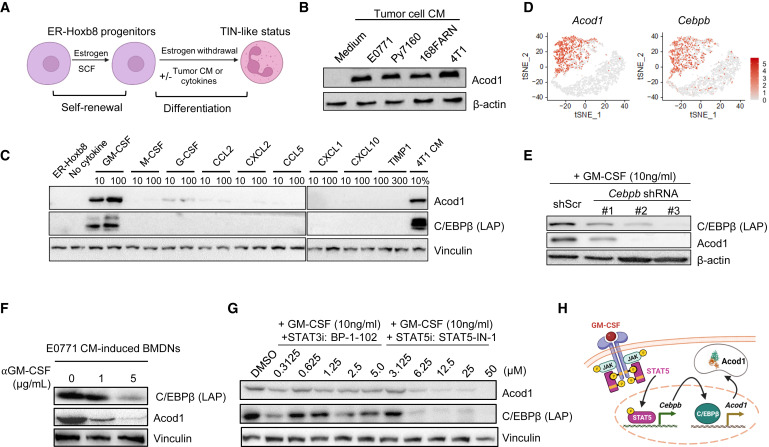
图4.肿瘤分泌的GM-CSF通过STAT5-C/EBPβ 轴在中性粒细胞中诱导Acod1的表达
5.Acod1通过减弱铁死亡,维持TIN的存活
与正常中性粒细胞相比,肺转移中的中性粒细胞产生更多的活性氧(ROS)。使用WT或Acod1-/-小鼠的E0771肺转移中的TINs进行了细胞ROS、脂质ROS和线粒体ROS的定量分析。Acod1缺乏的TIN显示出所有三种ROS类型的升高水平(图5A-C)。TINs中Acod1丧失导致了更高水平的ROS,可能会导致更明显的细胞死亡。Acod1的丧失导致转移性瘤内中性粒细胞的频率和存活率显著下降,但不影响BNs和脾脏中的中性粒细胞的存活率(图5D-F)。给携带E0771-TR肺转移的WT小鼠和Acod1-/-小鼠分别注射安慰剂或铁死亡抑制剂Ferrostatin-1(Fer-1)。结果显示,Fer-1显著恢复了Acod1-/-小鼠的转移负荷(图5G)和TINs数量(图5H),使其恢复到与WT小鼠相当的水平。为了重现Acod1在体外抵抗TME诱导的中性粒细胞铁死亡的现象,研究者在存在或缺乏Fer-1和4OI的条件下,用WT或Acod1-/-小鼠的GM-CSF培养的BM细胞,在E0771乳腺肿瘤外植体上清液(TES)中处理(图5I)。与WT BMDNs相比,TES导致Acod1-/- BMDNs的更明显脂质过氧化和存活率下降(图5J-L)。当细胞接受4OI或Fer-1处理时,这种差异消失(图5J-L)。
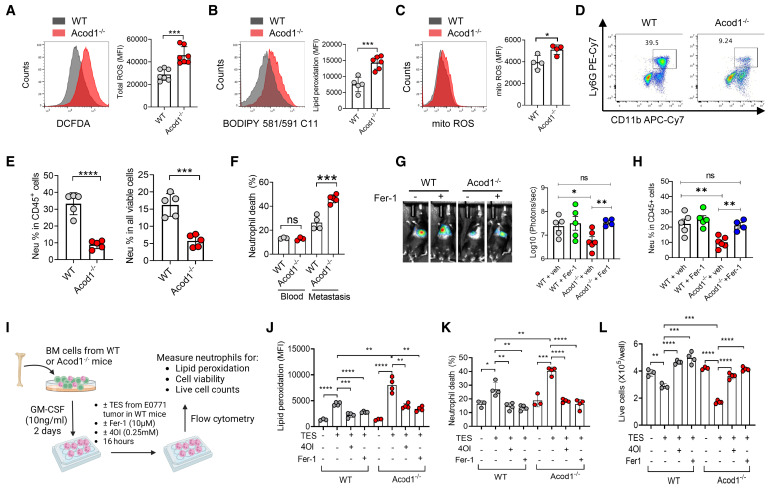
图5.Acod1通过减弱铁死亡,维持TIN的存活
6.Acod1通过激活Nrf2介导的抗氧化应答来减轻TIN的铁死亡
证据表明,Acod1可以通过激活依赖于Nrf2的抗氧化应答,拯救TIN免受铁死亡的影响。检测从WT和Acod1-/-小鼠的E0771肺转移瘤中分离的TINs中Nrf2的表达情况,并观察到Acod1损失显著降低了Nrf2蛋白的表达(图6A),尽管Nrf2的mRNA水平没有改变(图6B)。与Nrf2的功能一致,Acod1-/- TINs显著下调了抗氧化基因的表达,如Gpx4、Gclc和Nqo1,这些基因都参与铁死亡的抵抗(图C6)。使用Nrf2抑制剂ML385处理转移瘤携带的小鼠消除了WT和Acod1-/- TINs之间这些基因的差异表达(图6C)。用依康酸或其衍生物4OI和DMI处理的BMDNs显示出更高的Nrf2蛋白和其转录靶基因Gpx4、Gclc和Nqo1的表达。在用E0771 TES激活的BMDNs中,ML385增强了脂质过氧化,而Nrf2活化剂NK252呈剂量依赖性地减少了脂质过氧化。此外,ML385增加了WT TES激活的BMDNs的脂质过氧化,并降低了细胞存活率,使其与经ML385处理的Acod1-/- TES激活的BMDNs相当(图6D-F)。NK252降低了Acod1-/- BMDNs经TES处理后的脂质过氧化,并增加了细胞存活率,在100 uM浓度下减少了WT和Acod1-/- BMDNs之间的差异(图6G-I)。与Acod1-/- BMDNs相比,WT BMDNs含有更多的谷胱甘肽,而外源的4OI或DMI显著增加了两种类型的BMDNs中的谷胱甘肽水平(图6J和图6K)。
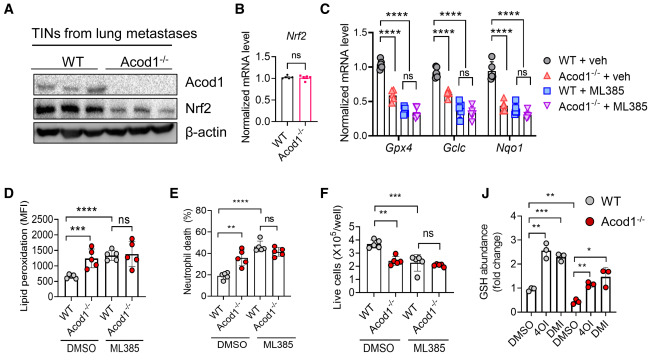
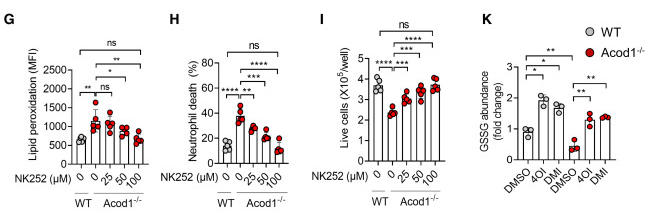
6.Acod1通过激活Nrf2介导的抗氧化应答来减轻TIN的铁死亡
7.Acod1的去除可增强适应性免疫,增强免疫治疗的效果
Acod1去除对转移的抑制效果依赖于适应性免疫,因为Rag1-/- Acod1+/+和Rag1-/- Acod1-/-小鼠显示出相似的E0771-TR肺转移负荷和存活时间(图A-C)。由于Acod1缺乏削弱了TINs的功能,检测Acod1去除对肿瘤浸润T细胞和免疫检查点阻断(ICB)对肺转移的疗效的影响。使用E0771-TR肺转移模型,观察到虽然Acod1去除和ICB(αPD1加αCTLA4)各自延长了小鼠的存活时间,但经过ICB治疗的Acod1-/-宿主显示出显著延长的存活时间(图D)。在静脉注射后的第15天进行的免疫表型分析显示,肺部的TIN密度在Acod1去除和ICB联合治疗中降低最显著(图E)。经过ICB治疗的Acod1-/-小鼠群体在转移性肿瘤微环境中显示出最有利的抗肿瘤T细胞免疫状态,其特征是总CD8 + T细胞、IFNγ + CD8 + T细胞、Gzmb + CD8 + T细胞和总CD4 + T细胞的百分比最高,T regs的百分比最低(图F)。经过ICB治疗的Mrp8-cre + Acod1 f/f小鼠的存活时间显著长于经ICB治疗的Acod1 f/f小鼠的存活时间(图G)。当ICB治疗的Mrp8-cre + Acod1 f/f小鼠接受Fer-1或安慰剂处理时,Fer-1加速了携带转移病变小鼠的死亡(图H),这表明中性粒细胞中的Acod1去除通过上调中性粒细胞的铁死亡来增强ICB的作用。Acod1的去除没有改变PD-L1和Arg1的表达。来自肺转移灶的WT和Acod1-/- TINs对CD4 +和CD8 + T细胞的抑制作用相似。来自携带转移病变的WT和Acod1-/-小鼠的脾脏中性粒细胞对T细胞的抑制作用要弱得多,并且两种基因型之间没有差异。数据表明,Acod1的上调使TINs在转移病灶中存活和持久存在,以通过TINs的其他机制持续执行免疫抑制。
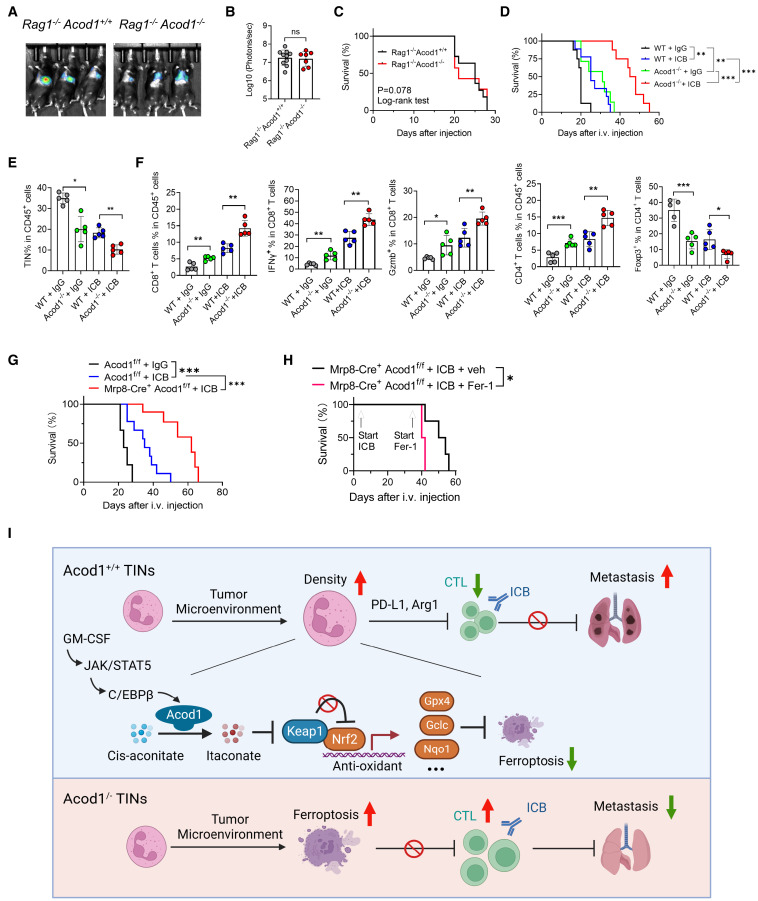
图7.Acod1的去除可增强适应性免疫,增强免疫治疗的效果
结论
作者发现免疫抑制性TIN通过上调Acod1和产生衣康酸酯在转移性TME中存活,衣康酸酯激活Nrf2依赖性抗氧化反应以逃避铁死亡并在转移中维持TIN 丰度。
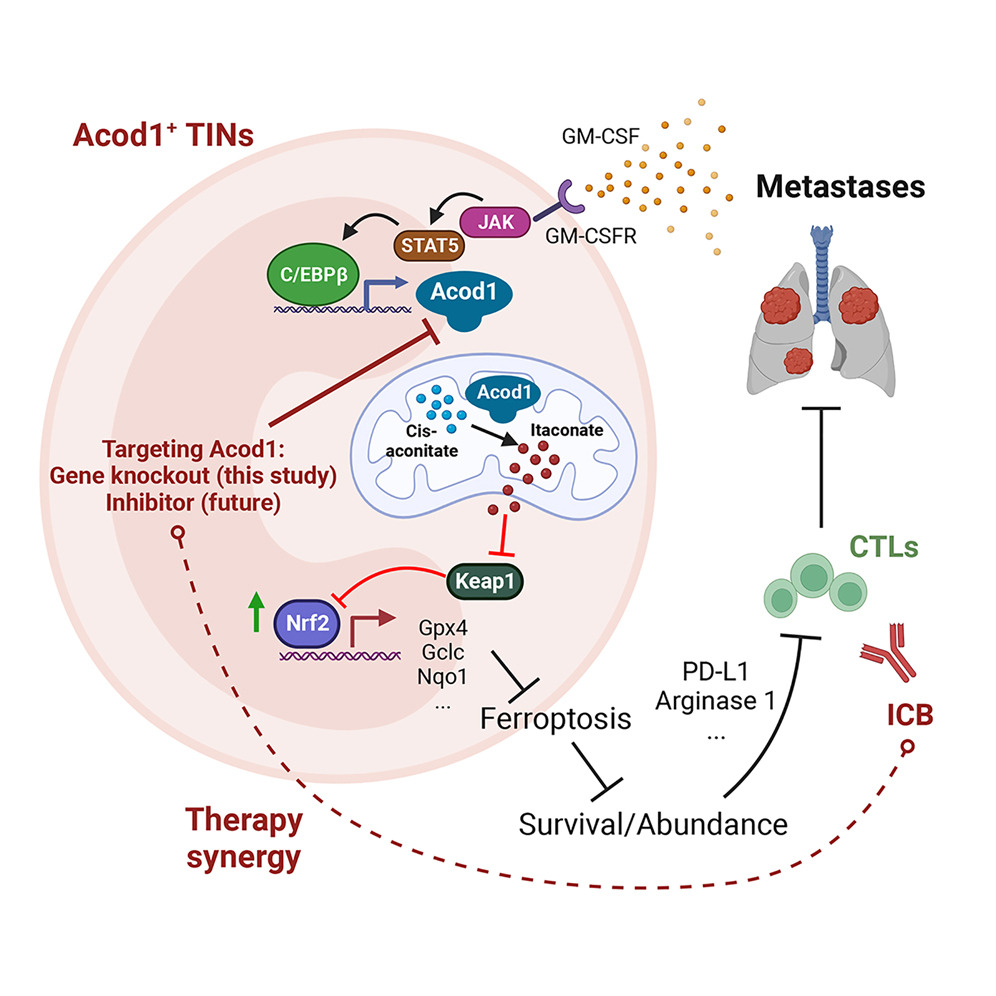
实验方法
IPA分析,scRNA-seq,转录组学,免疫荧光,qRT-PCR,ROS定量分析,免疫表型分析,蛋白质印迹分析,细胞培养,流式细胞术,小鼠肿瘤移植实验
参考文献
Zhao Y, Liu Z, Liu G, Zhang Y, Liu S, Gan D, et al. Neutrophils resist ferroptosis and promote breast cancer metastasis through aconitate decarboxylase 1. Cell Metab. 2023 Oct 3;35(10):1688-1703.e10. doi: 10.1016/j.cmet.2023.09.004.






