调节性T细胞(Tregs)摘要分享
Tregs是一种独特的细胞群,可以调节和抑制免疫系统中的其他细胞,促进对自身和外来抗原的免疫耐受。它们是在几十年前被发现的,已知在维持免疫稳态中具有战略作用。它们的功能与多种病理的发展密切相关,包括自身免疫和癌症。越来越多的证据表明,消除Tregs可以增强抗肿瘤免疫反应。然而,Treg细胞的系统性消耗可同时引起有害的自身免疫。
Tregs的活性是研究最广泛的调节免疫反应的机制。Tregs可以控制与感染相关的炎症,也可以控制不适当的针对组织或细胞的炎症。活化的T调节性细胞产生抑制性细胞因子。Tregs抑制免疫系统的能力可能是由于与其他细胞的直接相互作用,但也可能通过分泌抑制化合物以旁分泌的方式。尽管效应T细胞的代谢过程是众所周知的,但对Tregs机制的理解尚未完全阐明。
最近相关文章摘要
1、肿瘤微环境中调节性T细胞的保守转录连通性为新的联合癌症治疗策略提供了信息

虽然调节性T细胞(Treg)传统上被认为是自身免疫和癌症中抗原提呈细胞和效应T细胞的专业抑制因子,但最近关于Treg细胞在组织维持中的独特功能的发现表明,它们的调节范围扩展到更广泛的细胞范围,并且比以前认为的更广泛。为了阐明肿瘤Treg细胞与多种支持肿瘤的辅助细胞类型的“连通性”,我们探索了实验性肺癌和损伤性炎症中Treg细胞准时耗竭时单细胞转录组的即时早期变化。在任何显著的T细胞激活和炎症之前,成纤维细胞、内皮细胞和髓细胞在癌症和损伤环境中都表现出明显的基因表达变化。因子分析揭示了共同的Treg细胞依赖基因程序,最重要的是,在任何一种情况下,VEGF和CCR2信号相关基因在Treg细胞剥夺以及Treg细胞贫乏与Treg细胞丰富的人肺腺癌中都有显著的上调。因此,与相应的单药治疗相比,准时Treg细胞消耗联合短期VEGF阻断显著改善了小鼠PD-1阻断耐药肺腺癌进展的控制,突出了一种有希望的基于因子的查询方法来阐明新的合理的实体器官癌联合治疗。
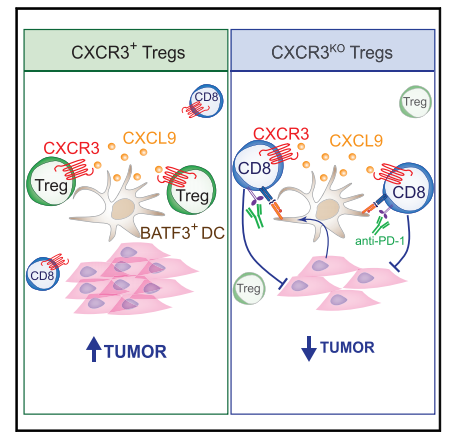
2、CXCR3在调节性T细胞中的表达驱动与肿瘤中I型树突状细胞的相互作用,从而限制CD8+ T细胞抗肿瘤免疫

调节性T细胞(Treg)是一种CD4+ T细胞的免疫抑制群体,浸润到实体癌症中代表了癌症免疫治疗的障碍。趋化因子受体是炎症组织(包括癌症)中Treg细胞募集和细胞间相互作用的关键,因此是理想的治疗靶点。在这里,我们在多种癌症模型中发现,与淋巴组织相比,CXCR3+ Treg细胞在肿瘤中增加,表现出活化的表型,并优先与产生CXCL9的BATF3+树突状细胞(DC)相互作用。Treg细胞中CXCR3的基因消融破坏了DC1-Treg细胞的相互作用,同时增加了DC-CD8+ T细胞的相互作用。机制上,Treg细胞中CXCR3消融增加了DC1s的肿瘤抗原特异性交叉呈递,增加了肿瘤中CD8+ T细胞的启动和再激活。这最终会损害肿瘤进展,特别是与抗PD -1检查点阻断免疫疗法联合使用。总的来说,CXCR3被证明是肿瘤中Treg细胞积累和免疫抑制的关键趋化因子受体。
3、双免疫检查点阻断在功能失调的CD8+ T细胞和活化的Treg细胞室中诱导相似的改变

为了探讨新辅助PD-1和CTLA4阻断对治疗- 初始头颈部鳞状细胞癌瘤内T细胞的影响,我们分析了应答和无应答患者的原发肿瘤免疫浸润。在基线时,活性(4-1BB/OX-40+)和非活性调节性CD4+ T细胞之间的比例较高与免疫治疗应答相关。此外,在治疗后,这些活跃的Treg群体显示出应答患者的显著减少。在一个类似的过程中,肿瘤内功能失调的CD8+ T细胞在有反应的患者中表现出活性和功能失调相关基因的表达降低,而在临床无反应的NK细胞在治疗早期表现出增加的细胞毒性谱。这些数据揭示了对PD-1/CTLA4双重阻断的免疫变化,包括应答患者中假定的肿瘤反应性Treg和CD8+ T细胞区室的平行重塑,并表明在基线时激活Treg的存在可能与应答有关。
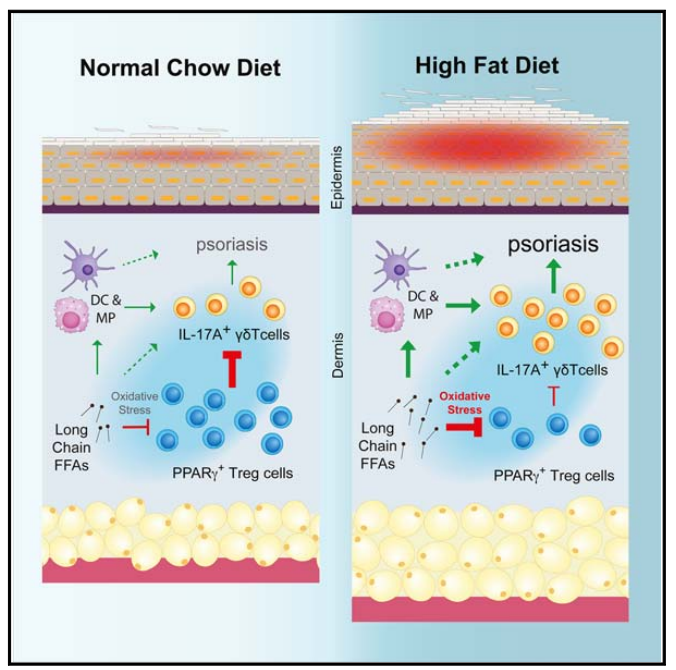
4、肥胖引起的皮肤PPARγ+ Treg细胞失调促进IL - 17A介导的银屑病炎症

肥胖是银屑病的主要危险因素,但肥胖如何破坏控制皮肤炎症的调节机制尚不清楚。在这里,我们发现皮肤富含独特的CD4+ Foxp3+表达核受体过氧化物酶体增殖激活受体γ (PPARγ)的调节性T (Treg)细胞群。PPARγ驱动了IL-17A+ γδ T细胞介导的银屑病炎症的独特转录程序和功能抑制。然而,饮食诱导的肥胖导致PPARγ+皮肤Treg细胞减少,并相应失去对IL-17A+ γδ T细胞介导的炎症的控制。在机制上,肥胖小鼠的PPARγ+皮肤Treg细胞优先吸收高水平的长链游离脂肪酸,从而导致细胞脂毒性、氧化应激和线粒体功能障碍。利用这些PPARγ+皮肤Treg细胞的抗炎特性可能具有治疗肥胖相关炎症性皮肤病的潜力。
5、肥胖引起的皮肤PPARγ+ Treg细胞失调促进IL - 17A介导的银屑病炎症

白细胞介素-2 (IL-2)是一种多效性细胞因子,通过调节性T细胞(Tregs)和效应细胞协调双向免疫反应,导致矛盾的后果。在这里,我们报告了一种策略,利用遗传密码扩展引导将潜在的生物反应性人工氨基酸氟硫酸盐- L -酪氨酸(FSY)结合到IL-2中,与IL-2Rα进行接近性共价结合,以选择性地促进Treg激活。我们发现,携带FSY的IL-2变体,如L72-FSY,在接近时通过硫氟交换与IL-2Rα共价结合,导致IL-2的持续循环,并选择性地促进Tregs细胞的扩增,而不是效应细胞。对L72-FSY扩增Tregs的进一步评估表明,L72-FSY将Tregs维持在中枢记忆表型,而不会驱动终末分化,这可以通过淋巴细胞活化基因3 (LAG-3)的表达减弱和程序性细胞死亡蛋白1 (PD-1)的表达增强来证明。与野生型IL-2治疗相比,皮下给药L72-FSY对普利坦诱导的狼疮和移植物抗宿主病(GvHD)小鼠模型的治疗效果增强且持续。通过N端聚乙二醇修饰,L72-FSY的疗效进一步提高,从而增加了其循环保留,从而获得优先和持续的效果。这种接近共价结合策略可能会加速多效细胞因子作为一类新的免疫调节疗法的发展。
6、自身免疫性肾脏疾病和移植中的调节性T细胞

表达转录因子叉头盒蛋白P3 (FOXP3)的调节性T (Treg)细胞天然存在于免疫系统中,并在维持免疫自身耐受和免疫系统和组织稳态中发挥作用。Treg细胞通过多种机制,特别是通过控制抗原提呈细胞的功能,抑制T细胞的活化、扩增和效应功能。它们还可以通过抑制炎症和促进组织再生来促进组织修复,例如,通过产生生长因子和促进干细胞分化和增殖。Treg细胞的单基因异常和Treg细胞功能分子的遗传变异可导致或使患者易患自身免疫性疾病和其他炎症性疾病,包括肾脏疾病。Treg细胞可以潜在地利用或靶向治疗免疫疾病并建立移植耐受性,例如,通过使用IL-2或小分子在体内扩增天然Treg细胞,或通过在体外扩增它们以进行过继性Treg细胞治疗。目前正在努力将抗原特异性的传统T细胞转化为Treg细胞,并从天然Treg细胞中产生嵌合抗原受体Treg细胞,用于过继性Treg细胞治疗,目的是在临床中实现抗原特异性免疫抑制和耐受。
参考文献
1. Glasner A, Rose SA, Sharma R, Gudjonson H, Chu T, Green JA, Rampersaud S, Valdez IK, Andretta ES, Dhillon BS, Schizas M, Dikiy S, Mendoza A, Hu W, Wang ZM, Chaudhary O, Xu T, Mazutis L, Rizzuto G, Quintanal-Villalonga A, Manoj P, de Stanchina E, Rudin CM, Pe'er D, Rudensky AY. Conserved transcriptional connectivity of regulatory T cells in the tumor microenvironment informs new combination cancer therapy strategies. Nat Immunol. 2023 Jun;24(6):1020-1035. doi: 10.1038/s41590-023-01504-2. Epub 2023 May 1. PMID: 37127830; PMCID: PMC10232368.
2. Moreno Ayala MA, Campbell TF, Zhang C, Dahan N, Bockman A, Prakash V, Feng L, Sher T, DuPage M. CXCR3 expression in regulatory T cells drives interactions with type I dendritic cells in tumors to restrict CD8+ T cell antitumor immunity. Immunity. 2023 Jul 11;56(7):1613-1630.e5. doi: 10.1016/j.immuni.2023.06.003. Epub 2023 Jun 30. PMID: 37392735.
3. van der Leun AM, Traets JJH, Vos JL, Elbers JBW, Patiwael S, Qiao X, Machuca-Ostos M, Thommen DS, Haanen JBAG, Schumacher TNM, Zuur CL. Dual Immune Checkpoint Blockade Induces Analogous Alterations in the Dysfunctional CD8+ T-cell and Activated Treg Compartment. Cancer Discov. 2023 Oct 5;13(10):2212-2227. doi: 10.1158/2159-8290.CD-22-0851. PMID: 37548431; PMCID: PMC10551666.
4. Sivasami P, Elkins C, Diaz-Saldana PP, Goss K, Peng A, Hamersky M 4th, Bae J, Xu M, Pollack BP, Horwitz EM, Scharer CD, Seldin L, Li C. Obesity-induced dysregulation of skin-resident PPARγ+ Treg cells promotes IL-17A-mediated psoriatic inflammation. Immunity. 2023 Aug 8;56(8):1844-1861.e6. doi: 10.1016/j.immuni.2023.06.021. Epub 2023 Jul 20. PMID: 37478855; PMCID: PMC10527179.
5. Zhang B, Sun J, Yuan Y, Ji D, Sun Y, Liu Y, Li S, Zhu X, Wu X, Hu J, Xie Q, Wu L, Liu L, Cheng B, Zhang Y, Jiang L, Zhao L, Yu F, Song W, Wang M, Xu Y, Ma S, Fei Y, Zhang L, Zhou D, Zhang X. Proximity-enabled covalent binding of IL-2 to IL-2Rα selectively activates regulatory T cells and suppresses autoimmunity. Signal Transduct Target Ther. 2023 Jan 23;8(1):28. doi: 10.1038/s41392-022-01208-3. PMID: 36690610; PMCID: PMC9871032.
6. Mikami N, Sakaguchi S. Regulatory T cells in autoimmune kidney diseases and transplantation. Nat Rev Nephrol. 2023 Sep;19(9):544-557. doi: 10.1038/s41581-023-00733-w. Epub 2023 Jul 3. Erratum in: Nat Rev Nephrol. 2023 Nov;19(11):747. PMID: 37400628.






