OIP5-AS1的m6A修饰介导hnRNPA1泛素化和降解,促进胃癌的糖酵解、肿瘤发生和转移

opa相互作用蛋白5反义转录物1 (OIP5-AS1)在胃癌等多种肿瘤的发生、发展中起重要作用。然而,OIP5-AS1的详细分子机制尚未完全阐明。在本研究中,作者发现OIP5-AS1在胃癌组织和细胞系中特异性高表达,并与不良预后相关。OIP5-AS1的缺失抑制胃癌细胞的增殖、迁移、侵袭、上皮-间充质转化(EMT)和糖酵解,而OIP5-AS1的异位表达则产生相反的影响。同时,敲低OIP5-AS1抑制了患者来源的异种移植模型的肿瘤生长,并抑制了肿瘤转移。机制上,IGF2BP3通过OIP5-AS1上的N6 -甲基腺苷(m6A)修饰位点与OIP5-AS1结合,从而稳定OIP5-AS1。此外,OIP5-AS1阻止Trim21介导的hnRNPA1泛素化降解,稳定hnRNPA1蛋白,并通过调控PKM2信号通路促进胃癌恶性进展。该研究于2023年10月发表在《Gastric Cancer》,IF:7.4。
技术路线
主要研究结果
1. OIP5 - AS1的高表达与胃癌患者的临床指标密切相关
初步分析GEPIA STAD数据库,发现与癌旁非肿瘤组织相比,OIP5-AS1在胃癌组织中显著升高(图1A)。采用qRT-PCR检测OIP5-AS1在90对胃癌及相应的癌旁组织中的表达,发现OIP5-AS1在肿瘤组织中的表达高于正常组织(图1B)。检测OIP5-AS1表达与胃癌患者临床病理参数之间的关系,发现OIP5-AS1与TNM阶段、T阶段和远处转移呈正相关(图1C-E)。在年龄、性别和淋巴结转移方面未观察到显著差异(图1E-G)。此外,Kaplan-Meier分析表明,与OIP5-AS1表达水平较低的患者相比,OIP5-AS1表达水平较高的患者总体生存率较差(图1H)。与人正常胃黏膜细胞株GES-1相比,OIP5-AS1在胃癌细胞株(MGC-803、BGC-823、SGC-7901和AGS)中的表达水平显著上调(图1I),与临床结果一致。最后,使用FISH和亚细胞分离实验来验证OIP5-AS1在胃癌细胞中是一个细胞质lncRNA(图1J, K)。
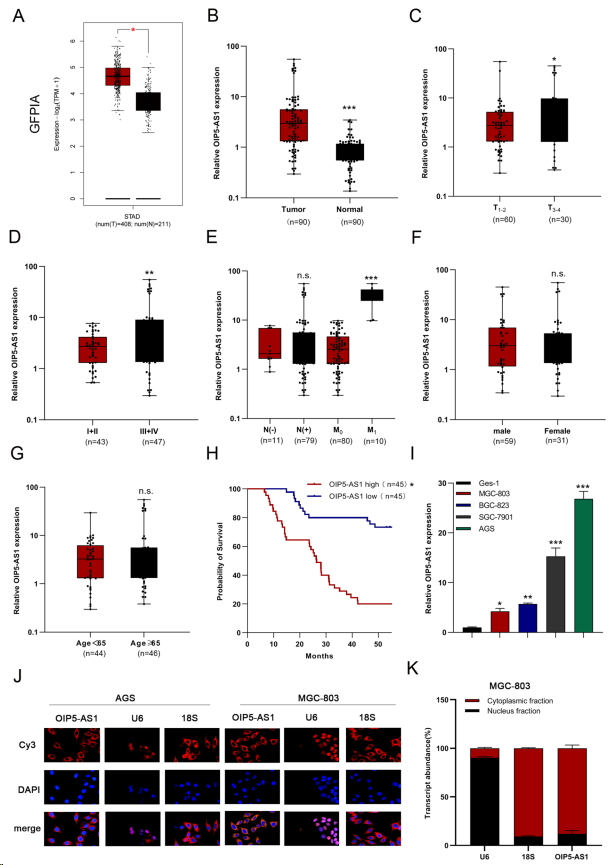
图1. OIP5-AS1的高表达水平与胃癌患者的临床参数密切相关
2. OIP5 - AS1加速体外细胞生长和集落形成以及体内肿瘤形成
为研究OIP5-AS1在GC细胞中的调控作用,使用慢病毒载体在MGC-803细胞中稳定过表达OIP5-AS1,并在AGS细胞中使用两个不同的shRNA序列稳定沉默OIP5-AS1(图2A)。CCK-8和EdU分析显示,敲除OIP5-AS1显著减弱细胞增殖能力,而过表达OIP5-AS1则促进细胞增殖(图2B-D)。同样,OIP5-AS1缺陷降低细胞的克隆形成能力,而OIP5-AS1过表达促进GC细胞的生长(图2E,F)。此外,下调OIP5-AS1显著降低Cyclin D1和CDK2的表达,同时增加p21和p27的表达,这在OIP5-AS1过表达细胞系中得到验证(图2G)。为验证OIP5-AS1在体内对胃癌肿瘤生长的影响,利用新鲜胃癌组织建立患者来源的异种移植模型,尾静脉接种sh-OIP5-AS1或shNC慢病毒。沉默OIP5-AS1组产生的肿瘤体积和重量均显著低于对照组(图2H-K)。此外,IHC分析显示,sh- OIP5-AS1处理组中增殖标志物PCNA的表达降低(图2L)。此外,与对照组相比,OIP5-AS1被阻断后,移植瘤中OIP5-AS1的表达明显下调(图2M)。
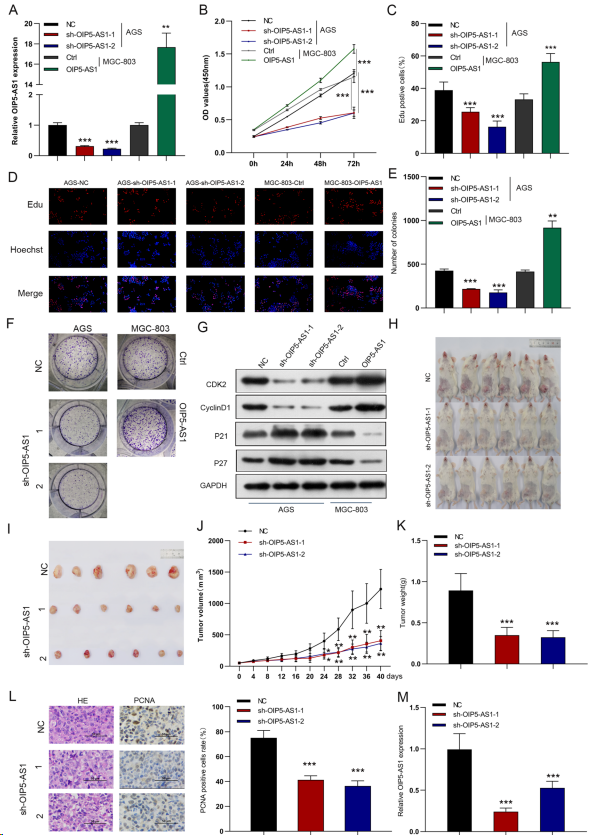
图2. OIP5-AS1在体外促进细胞生长和集落形成,在体内促进肿瘤形成
3. OIP5-AS1在体外促进胃癌细胞的迁移和侵袭,在体内促进胃癌移植瘤的转移
随后,通过划痕实验和transwell侵袭实验来研究OIP5-AS1在胃癌细胞转移行为中的作用。如图3A所示,沉默OIP5-AS1的表达被显著抑制,而强制OIP5-AS1的表达增强GC细胞的迁移能力。同样,OIP5-AS1沉默细胞的侵袭速度明显较慢,而OIP5-AS1过表达细胞的侵袭速度比相应对照细胞快(图3B)。western blot结果显示,沉默OIP5-AS1上调上皮-间充质转化(EMT)相关蛋白e -钙黏蛋白(E-cadherin)表达,下调n-钙黏蛋白(N-cadherin)、波形蛋白(vimentin)和slug表达,但过表达OIP5-AS1具有相反的作用(图3C)。为研究OIP5-AS1在体内肿瘤转移中的作用,作者将荧光素酶标记的Ctrl-、OIP5-AS1-、sh-OIP5-AS1-或shNC转染细胞注射到NOD-SCID小鼠的尾静脉中。图3D, E 显示OIP5-AS1沉默组小鼠肺内转移性生长显著减少,而OIP5-AS1过表达组小鼠肺内转移性生长显著增加。

图3. OIP5-AS1在体外促进胃癌细胞的迁移和侵袭,在体内促进移植瘤的转移
4. OIP5 - AS1调控胃癌细胞中的Warburg效应
进行葡萄糖摄取、乳酸和海马实验检测OIP5-AS1是否影响有氧糖酵解。正如预期的那样,沉默OIP5-AS1的细胞显示出葡萄糖摄取和乳酸生成的显著下降。然而,过表达OIP5-AS1的细胞增加葡萄糖摄取和乳酸生成(图4A,B)。此外,敲低OIP5-AS1抑制糖酵解和糖酵解能力,而OIP5-AS1过表达显著增强GC细胞的糖酵解和糖酵解能力(图4C)。OIP5-AS1敲低显著增加ATP生成和最大呼吸,而强制表达OIP5-AS1可降低这些因子(图4D)。采用糖酵解抑制剂2-脱氧葡萄糖(2-DG)评估OIP5-AS1是否通过调节有氧糖酵解影响细胞增殖和转移。在CCK-8和Transwell侵袭实验中,2-DG处理抑制OIP5-AS1敲除和OIP5-AS1过表达细胞的增殖和转移(图4E,F)。
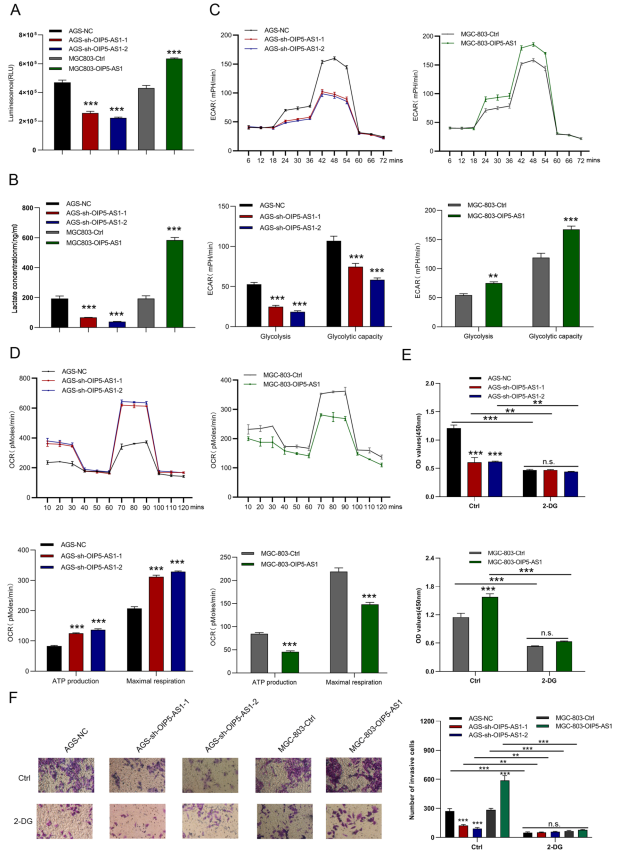
图4. OIP5-AS1调控GC细胞的Warburg效应
5. IGF2BP3以依赖m6A的方式调控OIP5 - AS1的表达
在AGS细胞中,IGF2BP3直接与OIP5-AS1结合,如RNA下拉实验所示(图5A)。随后的RIP实验验证IGF2BP3抗体在AGS细胞中对OIP5-AS1的富集,证实IGF2BP3与OIP5-AS1之间的相互作用(图5B)。利用SRAMP(m6A修饰位点预测因子)预测OIP5-AS1序列中的经典m6A基序(GAACT),从而推测OIP5-AS1在AGS细胞中可能存在m6A修饰。采用MeRIP实验验证OIP5-AS1中m6A修饰(图5C)。此外,RNA pull-down实验显示,突变OIP5-AS1中的m6A基序后,IGF2BP3与OIP5-AS1的结合显著下降,表明IGF2BP3与OIP5-AS1的结合依赖于m6A修饰(图5D)。METTL3是一种重要的m6A甲基转移酶,被称为m6A writer,在胃癌组织中高表达,与患者的不良预后相关。因此,在GC细胞中敲低IGF2BP3或METTL3,以研究IGF2BP3是否调节OIP5-AS1的稳定性,发现IGF2BP3的表达显著降低(图5E)。然后,使用转录抑制剂Actinomycin D处理来研究OIP5-AS1随时间的稳定性。IGF2BP3的沉默导致OIP5-AS1的稳定性和半衰期明显降低(图5F)。同样,METTL3的缺失显著缩短OIP5-AS1的半衰期(图5F)。与对照组相比,在使用IGF2BP3或m6A特异性抗体进行RIP检测时,METTL3敲低显著影响OIP5-AS1的富集(图5G,H)。
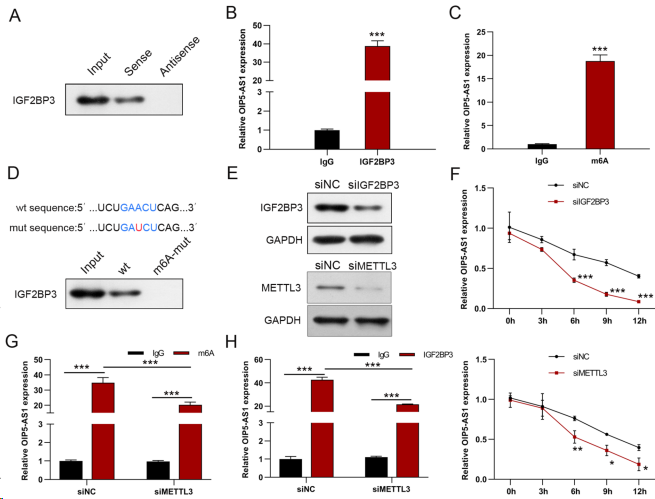
图5. IGF2BP3以依赖m6A的方式调控OIP5-AS1的表达
6. IGF2BP3通过OIP5‑AS1调节GC细胞的生物活性
将siIGF2BP3和OIP5-AS1慢病毒共转染AGS细胞,探讨IGF2BP3是否参与OIP5-AS1介导的胃癌细胞生物学功能。qRT-PCR结果表明,在GC细胞中过表达OIP5-AS1后,si-IGF2BP3转染细胞中的OIP5-AS1表达水平部分升高(图6A)。IGF2BP3敲低显著抑制胃癌细胞的增殖、迁移和侵袭,而这些作用可被OIP5-AS1上调逆转(图6B-G、7A、B)。此外,IGF2BP3沉默细胞中葡萄糖摄取、乳酸生成、糖酵解、糖酵解能力下降、ATP生成增加和最大呼吸作用可被OIP5-AS1过表达逆转(图7C-E)。这些结果表明,OIP5-AS1抑制剂部分介导IGF2BP3的癌基因效应。
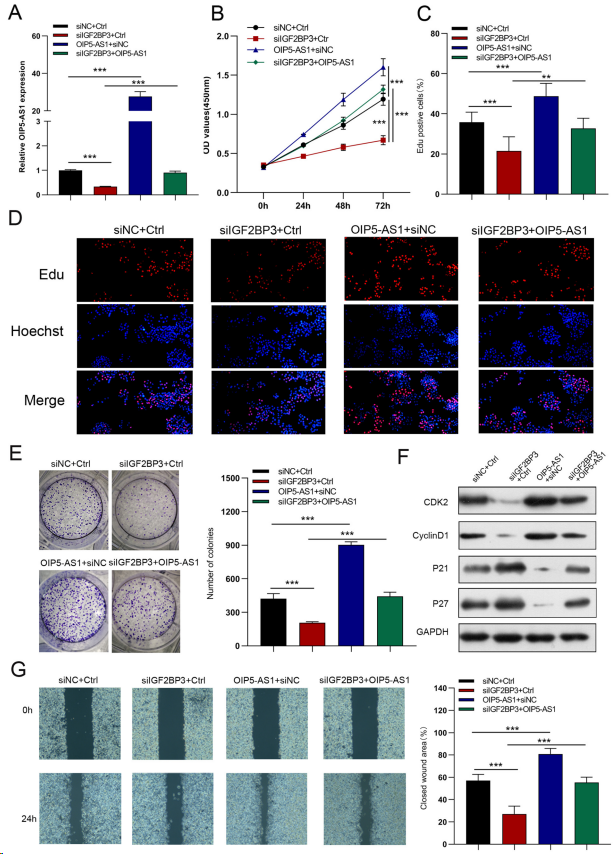
图6. IGF2BP3通过OIP5- AS1调节GC细胞的生物活性
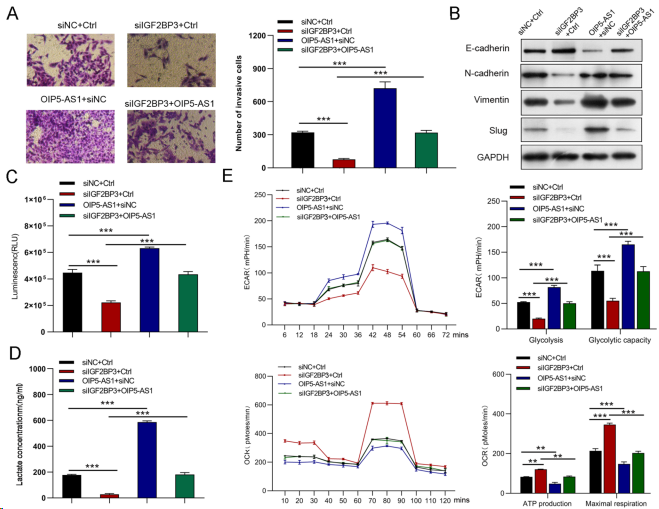
图7. IGF2BP3通过OIP5-AS1调控GC细胞侵袭、EMT和葡萄糖代谢
7. OIP5 - AS1通过阻断Trim21介导的hnRNPA1泛素化和降解来增强hnRNPA1的稳定性
RNA pull-down和RIP实验证实OIP5-AS1可能与hnRNPA1相互作用(图8A,B)。根据截断实验,hnRNPA1与OIP5-AS1的0 ~ 500 nt片段结合(图8C)。检测敲低OIP5-AS1的AGS细胞和过表达OIP5-AS1的MGC-803细胞中hnRNPA1的表达水平,进一步阐明OIP5-AS1与hnRNPA1相互作用的分子机制。观察到,在OIP5-AS1沉默和OIP5-AS1过表达的细胞中,hnRNPA1 mRNA水平保持不变(图8D)。然而,在OIP5-AS1下调的细胞中,hnRNPA1蛋白水平显著降低,而在OIP5-AS1上调的细胞中,hnRNPA1蛋白水平显著升高(图8E)。蛋白稳定性实验显示,敲低OIP5-AS1可以显著缩短GC细胞中hnRNPA1蛋白的半衰期,而过表达OIP5-AS1则显著增加hnRNPA1蛋白的半衰期(图8F,G)。此外,当使用蛋白酶体抑制剂MG132处理GC细胞时,OIP5-AS1沉默后hnRNPA1蛋白水平的下降被减弱,而OIP5-AS1过表达则有相反的效果(图8H)。此外,OIP5-AS1敲低细胞的hnRNPA1泛素化水平增加,而OIP5-AS1过表达细胞的hnRNPA1泛素化水平降低(图8I),表明OIP5-AS1参与胃癌细胞中hnRNPA1的蛋白酶体依赖性降解。此外,OIP5-AS1敲低增强PKM1的表达,同时降低PKM2的表达(图8J)。相反,强制表达OIP5-AS1降低PKM1的表达,增加PKM2的表达(图8J)。如图8K所示,与GES-1细胞相比,GC细胞系中Trim21的表达水平低,hnRNPA1的表达水平高。此外,尽管OIP5-AS1的表达水平没有显著差异,但在Trim21过表达的细胞中,hnRNPA1的表达水平被下调(图8L,M)。进行CO-IP检测,观察到在AGS细胞中,Trim21与hnRNPA1结合(图8N)。此外,当OIP5-AS1被沉默或过表达时,检测Trim21和hnRNPA1之间的关联。OIP5-AS1的下调显著改善,而OIP5-AS1的上调降低Trim21和hnRNPA1的相互作用(图8O)。
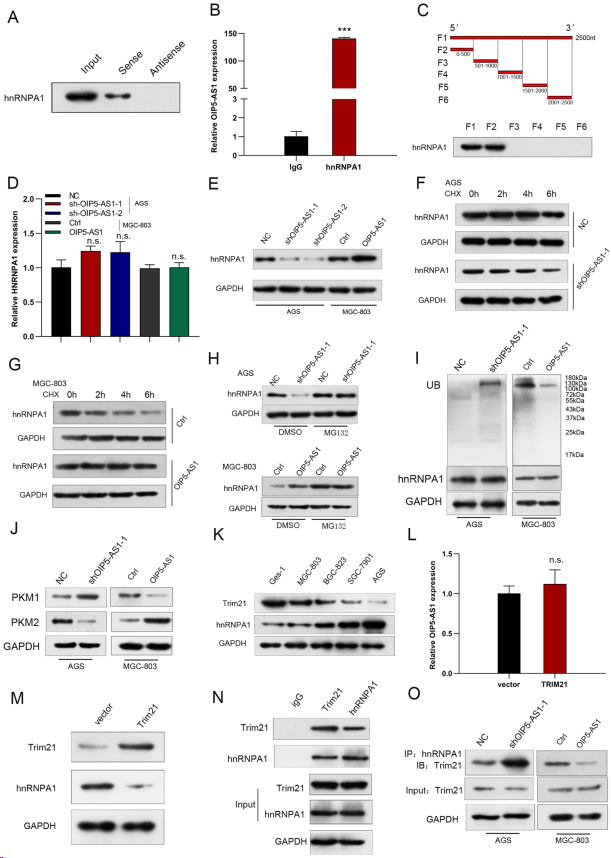
图8. OIP5-AS1通过阻断Trim21介导的hnRNPA1泛素化和降解增强hnRNPA1的稳定性
8. hnRNPA1介导胃癌细胞中OIP5-AS1的调控
为验证OIP5-AS1是否影响HNRNPA1调控的胃癌细胞功能,进行挽救实验。蛋白质印迹分析显示,sh-OIP5- AS1下调的hnRNPA1和PKM2蛋白表达以及上调的PKM1蛋白表达可以被hnRNPA1过表达所逆转(图9A),但在hnRNPA1沉默后,OIP5-AS1过表达所诱导的hnRNPA1和PKM2蛋白表达增加以及PKM1蛋白表达降低被消除(图11A)。hnRNPA1的强制表达部分恢复OIP5-AS1敲低介导的GC细胞生长、迁移和侵袭的抑制(图9B-G,10A,B),而hnRNPA1的抑制部分逆转OIP5-AS1上调诱导的GC细胞生长和转移的促进作用(图11B-G,12A,B)。此外,hnRNPA1的刺激恢复降低的葡萄糖摄取、乳酸生成、糖酵解和糖酵解能力。同时增强OIP5-AS1沉默引起的ATP生成和最大呼吸(图10C-F)。然而,hnRNPA1下调消除OIP5-AS1过表达引起的葡萄糖摄取、乳酸生成、糖酵解和糖酵解能力升高,并降低ATP生成和最大呼吸(图12C-F)。综上所述,OIP5-AS1通过竞争性结合hnRNPA1发挥致癌作用。
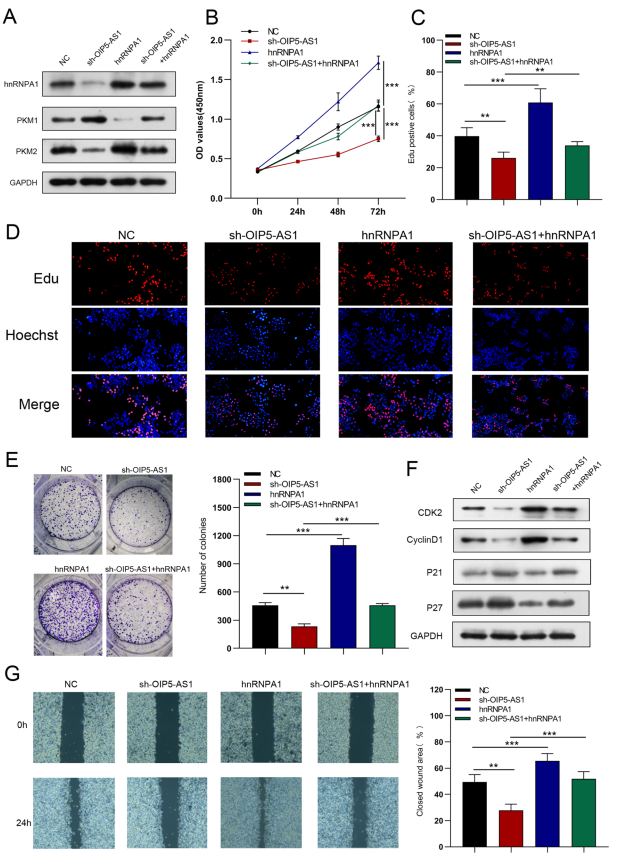
图9. hnRNPA1介导GC细胞中OIP5-AS1的调控
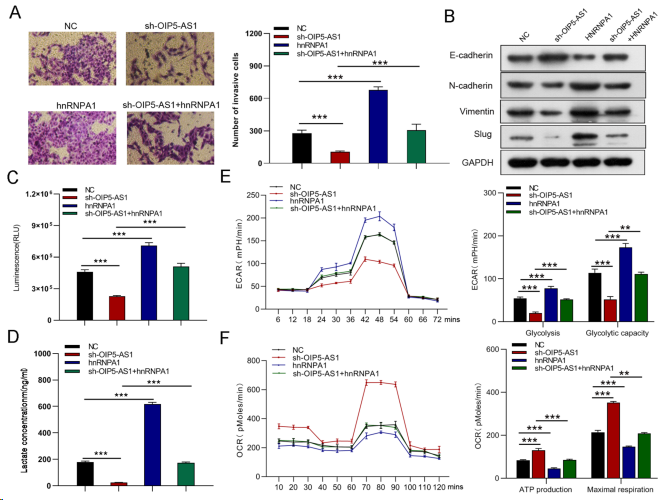
图10. hnRNPA1介导OIP5-AS1对GC细胞侵袭、EMT和糖代谢的调节
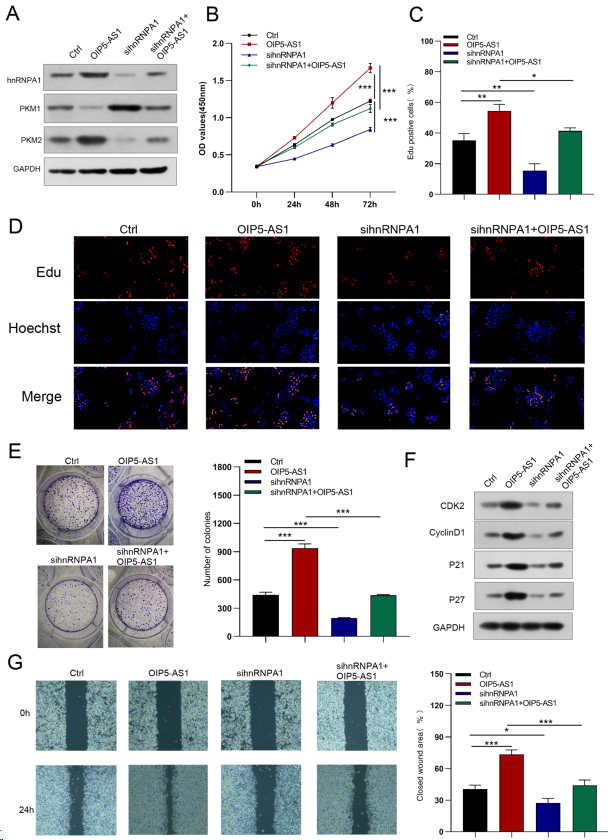
图11. 沉默hnRNPA1抑制OIP5- AS1对胃癌细胞生长和迁移的促进作用
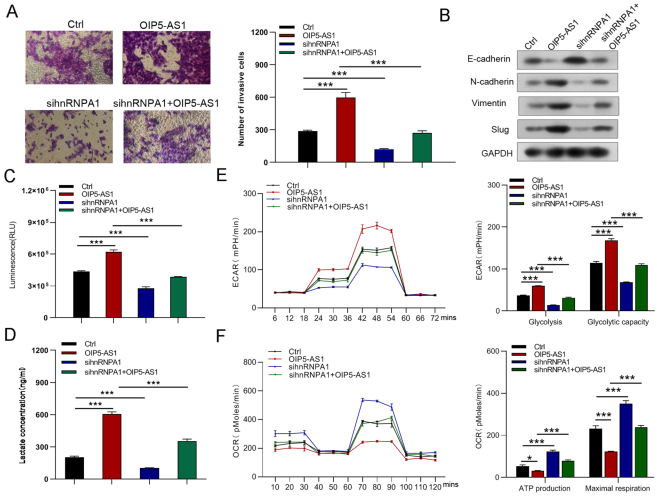
图12. 敲低hnRNPA1可逆转OIP5-AS1对MGC823细胞侵袭、EMT和糖酵解的促进作用
结论
综上所述,本研究发现经m6A修饰稳定的OIP5-AS1通过抑制Trim21介导的HNRNPA1泛素化和降解促进胃癌进展,导致PKM2形成。这些发现有助于我们对胃癌中IGF2BP3/OIP5-AS1/Trim21/hnRNPA1/PKM2轴的理解,并提示OIP5-AS1可能为胃癌的诊断和治疗开辟一个潜在的新视角。
实验方法
质粒,慢病毒和转染,细胞培养,qRT‑PCR,WB,IHC和HE染色,CCK-8,EdU实验,菌落形成,Transwell侵袭实验,伤口愈合实验,RIP,Co‑IP,RNA pull down和截断实验,RNA稳定性测定,泛素化分析,MeRIP,葡萄糖摄取和乳酸测定,亚细胞RNA分离,细胞外酸化速率和耗氧量测定,患者来源的异种移植模型,体内动物模型转移实验,蛋白质稳定性测定
参考文献
Xie R, Liu L, Lu X, He C, Yao H, Li G. N6-methyladenosine modification of OIP5-AS1 promotes glycolysis, tumorigenesis, and metastasis of gastric cancer by inhibiting Trim21-mediated hnRNPA1 ubiquitination and degradation. Gastric Cancer. 2023 Oct 28. doi: 10.1007/s10120-023-01437-7. Epub ahead of print. PMID: 37897508.






