包裹线粒体的融合脂质体作为治疗骨关节炎有前景的递送系统
利用线粒体(MT)治疗人类疾病已经进行了许多尝试;然而,MT很大,因此很难有效传递。因此,建立了基于膜融合的转移策略。设计并合成了融合线粒体胶囊(FMCs),其包含中性脂质(PE)、阳离子脂质(DOTAP)、芳香族脂质(Liss Rhod PE)和三种类型的脂质体(FMC0、FMC1和FMC2)。影响膜融合效率的DOTAP含量在不同的FMC制剂中有所不同。通过DLS、TEM和AFM分析这些FMC的特征,并分别通过FRET、mtDNA拷贝数和CLSM确认FMC-MT和FMC软骨细胞之间的封装和融合效率。与裸MT相比,FMCs向软骨细胞的输送速度更快、效率更高。此外,融合是一种比内吞作用更稳定的递送方式,这一点从减少了对线粒体自噬的诱导而得到了证明。体外和体内实验表明,FMCs减少炎性细胞因子和MMP13的表达,增加细胞外基质成分的表达,促进软骨再生。这些发现表明,FMCs是一种非常有效和有前途的MT递送策略,以促进软骨再生,并突出了它们作为MT转移治疗的新平台的潜力。本研究于2023年10月发表在《Biomaterials》期刊上,IF=14.0。
主要技术路线
![]()
![]()
![]()
![]()
![]()
![]()

![]()
![]()
![]()
![]()
主要研究结果
1、FCs和FMCs的表征及MT包封评价
在这项研究中,作者从干细胞裂解后获得的核/MT/细胞质中分离出MT(裸(n)MT)。为了确认分离线粒体的纯度,采用Western blot方法鉴定每个部分中的标记蛋白。核膜蛋白Lamin B1被鉴定为核分离标记,细胞骨架蛋白α-微管蛋白被鉴定为细胞质分离标记,线粒体外膜蛋白TOMM20被鉴定为线粒体分离标记。因此,可以确定在每个片段中都表达了相应的标记物,并以此验证线粒体分离良好。为了证实分离的MT的功能,作者测量了裂解物中ATP的量,以及细胞色素C氧化酶(CCO)的表达;两者都随着MT数量的增加而增加。这表明从干细胞分离的MT在细胞外的功能是正常的。
阳离子脂质体被用作运送核酸的载体,核酸是一种阴离子物质,其中一个典型的例子是lipofectamine。受此启发,作者假设阳离子脂质体将有利于负离子线粒体的传递,并进行了这项研究。为了稳定地包封阴离子MT,作者制造了融合越来越多的阳离子脂质DOTAP的促聚变胶囊(FC)。图1A提供了该方法的简要说明。脂质体包括PE、Liss Rhod PE和DOTAP。作者改变阳离子脂质DOTAP的比例为0、1和2。Liss Rhod PE发出红色荧光,使作者能够对脂质体进行详细成像。
首先,作者用CLSM从形态上证实了MTs被包裹在FCs中(图1B)。用Mitotracker Green标记的MT被包裹在脂质体中,绿色荧光与罗丹明(脂质体)的红色荧光重叠。这些重叠的(黄色)信号表明许多MT被包裹在脂质体中。此外,体素图像显示,脂质体中的MT是稳定的。这些结果表明,FC和FMC的形状没有差异,表明FMC包裹线粒体保持了稳定的结构。
为了定量比较MT的包埋效率,进行了FRET(荧光共振能量转移)分析(图1C)。MT用绿色Mitotracker标记(λex=490/λem=516),脂质体用Liss Rhod PE标记(λex=560/λem=583)。利用488 nm激光激发并测量发射波长范围为520~650 nm的曲线图,计算了FRET效率。含DOTAP量最高的FMC2对MT的包封率最高,且随DOTAP含量的增加而增加。总体而言,阳离子脂质体FMC1和FMC2的包封率高于阴离子脂质体FMC0。阳离子脂质体与阴离子线粒体相互作用的条件更有利,其效率与DOTAP的量成正比。因此,基于DOTAP的阳离子脂质体可以作为线粒体胶囊的假设得到了证实。
接下来,进行了筛选实验,以确定MT与FC的最佳包封率。作者发现1:2的比例是最有效的。这一结果得到了异质性分析的验证,结果表明,以此MT与脂质体的比例制备的FMCs中,大鼠线粒体DNA在细胞中的表达最高。因此,在随后的所有实验中,作者都使用了这个比率,并将得到的被包裹的线粒体胶囊称为FMC2。
接下来,利用原子力显微镜(AFM)(图1D)研究了不同DOTAP比率的FCs的物理性质。FCs的直径相似(600-700 nm),但高度不同:FC0测量130 nm,FC1测量50 nm,FC2测量18 nm。相应的RQ值分别为49.85、17.31和7.56。这些结果证实了FCs的柔性与DOTAP的量成正比,而其刚性与DOTAP的量成反比。这些发现突出了DOTAP含量和灵活性对于优化脂质体MT包封率的重要性。综上所述,这些结果表明FMC2是最佳制剂。
FCs和FMCs用透射电子显微镜(TEM)成像(图1E)。在形态上,FCs和FMCs的形态没有差异,表明包裹线粒体的FMCs保持了稳定的结构。
此外,作者通过动态光散射(DLS)测量脂质体大小的变化,间接证实了这些MT被包裹到FCs中。不含MT的FCs(MT非囊化,仅脂质体)小于含有线粒体(MT囊化)的FMCs(图1F)。约25 ~ 80nm的大小变化表明脂质体随着MT的包封而变大。
接下来,作者研究了DOTAP的量如何影响MT包裹后脂质体的Zeta电位(ZP)(图1G)。MT本身具有约38 mV的负电荷;然而,脂质体中带正电荷的脂类携带+40 mV或更多的高电荷。当带正电的DOTAP的比例增大时,ZP增大。使用含有DOTAP的阳离子脂质体(FC1和2)有利于包裹MT,因为它比阴离子脂质体(FC0)更容易通过静电作用与MT的阴离子膜结构反应。此外,与阴离子NMT或FMC0相比,阳离子FMC1和2有望与细胞膜更有利地相互作用。
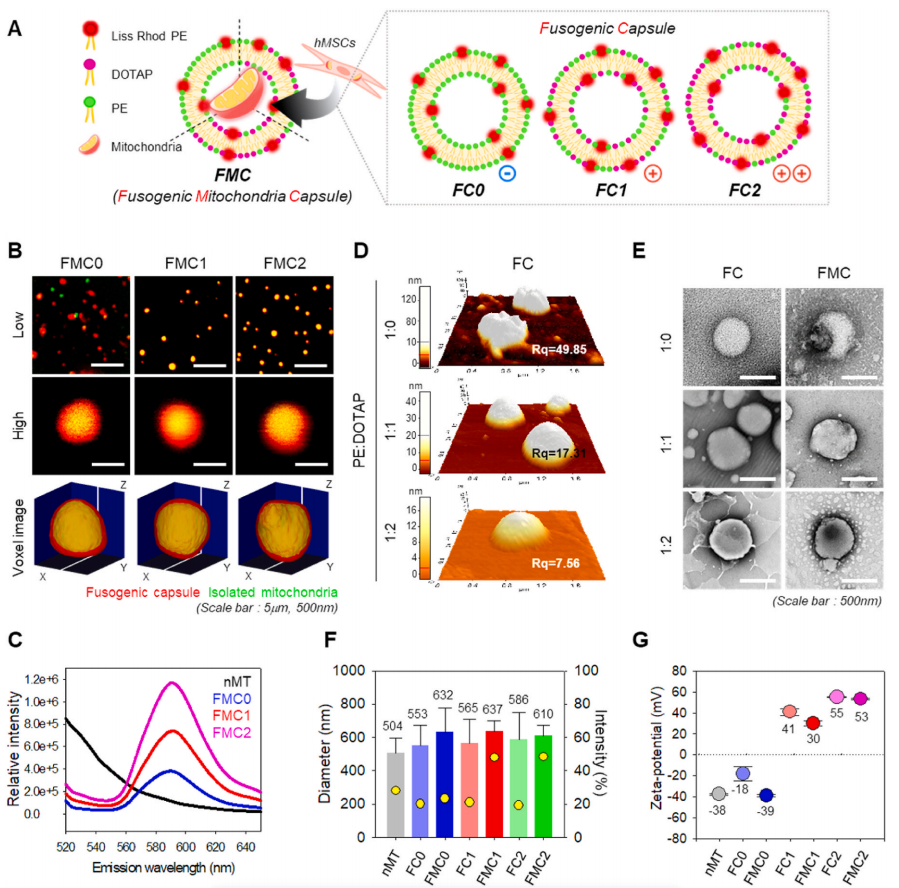
图1 FCs和FMCs的表征,以及FCs的NMT封装
2、FMCs及其内部线粒体的稳定性与NMT的比较
接下来,作者研究了FCs和FMCs随时间的结构稳定性,并与nMT进行了比较(图2)。将制备的FCs和FMCs分别在缓冲溶液中保存12周和5天,并用DLS测量包膜形成的保留程度(图2A)。结果证实,无论DOTAP比率如何,FCS在长达12周的时间内保持其原始大小(左图)。通过这些结果,作者强调,作者生产的融合蛋白胶囊结构稳定,可以长期储存。然而,nMT的大小从第3天开始显著增加(右图)。作者确定,这种结构不稳定的现象可能是线粒体分解的开始,也可能是生理/生理功能障碍的迹象。换句话说,从第3天开始就确定了nMT的生存能力。因此,确定长期检查FMC的稳定性是没有意义的,并对稳定性进行了长达5天的评估。结果表明,脂质体在包裹MT后的第5天内,其大小基本保持不变,说明脂质体的稳定性在5天内没有明显变化,这是因为脂质体的阳离子性质阻止了静电斥力的融合。
为了直观地证实这些结果,作者用CLSM观察了第0天和第3天nMT和FMCs的形态(图2B)。在第0天,nMT和FMCs分布均匀;特别是体素成像证实MT被很好地包裹在FMCs中。体素图像是指对z堆叠图像中的每个像素进行三维重建,从而创建3D表示。在第3天,由于MT之间的聚集,溶液中的nMT大小增加。相比之下,FMCs的分布保持稳定,包埋形式保持良好。进行了透射电子显微镜检查,以进一步澄清在第3天观察到的变化(图2C)。对于以前的结果,FMCs保持了它们的形态和分布,但nMT形成了聚集体,有些已经被破坏。
上述结果表明,在体外条件下,FMC提高了MT的物理稳定性。然而,由于这些结果不能显示包裹在FMC内的MT的活性,作者检查了线粒体细胞色素C(CytoC)的表达水平,以评估MTs的活性(图2D)。众所周知,当细胞从MT内部泄漏到外部时,细胞凋亡就开始发生,当MT处于不健康状态时,就会发生细胞C泄漏。制备nMT和FMC2,在4◦C培养一天,第二天(第1天)裂解标本并进行分析。由于TOMM20的表达类似于nMT和FMC2,因此可以看出它含有相同数量的MT。然而,已证实FMC2的线粒体CytoC表达水平大约是nMT的两倍。由于这意味着在nMT中发生了大量的CytoC渗漏,因此可以判断存活的可能性很低。基于这些结果,证实了FMC2在体外一天的状态下能够增加MT的结构稳定性和活性。
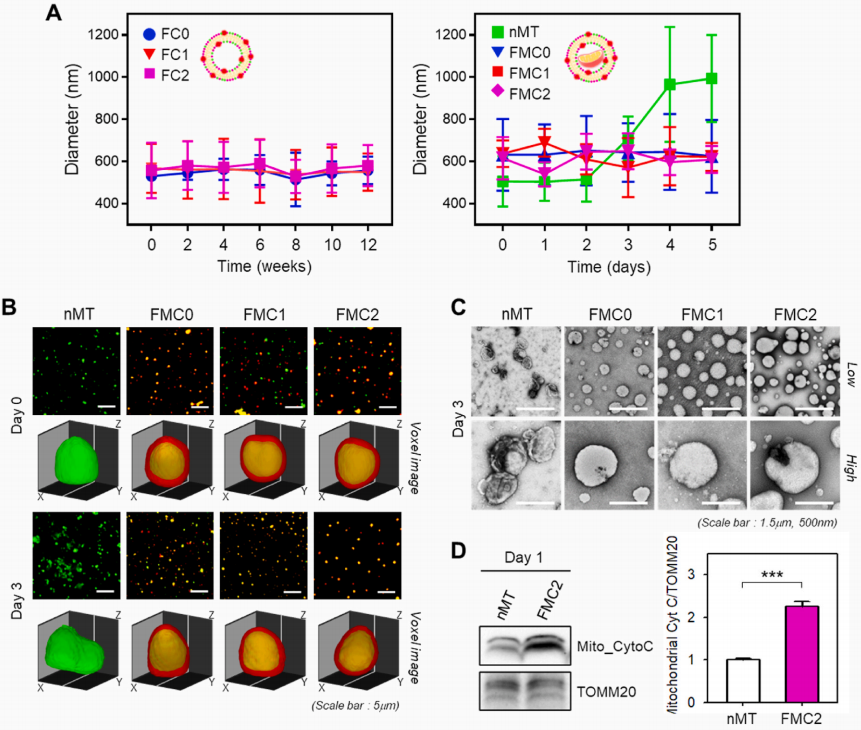
图2 与nMT比较,评价FMCs的稳定性及其内部线粒体的稳定性
3、应用FMC对线粒体递送方法的评价
3.1.FMCS转导脂多糖处理的C28/I2细胞
接下来,作者使用WST-1试验评估脂质体递送系统的细胞毒性(图3A)。通过处理高达75μg的细胞来评估三种类型的FC;在这个剂量下,FC1没有显示出细胞毒性。30μg的FC0和FC2对细胞的存活率>80%,7.5、15和30μg的FC2对细胞的存活率最高可达4h,但没有明显的细胞毒性。此外,作者还将细胞暴露于FCs(4和8 μg)0.5h和1h,以观察融合效率。融合后1h的融合效率高于0.5h,8 μg的FCs融合效率高于4μg的FCs,在此基础上,作者进一步实验采用8μg的FC剂量。
CLSM验证融合基因MT的传递(图3B)。受体C28/I2细胞中的MT被染成蓝色,来自供体MSCs的MT被染成绿色,FMCs被标记为红色。受体MTs(蓝色)的荧光强度相似,但来自FMC1和FMC2的供体MTs(绿色)的信号比来自nMTs和FMC0的信号强得多。红色荧光强度(代表融合效率)也被测量,结果证实FMC2表现出最有效的融合MT递送。
最后,为了定量地验证这一现象,分析了异种MT(图3C)交付后的mtDNA拷贝数。由于受体细胞(C28/I2)是人类来源的,供体(异种)MT是从大鼠来源的成肌细胞L6细胞系中分离出来的。4μg MTs给药后1h,FMC1和FMC2给药的大鼠细胞内MT比nMT多,4h后以FMC2给药最多。相比之下,nMT和FMC0递送的数量要少得多,1h和4h的水平相似。因此,FMC2是在最短时间内递送最大数量MT的平台。
通过监测与脂多糖处理的C28/I2细胞的膜融合,作者确认FMC2是最有效的MT递送平台(图3D)。在图3D中,绿色信号表示质膜(PM),青色信号表示传送的MT,红色信号表示FMC2。与未经处理的(NT)细胞不同,暴露于nMT和FMC2的细胞胞浆中含有MT。
此外,暴露于FMC2的细胞中的绿色和红色信号重叠,表示膜融合(黄色)。同样,即使细胞暴露在空的(无MT)FC2胶囊中,也会发生膜融合。综上所述,这些结果表明,nMT和FMC0通过内吞途径传递,FMC1和FMC2通过膜融合途径传递,提示后一种方法是更有利的策略。

图3 FMCs的细胞膜融合比NMT的内吞作用提供线粒体的速度更快,数量更多
3.2 MT的胞内和膜融合传递途径的差异
如上所述,有两种途径可以将MT通过NMT和FMC2输送到细胞中(图4A)。内吞作用是将外来物质输送到细胞内的一种常见机制;然而,当外来物质通过内吞作用输送时,它必须从内吞体内逃逸,因为剩下的任何物质都会被溶酶体移走并降解。因此,通过内吞作用进入细胞质的MT有被降解的风险。相比之下,由FMCs交付的MT不会经历这一过程。相反,FMCs与细胞膜融合,形成一个通道,允许将包裹的MT直接输送到细胞质。
用CLSM(图4B)观察了用这两种方法运送到细胞的线粒体的命运。线粒体用MitoTracker染成蓝色,早期内体(EE)染成绿色,FMC2染成红色。未观察到nMT的脂质体信号。仅观察到EE和MT信号。图4B中的裁剪图像显示了EE和MT信号的重叠(青色;由红色箭头表示)。此外,直线剖面图显示绿色峰和蓝色峰重叠(红色突出显示)。相反,FMC2脂质体信号遍布细胞膜,证实融合发生,EE和MT信号是分开的(黄色箭头)。同样,线条轮廓也不重叠(黄色突出显示)。这些结果证实了NMT通过内吞作用进入细胞,FMC2通过膜融合传递MT。
nMT和FMC2的关键区别在于它们通过内小体进入细胞,而FMC2通过膜融合传递MT。因此,作者接下来检查了内体pH的影响。作为MT膜电位指标的JC-1染色证实,与pH 7.4相比,在pH 5.5(晚期内吞体内的pH)时,MT膜电位降低。这意味着MT可能暴露在酸性条件下,导致功能不佳。因此,内吞作用并不是MT传递的最佳方式。
通常情况下,如果溶酶体中的外来物质没有逃逸,它们会被溶酶体清除。因此,为了确认传递的MTs是否被消化在细胞质中,作者将溶酶体染色为绿色,并用CLSM观察细胞(图4C)。对于nMT,大量的MT与溶酶体重叠,形成青色信号(红色箭头);这种重叠被线条轮廓(红色突出显示)证实。这意味着传递的MT被溶酶消化。相反,成像和线条轮廓结果显示,FMC2信号与MT和溶酶体信号(黄色突出显示)明显分开。
线粒体自噬是启动线粒体消化过程的消化器官。基于此,作者认为评估线粒体自噬标志物的表达水平将确定转移到细胞中的线粒体的命运(图4D)。因此,Parkin和LC3B在FMC2中的表达水平均低于nMT,这是一个显著的结果。这显示了与图4C中的结果相同的图案。基于这些结果,证实了当线粒体通过内吞作用递送时,相当数量的线粒体被溶酶体或线粒体自噬消化。另一方面,由于FMC2避免了这一过程,可以假设转移的线粒体有更高的存活机会。因此,FMC2作为运送线粒体的转运体,确保了一条安全的运送路线。
通过在低温(4◦C)下抑制细胞膜活性,作者比较了nMT和FMC2传递MT的效率(图4e)。数据显示,在4◦C时,nMT的效率是37◦C的一半。然而,FMC2在这两种温度下的效率是一样的。因此,即使细胞膜活性降低,FMC2也能传递MT。此外,作者比较了内吞抑制条件下线粒体的传递效率,以证实FMC通过膜融合传递到细胞的说法。
抑制条件如下:4◦C(细胞膜弹性和三磷酸腺苷合成抑制)、阿米洛利(阿米洛利、巨噬细胞吞噬抑制)、CPM(氯丙嗪、网织蛋白介导的内吞抑制)和FLP(非线菌素、小窝介导的内吞抑制)。抑制内吞作用减少了NMT对C28/I2细胞的输送。然而,FMC2的交付没有受到影响。这表明FMC2可以将货物运送到细胞膜活性较低的细胞。这些数据再次表明,与细胞膜融合是一种比内吞作用更有利的策略。
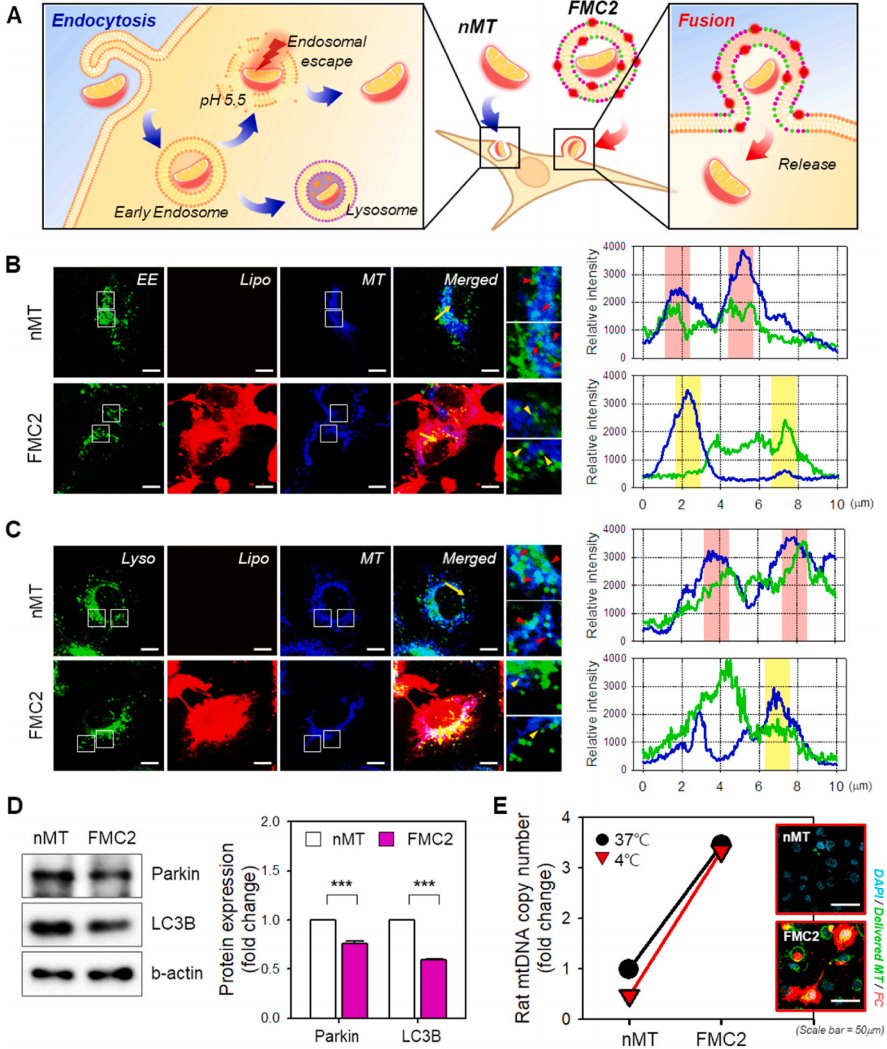
图4 nMT和FMC2使用的线粒体传递途径的差异,以及传递的线粒体的命运
4、2D OA模型(内毒素处理的C28/I2细胞)线粒体交付后细胞功能的恢复
以软骨细胞系C28/I2为研究对象,采用体外培养的方法建立骨性关节炎模型。用内毒素作为损伤诱导剂,诱导OA样细胞的形成。已知脂多糖可诱导病理反应,如核因子-κB的磷酸化和细胞内炎性细胞因子的产生。首先,作者建立了一个二维OA模型,以确定C28/I2细胞是否受到内毒素的损伤。结果证实,内毒素刺激后,Ⅱ型胶原(Col II)表达减少,基质金属蛋白酶-13(MMP13)、IL-6和肿瘤坏死因子-α(TNF-α)表达增加。研究还证实,线粒体功能障碍是由ATP含量下降引起的。接下来,作者检查了MT交付到2D OA模型后细胞恢复的程度(图5A)。nMT和FMC2作用于细胞后,Col II的表达增加,而FMC2则降低了MMP13的表达。这一作用是通过抑制传递的MT对NF-κB的磷酸化而实现的。
用qRT-PCR检测MT交付后编码IL-6和TNF-α的mRNA的表达变化(图5C),这是已知的OA相关炎症因子。结果表明,MT介导的C28/I2细胞可减少这些炎症因子的表达,表明MT恢复了最佳的细胞功能。FMC2的这种影响更加明显,证实了FMC2在传递MT和减少炎症方面更有效。
此外,作者还用酶联免疫吸附试验(ELISA)检测了分泌性炎症因子的表达(图5D)。注射MT后,经内毒素处理的C28/I2细胞分泌炎症因子的能力下降。与上述结果一致,FMC2比NMT更有效地恢复受损软骨细胞的正常功能。综上所述,这些数据表明MT转移术是治疗骨性关节炎的一种有前途的方法。此外,经FMC2途径给药的细胞修复效果好于nMT,提示FMC2是修复受损软骨细胞功能的更有效的方法。
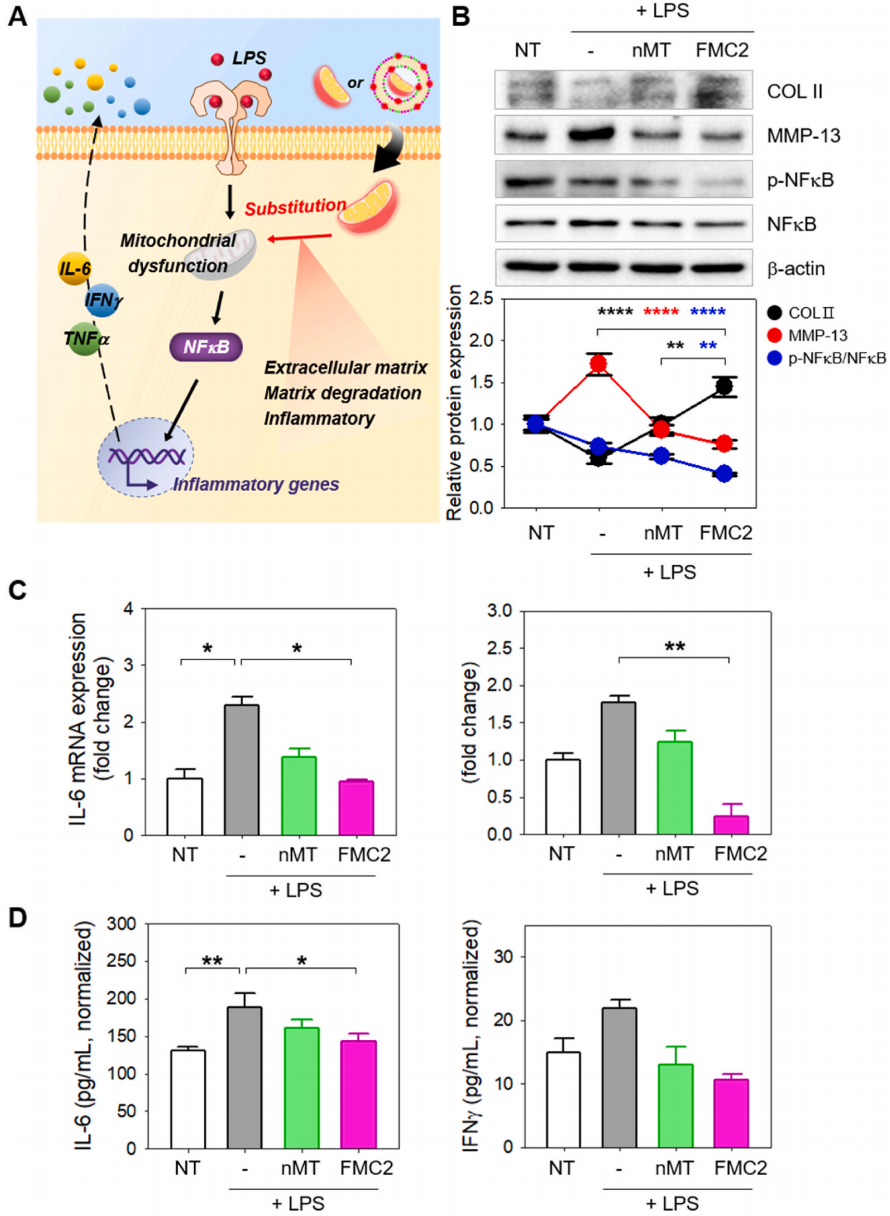
图5 FMC2介导的线粒体对脂多糖处理的C28/I2细胞的治疗效果的2D模型
5、内毒素诱导的软骨细胞移植后三维培养功能恢复的实验研究
将脂多糖处理的C28/I2细胞进行三维培养,检测细胞的聚集和分化能力。如图6A所示,内毒素处理的C28/I2在三维培养皿中难以形成聚集体。相反,与NT组(未处理组、对照组)相似,nMT和FMC2处理的细胞能够形成聚集体,并可以进行三维培养。这一趋势在播种后持续了10天以上,表明MT不仅能防止脱分化或炎症,而且还能促进细胞团的生长。此外,细胞聚集体大小的增加表明细胞增殖或细胞外基质的产生可能已被促进。聚集体形成的定量分析表明,MT的存在对细胞聚集体的数量有很大的影响,表明MT对脂多糖造成的损伤具有修复作用。
在3D培养的8天中,作者检测了编码Aggrecan(细胞外基质的软骨成分)、SOX9(转录因子)、COLX(肥大标记)、细胞外基质降解酶MMP3和MMP13以及肿瘤坏死因子α(图6B)的基因的表达。在FMC2处理的细胞中,AGG的表达水平最高,SOX9的表达水平与NT相似。此外,脂多糖组和正常对照组均表达高水平的COLX、MMP3、MMP13和肿瘤坏死因子α,经FMC2治疗后均显著下降。
免疫荧光染色显示,FMC2处理的细胞SOX9(粉红色)和Col II(绿色,ECM)的表达增加,表明脂多糖造成的损伤已被传递的MT修复(图6C)。此外,FMC2诱导的恢复比NMT诱导的恢复更明显。相反,脂多糖抑制了SOX9和Col II的表达。这些结果表明,经FMC2注射MT后,受损软骨细胞可以恢复正常功能。
总体而言,这些数据表明,MT可以实现受损软骨细胞的功能恢复,不仅可以缓解炎症,促进组织生成,还可以促进细胞的生长和分化。这些发现对开发新的软骨再生治疗方法具有重要意义。
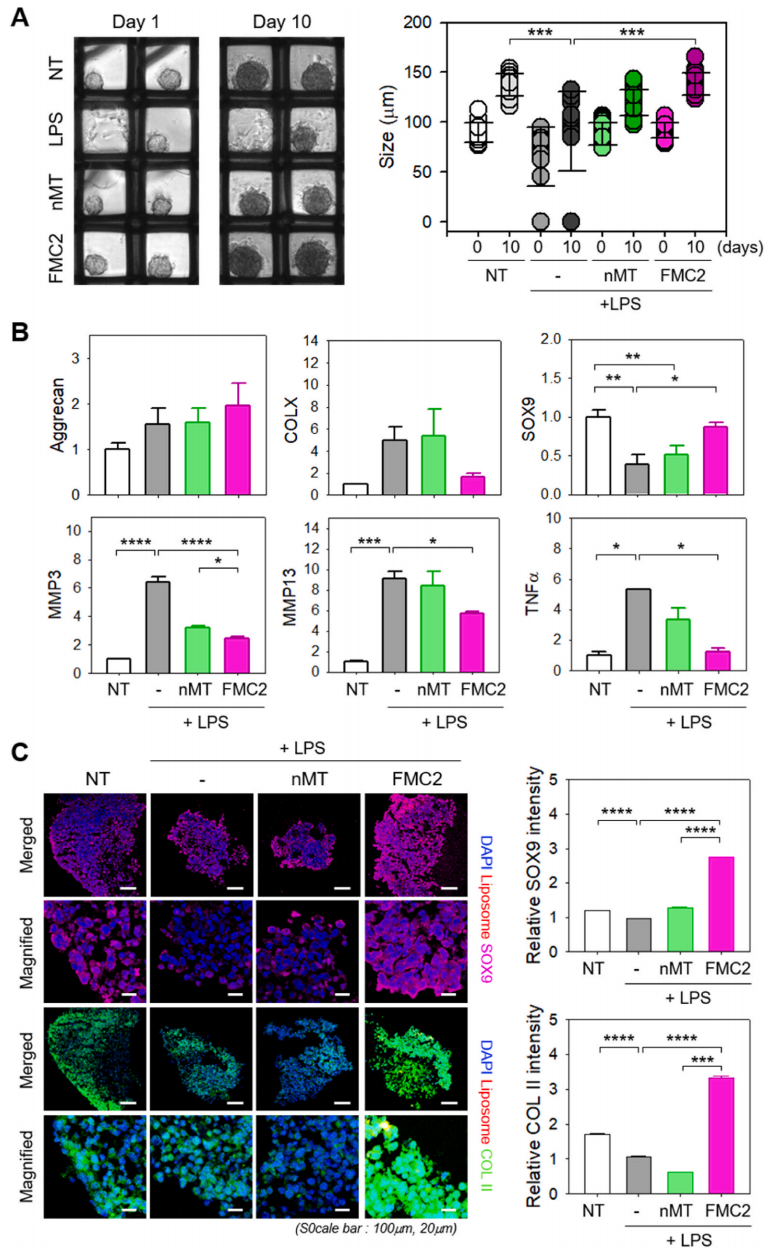
图6 3D模型(脂多糖处理的C28/I2球体)评估人工组织形成的程度和FMC2运送的线粒体的治疗效果
6、骨性关节炎动物模型注射FMC的实验研究
通过关节腔内注射MIA建立小鼠骨性关节炎模型,观察IA注射nMT和FMC2后的组织修复情况。FMC2注射两次(Inj.#2)小剂量(LD)每5天注射一次,nMT注射2次(Inj.#2)低剂量或高剂量(HD)和五次(Inj.#5)低剂量(LD)(图7A)。
在IA注射后第1天,用激光共聚焦显微镜观察nMT和FMC2的定位,以确定它们是否被输送到软骨组织(图7B)。将被输送到软骨的MT被标记为Mitotracker Deep Red,并进行了两次剂量的测试。在nMT组,在低剂量时很少观察到MT信号(绿色),而在高剂量时仅在一个狭窄的区域内传递。相比之下,在FMC2组中,即使在低剂量时也能观察到FMC(红色)和MT(绿色)信号,而在高剂量时它们均匀分布在更大的区域内。这些数据表明,通过FMC2在体内传递MT是更好的。
通过检测血液中炎症因子的含量,证实MT的抗炎作用。MIA致炎小鼠血液中的干扰素-γ含量高于野生型(WT)小鼠(图7C)。然而,当MT通过FMC2给药时,干扰素-γ的量下降到与WT小鼠相似的水平。这些结果表明,线粒体通过恢复受损炎症组织的正常功能来减轻炎症。
软骨组织用藏红花素-O和阿尔新蓝染色显示受损的软骨组织已修复,如硫酸甘氨酸(橙色)和酸性多糖(蓝色)的表达增加(图7D)。组织学分析注射生理盐水组(生理盐水),未见炎性软骨组织恢复。然而,通过FMC2传递的MT使软骨组织得以恢复。这比相同注射次数的相同剂量的#2 NMT LD恢复得更好,甚至比注射高剂量MT的#2 NMT HD组更有效。在注射相同剂量的NMT比FMC2更频繁的NMT组(#5 NMT LD),也观察到一些软骨的恢复。然而,与FMC2相比,多糖(蓝色)和GAGs(橙色)的染色区域显得更窄和更弱。这些结果以量化图表的形式呈现。
接下来,作者使用Mankin评分评估了MIA诱导的骨性关节炎模型中软骨组织损伤的严重程度(图7E)。Mankin评分系统考虑了软骨结构和蛋白多糖含量,是评估骨性关节炎严重程度的可靠而有效的方法。FMC2组动物的得分与WT组动物相似(约2分),但#2 NMT LD组和#2 nMTHD组的得分为11-13分(与生理盐水对照组相似)。#5 NMT LD的分数约为6分,相当于中等严重程度。这些结果在显微CT扫描和软骨下骨体积分析中也得到了证实。损伤软骨和软骨下骨的恢复率以FMCs最高。综上所述,这些数据表明,通过FMC2传递的MT在低剂量和低治疗频率下促进有效的软骨组织再生。
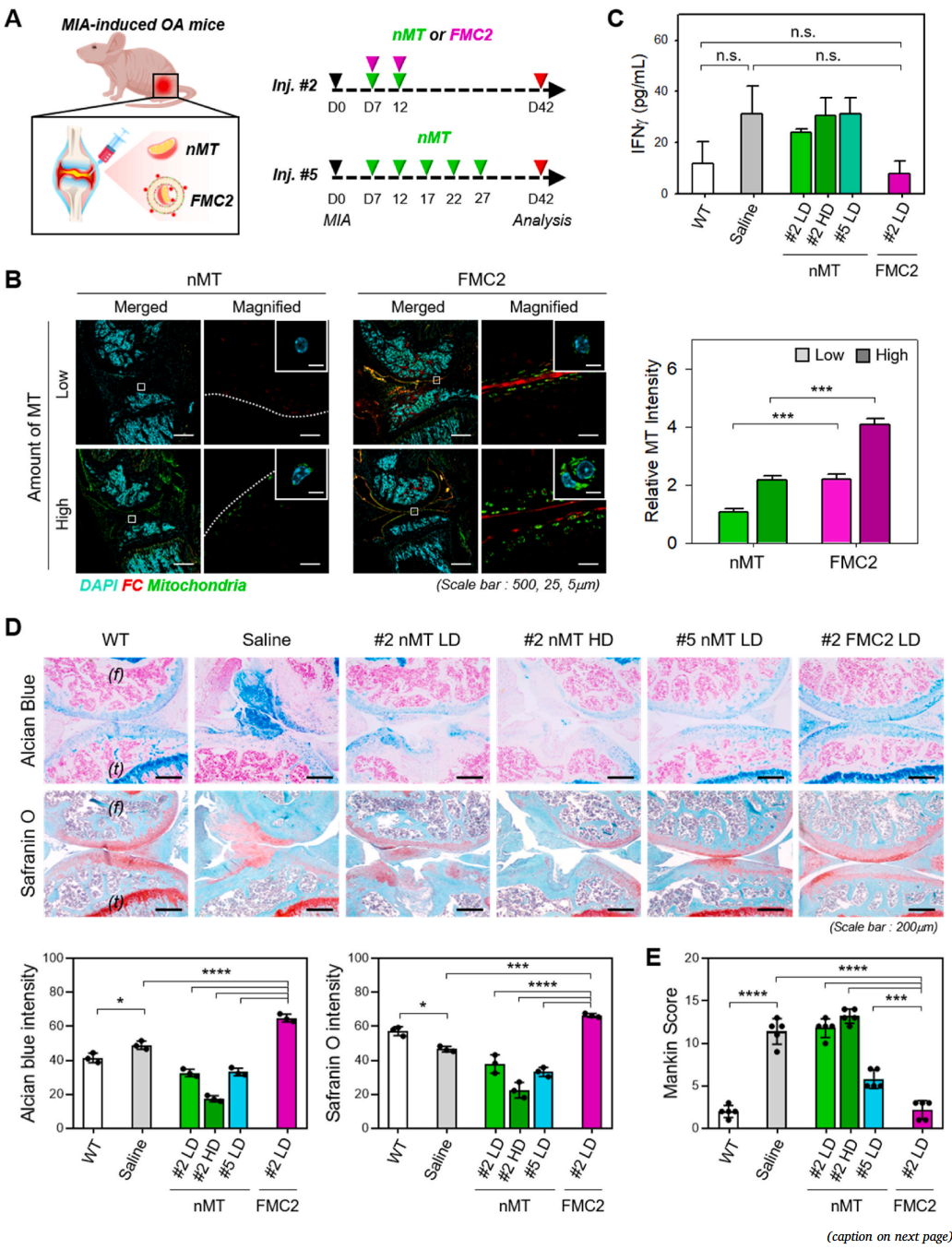
图7 线粒体导入MIA诱导的骨性关节炎模型小鼠的软骨穿透与修复
在这里,作者描述了一种膜融合方法,作为一种通过含有阳离子脂质的融合脂质体(DOTAP)将MT递送到靶细胞的策略。根据DOTAP比率分析了FMCs的形态和特性,并对其包封率、稳定性和膜融合效率进行了评价。结果表明,PE:DOTAP比为1:2的FMC2效果最好。作者还进行了体外和体内实验,以表明膜融合方法比内吞途径更安全和更快地输送更多的MT。此外,二维和三维培养系统证实,在MT交付后,ECM成分的软骨化表达增加,炎性细胞因子的表达减少。MIA诱导的骨性关节炎模型证实,在低剂量和低频率的治疗条件下,FMC2比nMT更有效。因此,稳定的MT膜融合递送系统在恢复骨关节炎受损细胞或组织的功能方面具有巨大的潜力。
实验方法
细胞培养、FC细胞毒性评价、nMT和FMC稳定性评价、从供体细胞分离MT
参考文献
[1] Kim HR, Cho HB, Lee S, Park JI, Kim HJ, Park KH. Fusogenic liposomes encapsulating mitochondria as a promising delivery system for osteoarthritis therapy. Biomaterials. 2023;302:122350.






