病理性高眼压通过Drp1诱导线粒体功能障碍导致青光眼视网膜神经节细胞泛凋亡

泛凋亡作为近年来的研究热点,是一种细胞炎症性程序性死亡,由特定的触发器激活,并由泛凋亡复合体(PANoptosome)调控,具有焦亡、凋亡和(或)坏死性凋亡的关键特征,但不能单独由这三种程序性死亡通路中的任何一种来解释。下图是2023年部分关于泛凋亡的中标题目:
青光眼是一种常见的神经退行性疾病,其特征是视网膜神经节细胞(RGC)缺失和视野缺损。病理性高眼压(ph-IOP)是青光眼的重要危险因素,它会触发控制 RGC 死亡和轴突变性的分子不同级联反应。动力蛋白相关蛋白1(Drp1)介导的线粒体动力学异常与青光眼发病机制有关。然而,对调节RGC损伤和死亡的确切途径知之甚少。在这里,我们旨在研究ERK1/2-Drp1-活性氧 (ROS) 轴在 RGC 死亡中的作用以及 Drp1 介导的线粒体动力学与 ph-IOP 损伤中 与泛凋亡之间的关系。作者研究表明抑制ERK1/2-Drp1-ROS通路是治疗ph-IOP诱导损伤的潜在治疗策略。此外,抑制 Drp1 可以通过调节 ph-IOP 模型中 NLRP3介导的细胞焦亡和 RIP介导的细胞坏死来调节 RGC泛凋亡。该研究发表在《Redox Biology》,IF:11.4。
技术路线

主要研究结果
1. 氧和葡萄糖剥夺再灌注(OGD/R )模型诱导 R28 细胞线粒体损伤和死亡
OGD/R细胞模型建立:将R28细胞传代后更换为无葡萄糖DMEM培养基并且将细胞置于缺氧室中培养4个小时,然后在正常完全培养基中复氧1小时、3小时或 6 小时(图1A)。使用 Hoechst 33342和PI双重染色检测发现OGD/R 诱导细胞死亡(图1B和C)。OGD/R 3小时后,JC-1染色检测线粒体膜电位发现线粒体膜电位下降,预示着细胞开始出现凋亡(图1D和E)。免疫荧光检测线粒体外膜蛋白Tom20来检查线粒体形态变化,发现OGD/R后线粒体明显碎片化增加(图1F和G)。OGD/R 损伤也增加了 线粒体ROS含量,(图1H)。之后检测了与线粒体动力学相关的蛋白水平的变化,发现线粒体裂变相关蛋白Drp1(Ser616)的磷酸化增加。为了探究Drp1(Ser616)激活的上游靶点,我们对RNA测序(RNA-seq)结果进行了分析,KEGG显示差异基因在MAPK通路中富集。之后进一步验证OGD/R后ERK1/2和p-ERK1/2的表达水平,发现发现 p-Drp1 (Ser616) 和 p-ERK1/2 表达水平在 OGD/R 后 1 h 达到峰值,而 Drp1 和 ERK1/2 的表达基本保持不变 (图1J 和 M)。证明在 OGD/R 后 3 小时进行了后续表型研究。这些结果初步表明,OGD/R模型可以诱导R28细胞的线粒体功能障碍和细胞死亡。
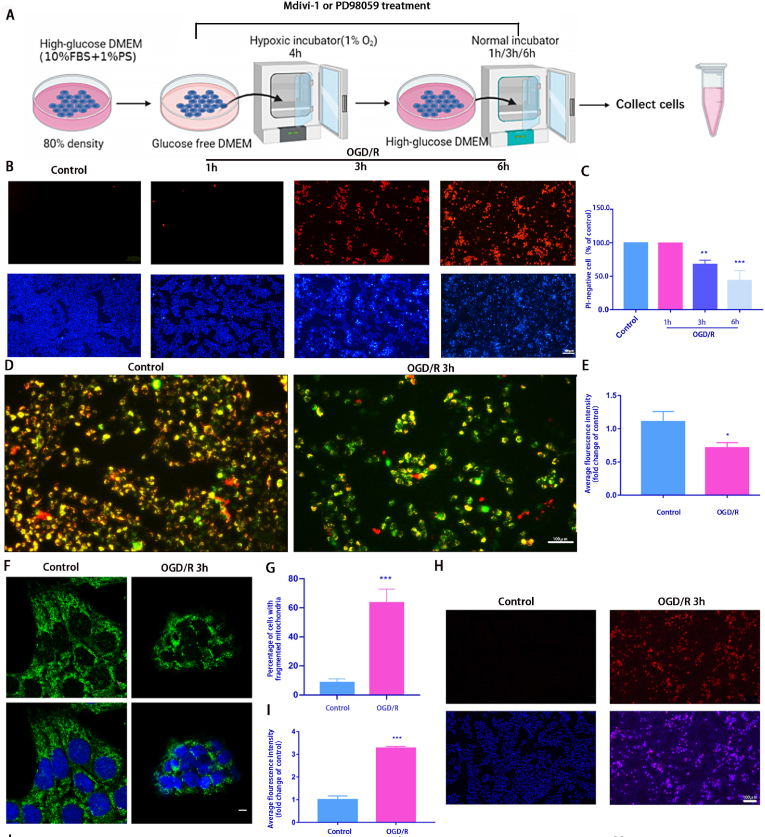
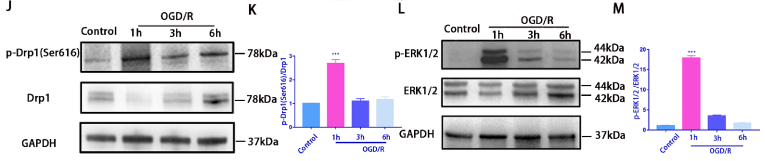
图1.氧和葡萄糖剥夺再灌注(OGD/R )模型诱导 R28 细胞线粒体损伤和死亡
2. Drp1抑制剂和敲低Drp1处理减弱了 R28 细胞中 OGD/R 诱导的细胞损伤
siRNA敲低Dpr1方法:将 R28 细胞铺板并培养至 30% 汇合度进行转染。转染4 h后,将R28细胞再培养48 h,然后进行OGD/R建模(图2A)。为了进一步确定Drp1介导的线粒体裂变对OGD/R诱导损伤的影响,在OGD/R模型中分别使用Mdivi-1(Drp1抑制剂)或 siRNA 研究了p-Drp1(Ser616)对R28细胞的影响,发现使用Mdivi-1或者敲低p-Drp1能够显著降低PI阳性细胞(图2B和C)。OGD/R诱导的和ATP产量减少在Mdivi-1处理组中部分恢复(图2D 和 E。在用Mdivi-1和siRNA处理后,OGD/R诱导的线粒体片段化和mtROS含量显着降低 (图2F 和 G、2I 和 J)。说明Mdivi-1或siRNA处理都能够对线粒体功能产生保护作用从而缓解细胞损伤。
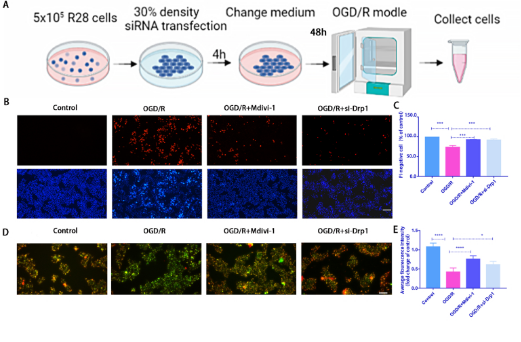
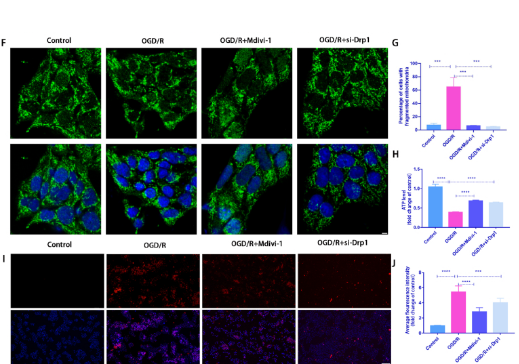
图2.Drp1抑制剂和敲低Drp1处理减弱了 R28 细胞中 OGD/R 诱导的细胞损伤
3. ERK1/2介导的 Drp1 Ser616磷酸化调节R28细胞OGD/R诱导损伤期间的线粒体变化
由于 OGD/R 模型中 p-ERK1/2 显著升高,接着使用 p-ERK1/2 抑制剂 PD98059 来确定它是否可以通过 p-Drp1(Ser616)预防OGD/R损伤,以阐明 p-ERK1/2 和 p-Drp1(Ser616)之间的关系。图3A和B表明实验发现,OGD/R诱导的p-Drp1(Ser616)在PD98059处理后被显着抑制。Hoechst 33342 和 PI 双染色结果显示,与单独使用 OGD/R 相比,PD98059 或 敲低 p-ERK1/2 显著提高了细胞存活率(图3C和D)。此外,线粒体功能部分恢复,ATP水平显着增加(图3E和F,3I)。此外,PD98059 和敲低 p-ERK1/2减少了线粒体片段化和 mtROS 的产生 (图3G 和 H、3J 和 K)。这些结果表明,抑制ERK-Drp1(Ser616)通路通过挽救线粒体功能障碍和清除mtROS产生来防止OGD/R诱导的损伤。


图3. ERK1/2介导的 Drp1 Ser616磷酸化调节R28细胞OGD/R诱导损伤期间的线粒体变化
4. ph-IOP 损伤诱导的小鼠 中出现RGC 线粒体损伤和细胞死亡
HE结果显示,ph-IOP组的视网膜结构逐渐不规则,视网膜层明显疏松无序,RGCs数量处理随时间减少。视网膜GCL和内丛状层(IPL)明显水肿,48 h视网膜厚度明显减小,ph-IOP损伤显著降低视网膜GCL细胞数量(图4A和B),在视网膜石蜡切片的RBPMS免疫荧光染色中也呈现相同趋势,对照组标记的RGCs数量更多(图4C和D)。视网膜 ph-IOP 损伤后 TUNEL 染色阳性细胞数量也显著增加 (图4E 和 F)。此外,ROS总量在视网膜ph-IOP损伤后24 h达到峰值,48 h后略有下降。
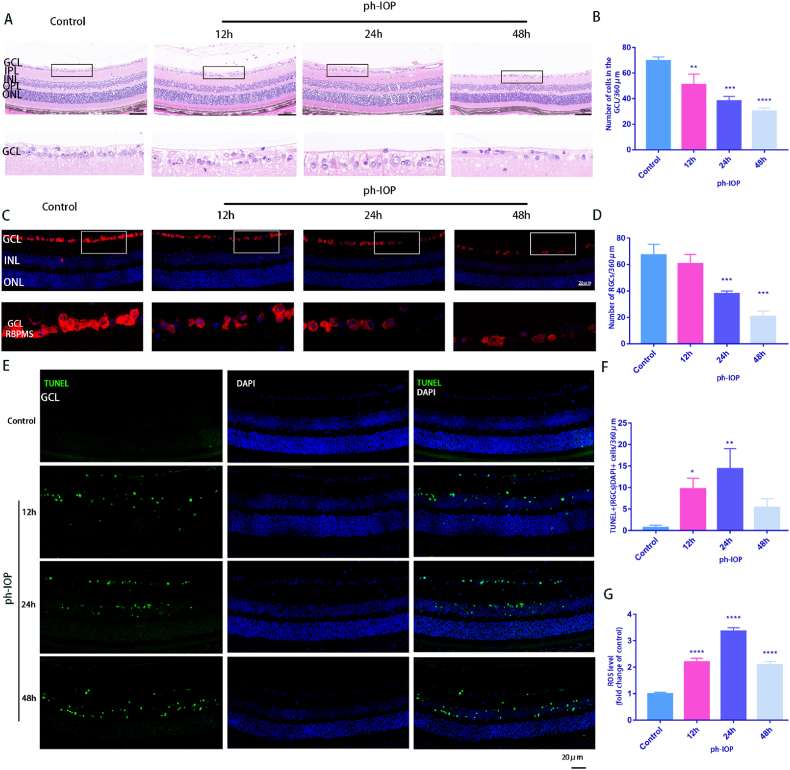
图4.ph-IOP 损伤诱导的小鼠 中出现RGC 线粒体损伤和细胞死亡
5. ph-IOP损伤激活的ERK1/2-Drp1(Ser616)-ROS信号通路
在ph-IOP损伤后3 h、6 h、12 h、24 h和48 h检测小鼠视网膜中ERK1/2和Drp1(Ser616)蛋白的表达。p-ERK1/2 表达在 3 h 时升高,并在 12 h 达到峰值。同时,p-Drp1(Ser616)表达在6 h时显著升高,并在24 h时达到峰值(图5A-C)。同时,RBPMS与p-Drp1(Ser616)和p-ERK1/2共染色进行免疫荧光分析,结果与WB结果一致(图5D-G)。p-ERK1/2和p-Drp1(Ser616)的荧光强度分别在12 h和24 h达到峰值。WB 结果显示,视网膜PD98059治疗可降低 ph-IOP 诱导的 p-Drp1(Ser616) 升高 (图5H 和 I),表明 p-ERK1/2 可能通过 p-Drp1 (Ser616) 在 RGC 损伤中发挥作用。随后,Mdivi-1 和 PD98059 分别用于抑制 p-Drp1 (Ser616) 和 p-ERK1/2,显着降低小鼠视网膜 (图5J 和 K)。这些结果表明,ERK1/2-Drp1信号通路可能促进ph-IOP损伤中ROS的产生。
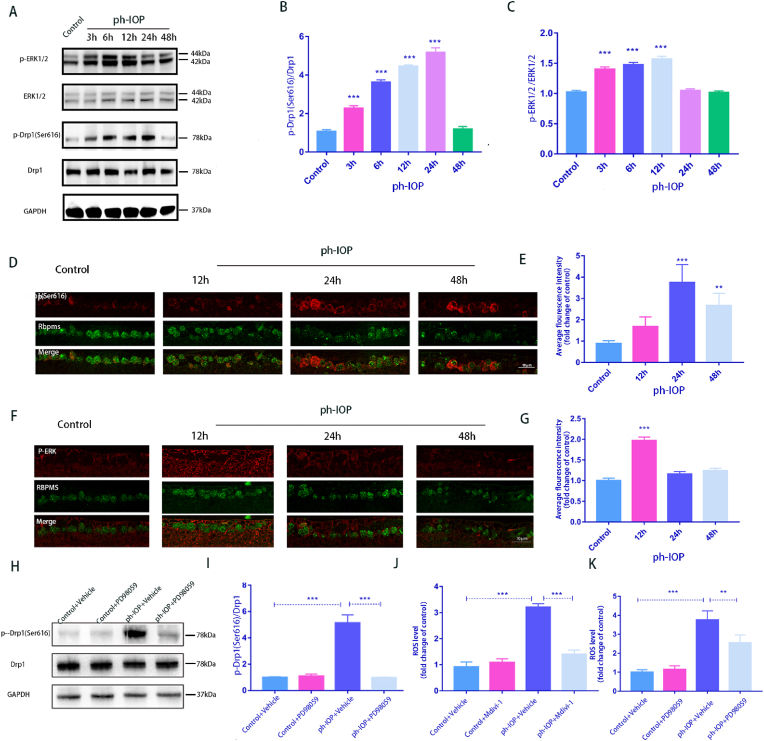
图5.ph-IOP损伤激活的ERK1/2-Drp1(Ser616)-ROS信号通路
6. 抑制 ERK1/2-Drp1-ROS 信号通路可减少 ph-IOP 诱导的小鼠 RGC 损伤
接下来使用PD98059、Mdivi-1和Mito-TEMPO(ROS抑制剂)研究抑制ERK1/2-Drp1-ROS通路是否可以预防视网膜形态损伤和RGC丢失。HE结果显示,ph-IOP损伤后24 h,对照组视网膜GCL的视网膜形态和细胞数量均有明显损伤。PD98059、Mdivi-1或Mito-TEMPO治疗后,视网膜形态部分恢复,随后GCL细胞数量也在一定程度上反弹(图6A和B)。该结果通过RBPMS染色(图6C和D)。对于平坦的视网膜(图6E和F)。注射抑制剂后,TUNEL阳性RGCs和其他视网膜细胞的数量显著减少(图6G和H)。此外,PD98059和Mdivi-1治疗可防止视网膜 ATP 的耗竭。ph-IOP损伤后视网膜ATP含量明显低于正常组。抑制剂处理后ATP含量显著升高(图6I 和J)。Mdivi-1 和 PD98059 治疗保留了 ph-IOP 损伤后GCL中线粒体结构的形态,因为这些组中结构混乱的线粒体数量较低(图6K).
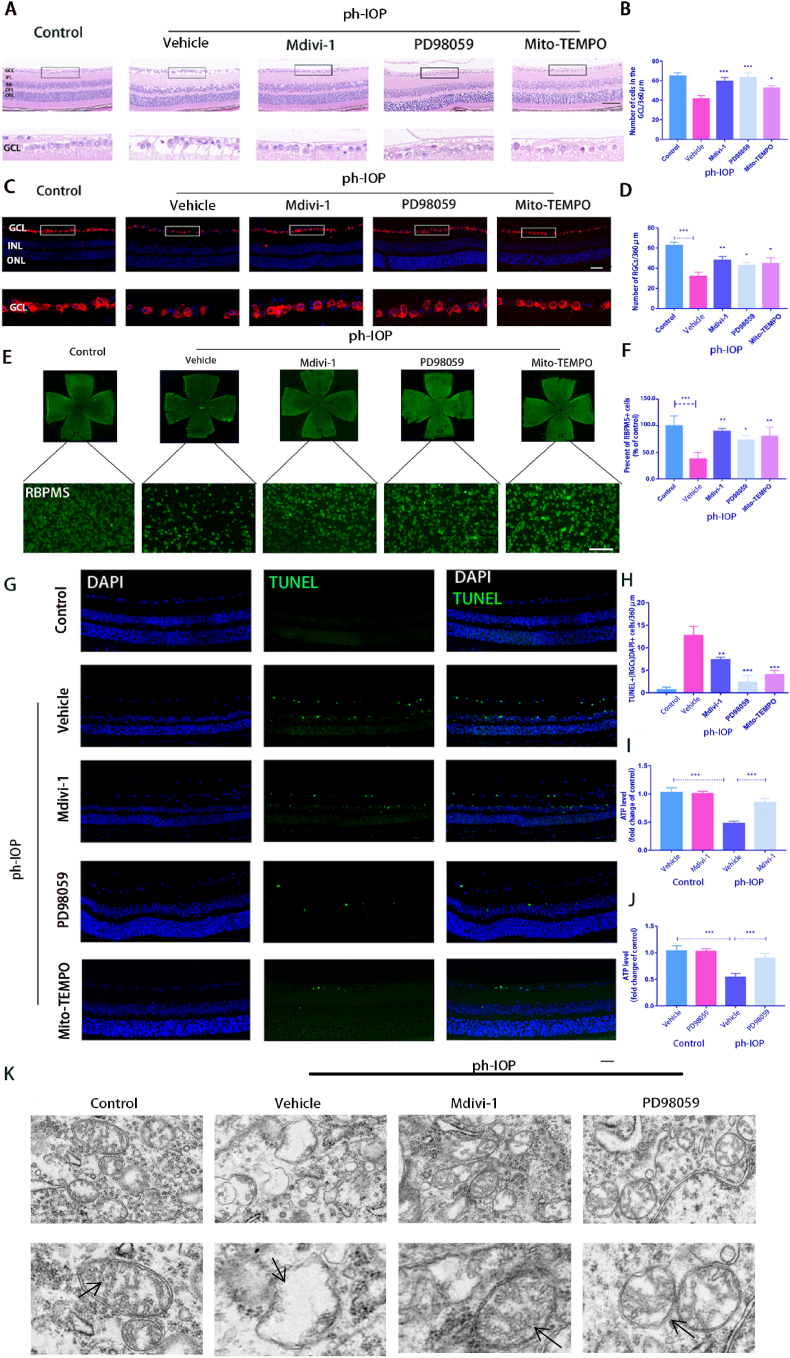
图6.抑制 ERK1/2-Drp1-ROS 信号通路可减少 ph-IOP 诱导的小鼠 RGC 损伤
7.使用Mdivi-1抑制Drp1或siRNA 处理可挽救 ph-IOP 诱导的 RGC 泛凋亡
玻璃体内注射Drp1 siRNA敲低Drp1,siRNA注射72 h后构建ph-IOP模型,以阐明Drp1在ph-IOP诱导的青光眼中的作用。检查siRNA治疗后的视网膜形态和RGC细胞丢失,发现si-Drp1有效地挽救了ph-IOP诱导的视网膜损伤和RGC丢失(图7A-D)。WB结果显示,与对照+NC组相比,si-Drp1显著降低试验组p-Drp1(Ser616)表达(图7E 和 F)。为了研究Drp1与RGCs的泛凋亡的关系,我们采用WB和免疫荧光法分析了泛凋亡相关蛋白的表达。WB 结果显示,在敲低Dpr1后,细胞凋亡标志物(cleaved-caspase3)(图 7J)、细胞焦亡(NLRP3/caspase1/GSDMD)(图7G–I)和坏死性凋亡(p-RIP1/p-RIP3/p-MLKL)(图7K-M)显著下调。使用 Mdivi-1在处理ph-IOP模型小鼠,WB和免疫荧光检测发现,Mdivi-1或si-Drp1处理后GCL中cleaved-caspase3、caspase1和p-MLKL表达水平显著降低(图8A-C)。总的来说,作者认为推断Drp1参与调节 ph-IOP 诱导的视网膜细胞泛凋亡(图9)。
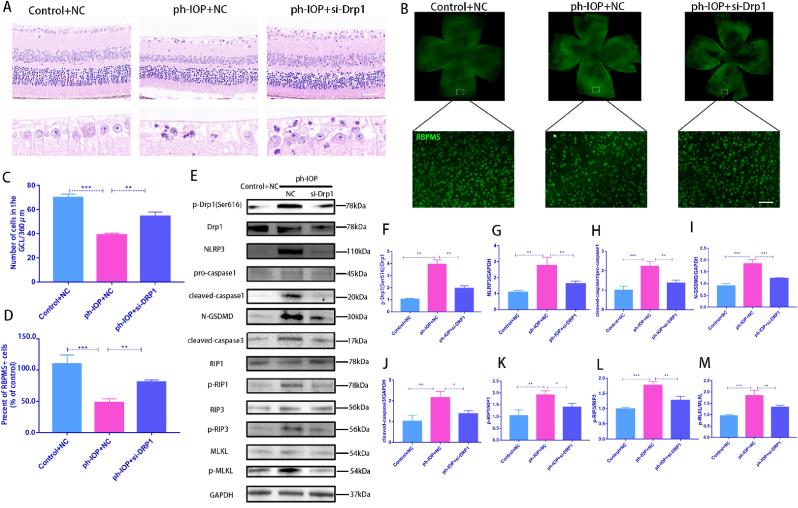
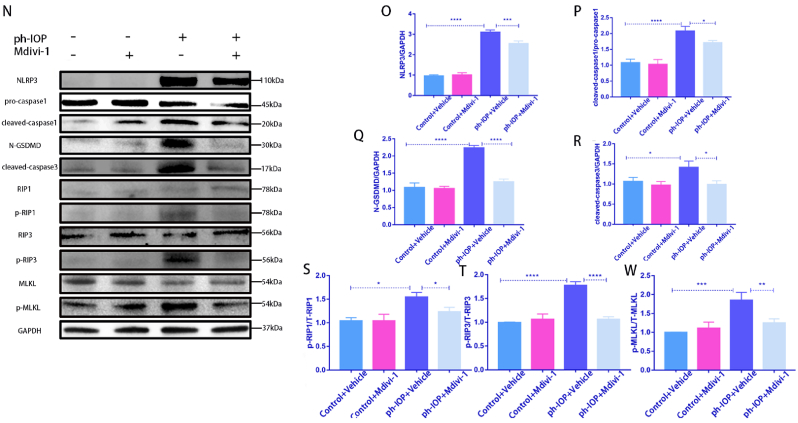
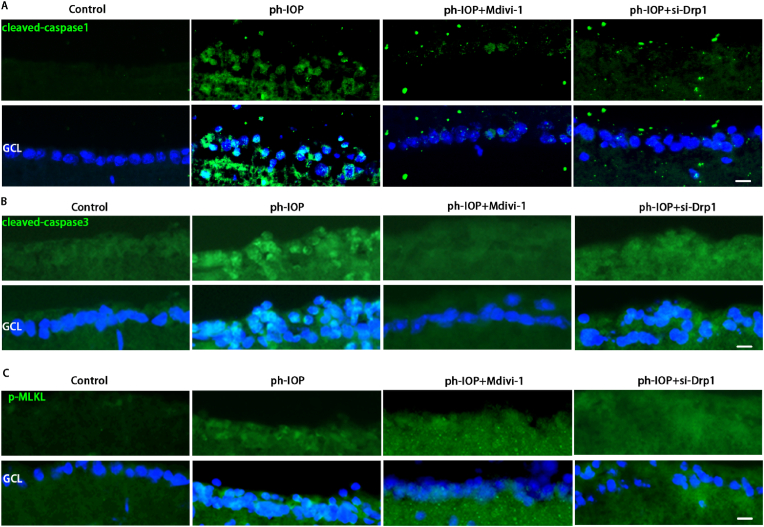
图7&8.使用Mdivi-1抑制Drp1或siRNA 处理可挽救 ph-IOP 诱导的 RGC 泛凋亡
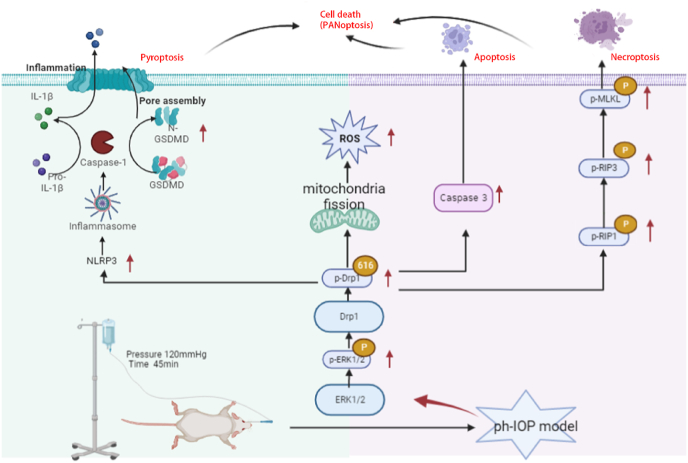
图9.ph-IOP - 通过 ERK1/2-Drp1-ROS 信号通路诱导 RGC 死亡
结论
作者发现抑制ERK1/2-Drp1-ROS通路是治疗ph-IOP诱导损伤的潜在治疗策略。为可能的保护性干预措施提供了新的见解,这些干预措施可以调节线粒体动力学以提高RGC的存活率。
实验方法
细胞培养,大鼠氧-葡萄糖剥夺/再灌注(OGD/R)模型,小鼠p-IOP模型,Hoechst 33342/碘化丙啶(PI)双染色测定,免疫荧光(IF)染色,透射电子显微镜(TEM),蛋白质印迹(WB)分析,RNA测序(RNA-seq)及数据分析,HE染色,TUNEL染色测定,三磷酸腺苷(ATP)测量,小干扰RNA(siRNA)转染,线粒体膜电位测定,ROS检测
参考文献
Zeng Z, You M, Fan C, Rong R, Li H, Xia X. Pathologically high intraocular pressure induces mitochondrial dysfunction through Drp1 and leads to retinal ganglion cell PANoptosis in glaucoma. Redox Biol. 2023 Jun; 62:102687. doi: 10.1016/j.redox.2023.102687.






