从不吸烟者与吸烟者肺腺癌的独特
尽管吸烟是肺癌最重要的危险因素之一,但仍有大约 25% 的肺癌患者一生中吸烟少于 100 支,这被定义为从不吸烟者 (LCINS) 的肺癌。与吸烟者肺癌 (LCIS) 相比,LCINS 表现出独特的基因组结构,包括较低的肿瘤突变负荷 (TMB)、以 C>T 为主的核苷酸碱基替换以及更频繁的 EGFR、ERBB2、ALK 和 ROS1 体细胞改变。这些基因改变的普遍性为LCINS的靶向治疗带来了更多益处,这可能部分解释了LCINS患者更好的预后。然而,LCINS对抗程序性死亡配体1(PD-L1)免疫疗法的反应要差得多,这表明LCINS的肿瘤微环境(TME)可能与LCIS不同。因此,了解LCINS的复杂TME有助于改进其精准的治疗策略。本文解释了两种患者见不同的免疫微环境,于2023年9月发表《Cell Reports Medicine》,IF=14.3。
技术路线
主要研究结果
1、从不吸烟的LUAD患病率增加
为了表征从不吸烟的LUAD,作者首先对2009年1月至2016年12月在四川大学华西医院诊断为LUAD的8,396名中国患者进行了分析。超过一半的患者(59.4%)从不吸烟,在所有LUAD病例中,这一比例在8年内呈上升趋势。与吸烟者的LUAD相比,从不吸烟者的LUAD在女性中更为常见,且诊断年龄较轻,与其他研究相似。在预后方面,不吸烟者的总生存期(OS)明显优于吸烟者,这也是先前报道的。多因素Cox回归分析显示,存在吸烟史是LUAD患者较差OS的独立危险因素(危险比[HR], 1.31;95%置信区间[CI], 1.17-1.46;P < 0.001)。此外,与先前的研究一致,对LUAD基因改变的分析表明,EGFR突变在从不吸烟的LUAD中更为常见,而KRAS在吸烟者中更常发生突变(7.5% vs. 21.8%, p < 0.001)。此外,从不吸烟的LUAD患者PD-L1表达明显低于吸烟者(阴性[<1%],80.2% vs 65.7%, p < 0.001;低表达[1% ~ 49%],15.0% vs. 20.7%, p < 0.001;高表达[R50%], 4.8%比13.6%,p < 0.001),支持不吸烟LUAD患者对抗pd - l1免疫治疗的反应较差。综上所述,从不吸烟的LUAD表现出与吸烟者不同的临床和分子特征,突出了在单细胞分辨率下探索从不吸烟的LUAD的TME的重要性。
2、LUAD单细胞表达图谱及细胞类型鉴定
为了阐明不吸烟者LUAD的不同TME,对22例LUAD患者(13例不吸烟者和9例吸烟者)的肿瘤标本及其可用的远端正常肺组织进行了scRNA-seq(图1A)。首先,作者进行了1021个基因面板靶向区域测序(TRS),以在基因组水平上确认入组患者的吸烟状况。与以往的研究一致,本研究中从不吸烟的LUAD比吸烟的LUAD有更多的EGFR突变(84.6% vs. 25.0%, p = 0.018),更少的KRAS突变(0.0% vs. 25.0%, p = 0.058), TMB更低(中位数,3.36 vs. 4.80突变/ Mb, p = 0.08)(图1B和7C)。因此,作者纳入的样本代表了具有明确吸烟状态的LUAD,对这些样本进行scRNA-seq调查将有助于研究不吸烟者和吸烟者LUAD之间TME的差异。从不吸烟者/吸烟者的肿瘤组织和正常肺组织分别称为tNS/tS和nNS/nS。基于典型标记基因的表达,作者将165,753个质量控制通过的细胞分为八种主要细胞类型(图1C-1E),包括上皮细胞、免疫细胞(T淋巴细胞、自然杀伤[NK]细胞、B淋巴细胞、骨髓细胞和肥大细胞)和基质细胞(成纤维细胞和内皮细胞)。作者发现不同患者的免疫细胞和基质细胞按细胞类型聚集在一起,而上皮细胞在不同患者之间表现出高度的异质性(图1C)。鉴定出的最丰富的细胞是T/NK淋巴细胞和骨髓细胞(图1C)。此外,作者证实肿瘤组织中NK细胞比例低于正常肺组织,B淋巴细胞比例高于正常肺组织(图1F),表明TME激活了适应性免疫反应。值得注意的是,tNS中的NK细胞比tS中的NK细胞下降得更明显,这表明从不吸烟的LUAD的TMEs更有可能损害NK细胞的归巢。
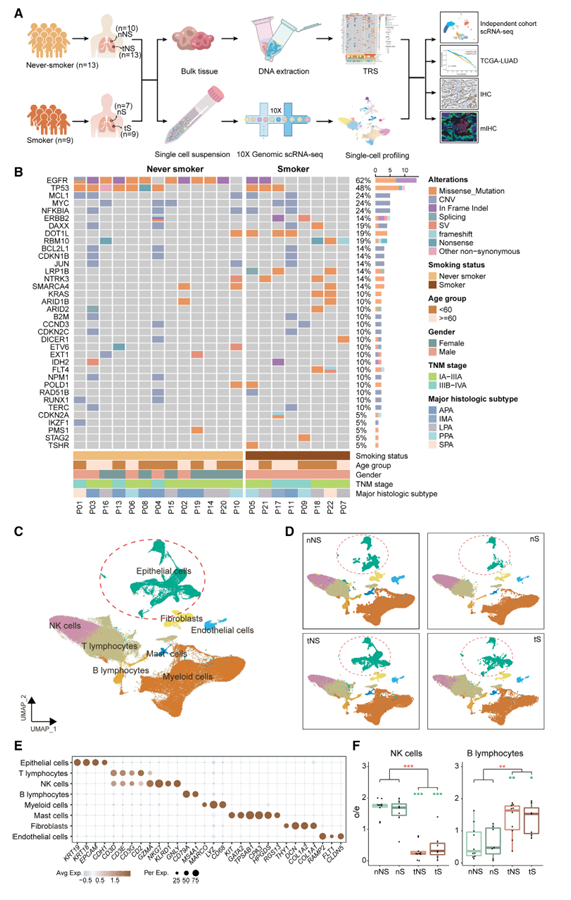
图1、从不吸烟者和吸烟者luad的突变景观和综合单细胞图谱
3、从不吸烟的LUAD内癌细胞的侵袭性较低
共获得肿瘤和正常肺组织上皮细胞24,965个。其中,来自正常肺组织的上皮细胞进一步聚集成5个不同的亚型,包括肺泡I型(AT1: AGER和RTKN2)、肺泡II型(AT2: SFTPC和SFTPD)、基底(KRT15和KRT17)、纤毛细胞(FOXJ1、CAPS和TPPP3)和俱乐部细胞(SCGB1A1),以及一个未定义的与俱乐部、纤毛细胞和淋巴细胞浸润相关基因高表达的群体(CCL4、CD52、CORO1A和CXCR4)。考虑到肿瘤组织中可能存在残留的非恶性细胞,我们采用推断拷贝数变异(inferering copy number variation, inferCNVs)来区分癌细胞和非恶性细胞。来自肿瘤组织的非恶性细胞与来自正常肺组织的上皮细胞重叠(图2A和2B)。我们观察到不同患者的癌细胞表现出很强的异质性,而正常肺组织的上皮细胞则没有异质性(图2A、2B)。为了明确癌细胞和正常上皮细胞之间的差异,我们在随后的分析中将这些非恶性细胞从肿瘤组织中排除。肺泡细胞包括AT1和AT2亚型,其中后者被认为是LUAD的起源。先前的研究表明,AT2细胞作为干细胞样祖细胞,参与肺泡更新、修复和癌变。利用已建立的AT2标记基因,包括SFTPB、SFTPC、SFTPD和SFTA3,我们比较了四种组织类型(tNS、tS、nNS和nS)中AT2特征的表达。结果显示,肿瘤组织(tNS/tS)表达的AT2信号低于正常肺组织(nNS/nS)(图2C)。此外,无论是肿瘤组织还是正常肺组织,吸烟者组织(tS/nS)的AT2信号均低于非吸烟者组织(tNS/nNS)。通过AT2细胞标记物SFTPC的多重免疫组织化学(mIHC)染色(图2D)和已发表的LUAD单细胞数据分析(GEO: GSE131907)。考虑到吸烟引起肺上皮损伤,是肺癌的明确外源性致癌物,我们的研究结果表明,吸烟引起正常肺上皮细胞的损伤。此外,我们探讨了AT2标记是否是患者生存的临床相关生物标志物,并在癌症基因组图谱(TCGA) LUAD大量RNA-seq数据集中发现AT2标记的高表达与改善的OS之间存在显著关联(p = 0.0045),这可以部分解释不吸烟的LUAD患者预后较好。为了加深我们对癌细胞转录特征的理解,我们利用Seurat FindMarkers功能,分别鉴定出14个上调的tNS特征基因和30个上调的tS特征基因(图2E)。其中,tNS特征中的4个基因(CTSH、LPCAT1、GPR116和PABPC1)和tS特征中的1个基因(MIF)通过免疫组化(IHC)分析得到验证(图2F)。GO富集分析显示,不吸烟者和吸烟者的LUAD参与不同的信号通路。例如,tNS信号与表面活性剂的稳态和磷脂的生物合成和代谢有关,而tS信号与肿瘤的生物学特性有关,包括细胞生长和迁移,这意味着tS癌细胞更具侵袭性。此外,tS特征的高表达与不利的生存相关(p = 0.043;图2 g)。为了进一步放大癌细胞,我们对所有癌细胞进行了亚聚类,得到了16个聚类。大多数来自吸烟者的细胞聚集在一个病人身上,而一些来自不吸烟者的细胞聚集在几个病人身上。这表明吸烟者的癌细胞比不吸烟者表现出更强的异质性(图2H-2J)。有趣的是,我们发现C9集群包含来自17例患者的癌细胞,其中大部分来自从不吸烟的LUAD,这表明C9的表达模式可能部分代表了从不吸烟的LUAD中癌细胞的共同特征。为了破译C9的转录特征,我们进行了GO富集分析,发现C9中上调的基因参与抗原加工和递呈,特别是通过主要组织相容性复合体(MHC) II类。我们进一步用MHC-II标记基因对每个癌细胞簇进行评分,观察到C9具有明显更高的MHC-II标记评分(图2K)。此外,我们还发现另外两个tNS簇C3和C15(图2K)也表现出高MHC-II特征。此外,我们发现来自tNS的癌细胞具有更高的MHC-II表达,这通过tNS和tS样品的mIHC染色以及LUAD (GSE131907)公布的scRNA-seq数据分析得到了验证。先前的研究表明,肿瘤特异性MHC-II分子与肿瘤肿块中更好的CD4+ T淋巴细胞浸润和活化相关。在我们的研究中,我们还发现tNS中存在比tS中更高比例的初始和活性CD4+ T淋巴细胞(图7B左),这表明从不吸烟LUAD的癌细胞可能促进肿瘤肿块中更好的CD4+ T细胞浸润和激活,从而引发抗肿瘤免疫反应。鉴于癌细胞上MHC-II的高表达与癌症患者良好的预后相关,不吸烟LUAD患者癌细胞中MHC-II的高表达可能部分解释了不吸烟LUAD患者预后较好的原因。
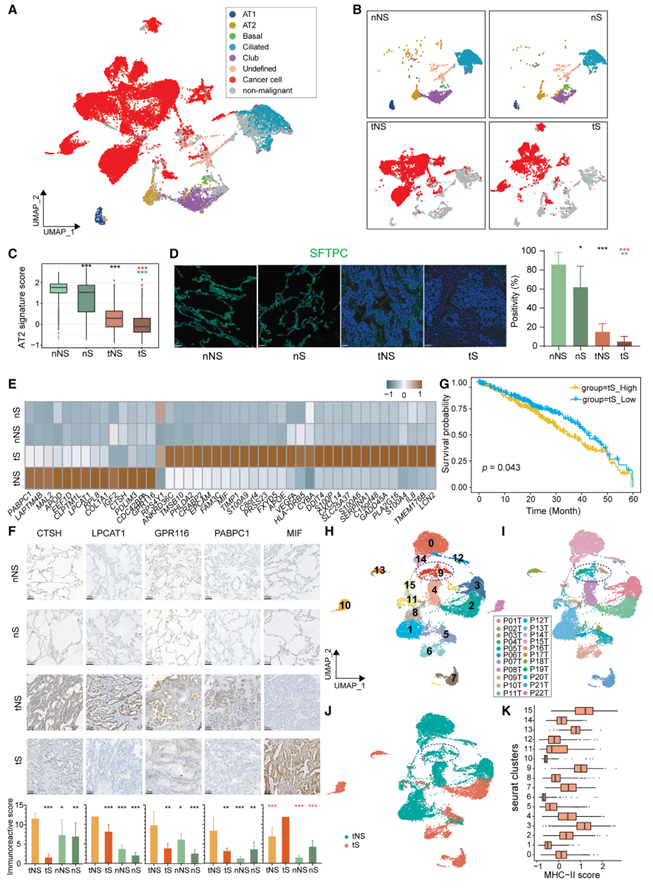
图2、从不吸烟者和吸烟者LUAD中癌细胞转录特征的鉴定
4、SPP1hi前细胞的鉴定及其与MDMs的潜在相互转化
骨髓细胞(n = 47,580)被分成20个簇,随后根据经典标记基因的表达将其分配到已知的细胞系:巨噬细胞(组织常驻巨噬细胞[TRM;C0, C1, C5, C12, C15],单核细胞源性巨噬细胞[MDM;C2, C4, C6, C8, C10, C13]),单核细胞(CD14+ [C3]和CD16+ [C11]单核细胞),树突状细胞(dc;cDC1s [C17], cDC2s [C7, C14],活化的dc [C18]和pDCs [C16])和中性粒细胞(C19)(图3A, 3B)。在这些细胞类型中,CD14+和CD16+单核细胞在肿瘤组织中均缺失(图3F)。据报道,巨噬细胞包括两种不同的谱系,TRM和MDM,其中TRM是局部自我更新的,而短期MDM是由成人造血干细胞产生的,这两者都在作者的研究中发现(图3A)。有趣的是,作者发现另一个巨噬细胞群(C9)具有混合特征,高表达细胞周期基因(MKI67、STMN1和TUBB)、TRM标记基因(MARCO、FABP4和C1QA)和MDM标记基因(APOE、SPP1和CCL2)(图3B),因此作者将这个具有潜在增殖特性的巨噬细胞群命名为Mixed_mac。为了确定Mixed_mac的转录状态,作者对三种巨噬细胞群体(TRM、MDM和Mixed_mac)进行了轨迹分析。结果表明,Mixed_mac细胞可以分为两部分:一部分(C9-1)位于靠近TRM的位置,另一部分(C9-2)位于靠近MDM的位置(图3C)。两个种群间基因表达差异分析表明,C9-1高水平表达TRM标记基因(FABP4、MARCO和INHBA),而C9-2高水平表达MDM标记基因(SPP1)(图3D);因此,作者将Mixed_mac的这两个种群分别命名为FABP4hi pro和SPP1hi pro。总的来说,作者研究中的巨噬细胞分为四个种群(TRM、MDM、FABP4hi pro和SPP1hi pro),它们的转录模式不同(图3E)。进一步分析这四种巨噬细胞群的分布,发现肿瘤组织中TRM比正常肺组织少,MDM比正常肺组织多(图3F),与前期研究一致。此外,与nS相比,tS组的TRM显著降低,而tNS组和nNS组之间没有明显变化(图3F),通过患者样本中CD68+ FABP4+细胞的mIHC染色证实了这一点(图3G)。重要的是,作者发现FABP4hi pro和TRM具有相似的分布(图3F), SPP1hi pro在四种组织类型中表现出与MDM相同的趋势(图3F和3H)。根据作者的轨迹结果(图3C)、骨髓细胞的UMAP图(图3A和S5A)以及这四种巨噬细胞群体的分布趋势(图3F),作者得出结论,FABP4hi pro可能会刷新TRM,证实了TRM的更新能力。同样,作者推断SPP1hi pro可以生成MDM。鉴于据报道MDM仅来源于单核细胞,作者对MDM、SPP1hi pro和单核细胞进行了轨迹分析。结果显示,SPP1hi前细胞和单核细胞都可能是MDMs的独立来源(图3I)。此外,SPP1hi前细胞主要存在于肿瘤组织中,尤其是在tNS样本中(图3H),这表明SPP1hi前细胞在TME中产生更多MDM,从而促进LUAD的发生,特别是对于从不吸烟的患者。
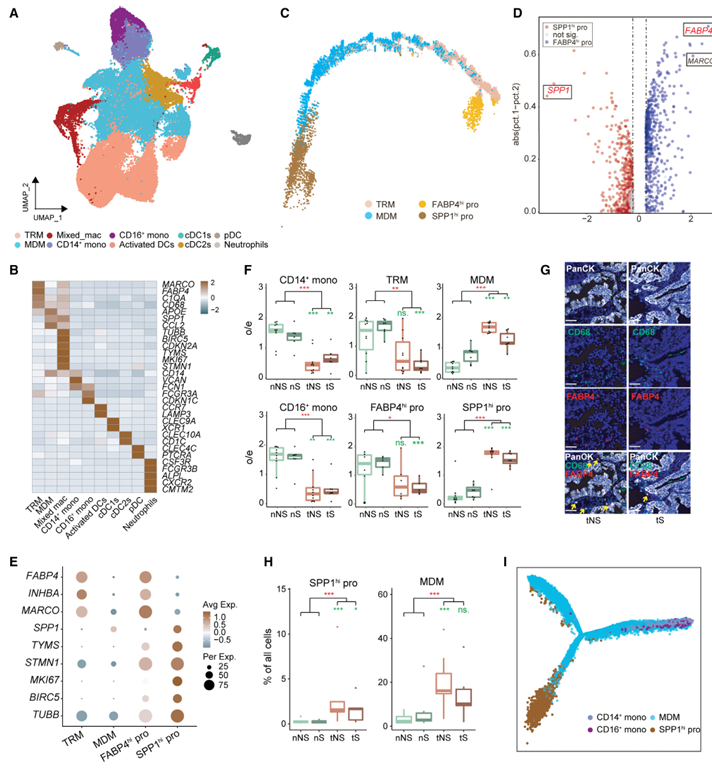
图3、骨髓细胞SPP1hi前细胞的鉴定
5、从不吸烟的LUAD内的巨噬细胞表现出更多的免疫抑制特性
巨噬细胞具有很高的可塑性,通常极化为两种表型,即“经典活化”的M1和“交替活化”的M2。M1巨噬细胞被认为具有促炎和抗肿瘤的表型,而M2巨噬细胞具有抗炎和促肿瘤的作用。利用M1/M2标记基因,作者证实了LUADs中M1和M2巨噬细胞共存(图4A)。肿瘤组织中TRM和MDM的M1评分均低于正常组织,M2评分均高于正常组织(图4B-4E),说明TRM和MDM在LUAD中具有免疫抑制作用。此外,作者发现tNS中TRM的M2评分高于tS(图4E),这是由于tNS中CTSA、CTSB、CTSC、CTSD和CCL18等部分M2标记基因的表达较高(图4F)。此外,在4种组织类型中,TRM的抗炎评分与M2评分的趋势相似(图4G和4H)。总的来说,这些发现表明TRMs在从不吸烟的LUAD中发挥更强的免疫抑制和促肿瘤作用。巨噬细胞作为抗原呈递(AP)细胞在适应性免疫应答中起着重要作用。根据AP标记基因,作者计算AP评分,发现肿瘤组织内的TRM/ MDMs评分高于正常肺组织(图4I和图4J),表明肿瘤适应性免疫被激活。此外,作者发现tNS中的TRMs和MDMs的AP评分明显低于tS(图4I和4J),这表明在不吸烟的LUAD中存在以巨噬细胞为代表的免疫抑制微环境。基于上述SPP1在巨噬细胞中的表达,作者观察到两个MDM集群(C2, C10)的细胞表达SPP1水平显著升高,并将其命名为SPP1hi MDM。值得注意的是,这个MDM子集几乎只存在于肿瘤样本中,这促使作者探索它对LUAD TME的影响。作者比较了tNS和tS的特异性特征(M1、M2、抗炎和AP)评分。结果显示,与tS相比,tNS的M1和AP评分较低,M2和抗炎评分较高(图4K),表明SPP1hi MDM在不吸烟LUAD的TME中发挥了更大的免疫抑制和致瘤作用。此外,SPP1hi MDM在tNS中的免疫抑制作用进一步被其更高的PD-L1表达所证实(图4L), PD-L1是抗PD-L1免疫治疗应答的生物标志物。综上所述,非吸烟LUAD患者的TRM和MDM均比吸烟LUAD患者表现出更强的免疫抑制作用。
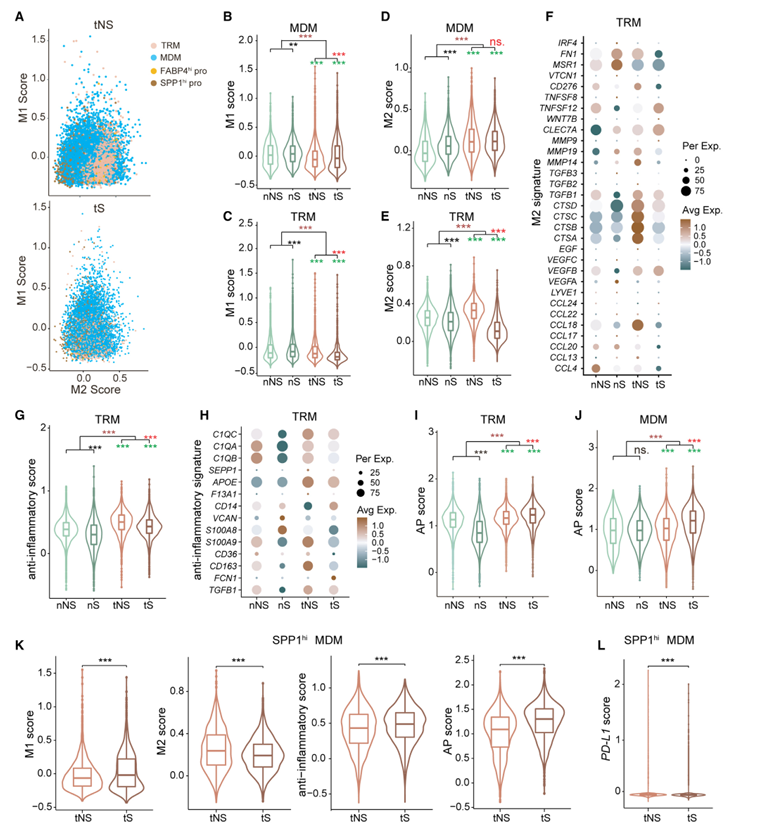
图4、LUAD中巨噬细胞群体的特征
6、T/NK细胞在从不吸烟的LUAD中表现出更强的抗肿瘤免疫抑制
作者对80,194个T/NK细胞进行了亚聚类,以鉴定CD4+ T淋巴细胞(原生CD4+、活性CD4+、调节性T [Treg])、CD8+ T淋巴细胞(GZMB CD8+、GZMK CD8+和耗散T细胞)和NK细胞(CD16+和CD16 )(图5A、5B)。在这些细胞中,Treg细胞在肿瘤组织中增加(图5C),与其他报道相似。此外,Treg细胞在tNS中比在tS中显著增加(图5D),这可以解释为tNS中有更多的TRM(图3F),因为据报道TRM可以招募、分化和扩增Treg细胞。CD16+ NK细胞作为细胞毒性NK细胞的主要亚群,在肿瘤组织中呈下降趋势,尤其是在tNS中(图5C)。结合作者之前观察到的NK细胞在tNS中的下降更为显著(图1E),作者推断NK细胞介导的免疫受损与数量减少和功能受损都有关。然而,GZMK+和耗尽的CD8+ T细胞在肿瘤组织和正常组织中均无显著差异(图5C)。CD8+ T淋巴细胞主要通过分泌GZMB、GZMK、GZMH、GZMM等颗粒酶发挥细胞毒作用。其中,GZMB具有最大的细胞毒能力。作者发现,GZMK CD8+ T细胞在肿瘤组织和正常组织之间没有显著差异,但GZMB CD8+ T细胞在肿瘤组织中明显减少,尤其是在tNS中(图5C),这表明细胞毒性CD8+ T细胞的适应性免疫反应在从不吸烟的LUAD中比吸烟者受到更大的抑制。为了进一步探讨不吸烟者和吸烟者LUAD患者GZMB CD8+ T细胞中的异常分子,作者进行了差异基因表达分析,发现tNS患者GZMA和GZMH的表达升高(图5E-5G)。根据颗粒介导的细胞毒性标记基因,作者发现与tS相比,tNS中GZMB CD8+ T细胞GZMB的表达较低,而GZMA、GZMH和GZMM的表达较高(图5G)。这些结果表明,GZMB CD8+ T细胞在tNS中数量显著减少,但其功能可能受损。此外,GZMK CD8+ T细胞表达的细胞毒性标志物(GNLY、NKG7和FGFBP2)水平低于GZMB CD8+淋巴细胞,但同时表达了一定水平的衰竭标志物(LAG3和PDCD1)(图5B)。据报道,GZMK CD8+亚群是小鼠和人类炎症老化的标志,因此GZMK CD8+ T群可能代表LUAD中从效应T细胞到耗竭T细胞的过渡状态。
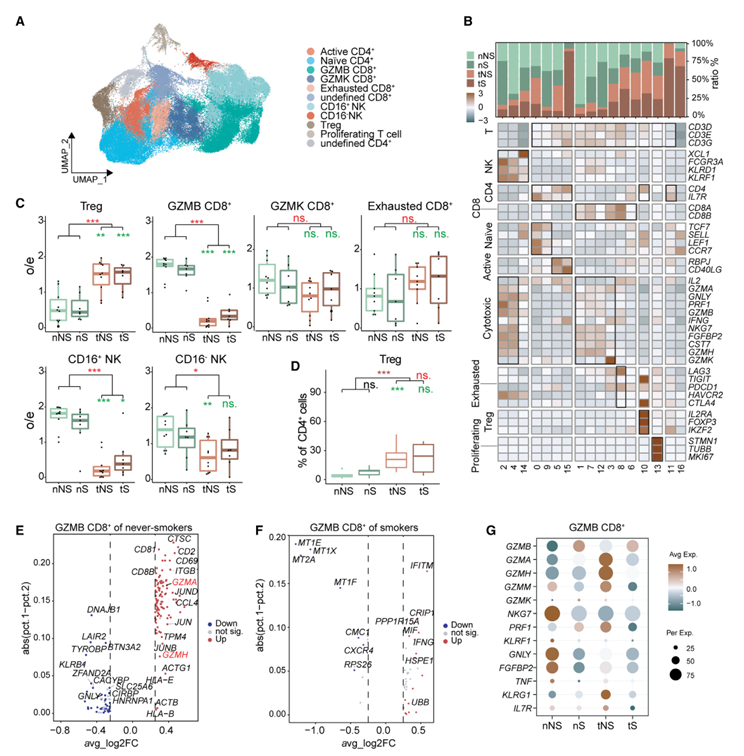
图5、LUAD中T/NK淋巴细胞对促肿瘤表型的重编程
7、间质细胞在非吸烟者和吸烟者LUAD中发挥不同的促肿瘤作用
组织中的基质细胞包括内皮细胞(ECs)和成纤维细胞。首先,作者确定了五种不同的ECs亚型,包括淋巴型、尖端型、茎型和肿瘤型ECs以及内皮祖细胞(图6A和6B)。与以往研究一致,作者也发现肿瘤ECs主要存在于肿瘤组织中(图6C)。为了更深入地了解ECs,作者进行了基因集变异分析(GSVA)来比较肿瘤和正常肺组织中ECs的表达谱(图6D)。肿瘤组织中最富集的通路包括上皮-间质转化、Wnt/b-catenin信号传导和血管生成,这可能有助于LUAD的进展。作者进一步比较了tNS和tS样品中ECs的表达谱,发现tS的ECs中肌生成通路上调,而tNS的ECs中凋亡通路上调(图6E),提示ECs在不吸烟者和吸烟者LUAD中发挥不同的作用。在作者的数据中确定了9种不同亚型的成纤维细胞(图6F和6G),包括COL13A1+、炎性成纤维细胞、脂肪成纤维细胞、间皮细胞、mmp -高、肌成纤维细胞、周细胞、平滑肌细胞和通用P16+成纤维细胞。此外,作者发现肿瘤组织中肌成纤维细胞比正常肺组织多(图6H),支持肌成纤维细胞作为癌症相关成纤维细胞促进肿瘤进展的作用。GSVA分析显示,与正常肺组织相比,肿瘤组织中血管生成通路丰富(图6I)。此外,肌生成在tNS样本中不富集,而在tS样本中富集(图6J),这表明成纤维细胞在不吸烟者和吸烟者LUAD中的作用不同。
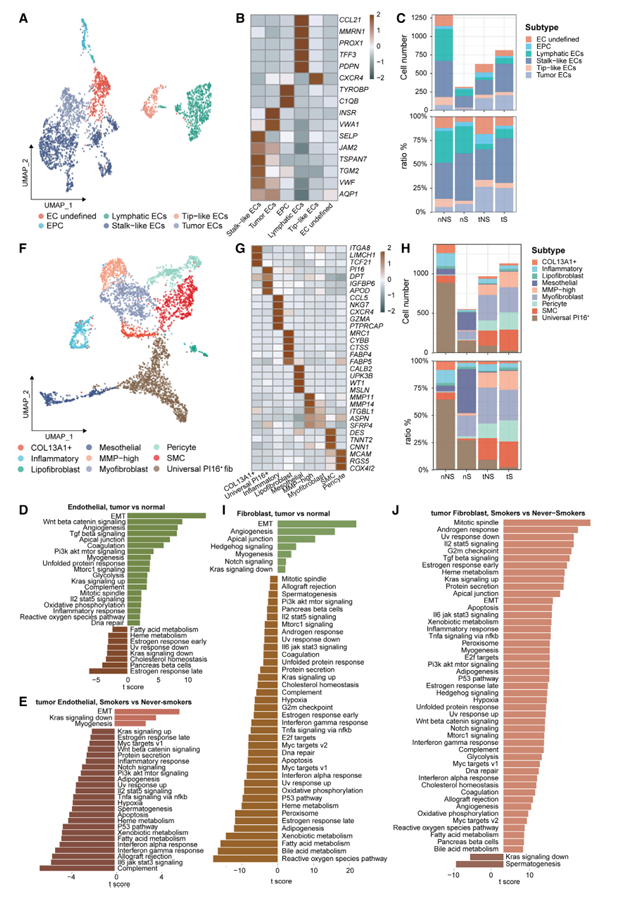
图6、本研究中鉴定的基质细胞亚群
8、细胞间相互作用揭示CD47是不吸烟LUAD的免疫治疗靶点
为了描述LUAD TME中的细胞间通讯,作者首先利用CellPhoneDB构建了细胞相互作用网络,以鉴定主要细胞类型之间配体/受体的表达,作者发现巨噬细胞(TRM、MDM、FABP4hi pro和SPP1hi pro)与其他细胞类型,特别是癌细胞之间存在广泛的通讯(图7A)。此外,四种巨噬细胞亚型在tNS中的含量均高于tS(图7B,左)。因此,巨噬细胞对从不吸烟的LUAD的肿瘤发展起着更大的作用。临床中,LCINS对抗pd - l1免疫治疗的敏感性低于LCIS。作者首先分析了非吸烟者和吸烟者LUAD中最常见的预测性生物标志物,包括TMB和PD-L1。结果显示,与tS相比,tNS的TMB较低(p = 0.08;图7C),并且癌细胞中PDL1的表达较低(p < 2.22e 16;图7D),经mIHC显微镜验证(图7F)。这些结果可以解释不吸烟的LUAD患者对抗pd - l1免疫治疗的不满意反应。为了探索不吸烟LUAD的更好的免疫治疗策略,作者检测了不同细胞类型中免疫检查点的表达。与PD-L1相比,CD47和CEACAM1在癌细胞上的表达明显升高。有趣的是,CD47的配体SIRPA在四种巨噬细胞亚型(MDM、SPP1hi pro、TRM和FABP4hi pro)上的表达比其他免疫细胞或基质细胞高得多(图7B,右)。此外,值得注意的是,从不吸烟的LUAD患者癌细胞的CD47表达高于吸烟者(图7E),这一点通过mIHC染色得到了验证(图7F)。根据作者的观察,四种巨噬细胞亚型在tNS中比在tS中存在更多(图7B,左),作者得出结论,免疫检查点CD47-SIRPA轴可能在从不吸烟的LUAD中发挥更大的免疫抑制作用。重要的是,抗cd47抗体在实体肿瘤(包括肺癌)中的临床试验正在进行中。由于癌细胞中MHC-I分子表达较低的肿瘤对抗cd47抗体更敏感,作者比较了tNS和tS之间MHC-I分子的表达,结果显示tNS的MHC-I分子(HLA-A, HLA-B和HLA-C)的表达较低(图7G),这意味着从不吸烟的LUAD可以从抗cd47免疫治疗中获益更多。因此,CD47可能是LUAD的潜在免疫治疗靶点,特别是对于从不吸烟的LUAD。
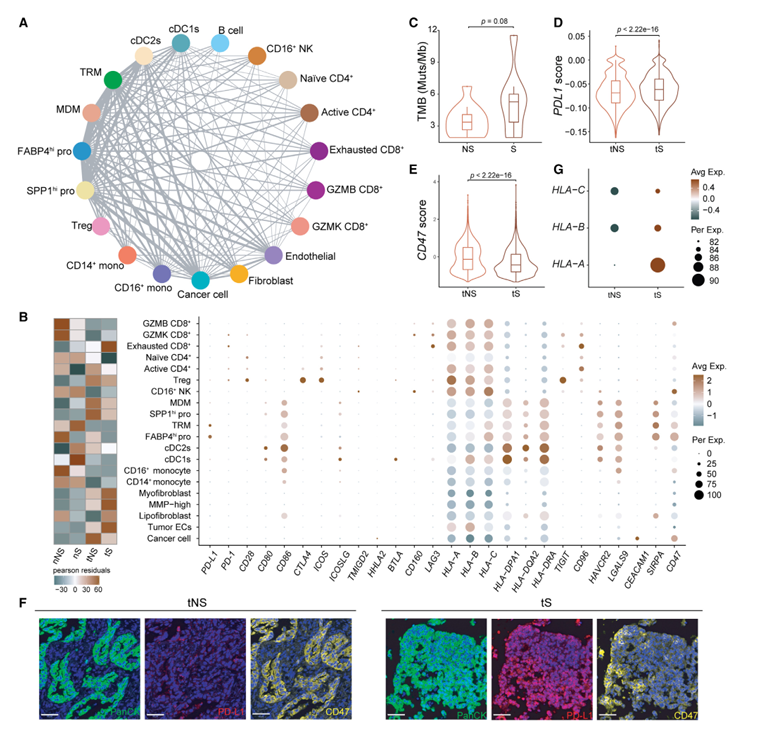
图7、LUAD中细胞类型间的细胞间通信网络
结论
总之,在从不吸烟的LUAD中,癌细胞表现出较少的侵袭作用,而免疫环境表现出更多的免疫抑制作用。此外,一种名为SPP1hi pro的巨噬细胞亚型被发现是TME内另一种独立的MDM来源,它具有免疫抑制作用。重要的是,靶向CD47-SIRPAa免疫检查点轴可能是治疗不吸烟luad的更好的免疫治疗策略。因此,本研究提高了我们对不吸烟LUAD的肿瘤发生机制的理解,并提供了一种潜在的免疫治疗策略。
实验方法
单细胞测序,靶向区域测序和基因组数据分析,免疫组化(IHC),多重免疫组化(mIHC)染色,基因集变异分析(GSVA),细胞间相互作用分析
参考文献
Luo W, Zeng Z, Jin Y, Yang L, Fan T, Wang Z, Pan Y, Yang Y, Yao M, Li Y, Xiao X, Wang G, Wang C, Chang S, Che G, Zhang L, Li Y, Peng Y, Li W. Distinct immune microenvironment of lung adenocarcinoma in never-smokers from smokers. Cell Rep Med. 2023 Jun 20;4(6):101078. doi: 10.1016/j.xcrm.2023.101078IF: 14.3 Q1 . Epub 2023 Jun 9. PMID: 37301197; PMCID: PMC10313938.






