国自然热点-迁移体的最近新文章:PI(4,5)P -Rab35轴调节迁移体形成

迁移体是最近发现的新兴细胞器,其形成与细胞迁移密切相关。当细胞在胞外基质上迁移时,被称为收缩纤维(RFs)的长膜突起从细胞后部的质膜上拉出。RFs就像连接细胞体和基质的绳索。迁移体是一种大的囊泡状结构,在RFS形成开始数小时后开始在RFs上生长。迁移体内部包含多个小囊泡,像石榴一样,可携带多种生物分子。迁移体提供了一种整合和传递时空化学信息的机制,用于细胞间的交流。目前关于迁移体的中标项目逐渐增多,迁移体的功能和机理研究仍待发掘,因此不失为基金申请的好方向。下图为2023年部分迁移体中标项目的题目:
那么,如何在课题中引入和研究迁移体呢?下面,作者通过一篇最近的新高分文章解读来了解。
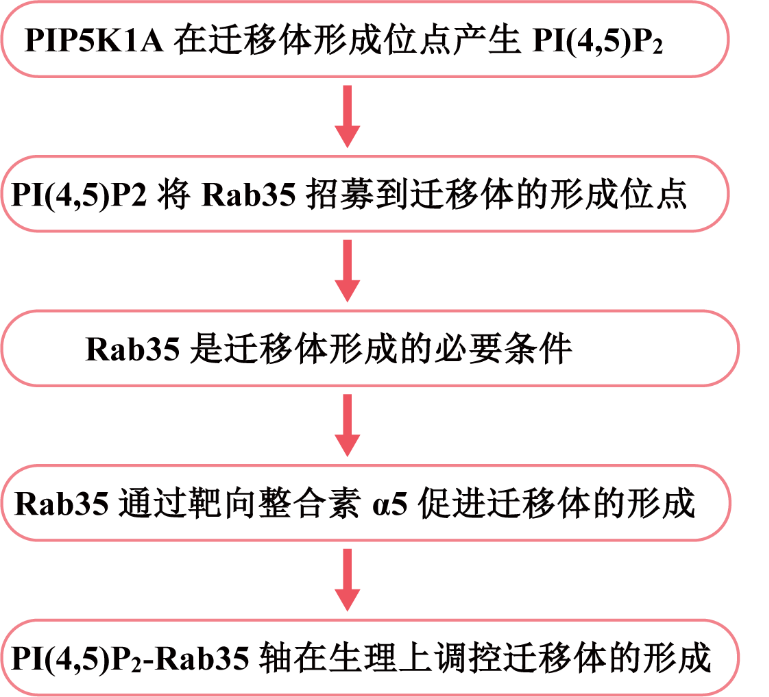
迁移体是最近发现的细胞器,它形成于迁移细胞后缘的RFs的末端或分支点上。先前,作者发现整合素在迁移体形成部位的募集对迁移体的生物发生至关重要。在这项研究中,作者发现在迁移体形成之前,PIP5K1A(一种将PI4P转化为PI(4,5)P2的PI4P激酶)被募集到迁移体形成位点。PIP5K1A的募集导致在迁移体形成位点产生PI(4,5)P2。一旦积累,PI(4,5)P2通过与Rab35的C端多碱性簇相互作用将Rab35招募到迁移体形成位点。作者进一步证明,活性Rab35通过在迁移体形成位点募集和聚集整合素α5来促进迁移体的形成,这可能是由整合素α5和Rab35之间的相互作用介导。该研究确定了协调迁移体生物形成的上游信号通路,于2023年8月发表在《Journal of Cell Biology》,IF = 44.1。
研究思路
主要研究结果
1. PIP5K1A在迁移体形成位点产生PI(4,5)P2
之前,作者发现PI(4,5)P2的探针PLCγ-PH-TagBFP可以标记迁移体,作者在这里证实了这一点(图1A)。使用抗PI(4,5)P2抗体对细胞进行染色也显示迁移体中PI(4,5)P2信号的富集(图1B)。这些结果表明迁移体含有PI(4,5)P2。为了研究PI(4,5)P2在迁移体上的动态分布,作者进行了延时成像发现PI(4,5)P2的探针PLCγ-PH-TagBFP在TSPAN4之前被募集到迁移体(图1C)。接下来,作者比较了PLCγ-PH-TagBFP与整合素α5的动态关系。作者发现PLCγ-PH-TagBFP的募集速度略快于整合素α5(图1D, E)。这些数据表明在迁移体生长之前,PI(4,5)P2在迁移体形成部位产生或聚集。PI4P激酶可将PI4P转化为PI(4,5)P2,从而产生PI(4,5)P2。为了检测PI4P激酶是否参与迁移体形成部位PI(4,5)P2的生成,作者对细胞进行了染色,作者发现PIP5K1A定位在迁移体上(图1F)。同样,异位表达的PIP5K1A-GFP定位在迁移体上,延时成像显示PIP5K1A-GFP被招募到迁移体形成的位置,比TSPAN4的招募要早(图1G)。这与PI(4,5)P2信号的外观一致(图1C)。
接下来,作者测试了PIP5K1A是否在迁移体形成位点负责PI(4,5)P2的生成。使用PIP5K1A抑制剂ISA2011B处理细胞,发现ISA2011B处理阻断了迁移体的形成(图1H, I)。为了进一步证实PI(4,5)P2是迁移体形成所必需的,在PIP5K1A敲除(KO)细胞中,迁移体的形成明显减少,而异位表达的野生型(WT) PIP5K1A恢复了迁移体的形成(图1J, K)。这表明PIP5K1A的酶活性是迁移体形成所必需的,并进一步证明PI(4,5)P2的水平是迁移体形成的决定因素。总之,这些结果表明PIP5K1A在迁移体形成部位产生PI(4,5)P2是迁移体生物发生所必需的。由于PI(4,5)P2可以被脂质磷酸酶水解,作者接下来研究了已知PI(4,5)P2磷酸酶的定位,发现PLCD3定位在迁移体上为了进一步测试PI(4,5)P2在迁移体形成中的作用,作者构建了PLCD3 KO细胞系。在该细胞系中,迁移体的形成明显增强,PLCD3的异位表达使迁移体的形成恢复到正常水平。总之,这些证实PI(4,5)P2在迁移体形成中的作用。
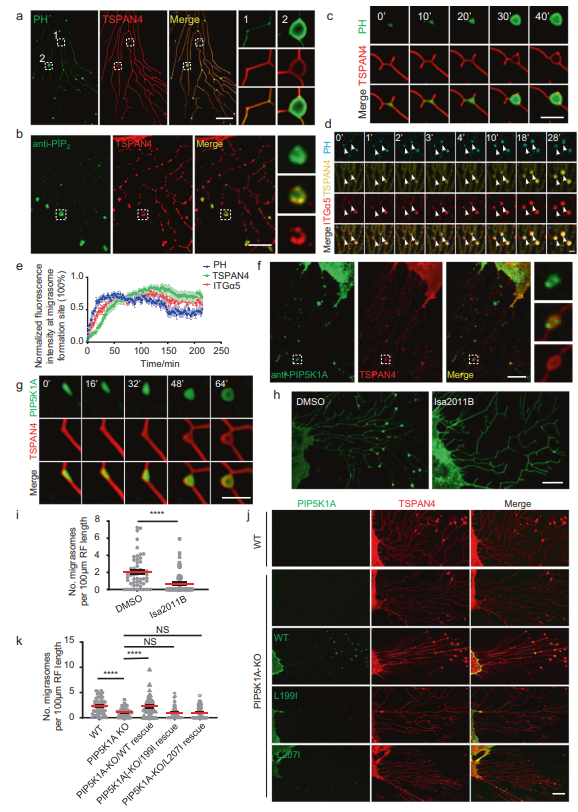
图1 PIP5K1A在迁移体形成位点产生PI(4,5)P2。
2. PI(4,5)P2将Rab35招募到迁移体的形成位点
接下来,作者研究了PI(4,5)P2如何调控迁移体的形成。作者推断PI(4,5)P2可能通过募集PI(4,5)P2结合蛋白调控迁移体的形成,而这些蛋白是迁移体形成所必需的。为了筛选可能定位于迁移体的PI(4,5)P2结合蛋白,作者首先编制了大鼠基因组中所有PI(4,5)P2结合蛋白的列表。接下来,作者将此列表与迁移体中的蛋白质列表进行比较,作者之前通过纯化迁移体的质谱(MS)分析发现了23个PI(4,5) P2结合蛋白MS列表,包括Rab35(图2a)。然后,作者为其中的19个蛋白生成了mcherry标记的构建体,并发现其中一些蛋白定位在迁移体上。在这些蛋白中,作者选择Rab35进行进一步的研究,因为Rab35在细胞器生物发生中起着关键作用。
首先用抗Rab35抗体染色细胞来证实Rab35的募集。作者发现内源性Rab35确实定位于迁移体和沿着RFs的小点上(图2B)。同样,异位表达的mCherry-Rab35定位于迁移体和迁移体形成位点(图2C)。为了研究Rab35招募的动态,作者使用mCherry-Rab35进行了延时成像(图2D),发现Rab35信号首先沿RFs均匀扩散分布。在迁移体形成之前,Rab35信号逐渐集中在分支点,并变得更加强烈。最终,Rab35阳性点开始扩大并长成迁移体(图2D)。这些结果表明Rab35在迁移体生物发生之前被募集到迁移体形成的位点。接下来,作者测试了Rab35在迁移体形成位点的募集是否依赖于PI(4,5)P2。作者用PIP5K1A抑制剂ISA2011B处理细胞,观察到Rab35在迁移体形成位点的募集受损(图2E, F)。同样,在PIP5K1A KO细胞中,Rab35未能被募集到迁移体形成位点(图2G, H)。这些结果证实Rab35的募集依赖于PI(4,5)P2。
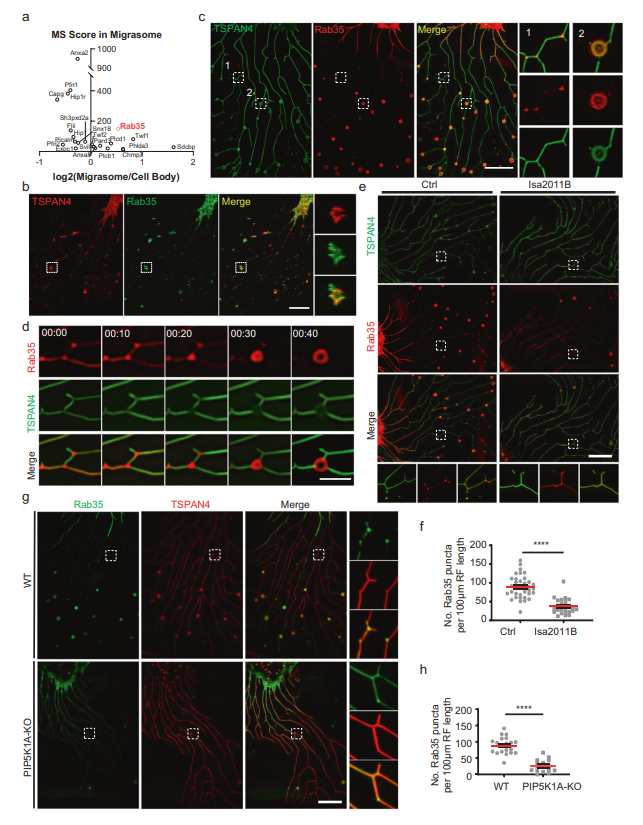
图2 PI(4,5)P2将Rab35招募到迁移体的形成位点
3. Rab35是迁移体形成的必要条件
接下来,为了测试Rab35是否需要迁移体的形成,作者产生了Rab35 KO细胞系。作者发现,Rab35的KO严重损害了迁移体的形成(图3A, B)。有趣的是,Rab35的KO增加了RFs的数量和长度(图3A, C)。Rab35 KO细胞系中WT Rab35和组成型活性Rab35-q67l的稳定表达挽救了迁移体的形成,而Rab35-s22n的显性阴性突变体的稳定表达未能挽救迁移体的形成(图3D, F)。这些结果表明,活性Rab35是迁移体形成所必需的。先前的文献表明,PI(4,5)P2通过与其C端多碱性氨基酸团簇(由一段带正电的赖氨酸和精氨酸残基组成)相互作用将Rab35招募到质膜上当作者用非极性中性氨基酸Ala (Rab35-7a)取代多碱性氨基酸簇时,作者发现突变体Rab35不能被招募到迁移体中,也不能挽救迁移体的形成(图3D, E)。为了进一步证实Rab35在迁移体形成中的作用,作者建立了稳定表达WT Rab35、显性阴性Rab35-s22n和组成活性Rab35-q67l的细胞系。与拯救实验一致,作者发现过表达WT Rab35和组成活性Rab35-q67l增强了迁移体的形成,而表达显性阴性的Rab35-s22n减少了迁移体的形成。此外,表达显性阴性的Rab35-s22n增强迁移体形成(图3F)。综上所述,这些数据表明Rab35在调节RFs长度和迁移体形成中起重要作用。
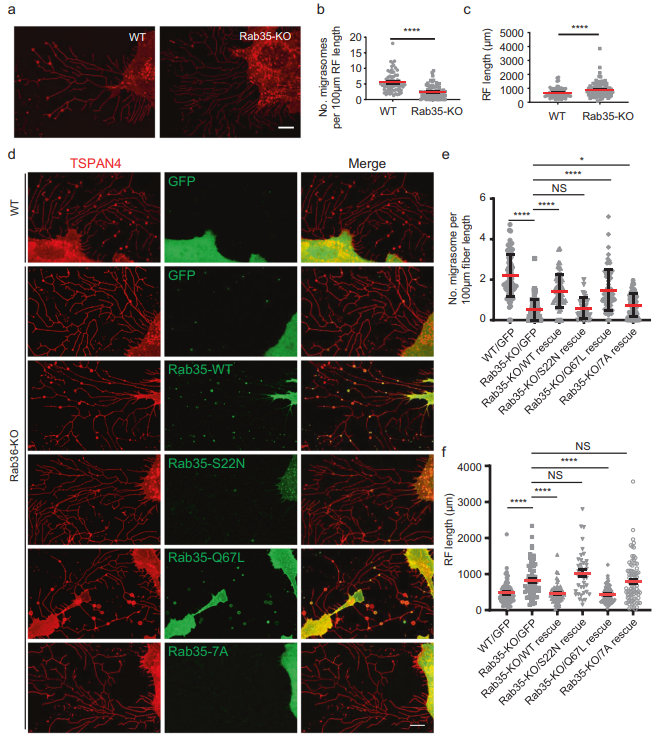
图3 Rab35是迁移体形成所必需的
4. Rab35通过靶向整合素α5促进迁移体的形成
最后,作者研究了Rab35如何促进迁移体的形成。先前的文献表明Rab35是整合素运输所必需的,因此作者选择研究整合素和Rab35之间的关系。先前作者发现整合素异源二聚体与细胞外基质(ECM)蛋白的配对决定迁移体的形成具体来说,作者发现当细胞在包被特定ECM蛋白的培养皿中生长时,可以与特定ECM蛋白结合的整合素异二聚体在迁移体形成位点高度富集,并在迁移体的生物发生中发挥重要作用。在纤维连接蛋白上生长的细胞中,整合素α5β1在迁移体中高度富集。在WT细胞中,大部分整合素α5集中在迁移体上,缩回纤维中很少有整合素α5。相反,作者发现在Rab35 KO细胞中,ITGα5-GFP不是集中在迁移体形成部位,而是沿RFs均匀弥散分布(图4A-C)。这表明在Rab35缺失的情况下,整合素对迁移体形成位点的靶向作用受损。接下来,作者研究了rab35依赖性募集ITGα5-GFP的分子机制。先前的报道表明,所有整合素α亚基都可以通过保守的膜-近端GFFKR基序与Rab21结合,该基序也存在于整合素α5.14中。作者想知道Rab35是否可以通过该基序与整合素α5结合。为了验证这一假设,作者制作了一个整合素α5突变蛋白,GFFKR突变为AAAAA (1-5A)。作为对照,作者还生成了另外4个突变体,其中整合素α5细胞质部分的4组连续5个氨基酸突变为AAAAA (2-5A, 3-5A, 4-5A, 5-5A)(图4D)。总之,这些突变体覆盖了大部分整合素α5细胞质结构域。作者发现GFFKR/AAAAA (1-5A)突变体对迁移体形成位点的靶向性受损(图4E, F)。这表明GFFKR基序是将整合素α5靶向到迁移体形成位点所必需的,可能是通过影响与Rab35的关联。
接下来,作者想直接测试Rab35和整合素α5之间可能的相互作用。使用双色荧光相互关联光谱(dcFCCS)捕捉Rab35与整合素α5的胞质结构域(ITGα5-cyto)之间的相互作用(图4)。作者首先纯化了GFP-Rab35-WT和GFPRab35-Q67L(组成型活性突变体)蛋白,合成了用荧光团Cy5 (Cyanine5)标记的ITGα5-cyto-WT和ITGα5-cyto-1-5A。当GFP-Rab35-WT与Cy5-ITGα5-cyto-WT或Cy5荧光团混合时,两者均未表现出显著的互相关信号(图4H),说明WT-Rab35与Cy5-ITGα5-cyto-WT没有结合。而本构活性突变体GFP-Rab35-Q67L在类似实验条件下与Cy5-ITGα5-cytoWT表现出较强的相互关联信号(图4H),表明GFP-Rab35-Q67L可以结合Cy5-ITGα5-cyto-WT。相比之下,GFP-Rab35-Q67L与Cy5-ITGα5-cyto-1-5A没有交叉相关信号(图4H),这表明整合素α5的胞质结构域与Rab35的活性形式结合需要GFFKR基序。值得注意的是,重组GFP-Rab35-WT是从大肠杆菌中纯化出来的,因此应该处于失活状态。作为对照,作者还测试了GFP-Rab35-S22N与Cy5-ITG-α5-cyto-WT的结合,发现GFP-Rab35-S22N与Cy5-ITG-α5-cyto-WT之间没有结合。这些数据表明,活性Rab35可以通过GFFKR基序结合到整合素α5的细胞质结构域。作者推断,如果Rab35通过与整合素α5的GFFKR基序相互作用将整合素α5招募到迁移体的形成位点,那么将含有GFFKR基序的整合素α5衍生肽加载到细胞中应该会竞争性地抑制Rab35介导的整合素α5招募到迁移体的形成位点,从而减少迁移体的形成。事实上,作者发现用质膜渗透肽Tat-ITGα5-cyto-WT处理细胞减少了整合素对迁移体形成部位的靶向和迁移体的形成。相比之下,用GFFKR/AAAAA突变肽处理细胞未能阻断整合素靶向或迁移体的形成(图4I-L)。这些结果表明Rab35通过将整合素靶向到迁移体形成位点来促进迁移体的形成。
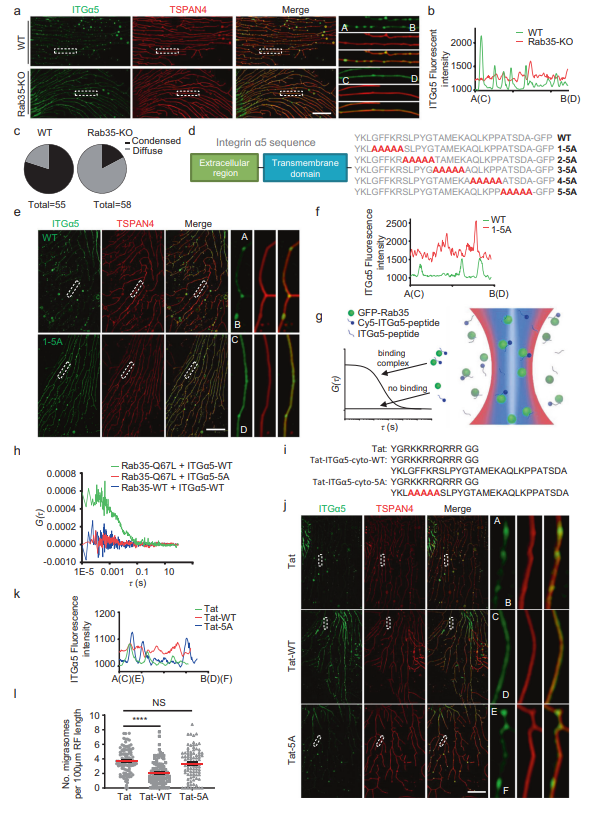
图4 Rab35通过靶向整合素α5促进迁移体的形成
5. PI(4,5)P2-Rab35轴在生理上调控迁移体的形成,并且在进化上是保守的
最后,作者测试了PI(4,5)P2-Rab35轴是否在不同环境下调节迁移体的形成。作者首先测试了BJ细胞,这是一种从新生儿男性正常包皮皮肤上建立的成纤维细胞系。作者发现,用PIP5K1A抑制剂ISA2011B(图5A, B)或敲低PIP5K1A(图5C, D)处理BJ细胞,会显著损害迁移体的形成。此外,用Tat-ITGα5-cyto-WT处理BJ细胞,可以阻断迁移体的形成(图5E, F)。这些观察结果表明,PI(4,5)P2-Rab35轴对迁移体形成的调节在人类细胞中是保守的。最后,作者在体内测试了PI(4,5)P2-Rab35轴是否调控迁移体的形成。以前,作者报道斑马鱼在胚胎发育过程中形成迁移体。这里,作者发现与GFFKR/AAAAA突变肽相比(图5K, L),用PIP5K1A抑制剂(图5G, H)处理斑马鱼胚胎可以显著减少迁移体的形成。此外,使用反义morpholino寡核苷酸(MO)敲除Rab35可显著降低斑马鱼胚胎中迁移体的形成(图5I, J)。总之,这些发现表明PI(4,5)P2-Rab35轴在一系列生理环境中调节迁移体的形成,并且在不同的脊椎动物中是保守的。
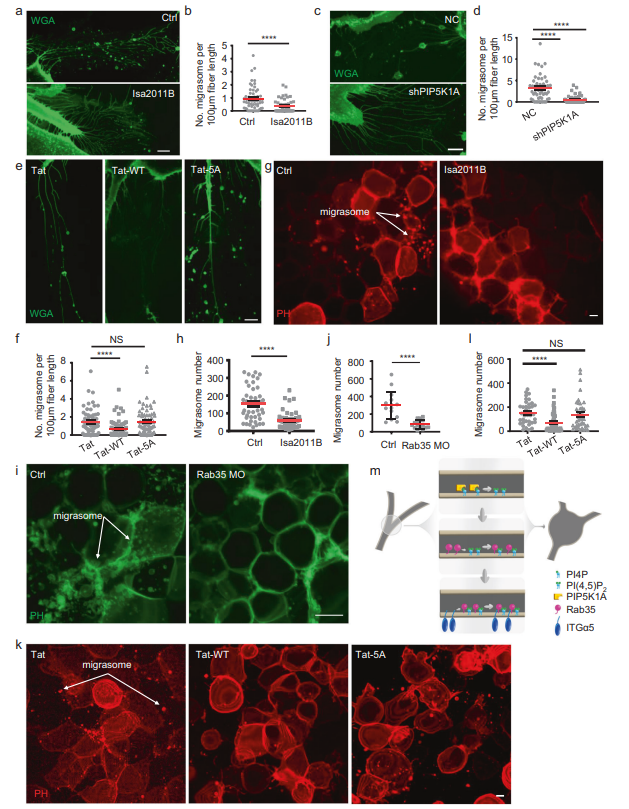
图5 PI(4,5)P2-Rab35轴在生理上调控迁移体的形成,并且在进化上是保守的
讨论
作者提出调节迁移体生物发生的信号事件的临时模型(图5)。PIP5K1A的募集和迁移体形成位点上PI(4,5)P2的重新合成可能是迁移体形成的触发信号。一旦PI(4,5)P2达到浓度阈值,活性Rab35通过其多碱性簇被招募到迁移体形成部位。然后,Rab35作为适配器将整合素募集到迁移体形成位点。因此,活性Rab35和整合素之间的相互作用为迁移体的形成创造了必要的粘附点。
细胞器的生物发生通常受到信号通路的严格调控。在许多情况下,脂质激酶是这些信号级联反应的核心,它将代谢、机械和其他信号结合起来,启动特定细胞器的生物发生。这项研究结果揭示了PI(4,5)P2-Rab35轴在迁移体形成中的重要作用。迁移体可以添加到越来越多的细胞器列表中,其生物发生由磷酸肌苷信号控制。此外,作者的数据表明,迁移体的形成是一个受信号通路严格调控的主动生物发生过程,而不是一个膜脱落过程,在这个过程中,膜碎片被动地从迁移细胞的后缘丢失。作者发现PIP5K1A在迁移体形成之前被招募到迁移体形成的部位,这个过程中的分子机制仍不清楚,可能是由迁移体形成部位的特定脂质/蛋白质组成决定的;也有可能生物物理特性,如膜曲率,可能有助于PIP5K1A的优先招募。未来的研究需要解决这个重要的问题。PIP5K1A募集后PI(4,5)P2的快速积累,表明至少有一部分迁移体形成位点上的PI(4,5)P2是由位于这些位点的PIP5K1A重新合成的。迁移体上高度富集的PI(4,5)P2不会扩散到RFs上,这表明迁移体形成部位可能具有独特的特性,有利于PI(4,5)P2的驻留。作者推测,从头合成加上PI(4,5)P2的驻留可能解释了PI(4,5)P2在迁移体形成部位的快速积累。研究证实整合素α5靶向迁移体形成位点依赖于活性Rab35。dcFCCS分析表明,整合素α5的胞质部分可以通过其GFFKR基序与活性Rab35相互作用。这些数据表明Rab35可能通过直接相互作用将整合素α5募集到迁移体形成位点。然而,Rab35与整合素α5的相互作用也有可能是间接的。除了整合素,Rab35可能还有其他效应蛋白和衔接蛋白参与迁移体的生物发生。此外,Rab35的活性如何在迁移体的生物发生中受到调节尚不清楚。为了回答这些重要的问题,未来的研究应关注迁移体生物发生的复杂调控网络。
实验方法
细胞培养和转染,免疫荧光,成像和图像分析,蛋白纯化,多肽合成,ITGα5-细胞肽标记,dcFCCS测量和数据分析
参考文献
Ding T, Ji J, Zhang W, Liu Y, Liu B, Han Y, Chen C, Yu L. The phosphatidylinositol (4,5)-bisphosphate-Rab35 axis regulates migrasome formation. Cell Res. 2023 Aug;33(8):617-627. doi: 10.1038/s41422-023-00811-5.






