单细胞测序联合空间转录组学揭示HNSCC新型肿瘤相关成纤维细胞亚群

尽管免疫疗法可以延长一些头颈部鳞状细胞癌(HNSCC)患者的生存期,但应答效率仍然很低。阐明肿瘤微环境(TME)中调节CD8+T细胞浸润和功能障碍的关键机制有助于最大限度地提高免疫疗法治疗HNSCC的益处。在这里,作者对具有不同免疫浸润的HNSCC标本进行空间转录组分析,并对五对肿瘤和邻近组织进行单细胞RNA测序(scRNA-seq),揭示了与CD8+T细胞浸润限制和功能障碍相关的特定肿瘤相关成纤维细胞CAF亚群。这些CAFs表现出CXCL(CXCL9、CXCL10、CXCL12)和主要组织相容性复合体I类(MHC-I)的高表达,以及半乳糖凝集素-9(Gal-9)的富集。MHC-IhiGal-9+CAF细胞比例与CD8+T细胞TCF1+GZMK+亚群丰度呈负相关。CAFs中的 Gal-9诱导CD8+T细胞功能障碍,并降低肿瘤浸润TCF1+CD8+T细胞比例。该研究于2023年11月发表在《cancer research》,IF 11.2。
技术路线
主要研究结果
1.肿瘤间质中存在CD8+T细胞
作者首先通过分析TCGA数据库中HNSCC和正常样本中CD3E和CD8A的表达来研究CD8+T细胞浸润(图1A)。肿瘤组织中CD3E和CD8A的TPM值较高,表明HNSCC肿瘤组织中CD8+T细胞浸润增加。此外,在HPV阳性的HNSCC中,CD3E和CD8A转录水平远高于HPV阴性的HNSCC(图1A),这表明CD8+T细胞浸润更高。为准确表征HNSCC中CD8+T细胞的空间分布,通过免疫组织化学(IHC)评估具有不同免疫亚型的HNSCC患者组织的CD8α染色(图1B)。免疫浸润类型也通过CD4/CD20分析确定。为比较肿瘤和邻近正常组织,特别选择了包含这两种组织类型的切片。在所有三种免疫浸润类型中(浸润型,沙漠型,排斥型),淋巴细胞浸润在浸润边缘的纤维化区域受到限制(图1B)。在免疫浸润肿瘤的肿瘤底部中,一些CD8α+细胞在肿瘤巢中浸润,尽管CD8α+细胞更喜欢纤维化区域(图1B左)。对于免疫沙漠型肿瘤,在肿瘤侵袭边缘的纤维化区域也检测到大量的CD8α+细胞,正如预期的那样,在肿瘤底部发现的CD8α+细胞很少(图1B中间)。有趣的是,在免疫排斥型肿瘤的纤维化区域中有大量的CD8α+细胞,很少有CD8α+细胞浸润到肿瘤巢中(图1B右)。这些结果表明,大多数CD8+T细胞局限于间质,而不是浸润于肿瘤巢中。
为进一步探索限制CD8+T细胞浸润的因素,作者对三种免疫类型的HNSCC组织进行空间转录组测序。这些组织来自相同的患者,但不同的样本用于确定图1B中的“免疫亚型”。用H&E染色处理标本(图1C),将10x Visium捕获的所有三个标本的spots分为10个簇,并与H&E图像对齐(图1D-G)。正如预期的那样,通过淋巴细胞相关基因的空间表达证实HNSCC的三种免疫类型由多个spots簇组成,并且在这些标本中表现出异质性。当浸润型样本和沙漠型样本比较时,沙漠型样本仅具有簇5和簇8的spots,排斥型样本仅具有聚类4和簇9的spots(图1H)。簇4是由肌肉细胞组成的簇(图1D)。根据H&E图像上簇的排列,高表达COL11A1、GRP、HOXCB2、BMP8A 和 NKD1的簇9(图1I),主要由肿瘤巢周围的成纤维细胞组成(图1D)。最近,John Grout等人发现,通过优先选择XI胶原蛋白和XII胶原蛋白的细胞外基质(ECM)重编程,α-SMA+CAF在人类肺部肿瘤的T细胞边缘化中发挥重要作用。在此,作者探讨了COL11A1、COL11A2和COL12A1在三种免疫类型中的表达和空间分布。一致地,排斥型标本基质富含COL11A1和COL12A1,浸润型标本缺乏COL11A1、COL11A2和COL12A2,而沙漠型标本具有COL12A1的高表达,但COL11A1与COL11A2低表达。然而,作者也注意到,在排斥型标本中,COL11A1和COL12A1也在簇9之外的簇1的spots中表达。作者进一步评估了免疫排斥人类HNSCC中α-SMA+CAF、CD8α+细胞和肿瘤巢之间的空间关系。大多数CD8α+细胞仅限于富含α-SMA+的区域,但作者也注意到,即使在α-SMA+纤维化区域和肿瘤巢之间的实际边界中,CD8α+细胞也从未浸润到肿瘤巢中。这些结果表明,CD8+T细胞在肿瘤间质中受到限制,除了细胞外基质重编程外,还有其他分子机制将CD8+T淋巴细胞限制在间质中。
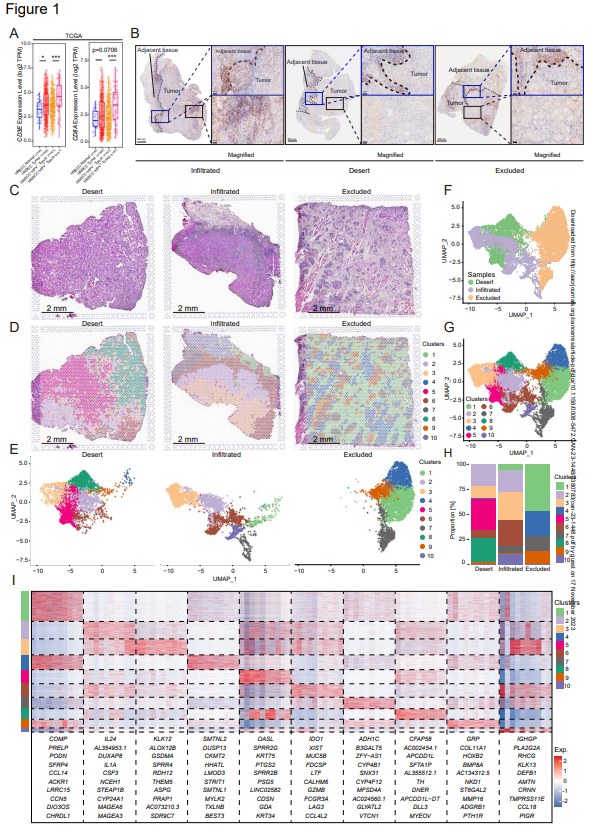
图1:CD8a+细胞在所有三种免疫类型的HNSCC的基质中存在
2. 单细胞分析揭示HNSCC中CAFs的异质性
为进一步研究HNSCCs的周围基质,作者通过scRNA-seq定义了成纤维细胞的异质性。将来自五名HNSCC患者不同位置的肿瘤和邻近正常组织样本消化成单细胞悬浮液,并捕获活细胞进行scRNA-seq。在质量控制和批量校正后,选择23485个具有成纤维细胞特征的细胞进行下游分析。作者首先比较了经t-SNE降维的来自肿瘤和邻近组织的成纤维细胞簇,并鉴定了10组成纤维细胞(图2A)。与先前的假设一致,来自肿瘤和邻近正常组织的成纤维细胞是多样的。来自相邻正常组织不同样本的成纤维细胞簇有很大差异,这可能是采集这些组织不同解剖部位的结果(图2A和2B)。除了簇1和簇4外,其他五个正常成纤维细胞簇在这五个正常相邻组织中几乎不共享。相反,来自肿瘤组织的成纤维细胞几乎不存在于相邻的正常组织中,即所谓的CAFs,仅表现为三个簇,簇5、簇6和簇10(图2A)。簇5和6在所有五个肿瘤组织中被识别,簇5是only一个几乎不存在于正常邻近组织中的簇,并且几乎只存在于所有五个癌症样本中。为进一步识别这些簇,作者确定了这些成纤维细胞的标志物,并试图揭示每个簇的可能性作用。然而,与成纤维细胞的多样性相反,所有这些成纤维细胞簇的标记物都不是only的,并且几个簇共享这些标记物的相似表达(图2C和D)。对于CAFs的三个细胞簇,top标记物(如簇5的COL7A1、簇6的LRCC15和簇10的CACNA2D3)也由其他簇共享(图2C)。事实上,很少有标记物可以专门标记每一簇的CAF。这些结果表明,CAFs表型在很大程度上取决于微环境,而不是其细胞系。
此外,为了将HNSCCs的CAF簇与其他类型肿瘤的CAF进行比较,作者评估了先前胰腺导管腺癌、乳腺癌和膀胱尿路上皮癌研究中鉴定的标志物表达(图2D)。在其他肿瘤中描述的大多数标记物具有与簇5、簇6和簇10中CAFs相似的表达模式。然而,作者发现簇6比簇5具有更高的iCAF的几种标记物表达,如IL6和CXCL12,而簇5表达myCAFs的标记物,如POSTN和ACTA2(图2D)。尽管iCAF的标记物(例如,PLA2G2A、IL6、CXCL12、CFD、DPT)可以区分簇6和簇5,但正常成纤维细胞表达的这些iCAF相关基因水平与簇6相似或更高。对于簇10,在三个簇中数量最低,这些细胞表达iCAF和myCAF的标记物(图2D和E),并且它们的表达模式位于簇5和簇6中间,这表明簇10处于过渡和瞬时状态。此外,成纤维细胞的拟时序分析也证实了簇10的过渡状态(图2F和G)。作者还注意到,簇5和簇6在拟时序分析中都显示出两个轨迹(图2G),这可能是簇中不同细胞系的结果。CD105,最近被鉴定为CAFs不同谱系的关键标志物之一,并没有区分CAFs的两个轨迹,这表明需要鉴定其他谱系决定分子。
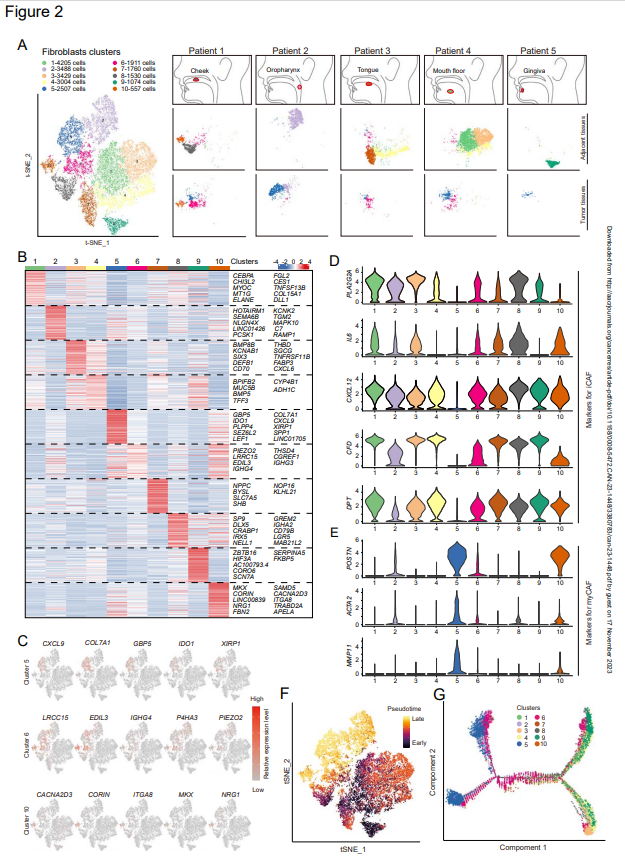
图2:HNSCC肿瘤及邻近组织成纤维细胞的整体分析
3. MHC-I和CXCL分子的高水平表达与CAFs和CD8+T细胞有关
为进一步研究和鉴定CAFs和正常成纤维细胞之间的差异,作者比较了相邻正常组织中CAFs的表达谱和正常成纤维细胞(NFs)的表达谱。关于上述成纤维细胞的多个簇,作者首先将CAFs和NFs作为整体进行比较。通过比较簇5和簇6的表达谱,发现CAFs和NFs的比较中几乎所有的top差异表达基因都在簇5中富集(图3A),这表明簇5在CAFs与NFs之间的差异中起着决定因素的作用。与先前的研究一致,CAFs具有独特的表达模式,并表达一组促肿瘤基因,如POSTN。差异表达基因的GO分析揭示了与细胞外基质相关术语的富集,强调CAFs通过TME重塑和与TME中细胞发生相互作用促进肿瘤发生(图3B)。此外,富集分析表明,CAFs在细胞因子信号传导(如IL17)和ECM受体相互作用中发挥作用(图3C)。有趣的是,作者注意到CAFs还表现出与T细胞受体信号传导和抗原处理和呈递相关基因的富集,富集分数仅棑在ECM受体相互作用后(图3C)。
然后,作者探索了CAFs的两个主要聚类,簇5和簇6,以验证先前比较中基因集的富集。MHC-I分子,包括HLA-A、HLA-B、HLA-C和B2M,在簇5中表现出更高的表达水平(图3D)。GSEA进一步证实,与抗原处理和呈递相关的基因在簇5中具有更高的表达(图3E)。由于先前的工作揭示了胰腺导管腺癌中的抗原呈递CAFs群体,作者还在scRNA-seq数据中探索了CD74和HLA-DRA(MHC-II)的表达,但在簇5中没有发现任何富集。相反,作者证实了MHC-I分子(包括B2M、HLA-A、HLA-B和HLA-C)在簇5中的表达增加(图3F)。此外,在三种免疫类型的HNSCC标本中,肿瘤底部具有较高的MHC I类分子表达水平,并且MHC I类分子高表达的spots大多位于排斥型标本的肿瘤巢周围。
由于簇5与免疫细胞具有更活跃的相互作用,并表现出调节造血细胞分化基因集的富集(图3E),作者在scRNA-seq数据中进一步评估簇5中 CAFs与不同类型免疫细胞之间的相互作用。就配体-受体与簇5的相互作用数量而言,髓系细胞和CD8+T细胞是排名最高的细胞,尽管CAF(簇5和簇6)之间的内部相互作用最频繁。为了定量分析相互作用,作者考虑了配体和受体的表达水平,并评估了传入和传出信号(图3G和H)。簇5中髓系细胞和CAFs表现出强大的传入和传出信号网络。对于CD8+T细胞,MHC-I、半乳糖凝集素、CD22、LCK和CXCL是最强的传入信号(图3G)。就传出信号而言,簇5高水平表达的MHC-I和CXCL用于信号传导(图3H)。就CXCL相互作用而言,据报道参与T细胞维持的CXCL12-CXCR4/CKR3轴是主要贡献者。此外,作者注意到CXCL9和CXCL10在最近的一项皮肤成纤维细胞研究中被确定为CD8+T细胞募集的关键趋化因子,它们在第5簇而不是第6簇中高度表达(图3D)。正如预期的那样,GEPIA相关性分析揭示了CD8A表达与CXCL9/CXCL10/CXCL12之间的显著正相关性,证实了CXCL9/CXCL10/CXCL12对CD8+T细胞的趋化作用。有趣的是,作者注意到CXCL9、CXCL10和CXCL12在不同免疫类型的HNSCC中具有特殊的表达模式。CXCL9和CXCL10在沙漠型和浸润型标本中丰富,在排斥型标本的基质中表达有限且。相反,沙漠型标本几乎没有CXCL12的表达,而排斥型标本具有高水平的CXCL12。浸润型标本在恶性区域显示CXCL12的表达,但在邻近正常区域具有较高水平的CXCL12。
这些结果表明,簇5负责CAFs的不同表达谱,并与MHC-I分子和CXCL趋化因子介导的CD8+T细胞具有强烈而频繁的相互作用。
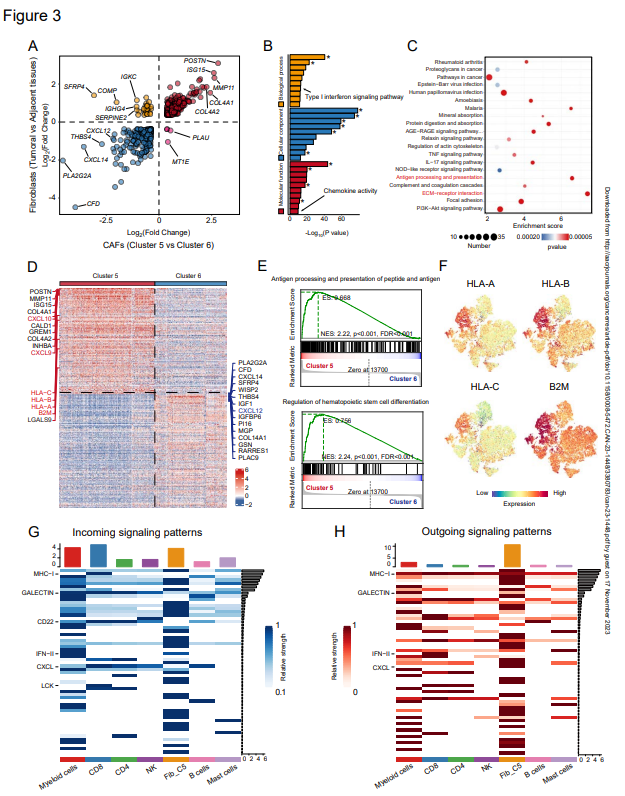
图3:CXCL和MHC I类分子的高表达水平与簇5 CAFs和CD8+T细胞有关
4. CAFs中MHC-I高表达限制了CD8+T细胞的抗肿瘤功能
为进一步阐明MHC-I分子在CAFs中表达增加的意义,作者首先通过肿瘤免疫组织估计资源(TIMER)分析了MHC分子对HNSCC患者生存的贡献。与预期相反,在累积生存率与免疫浸润呈正相关的HPV阳性HNSCC患者中,较高水平的MHC I类分子(HLA-a、HLA-B、HLA-C和B2M)与较差的结果相关。然后,作者从HNSCC肿瘤组织中分离CAFs,并敲低B2M的表达,其与HN6共同注射入裸鼠中(缺乏适应性免疫)。肿瘤生长或组织学形态没有显著变化,表明CAFs中的B2M没有直接改变肿瘤生长。
为进一步确定具有不同MHC-I表达水平的成纤维细胞是否影响体内肿瘤生长和抗肿瘤免疫,应用具有完整免疫系统的小鼠模型进行进一步研究。由于HNSCC自发致瘤小鼠模型的局限性,本研究使用了由SCC VII(一种不断应用于HNSCC研究的鳞状细胞系)和成纤维细胞形成的皮下荷瘤模型。作者使用从小鼠舌头分离的正常成纤维细胞(小鼠舌头成纤维细胞,MTFs)作为替代品,其有助于CAFs(图4A)。作者首先敲低了MTFs中B2m的表达(图4B),并证实敲低B2m不会影响SCC VII细胞的生存能力。然后,作者将SCC VII和成纤维细胞共同皮下注射到C3H/He小鼠中。有趣的是,与对照组相比,SCC VII和B2m KD MTFs形成的肿瘤在终点生长较慢且小得多,CD8+T细胞的耗竭挽救了观察到的表型(图4C)。为了研究B2m-KD成纤维细胞如何限制肿瘤生长,作者分离了皮下肿瘤进行进一步分析。耗竭标记物和免疫检查点分子,包括T细胞免疫球蛋白和粘蛋白结构域包含-3(TIM3)、淋巴细胞活化基因-3(LAG3)、细胞毒性淋巴细胞相关抗原-4(CTLA4)和具有Ig和ITIM结构域的T细胞免疫受体(TIGIT),在来自皮下肿瘤的CD8+T细胞中进行了检测,并在B2m-KD肿瘤中显示出TIGIT的轻微降低,但在其他肿瘤中没有显示出显著变化(图4D)。相反,具有B2m KD MTFs的肿瘤含有大量分泌抗肿瘤分子(穿孔素和IFN-γ)的CD8+T细胞,并且表达颗粒酶B的CD8+T细胞略有增加(图4D)。作者还注意到记忆CD8+T细胞(TCF1+CD8+T细胞)在B2m KD肿瘤中也略有增加(图4D)。作者还将SCC VII和B2m-KD小鼠胚胎成纤维细胞(MEFs)共同注射到C3H/He小鼠中,并获得类似的结果。然后,作者从转移淋巴结中分离并扩增CD8+T细胞,并将其与来自相同患者的CAFs共同培养(图4E)。作者发现在与B2M-KD CAFs的共培养中,当TIGIT的表达在B2M-KD组中减少时(图4H),结合CD8+T细胞的CAFs数量减少(图4F),穿孔素和TCF1的表达增加(图4G)。然后,用抗CD3/CD28抗体激活从HNSCC肿瘤患者中分离的CD8+T细胞(图4I)。证实了来自HNSCC肿瘤的CD8+T细胞中TCF1在激活后降低(图4J)。并注意到CXCR3(CXCL9和CXCL10的受体)显著增加,CXCR4(CXCL12的受体)保持不变(图4K),表明CD8+T细胞对CXCL9或CXCL10信号变得更敏感,这些信号通过簇5 CAFs高度表达(图3D)。这些发现表明,高表达MHC-I的CAFs可能限制CD8+T细胞的抗肿瘤能力。
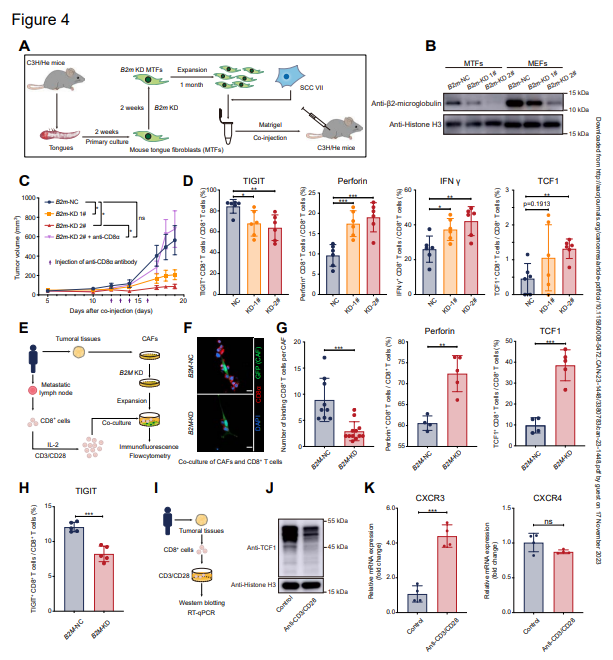
图4:MHC I类高表达限制了CD8+T细胞的抗肿瘤功能
5. 检查点分子配体半乳糖凝集素-9在MHC Ihi CAFs中富集
Jacqueline D.Shields先前的工作揭示了具有FASL和PD-L2的CAFs的CD8+T细胞以MHC-I依赖的方式发生抗原特异性缺失。因此,作者进一步检测了HNSCC成纤维细胞中免疫检查点配体的表达。有趣的是,在所有检查点配体中,半乳糖凝集素-9是only在MHC-Ihi CAFs中富集的分子(簇5)(图5A)。为了验证半乳糖凝集素-9在MHC-Ihi CAFs中的表达,采集了几个HNSCCs的肿瘤样本进行流式细胞术和免疫荧光染色。事实上,作者发现半乳凝集素-9在α-SMA+CAF中表达(图5B),且表达半乳凝集素-9的CAFs具有更高水平的MHC-I分子(图5C)。LGALS9(编码galectin-9的基因)存在于HNSCC特异性的所有三种免疫型中。为进一步确定肿瘤中galectin-9的分布,在70名HNSCC患者的较大队列中对galectin-9表达进行测试。在这些患者中,作者将galectin-9的表达模式分为四类(图5D):(i)基质细胞和恶性胰岛均未表达galectin-9(6/70,8.57%);(ii)galectin-9仅存在于肿瘤巢中,但不存在于基质中(4/70,5.71%);(iii)galectin-9仅存在于基质中(33/70,47.14%)。此外,作者注意到,CAF在体外培养两周后失去了Galectin-9的表达,当与HN6(HNSCC细胞系)培养时,细胞表面的HLA-A/B/C水平较高,HN6上的HLA-A/B/C水平下降(图5E),这暗示HMC-I高表达和galectin-9(MHC-IhiGal-9+CAF)正向表达的CAF表型取决于TME中的信号网络。
为了随后研究TME信号网络对MHC-IhiGal-9+CAF形成的贡献作用,使用SCENIC分析来鉴定scRNA-seq数据中的关键转录因子。正如预期的那样,CAFs簇具有高活性分数的不同调节子,MHC-IhiGal-9+CAF对STAT1、PRDM1和STAT2的调节子表现出高活性分数,也对调节因子特异性表现出高分数。此外,在CAFs簇的比较中,GSEA结果表明干扰素(IFN)和肿瘤坏死因子(TNF)信号通路在MHC-IhiGal-9+CAF中是活跃的(图5F)。然后,作者通过体外培养CAFs,以进一步探索信号网络的贡献(图5G和H)。在IFN和TNF-α处理下,CAFs具有更高的半乳糖凝集素-9和MHC I类分子(HLA/B/C和B2M)表达(图5G和H)。具体而言,IFN-β诱导半乳糖凝集素-9表达的最高倍数变化,而IFN-γ诱导MHC I类分子表达的高倍数变化(图5G和H)。正如预期的那样,当POSTN信号诱导高水平的CXCL12时,IFN和TNF信号与CXCL9和CXCL10的高表达相关(图5G)。作者还检测了用不同细胞因子处理的CAFs中PD-L1表达的变化。然而,在IFN刺激的CAFs中,PD-L1表达的变化与半乳糖凝集素-9表达的变化并不完全一致。与先前的报道一致,TGF-β信号传导与胶原表达相关(COL11A1、COL11A2、COL12A1)(图5G)。
作者还评估了用IFN和TNF-α处理的恶性细胞系(CAL27、HN6、HN30)中MHC I类分子和半乳糖凝集素-9的表达。正如预期的那样,HLA-A/B/C和半乳糖凝集素-9的表达在所有三种细胞系中增加,但水平不同。在这些细胞中,HN6细胞是对IFN最敏感的细胞,它们对IFN和TNF-α的反应与CAFs的反应相似。
这些结果表明,半乳糖凝集素-9是only一种在MHC-Ihi CAFs中富集并由TME中的IFN信号诱导的免疫检查点配体,在HNSCC患者中普遍由CAFs表达。
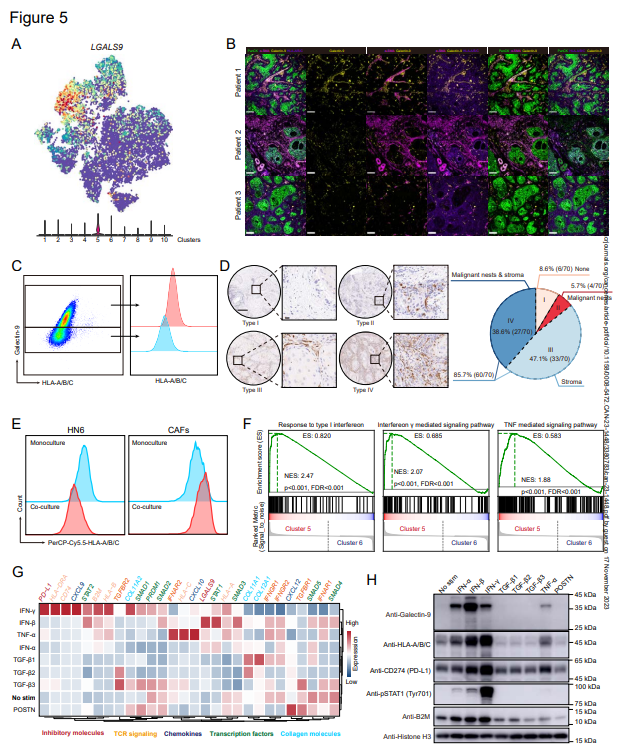
图5:免疫检查点配体分子半乳糖凝集素-9在CAFs的簇5中富集
6. Gal-9+CAFs诱导TCF1+GZMK+CD8+T细胞分化异常
为进一步鉴定Gal-9+CAF的作用并确定与Gal-9+CAFs相互作用的CD8+T细胞亚群,作者进一步分析了来自前五对肿瘤邻近正常组织的CD8+T细胞的scRNA-seq结果。这些CD8+T细胞聚类成八组,簇1和簇2在肿瘤组织和正常组织中共享(图6A-C)。肿瘤组织在簇3、簇5和簇6中具有更多的细胞(图6B)。簇4、簇7和簇8几乎是正常组织独有的(图6C)。根据拟时序分析,来自肿瘤和邻近组织的CD8+T细胞具有不同的分化轨迹,并且簇1在来自肿瘤组织的CD8+T细胞中位于初级过渡阶段(图6D)。为确定每个CD8+T细胞簇的状态,作者检测了八个簇中编码细胞毒素(GMZA、GMZB、GMZK、IFNG和PRF1)、检查点分子(CTLA4、HAVCR2、PDCD1、LAG3、TIGIT)和TCF1基因的表达(图6E),表明簇1和簇2是前效应CD8+T细胞,如先前报道的。表达高水平GZMA、GZMB、IFNG和PRF1的簇3-6是效应CD8+T细胞(图6E)。
为了定义与Gal-9+CAF相互作用的簇,选择五种肿瘤组织来分析Gal-9+CAFs与八种CD8+T细胞簇之间的相关性(图6F)。作者发现CD8+T细胞簇1是only一个与Gal-9+CAFs具有显著相关性的簇(图6F)。这些细胞表现出较高水平的CXCR3/CXCR4和半乳糖凝集素-9、CD44和P4HB受体(图6E)。此外,半乳糖凝集素-9的表达也与检查点分子(TIM3、CTLA4、TIGIT、LAG3、PDCD1)呈正相关,这进一步表明Gal-9+CAF和CD8+T细胞之间的相互作用与CD8+T的功能障碍有关。此外,TCF1+CD8+T细胞和半乳糖凝集素-9的相似空间分布也证实了Gal-9+CAF与TCF1+CCD8+T细胞的相互作用潜力(图6G)。
为阐明galectin-9在成纤维细胞中对CD8+T细胞的功能,作者构建了动物模型,作者将LGALS9敲低的MTF与SCC VII共注射,并分析了浸润CD8+T细胞变化(图7A)。具体而言,作者分析了免疫检查点分子(TIM3、TIGIT、CTLA4)和GZMB的表达(图7B)。正如预期的那样,TIM3、TIGIT和CTLA4在CD8+细胞中下调,细胞毒性细胞因子在LGALS9-KD组中上调(图7B)。此外,下调的galectin-9还诱导肿瘤中CD8+T细胞和TCF1+CD8+T细胞比例上调(图7C和D)。此外,对来自同一患者的LGALS9-kD CAF和CD8+T细胞进行共培养实验,其结果与动物实验相似(图7E和F)。将CD8+T细胞结合到CAF的数量在LGALS9-KD组中没有变化。这些结果表明galectin-9(由lgals9编码)导致CD8+T细胞功能障碍。
然后,作者在三种免疫类型的HNSCC标本的多重免疫荧光染色中定量评估Gal-9+CAF和TCF1+CD8+T细胞之间的空间关系(图7G-J),并对来自新患者队列的排斥型和浸润型肿瘤的FFPE中CD8+T细胞和Gal-9+CAF之间的位置相关性进行了另一种多重免疫组织化学分析(图7G)。浸润型和排斥型的肿瘤具有较高比例的Gal-9+CAF,并且这些细胞特异性地位于肿瘤巢周围(PanCK+区域)。在浸润型和排斥型肿瘤中,TCF1+CD8+T细胞(CD3ε+CD8α+TCF1+细胞)在CD8+T细胞中的百分比以及CD8+T淋巴细胞与Gal-9+CAF的比率较高。在肿瘤巢中,如先前在作者数据中所证明的,具有较高MHC-I水平的半乳糖凝集素-9+CAF与较高密度的CD8+细胞呈正相关(图7I)。TCF1+CD8+T细胞和Gal-9+CAFs之间的距离较短,TCF1+CCD8+T细胞在浸润型中优选Gal-9+CAF(图7H和J)。随着CXCR3/CXCR4在TCF1+CD8+T细胞中的较高表达和CXCL9/CXCL10在Gal-9+CAF中的较高表达(图3D),这些结果进一步验证了TCF1+CCD8+T细胞在空间分布上对Gal-9+CAFs的偏好。
所有结果表明,具有高水平MHC I类分子的Gal-9+CAF捕获并与效应前CD8+T细胞相互作用,并与这些CD8+T功能失调分化相关(图7K)。
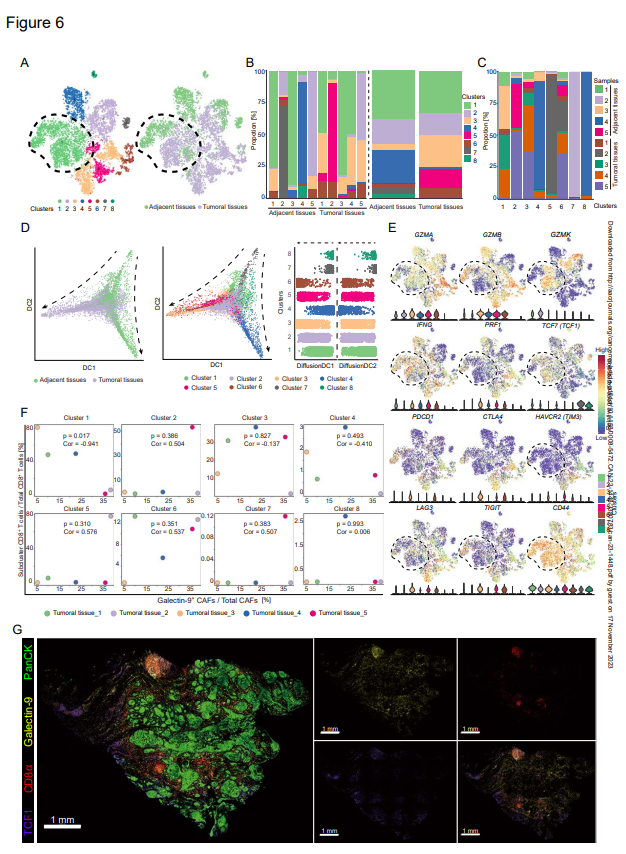
图6:TCF1+GZMK+CD8+T细胞与半乳糖凝集素-9+CAF呈负相关
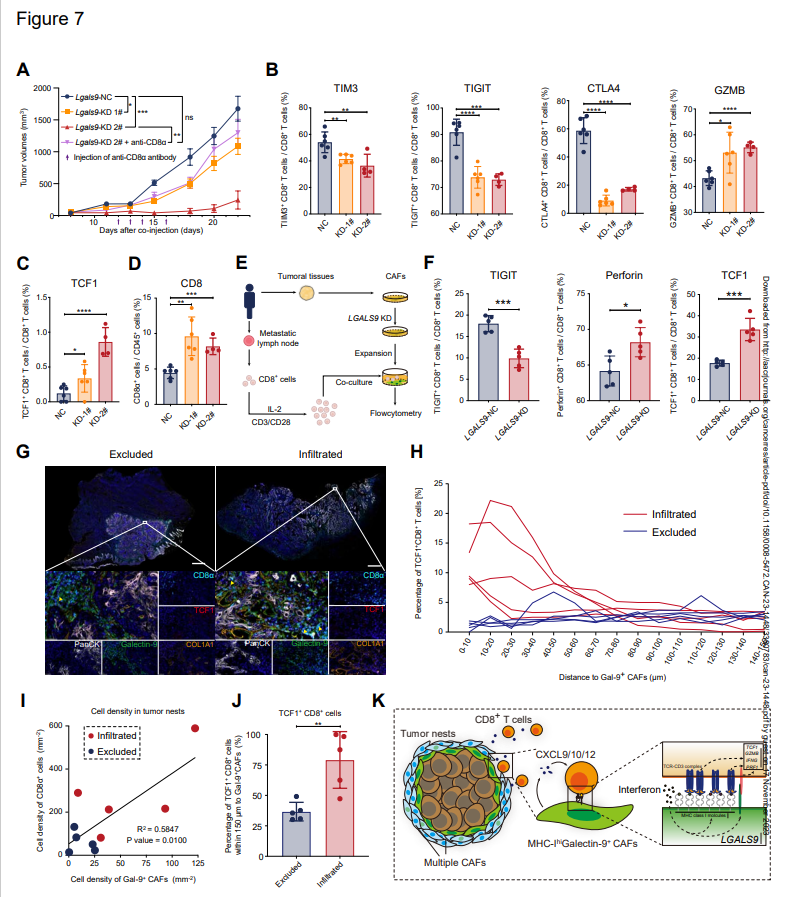
图7:半乳糖凝集素-9+CAF与TCF1+CD8+T细胞分化异常有关
结论
作者的研究确定了一簇CAFs,其以CXCL和MHC-I依赖的方式捕获TCF1+GZMK+CD8+T细胞,并通过半乳糖凝集素-9进一步诱导功能失调的转化。作者的工作为影响CD8+T细胞分布和功能障碍的因素提供了新的见解,并有可能应用于提高免疫疗法的疗效。
实验方法
细胞培养,免疫组化,空间转录组测序,scRNA-seq,流式细胞术,慢病毒转染,小鼠肿瘤模型构建,免疫荧光,real-time PCR,免疫印迹
参考文献:
Li C, Guo H, Zhai P, Yan M, Liu C, Wang X, Shi C, Li J, Tong T, Zhang Z, Ma H, Zhang J. Spatial and single-cell transcriptomics reveal a cancer-associated fibroblast subset in HNSCC that restricts infiltration and anti-tumor activity of CD8+ T cells. Cancer Res. 2023 Nov 6. doi: 10.1158/0008-5472.CAN-23-1448. Epub ahead of print. PMID: 37930937.






