长时间麻醉的确会有不良后果哦
老年手术患者围手术期神经认知障碍(PND)的发生率很高,这与麻醉诱导的长时间神经毒性密切相关。麻醉诱导的神经毒性的神经形态病理学基础一直难以捉摸。这项研究表明,长时间麻醉会引发NF-κB炎症通路激活、神经炎症、神经元兴奋性抑制、认知功能障碍和焦虑样行为。RNA 测序发现,长时间麻醉后,不同类型突触的基因下调。小胶质细胞的迁移、活化和吞噬作用增强。同时还观察到小胶质细胞形态的改变。补体级联的启动子 C1qa 和 C3 增加,标记突触的 C1qa 也升高。然后,作者发现 "Eat Me "补体途径介导了长时间麻醉后海马的小胶质细胞突触吞噬。之后,海马突触明显丢失。此外,树突棘减少,其基因也被下调。敲除小胶质细胞可以改善神经炎症和补体的激活,并挽救突触丢失、认知功能障碍和焦虑样行为。当神经炎症受到抑制或 C1q 中和时,补体也会减少,突触消失也会中断。这些研究结果表明,长时间麻醉会引发神经炎症和补体介导的小胶质细胞突触吞噬,从而在病理上导致 七氟醚诱导的神经毒性(SIN)中的突触消失。本文证明了 SIN 的神经形态病理学基础,这对 PND 患者有直接的治疗意义。本文于2023年1月发表在《BMC Medicine》IF: 9.3期刊上
技术路线

主要实验结果
1、长时间麻醉会引发认知功能障碍和焦虑样行为
第一次实验的时间表如图1a所示。图1的MWM、OFT以及EPM实验表明长时间七氟烷暴露诱导的 SIN 大鼠模型表现出一些神经行为改变,包括认知功能障碍和焦虑样行为。
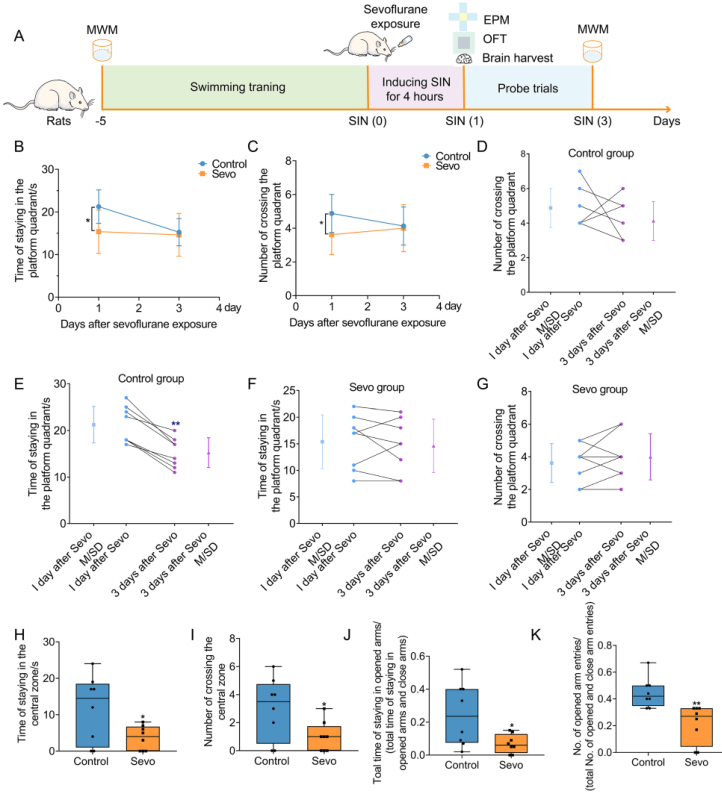
图1 长时间麻醉引起大鼠认知功能障碍和焦虑样行为
2、长时间麻醉诱导神经炎症,上调NF-κB炎症通路,下调神经元兴奋性,使凋亡信号失活
临床上,PND 主要发生在手术和麻醉后 1 周内。结合行为实验的结果,在七氟烷暴露后的第一天采集了大鼠的脑组织。ELISA表明,七氟烷暴露后,大脑皮层和海马中的促炎细胞因子,包括 TNF-α、IL-1β 和 IL-6 都增加了(图 2 A、B)。与对照组相比,Sevo 组海马中磷酸-NF-κB p65 的表达上调(图 2 D)。七氟烷暴露后,海马中 Phospho-NF-κB p65 向细胞核的转位增加(图 2 E)。然后,关注七氟烷暴露对神经元的影响,神经元是认知功能的执行细胞基础。HE 染色显示,两组患者海马中神经元的形态完好无损(图 2 C)。IF 染色显示,作为海马 CA1 区神经元兴奋性参数的 C-fos 在七氟醚暴露后下调(图 2 F)。同样,脑电图也显示海马中的突发性抑制。图 2 G 显示了具有代表性的海马脑电图原始轨迹(上图)和功率频谱图(下图),它们显示了七氟烷暴露后向突发性抑制的过渡。如图 2 H 所示,BSR 的显著增加也证明了这一变化。这种神经兴奋性的抑制促使作者探索它是否受到神经元凋亡的影响。七氟醚暴露后,海马 CA1 区和皮层的 TUNEL 检测呈阴性,无神经元凋亡(图 2 I)。Nissl 染色也表明,七氟与对照组海马 CA1 区的 Nissl 体数量没有差异(图 2 J)。凋亡相关蛋白表达也没有明显改变(图2 K-M)。因此,七氟醚暴露对细胞凋亡信号转导没有影响。更重要的是,长时间麻醉会诱导神经炎症激活,激活 NF-κB 炎症通路,并下调神经元的兴奋性。
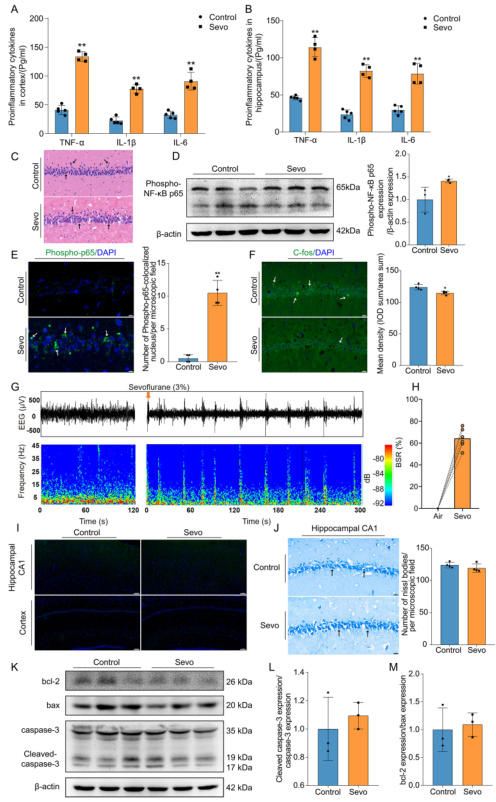
图2 长时间麻醉诱导神经炎症,上调NF-κB炎症通路,下调神经元兴奋性,使凋亡信号失活
3、长时间麻醉诱导小胶质细胞激活,促炎表型标志物增加,抗炎表型标志物减少,海马小胶质细胞形态改变
小胶质细胞作为中枢神经系统(CNS)的常驻吞噬细胞,是应激源的第一反应者,它们会迅速调整表型并发生功能变化,并参与 SIN 的病理过程。与对照组相比,七氟醚暴露后海马中的促炎表型标志物,包括 TNF-α mRNA、IL-1β mRNA、IL-6 mRNA、CD86 mRNA 和 iNOS mRNA 均上调(图 3 A)。此外,与对照组相比,抗炎表型标记物,包括海马中的 IL-4 mRNA、IL-10 mRNA、CD206 mRNA 和 Arg1 mRNA 均下调(图 3 B)。iba1(一种小胶质细胞活化标记物)的 IF 染色显示,与对照组相比,七氟醚暴露后海马中的小胶质细胞数量增加(图 3 C、E),这意味着小胶质细胞活化。与对照组相比,七氟醚暴露后海马 CA1 区的抗炎标记物 Arg-1 下调(图 3 D, I)。使用 Sholl 分析来确定海马 CA1 区的小胶质细胞形态学改变,以确认其激活和功能变化(图 3 F)。图中的intersection mask图描述了小胶质细胞伪足的空间分布和数量(图 3 F)。七氟烷暴露后,小胶质细胞固缩增加,最大交集数减少(图 3 G、H),这意味着小胶质细胞面积扩大,小胶质细胞伪足数量减少。交叉图显示,七氟烷暴露后,伪足分布更靠近小胶质细胞体(图 3 K),这说明小胶质细胞伪足回缩。此外,利用小胶质细胞的三维图像来观察小胶质细胞的形态学改变。如图 3 J 所示,小胶质细胞的细胞体增大,伪足减少并变短,七氟烷暴露强烈诱导了这些小胶质细胞形态的改变。
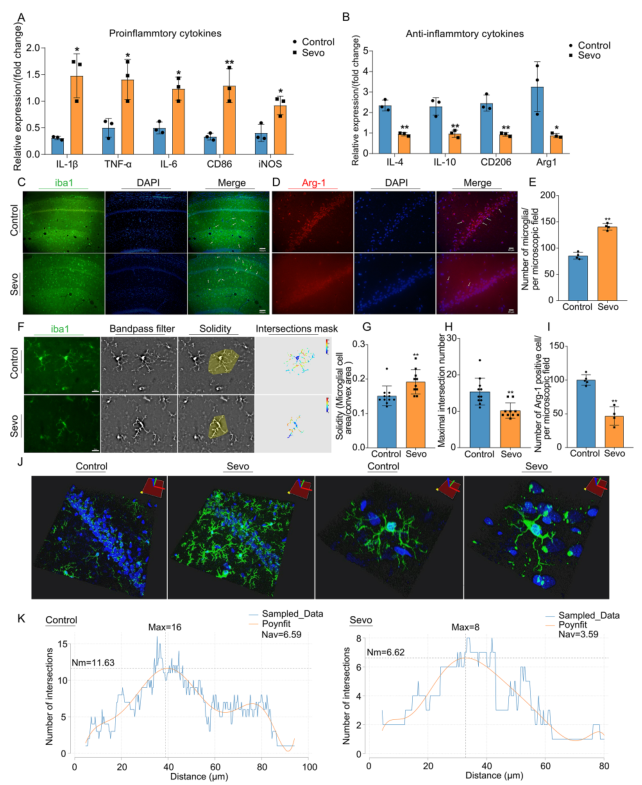
图3长时间麻醉诱导小胶质细胞激活,促炎表型标志物增加,抗炎表型标志物减少,海马小胶质细胞形态改变
4、RNA-seq分析显示长时间麻醉后海马DEGs富集至不同突触通路中,突触相关基因下调
使用 RNA-seq 筛选通路和基因,以确定导致 SIN 的可能神经形态病理学基础。令人惊讶的是,KEGG通路富集和GO富集分析都强烈表明,大多数DEGs与不同的突触或突触成分有关(图4)。
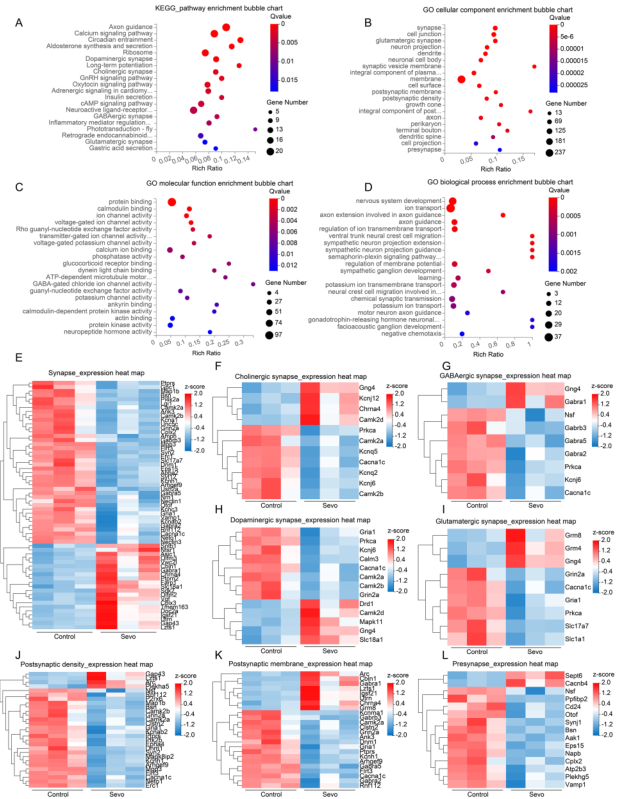
图4 RNA-seq分析显示,长时间麻醉后海马DEGs富集至不同突触通路中,突触相关基因下调
5、长时间麻醉会增强小胶质细胞的吞噬和趋化能力,并通过补体介导的小胶质细胞修剪导致海马突触消失
根据 RNA-seq 的结果,寻找将突触丢失与补体介导的小胶质细胞修剪联系起来的证据。有报道称,小胶质细胞的突触修剪可持续监测突触和大脑发育,补体驱动的病理性突触修剪也在许多中枢神经系统疾病中有所报道,包括阿尔茨海默病和额颞叶痴呆。首先,作者发现与对照组相比,Sevo 组海马中的突触标记物,包括 PSD95 mRNA、SYN1 mRNA 和 SYP mRNA 均出现下调(图 5 A)。此外,与对照组相比,Sevo 组海马中的 PSD95、SYN1 和 SYP 蛋白水平也出现了下调(图 5 E、G-I)。突触相关蛋白下调,这与 RNA 序列结果一致。随后证实海马中的补体标志物,包括 C1qa 和 C3,在蛋白和 mRNA 水平上也出现了上调(图 5 B、E、F)。其次,CD68 作为小胶质细胞吞噬标记物,在海马中的蛋白和 mRNA 水平都有所增加(图 5 C-E)。此外,海马 CA1 区与 CD68 共定位的小胶质细胞数量也有所增加(图 5 J、K)。CX3CR1由小胶质细胞和神经元共同表达,介导小胶质细胞的粘附、趋化和迁移功能。第三,与对照组相比,Sevo 组海马 CA1 区标记有 CX3CR1 的小胶质细胞数量增加(图 5 M、N)。第四,检测到七氟烷暴露后海马 CA1 区小胶质细胞标记 PSD95 的数量增加,表明小胶质细胞吞噬了 PSD95 点(图 5 L, O, P)。最后,观察到小胶质细胞定植 C1qa 的数量增加,表明长时间麻醉诱导小胶质细胞产生补体 C1qa(图 5 Q、R)。因此,吞噬能力增强、活性亢进、粘附性和趋化性增强的小胶质细胞会分泌补体,吞噬不同的突触,导致突触丢失和突触蛋白减少。
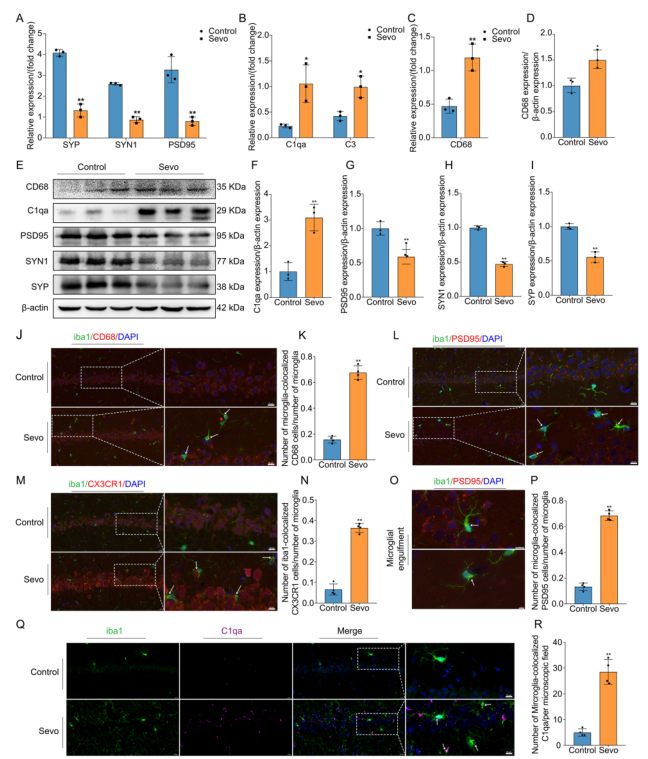
图5 长时间麻醉增强小胶质细胞吞噬和趋化性,然后触发小胶质突触吞噬,导致突触丢失
有报道称,C1qa 和 C3 参与突触丢失,在突触修剪过程中标记神经元之间不适当的突触连接,以便被吞噬小胶质细胞清除。在海马 CA1 区,Sevo 组与对照组相比,标记有 PSD95 点的 C1qa 数量增加(图 6 A、D),这表明七氟烷暴露诱导了补体介导的突触修剪。采用 IF 染色法检测突触数量和突触密度。PSD95(突触后蛋白标记)、SYN1(突触前蛋白标记)和 SYP(突触前蛋白标记)用于检测突触数量和突触密度。与对照组相比,Sevo 组海马 CA1 区的突触密度(SYN1 点)降低(图 6 B,F)。此外,七氟醚暴露后海马 CA1 区的突触数量(PSD95 与 SYP 点相连)也减少了(图 6 E、G)。用扫描电镜观察突触的超微结构改变,以检测突触小泡、突触前膜和突触后膜、活动区和突触间隙。在 Sevo 组,突触小泡减少,突触后膜连续性中断(图 6 C)。因此,突触数量和密度的减少以及突触超微结构的改变与补体介导的小胶质细胞修剪有关。
根据 RNA-seq 结果,发现树突棘和树突中富集的 DEGs 大多被下调(图 6 H、I 和图 4 B)。这显然表明树突棘和树突在七氟烷暴露后受到破坏。使用高尔基染色和 Sholl 分析检测了海马 CA1 区树突棘和树突的结构变化(图 6 J)。与对照组相比,Sevo 组树突棘(蘑菇状、粗壮状、细长状和总状)的数量减少了(图 6 K、N)。在 Sholl 分析中,Sevo 组神经元的最大交集数低于对照组(图 6 L、M)。图 6 M 显示了树突和树突棘的空间分布和数量。
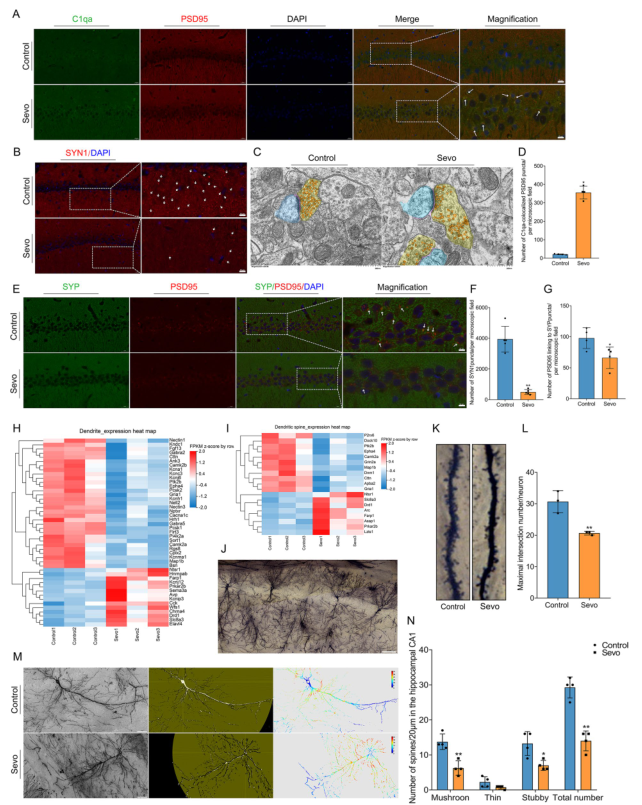
图6 长时间麻醉通过补体介导的突触消融和树突棘及其基因减少引起海马突触消融
6、小胶质细胞耗竭挽救了SIN大鼠的认知功能障碍并改善了焦虑样行为
接下来,研究过度活跃的小胶质细胞是否会在认知功能障碍和焦虑样行为中发挥关键作用。第二个实验的时间表如图 7 A 所示。利用补充了 PLX3397 的饮食喂养大鼠,以消除小胶质细胞群,同时又不会对正常动物造成明显的认知损伤。PLX3397能有效减少海马中的小胶质细胞数量和iba1蛋白水平(图7 B-D)。在MWM测试中,PLX3397增加了穿越平台的次数和在平台象限中游泳的时间,从而缓解了七氟烷暴露造成的认知障碍(图7 E和F)。在 OFT 试验中,PLX3397 治疗增加了进入中心区的次数和时间,缓解了焦虑和压力(图 7 G、H)。在 EPM 试验中,开放臂的停留时间和进入开放臂的次数增加了,这同样改善了焦虑样行为(图 7 I、J)。令人惊讶的是,小胶质细胞耗竭后,与 SYP 点定位的补体急剧减少,这意味着小胶质细胞耗竭改善了由补体驱动的病理性突触修剪(图 7 K、L)。
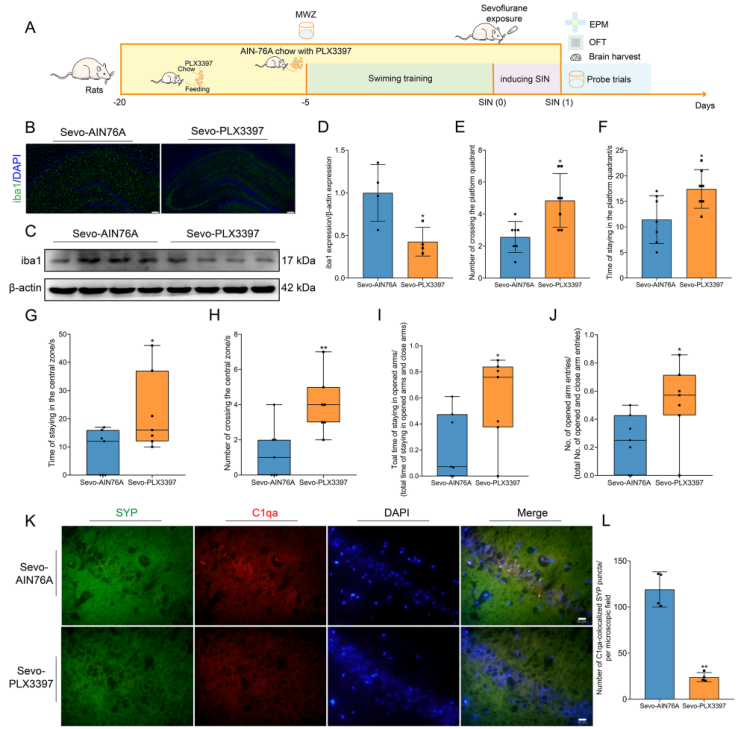
图7 小胶质细胞耗竭挽救了SIN大鼠的认知功能障碍并改善了焦虑样行为
7、RNA-seq分析表明消耗小胶质细胞可挽救海马突触相关基因的下调
为研究小胶质细胞缺失是否能挽救突触消融,再次使用 RNA-seq 鉴定 DEGs 及其富集,如图8所示,不出所料,这些 DEGs 和富集途径也与突触相关。
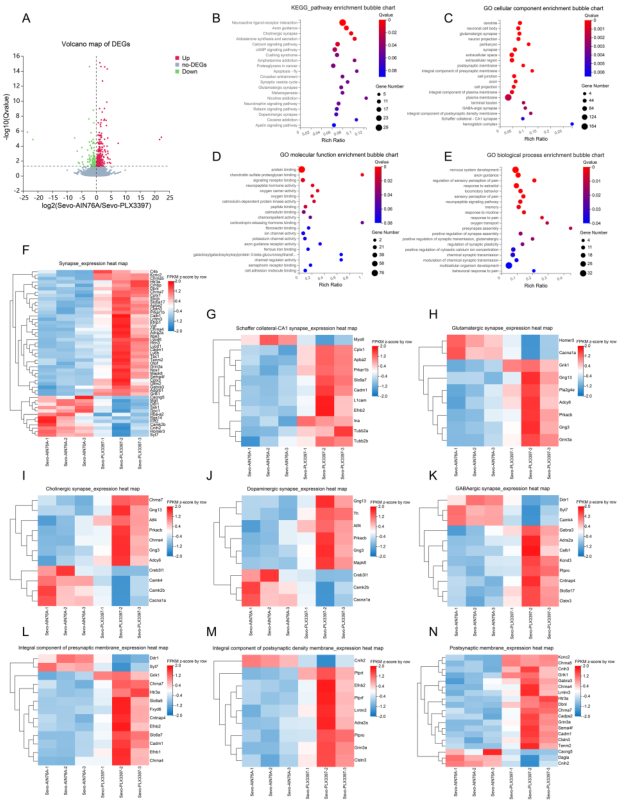
图8 RNA-seq分析显示,小胶质细胞缺失后海马中DEGs富集至不同突触通路,且突触相关基因上调
8、小胶质细胞缺失改善了NF-κB炎症通路的激活、海马炎症、补体激活和突触消融
随后研究PLX3397 治疗是否能破坏小胶质细胞的吞噬功能、炎症反应、补体生成和突触丢失。ELISA显示,海马中的促炎细胞因子 IL-1β 和 TNF-α 有所减少(图 9 A、B)。此外,PLX3397 通过下调磷酸-NF-kB p65 的表达,显著抑制 NF-κB 的炎症通路(图 9 E、F)。此外,PLX3397 还能抑制小胶质细胞的吞噬(下调 CD68 表达)和补体生成(图 9 C、D)。然后,通过 PLX3397 处理消耗小胶质细胞可挽救突触的消除并恢复突触蛋白的表达(图 9 G-J)。因此,PLX3397 诱导的小胶质细胞缺陷阻止了小胶质细胞介导的病理生理效应,包括神经炎症、补体产生、突触修剪和突触消除。
9、神经炎症抑制拯救突触消除和抑制补体激活
消除小胶质细胞和抑制神经炎症的治疗效果可以挽救突触损失。然而,仅抑制神经炎症是否能逆转突触缺失尚不清楚。使用非甾体抗炎药美洛昔康(NSAID-meloxicam)来减轻神经炎症,并检测抗神经炎症对突触缺失的影响。美洛昔康可以有效抑制海马的神经炎症(图 9 M)。令人惊讶的是,神经炎症抑制还能减少突触消除,降低补体激活,并挽救突触蛋白的损失(图 9 L-P)。同时,神经炎症抑制后与 PSD95 标记的 C1q 数量急剧下降(图 9 Q)。因此,通过抑制补体介导的突触丢失来抑制神经炎症可以逆转长期麻醉诱导的病理性突触损伤。
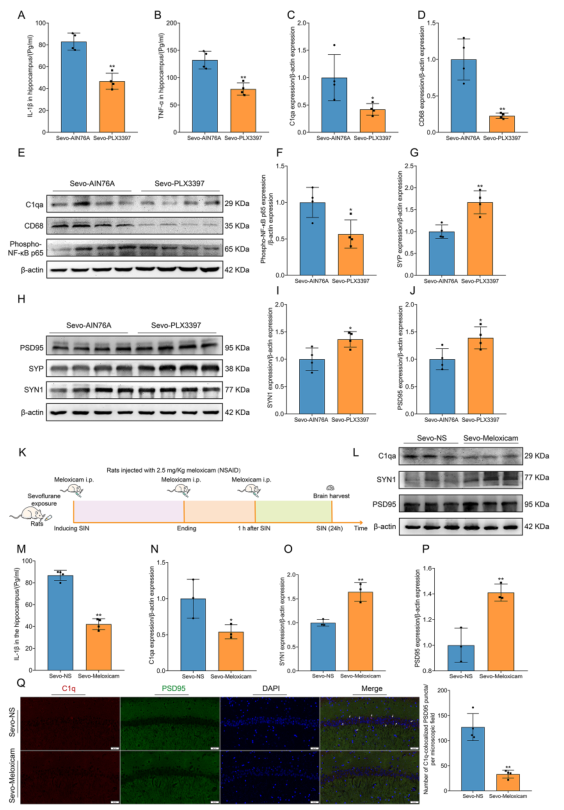
图9 小胶质细胞缺失改善了NF-κB炎症通路的激活、海马炎症、补体激活和突触消融,神经炎症抑制也挽救了突触消融
10、C1q中和抑制补体介导的突触消除和抑制小胶质细胞激活,从而改善SIN大鼠的认知功能障碍和焦虑样行为
第四次实验的时间表如图10A所示。使用 C1q 中和抗体来减少 C1q 并检测补体对突触丢失的影响。ELISA 分析表明,C1q 中和抗体能有效降低海马中的 C1q 水平(图 10 G)。WB 分析也证实,C1q 中和抗体能显著下调海马中 C1qa 的表达(图 10 E、H)。在 CFC 中,C1q 中和增加了凝固时间的百分比,从而挽救了七氟烷暴露造成的认知障碍(图 10 B)。在 OFT 中,C1q 中和增加了进入中心区的次数和时间,从而缓解了焦虑和压力(图 10 C、D)。在 C1q 中和的同时,iba1 的表达下调(图 10 F、I)。同时,海马中突触蛋白(PSD95、SYN1 和 SYP)的表达也有所增加(图 10 J-N)。因此,C1q中和可抑制补体介导的突触消除和抑制小胶质细胞活化,从而挽救突触丢失,改善SIN大鼠的认知功能障碍和焦虑样行为。
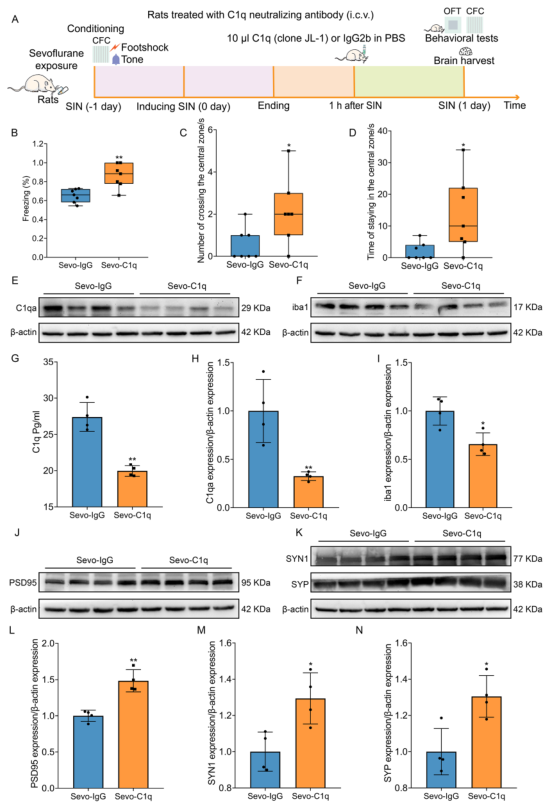
图10 SIN大鼠的C1q中和挽救突触消融,抑制小胶质细胞激活,改善认知功能障碍和焦虑样行为
总之,七氟醚对大鼠的长时间麻醉会引发认知障碍、焦虑样行为、神经炎症和补体激活。在长时间麻醉后,海马中的补体和神经炎症会导致小胶质细胞突触消失和树突棘脱落。海马中吞噬性和趋化性小胶质细胞明显增加,C1qa在突触上聚集,突触蛋白和基因下调。活化的小胶质细胞具有特定的形态结构和表型,会诱发神经炎症和补体激活,吞噬突触,导致突触丢失。通过 PLX3397 治疗消耗小胶质细胞可阻止这一过程。此外,用美洛昔康和 C1q 中和抑制神经炎症也能挽救突触丢失。
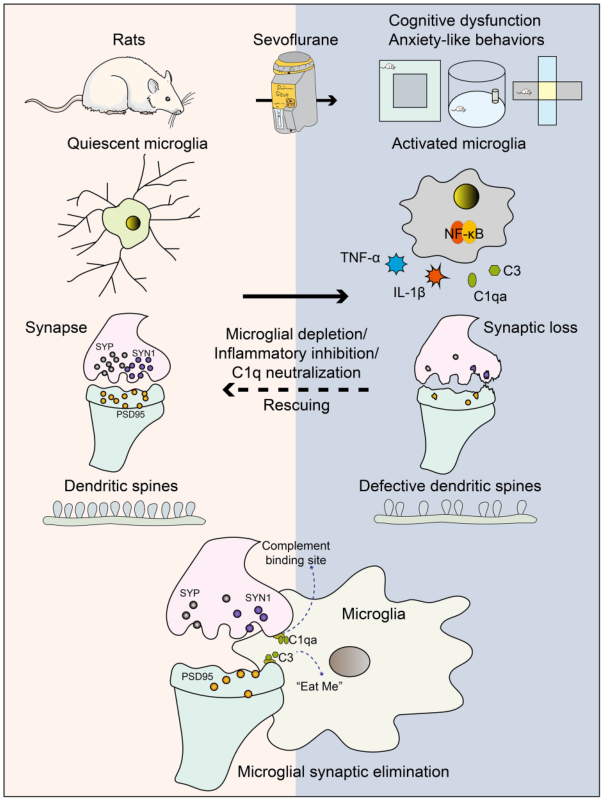
图11 SIN 的发病机理图。
实验方法
SD大鼠处理和建模,大鼠饲料中PLX3397配方,美洛昔康注射液,莫里斯水迷宫(MWM),矿场实验(OFT),高架十字迷宫实验(EPM),电极放置和海马局部场电位(LFP)记录,突发抑制识别与分析,RNA-seq,RT-PCR,ELISA,WB,免疫荧光染色,HE,Nissl染色,TUNEL,扫描电子显微镜(SEM),高尔基染色法,Sholl分析和定量形态学
参考文献
Xu F, Han L, Wang Y, Deng D, Ding Y, Zhao S, Zhang Q, Ma L, Chen X. Prolonged anesthesia induces neuroinflammation and complement-mediated microglial synaptic elimination involved in neurocognitive dysfunction and anxiety-like behaviors. BMC Med. 2023 Jan 5;21(1):7. doi: 10.1186/s12916-022-02705-6.






