关联CD4 +/CD8+ T细胞新抗原疫苗克服免疫检查点阻断剂抗药性,实现肿瘤消退

免疫检查点阻断疗法(ICB)的治疗效果目前仅限于被认为具有足够肿瘤突变负荷(TMB)的癌症亚群,这些亚群允许自体T细胞自发识别新抗原(NeoAg)。本研究探讨了是否可以通过联合免疫疗法改善侵袭性低TMB鳞状细胞肿瘤对ICB的反应,该疗法使用功能明确的NeoAg作为内源性CD4+和CD8+T细胞的靶点。单独接种CD4+或CD8+ NeoAg不能提供预防性或治疗性免疫力,但含有这两个亚群都能识别的NeoAg的疫苗能克服ICB抗性,并能根除包含PD-L1+ 肿瘤诱导癌干细胞(tCSC)亚群的已形成的大型肿瘤,前提是相关表位存在物理联系。机制上,治疗性 CD4+/CD8+ T 细胞 NeoAg 疫苗接种可改变肿瘤微环境 (TME),通过结合 ICB 介导的分子间表位扩散,使处于祖细胞和中间衰竭状态的 NeoAg 特异性 CD8+ T 细胞数量增加。该研究于2023年9月发表在《The Journal of Clinical Investigation》,IF:15.9。
技术路线:
主要研究结果:
1. 基于内源性CD4+和CD8+T细胞反应性的新抗原功能鉴定
用 1×107个照射过的SCC VII细胞(单独或辅以 50 μg polyI:C)对C3H/HeJ 小鼠进行皮下注射免疫。免疫小鼠在14天后再接种 5×105个转导表达荧光素酶和绿色荧光蛋白(SCC VII-Luc/GFP)的 SCC VII 活细胞,以实现生物发光(BLI)追踪。虽然仅用辐照过的 SCC VII 进行全细胞免疫接种并不能保护小鼠在受到挑战后免受肿瘤生长的影响--根据这一经典定义,SCC VII 是一种免疫原性很差的肿瘤--但通过多聚I:C的编码递送可以实现预防(图1A和B)。因此,SCC VII 含有能够产生保护性免疫的抗原。这取决于CD4+和CD8+ T 细胞,因为在接种疫苗之前(图1C)或之后(图1D),任何一个亚群的耗竭都会导致肿瘤在随后的挑战中生长。值得注意的是,与对照组相比,在接种前就被耗尽CD4+ T细胞的小鼠的肿瘤生长率降低,这表明在疫苗诱导反应的起始阶段和接种后维持其疗效都需要这种亚群。
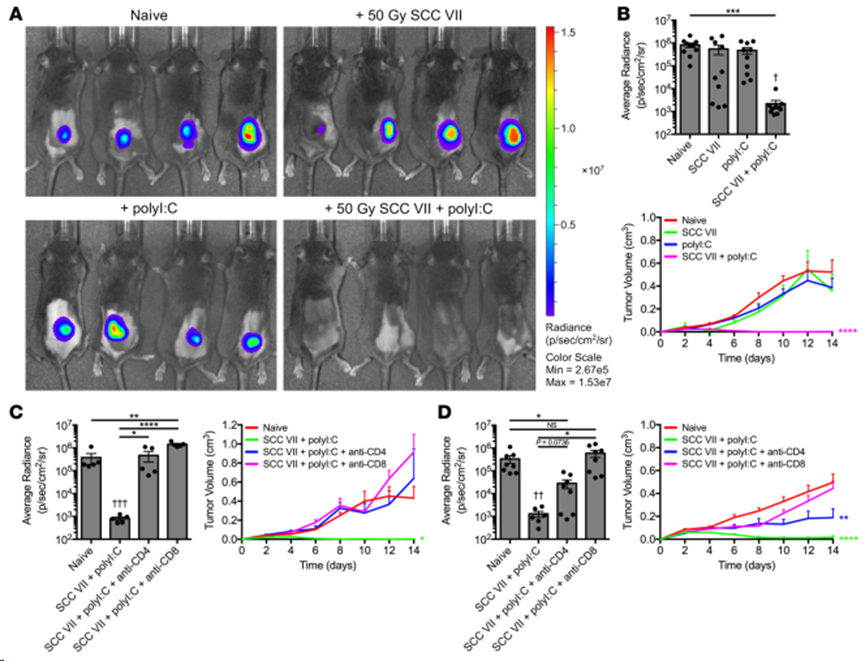
图1. SCC VII和polyI:C联合免疫对肝脏肿瘤的侵袭具有保护作用
随后,对产生强烈 IFN-γ 反应的肽池进行去卷积,以检测所针对的特定突变肽。分析结果显示,SCC VII 的天然免疫反应识别出的突变基因包括 Pik3ca(Mut_44)、Cltc(Mut_48)、Ctnnd1(Mut_61)和 Otud5(Mut_65 和 Mut_67)(图2A和B)。鉴定体细胞变异、选择候选突变进行功能测试以及对 NeoAg 进行功能验证所涉及的步骤用Circos图表示(图2C)。
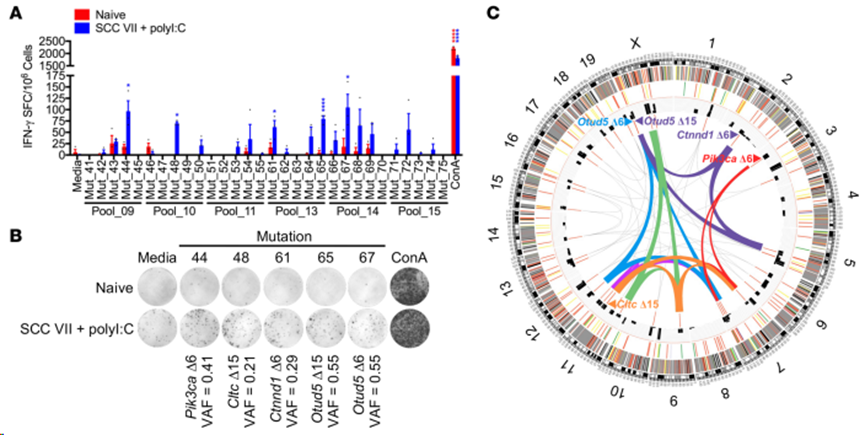
图2. SCC VII和polyI:C联合免疫后基于功能的新抗原鉴定
在检测各NeoAg肽对观察到的免疫的贡献时,只有Mut_48 (CltcΔ15)显示出对攻击产生保护作用(图3A),而WT肽(WT_48)无保护作用(图3B)。这些数据表明T细胞对Mut_48的反应介导了预防性肽疫苗接种后的保护性免疫。
评估分离自SCCⅶ肿瘤细胞免疫小鼠的CD4+和CD8+ T细胞的反应性,确定参与天然NeoAg特异性免疫应答的T细胞亚群。发现,Mut_48被CD4+和CD8+ T细胞识别,而Mut_44、Mut_61、Mut_65和Mut_67只能被CD4+ T细胞识别。此外,分离出的CD8+ T细胞识别Mut_72和Mut_73,这两种肽在Slc26a11基因中含有相同的错义突变(图3D)。然而,在初次/加强接种后,Mut_72和Mut_73均无法在体内产生针对SCCⅶ的保护性免疫(图3C)。这些结果表明,只有能被CD4+和CD8+ T细胞识别的Mut_48能够通过多肽疫苗诱导有效的预防性免疫
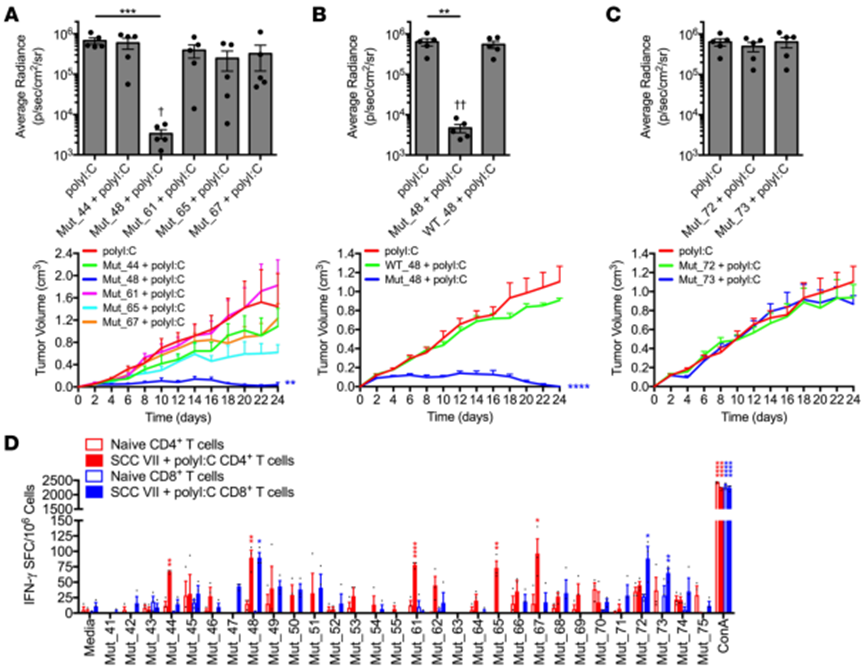
图3. CD4+和CD8+ T细胞对SCC vii衍生的新抗原反应的去卷积
为确定每个亚群识别的表位是相同的还是不同的,使用 IFN-γ ELISPOT 定量对一组含有Mut_48 H129Q突变的10-mer和15-mer肽(命名为Mut_48.1-Mut_48.10)的相对反应量(图4A)。从 SCC VII/polyI:C 免疫小鼠体内分离出的 CD8+ T 细胞在识别 Mut_48.10 10-mer 后产生的 IFN-γ 量最大,抗体阻断表明它是由 H-2Kk 呈递的(图4B)。共纯化的CD4+ T 细胞对通过 I-Ak 呈递的 Mut_48.5 15-mer(图4C)表现出最大的反应性,而对任何设计的 10-mer都没有预期的反应(数据未显示)。此外,使用免疫表位数据库和分析资源(IEDB)NetMHCpan(v4.0)方法对 Mut_48衍生的 10-mer与H-2Kk的结合进行了硅预测,估计大多数肽的亲和力较差,Mut_48.10 的最佳亲和力为 4988.7 nM IC50。值得注意的是,尽管预测的 H-2Kk 结合 IC50 值高于大多数筛选方案使用的 500 nM 临界值(图4D),但Mut_48.7-48.10 系列中包含的 10-mer肽仍能诱导 IFN-γ 生成。这些结果进一步证实,Mut_48 在较长的CD4+ T 细胞表位Mut_48.5 中包含一个 CD8+ T 细胞最小表位Mut_48.10,从而赋予这两个T细胞亚群产生 IFN-γ 的能力(图4E)。对刺激IFN-γ 的Mut_72和Mut_73的H-2Kk 结合预测进行扩展分析后,发现这两种肽的IC50亲和力均为250.9 nM,这表明IEDB NetMHCpan(v4.0)工具算法在过滤 CD8+ T 细胞体外免疫活性方面的效率约为 66%(图4F)。因此,本研究利用无偏见的功能性方法鉴定 NeoAg 使其能够在同一检测系统中更有效地探测CD4+和CD8+ T细胞表位。
免疫研究表明,含有CD4+和CD8+ T细胞识别的最小表位的Mut_48.5 15-聚合体对体内活 SCC VII 细胞挑战的保护程度与 Mut_48 20-聚合体相当。此外,CD4+ T 细胞表位对于观察到的保护作用是完全必要的,因为用仅含有 CD8+ T 细胞表位的截短 Mut_48.10 10-mer 免疫小鼠有部分保护作用(图 4G)。
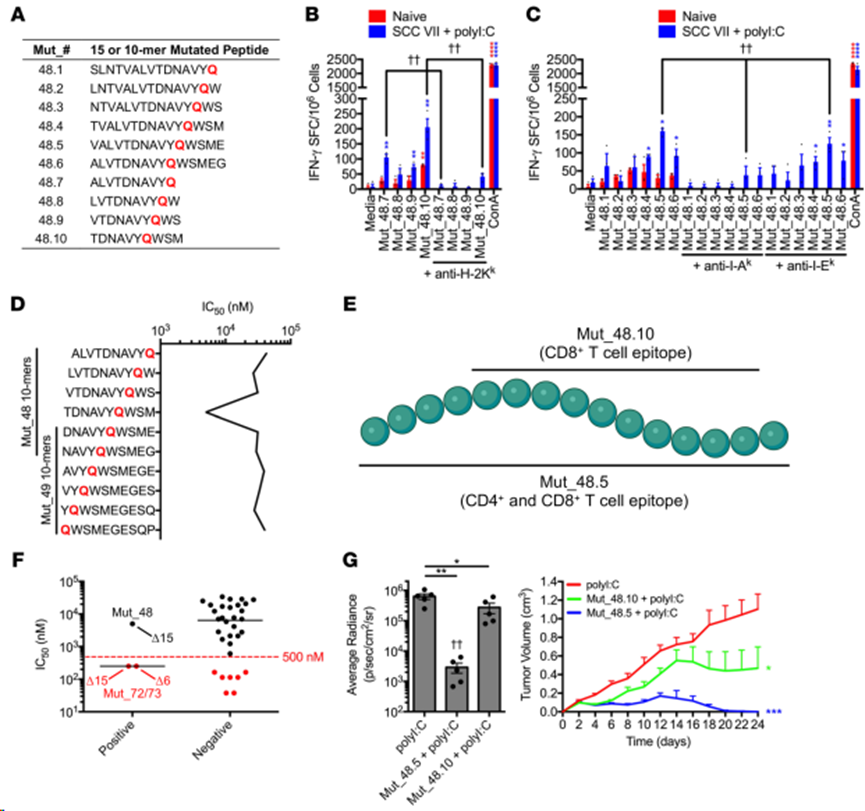
图4. CD4+和CD8+ T细胞疫苗衍生表位的MHC限制和功能相互作用
2. CD4+T细胞的肿瘤特异性和对CD8+T细胞的帮助
通过三重丙氨酸重复(-AAA-)共价连接 CD4+ 和 CD8+ T 细胞抗原,与由无系肽组成的疫苗接种相比,Mut_48 对 SCC VII 挑战的保护效果更佳(图 5)。因此,Mut_48 的功效与 CD4+ T 细胞辅助抗原以及肿瘤特异性 CTL NeoAg 的呈现有关,很可能是由相同的APC呈现的。此外,这些结果表明,CD4+ T 细胞需要肿瘤特异性的其他效应功能在该模型中是可有可无的。
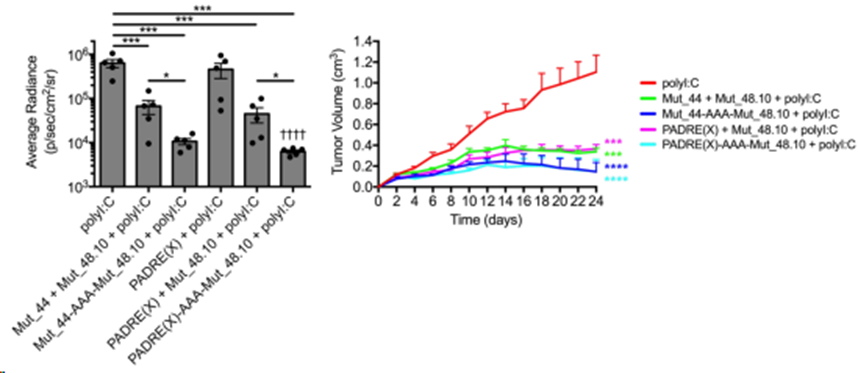
图5. 栓系CD4+ T细胞辅助性和最小CD8+ T细胞表位疫苗尽可能抑制SCCⅶ肿瘤生长
3. 结合新抗原疫苗接种可克服免疫检查点阻断的治疗耐药性
有研究表明,ICB 单药治疗可扩大内源性 NeoAg 特异性 T 细胞反应,并在与基于预测的疫苗联合使用时产生新的 NeoAg 反应,从而提高患者的无进展生存期。评估了基于已验证靶点的 NeoAg 疫苗能否与这一策略合理结合。首先使用上述原代/加强方案,通过免疫集合 NeoAg 疫苗(靶向 Pik3ca、Cltc、Ctnnd1 和 Otud5 突变)诱导 NeoAg 特异性 T 细胞应答。活体 SCC VII-Luc/GFP 肿瘤挑战三天后,小鼠通过静脉注射 PD-1 或 CTLA-4 阻断抗体,并测量其对肿瘤生长的影响。在这两种情况下,与单独使用 ICB 相比,ICB 都能明显加快 NeoAg 疫苗对生长中的 SCC VII 肿瘤产生治疗性免疫的能力。将 ICB 与多肽疫苗结合使用可防止约 50% 的单独接种 NeoAg 的C3H/HeJ小鼠晚期(超过第 24 天)SCC VII 肿瘤复发(图 6A 和 B)。抗PD-1和NeoAg联合疫苗接种明显加速了可触及肿瘤的消除,在第14天活动性排斥的早期动力学阶段协同效应明显(图6A)。此外,通过IFN-γ ELISPOT检测NeoAg疫苗接种后第42天的记忆T细胞反应,发现PD-1阻断增加Mut_48特异性T细胞反应的幅度,并显示分子间表位扩散到Mut_72和Mut_73的证据(图6C和D),这些靶点没有包括在多肽疫苗接种中,但以前曾观察到它们在与CD4+ T细胞物理分离后引起CD8+ T细胞反应(图3D)。相反,抗 CTLA-4 处理既没有显示协同作用,也没有显著影响 Mut_48 特异性 T 细胞的绝对数量。此外,抗 CTLA-4 还减少表位向其他特异性的扩散(图 6B)。
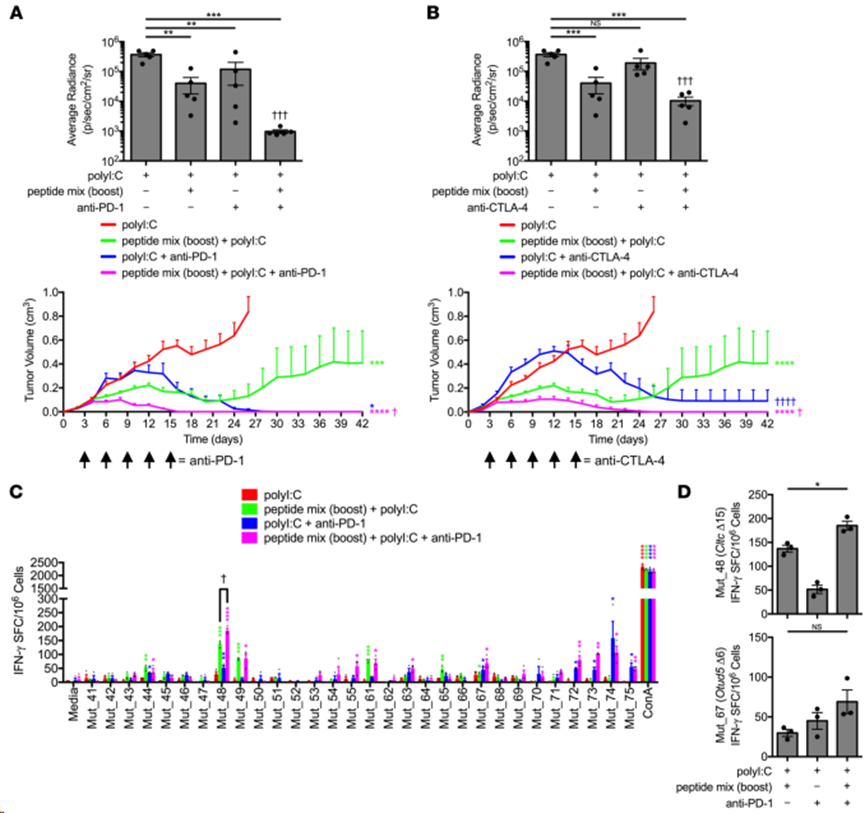
图6. 抗PD-1检查点阻断增加CltcΔ15-specific记忆频率,并促进分子间优势表位的扩散
SCC VII-Luc/GFP肿瘤在小鼠群中生长,使其体积达到约300至400立方毫米,然后在第10天和第24天用对侧静脉注射Mut_48+polyI:C混合物和/或静脉注射抗PD-1治疗2个周期。单独使用Mut_48疫苗并不能带来治疗效果,而抗PD-1则表现出不同程度的原发性和继发性耐药性,有时只能导致最初的肿瘤控制,但随后就会丧失。与此相反,将 PD-1 阻断与 Mut_48 NeoAg 疫苗结合使用,可以完全、持久(超过90天)地根除已形成的大肿瘤(图7A-D)。体外再刺激脾脏和肿瘤引流Ig LN的淋巴细胞发现,联合使用NeoAg和抗PD-1可协同增强记忆期Mut_48特异性T细胞反应(图7E)。此外,在第一轮免疫疗法后的第 17 天效应期分离的肿瘤浸润淋巴细胞(TIL)组分中,NeoAg 和抗 PD-1 联合给药显著增加总 CD8+ T 细胞的数量,而常规(Tconv)和调节性(Treg)CD4+ T 细胞的数量保持不变(图7F)。Mut_48 和抗 PD-1 治疗对肿瘤的排斥也伴随着对 SCC VII 向区域 LN 转移的抑制(图7G)。这些数据表明,功能性 NeoAg 介导的肿瘤排斥和区域转移预防在与 ICB 结合使用后具有最佳治疗效果。
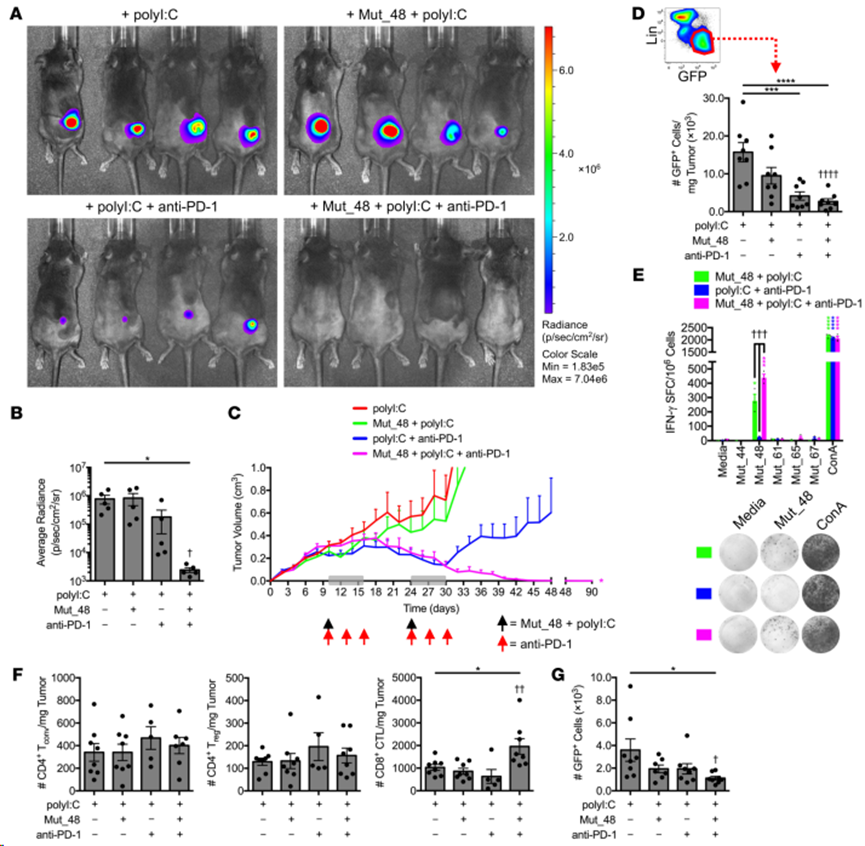
图7. 抗PD-1和CltcΔ15的延迟联合治疗可促进已建立的SCCⅶ肿瘤的清除
4. 新抗原疫苗接种增加干细胞样和中间耗竭的CD8+T细胞的存在
在肿瘤接种后第 10 天,用 Mut_48 + polyI:C混合物和/或i.p.抗PD-1对 SCC VII 肿瘤小鼠进行s.c.处理,在第 17 天效应期从 TIL、脾细胞和肿瘤排出的 Ig LN 分馏物中纯化 CD45+ 细胞,并进行 FACS 处理。将来自所有器官的入选 T 细胞合并在一起,并使用 21 种已知的表型特征将其投射到UMAP空间,以定义naive CD4+/CD8+ T 细胞(Tn)、CD4+/CD8+ Teff/mem、CD4+ Treg、CD8+ Tprec/prog、CD8+ Tex-int 和 CD8+ Tex-term 亚群。总CD4+和CD8+T 细胞得到清晰的分离(图 8A)。来自 TIL、脾脏和 LN 的 CD8+ T 细胞亚群似乎完全不同,而来自TIL和LN的CD4+ T细胞似乎占据与脾脏类似的独立空间(图8B上)。当单独观察TIL定位与治疗的关系时,可以观察到Mut_48疫苗接种与特定CD4+和CD8+T细胞亚群消失之间的密切联系,而相对于单独的polyI:C治疗,抗PD-1治疗要么引起更微妙的变化,要么似乎扩大先前存在的亚群(图 8B下)。
为更详细地了解治疗是如何影响 T 细胞分化的,确定24个元集群,它们捕捉到在整个 UMAP 区域观察到的标记物特征的粒度(图8C和D)。该图谱显示,各器官的治疗捕获了CD8+Tex、Teff 和Tmem系,其中门控CD8+ T 细胞的伪时间轨迹分析显示CD62L(Tn和Tmem)、TCF-1/SLAMF6(Tprec/prog 和 Tmem)、GzmB/CX3CR1/CD44/Ki-67(Tex-int 和 Teff)和 TOX/PD-1(Tex-int 和 Tex-term)之间高度协调的表达模式(图 8E)。 根据这些标准确定CD8+ Tex-int(元簇 7、10、12、13、18、21 和 22)和 CD8+ Tex-term(元簇17和19)(图 8C-F)。
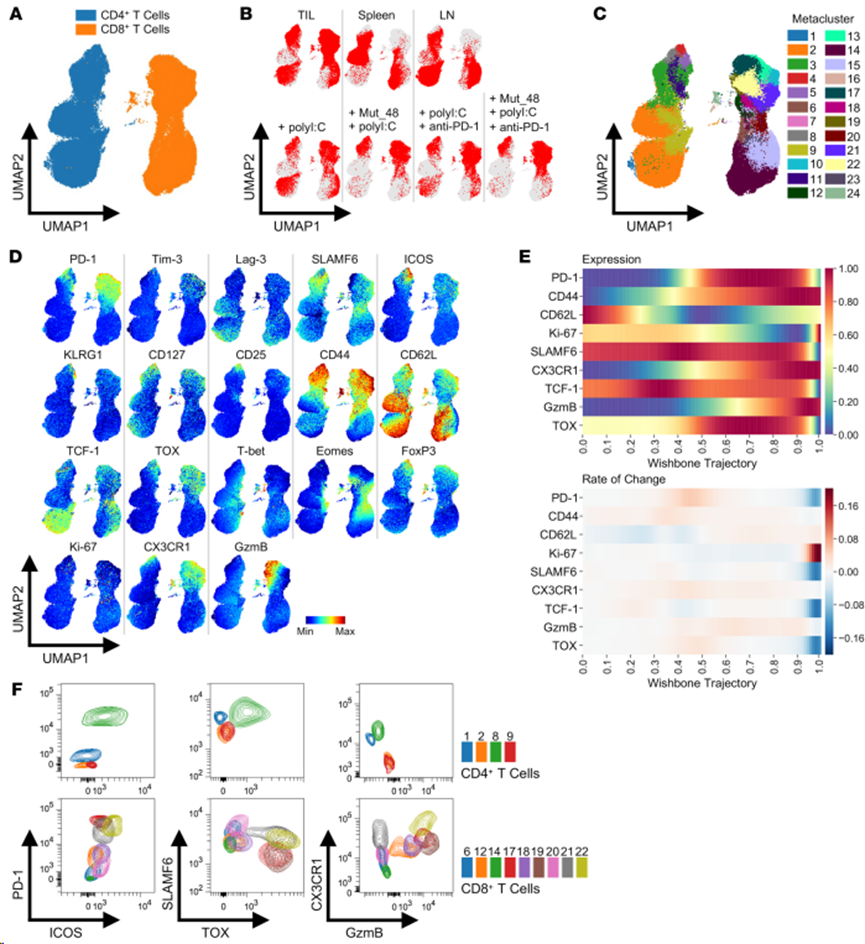
图8. 肿瘤和外周淋巴器官中CD4+和CD8+ T细胞亚群的鉴定
接下来,根据TIL(图 9A和B)、脾脏(图 10A和B)和肿瘤引流 Ig LN(图 10C和D)中各处理间 CD4+ T 细胞或 CD8+ T 细胞的频率对元集群进行解析。在 24 个元集群中,发现 4个CD4+ T 细胞相关元集群和 6个CD8+ T 细胞相关元集群相对于 TIL 中单独的polyI:C 处理具有统计学意义。在 CD4+ TIL 中,与接种 Mut_48 疫苗相关的 Tn 和 Teff/mem 细胞(元簇 1、2 和 9)显著减少,这与 T 细胞引诱作用一致。Mut_48 疫苗接种导致 CD4+ Teff/mem 元簇 8 的增加,根据 PD-1 和 ICOS 表达的增加,这似乎可能是 T 滤泡辅助细胞(Tfh)的来源(图 8F 和图 9B)。在所有器官和治疗中,CD4+Teff/mem(非Treg)没有显示细胞毒性标记(KLRG-1和GzmB),这与它们在该模型中作为辅助细胞的作用一致(图8D和F)。在 CD8+ TIL 中,与 Mut_48 疫苗诱导引物相关的 Tn(元簇 14)减少。抗 PD-1 治疗似乎足以导致 Tprec/prog 亚群(元簇 6 和 20)的扩大。单用抗-PD-1(元簇 18)、Mut_48 和抗-PD-1 组合(元簇 12 和 21)或任一处理(元簇 22)都能支持特定的Tex-int 亚群。单独接种Mut_48 疫苗后,Tex-term亚群(元簇 17 和 19)被观察到扩大;然而,抗-PD-1 治疗阻止这一现象,已知抗-PD-1 会动员 PD-1- Tn 和 PD-1lo Tprec/prog,而牺牲 PD-1hi Tex-term细胞(图 8F 和图 9B)。虽然 Mut_48 和抗 PD-1 联合治疗支持 TIL 中的 Tprec/prog 分化与单独治疗相比没有差异,但联合治疗后脾脏和肿瘤引流 Ig LN 中的小群 Tprec/prog(元簇 20)显著扩大(图 10A-D)。这些数据表明,将 PD-1 阻断与 NeoAg 肽疫苗接种相结合会导致非细胞毒性、辅助性 CD4+ T 细胞亚群的增长,并更有效地扩增外周的 CD8+Tprec/prog 和 TIL 部分中的 Tex-int 群体。
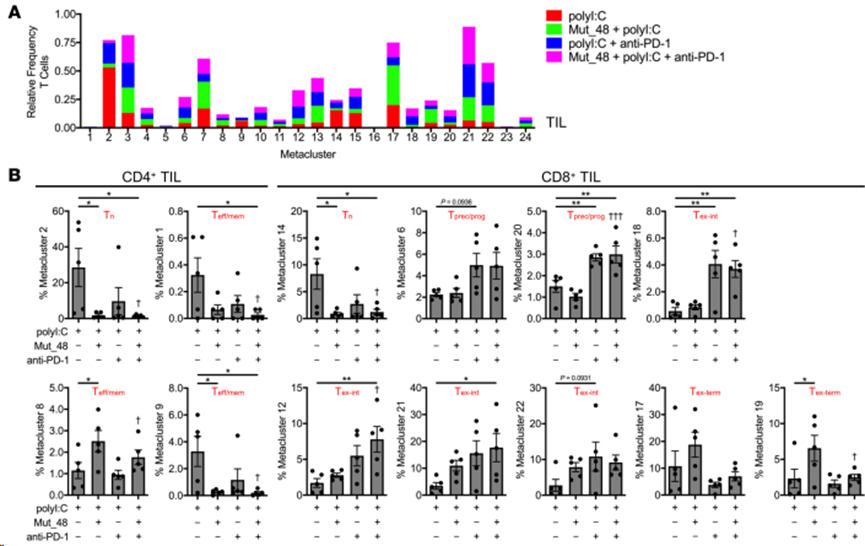
图9. CltcΔ15疫苗增强抗PD-1诱导的CD8+T细胞应答,并将其重新聚焦于肿瘤中的中间型、效应样亚群
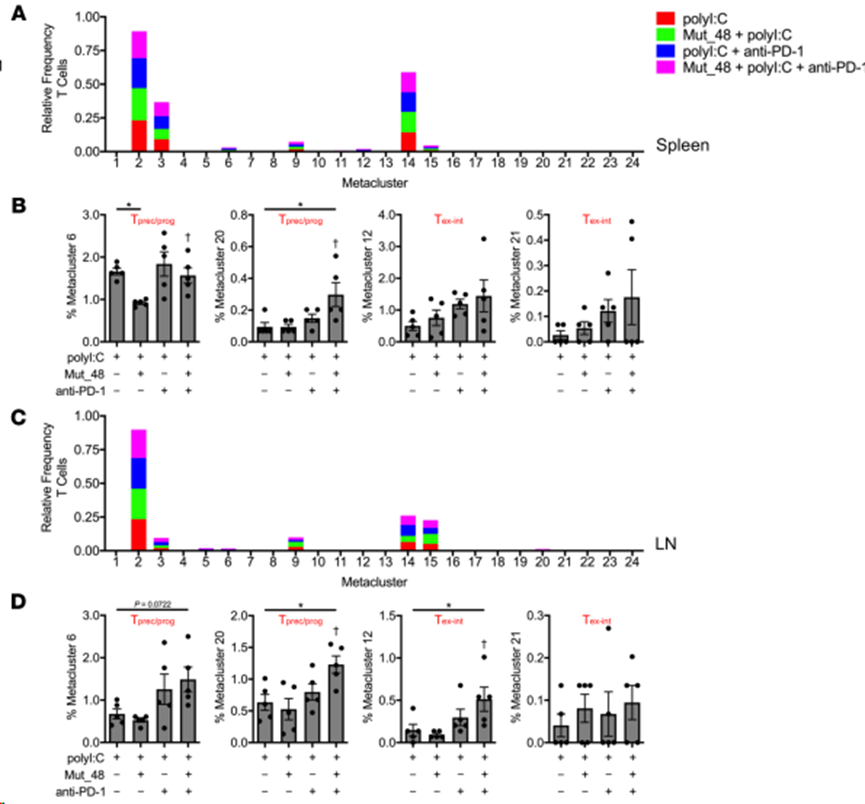
10. 联合抗PD-1和CltcΔ15扩增外周淋巴器官的前体/祖细胞和中间耗竭的CD8+T细胞
5. 新抗原疫苗的疗效需要CD4+ T细胞提供 Th1 型帮助
在接种 NeoAg 肽疫苗前消耗CD4+ T细胞会导致部分肿瘤控制,这表明在 CD4+ T细胞缺失的情况下启动的CD8+ T细胞并不完全有效,而在治疗前消耗 CD8+ T细胞会导致肿瘤快速生长,这表明 CD8+ T 细胞是抗 SCC VII 的必需效应因子。在CD4+ T细胞完全缺失的情况下,激动抗CD40交联抗体完全恢复了CD8+ T细胞介导的肿瘤排斥反应(图11A),这表明即使在CD4+ Tfh缺失的情况下,提供基于Th1的细胞帮助也是有效治疗的关键特征。与此相一致,在疫苗/PD-1阻断治疗联合方案中,当与 CD8+ T 细胞最小表位(Mut_48.10)相连时,Cltc CD4+ T 细胞表位可被 PADRE(X) 替代,并仍能导致完全的肿瘤排斥反应(图 11B)。这些发现共同表明,功能合理的 NeoAg疫苗联合疗法可以有效克服不同类型的肿瘤耐药机制(无论是对化疗还是检查点阻断单药)。
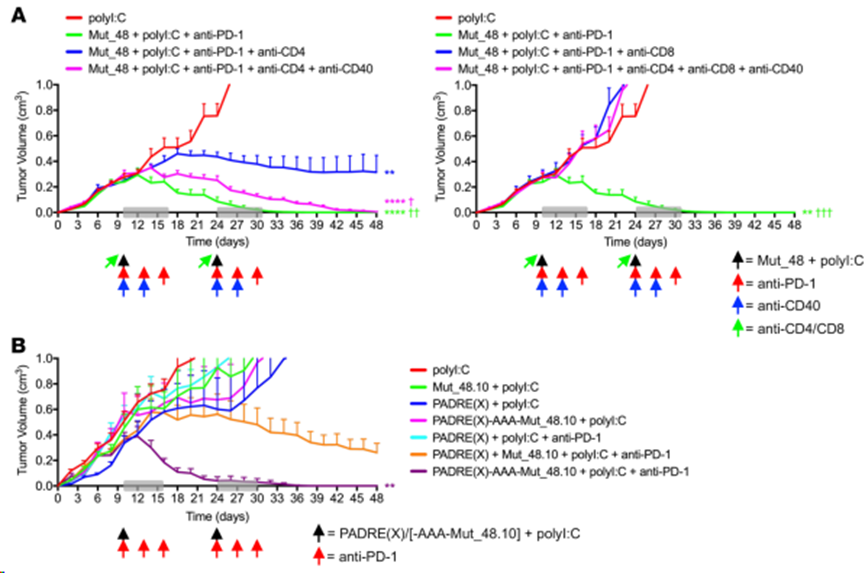
图11. 栓系CD4+ T细胞辅助表位通过CD40依赖机制优化检查点阻断和CTL介导的SCCⅶ肿瘤破坏
结论
综上所述,本研究证明ICB抗药性可以通过与NeoAg疫苗接种相结合的协同机制有效克服,从而维持稳定的 CD8+ T 细胞应答,这种应答能够抵御终末衰竭的发生,并同时靶向PD-L1+ 和 PD-L1-肿瘤细胞。可利用本文探索的概念来开发更有效的个性化癌症疫苗,从而扩大ICB可治疗的肿瘤范围。
实验方法
细胞培养,基于肿瘤和肽的免疫和疫苗接种,化疗,抗体介导的检查点阻断、CD4+/CD8+ T细胞清除以及对辅助依赖性的评估,肿瘤、脾脏和Ig LN单个核细胞分离,Q-PCR,WB,ELISPOT,Whole-animal成像,流式细胞术,光谱数据处理与分析,共聚焦显微镜,伤口闭合实验,Exome-Seq和RNA-Seq,生物信息学NeoAg鉴定,生物信息学分析小鼠与人类RNA-Seq数据集的匹配,
参考文献
Dolina JS, Lee J, Brightman SE, McArdle S, Hall SM, Thota RR, Zavala KS, Lanka M, Ramamoorthy Premlal AL, Greenbaum JA, Cohen EEW, Peters B, Schoenberger SP. Linked CD4+/CD8+ T cell neoantigen vaccination overcomes immune checkpoint blockade resistance and enables tumor regression. J Clin Invest. 2023 Sep 1;133(17):e164258. doi: 10.1172/JCI164258. PMID: 37655661; PMCID: PMC10471175.






