在帕金森病小鼠模型中敲除或抑制USP30 可保护多巴胺能神经元
编码α-突触核蛋白(αSyn)的基因SNCA突变可导致家族性帕金森病(PD),而αSyn异常是特发性帕金森病的关键病理标志。α-突触核蛋白病变可导致线粒体功能障碍,从而导致多巴胺能神经变性。PARKIN和PINK1在常染色体隐性PD中突变,通过诱导线粒体蛋白泛素化来调节功能失调线粒体的优先自噬清除(“线粒体自噬”),这一过程通过USP30被去泛素化抵消。本研究表明,USP30基因敲除小鼠的USP30缺失可以保护行为缺陷,并导致有丝分裂增加,磷酸化-s129 αSyn减少,αSyn诱导的SN多巴胺能神经元损失减弱。这些观察结果用一种有效的、选择性的、脑渗透的USP30抑制剂MTX115325进行了概括,该抑制剂具有良好的药物样特性。这些数据有力地支持了USP30抑制作为PD潜在的疾病改善疗法的进一步研究。
USP30被提出调节线粒体自噬,这是帕金森病的一个相关机制。在这里,作者表明USP30基因敲除小鼠和USP30抑制剂如MTX115325在帕金森病的αSyn小鼠模型中表现出神经保护反应。该文章与2023年11月发表在《Nature Communications》,IF:16.6。
技术路线:

主要研究结果:
1. USP30KO小鼠存活,无明显病理
为了在小鼠中产生USP30 KO,作者将USP30必需外显子4与loxP位点(条件准备等位基因)连接,然后使用CRE重组酶(构成等位基因)将其删除,以产生USP30 KO小鼠(图1a)。在脑、肾、心脏、骨骼肌、脾脏、肝脏、胰腺和睾丸中缺失USP30 mRNA证实了USP30基因的成功缺失(图1b)。此外,USP30 KO小鼠的皮质中未检测到USP30蛋白(图1c)。正如先前报道的那样,USP30 KO小鼠以预期的孟德尔频率出生(图1d)。为了了解USP30的丢失是否会导致随年龄增长的病理,作者建立了一个衰老队列,并表明与野生型(WT)同侪对照相比,USP30的丢失没有可检测到的有害影响(图1e)。综合来看,这些数据显示USP30缺失对小鼠没有不利影响。
为了验证USP30缺失会影响多巴胺能神经元线粒体自噬的假设,作者将USP30 KO小鼠与mito-QC报告小鼠杂交,后者具有GFP-mCherry串联融合到源自蛋白FIS146的线粒体定位信号。这使得在体内测量有丝分裂成为可能,因为在有丝分裂过程中,GFP信号在溶酶体的酸性环境中被淬灭。因此,没有绿色GFP信号的红色mCherry斑点反映了线粒体在有丝分裂降解过程中与溶酶体融合(图1f)。为了了解USP30缺失是否会影响线粒体清除,作者在16周龄时量化了mitto - qc / USP30 KO小鼠多巴胺能神经元中的线粒体自噬信号,并与mitto - qc WT幼崽进行了比较。在这种情况下,在单个SN多巴胺能神经元(图1g),作者量化了与溶酶体标记(LAMP1,绿色;图1f中左面板)代表有丝分裂体与溶酶体融合。作者发现,与WT小鼠相比,USP30 KO小鼠多巴胺能神经元中的mCherry斑点显著特异性增加(图1 h)综上所述,作者的结果表明,亏损USP30老鼠增加基底的mitophagy SNpc DA神经元,大脑皮层神经元和海马神经元,而不是肌肉。
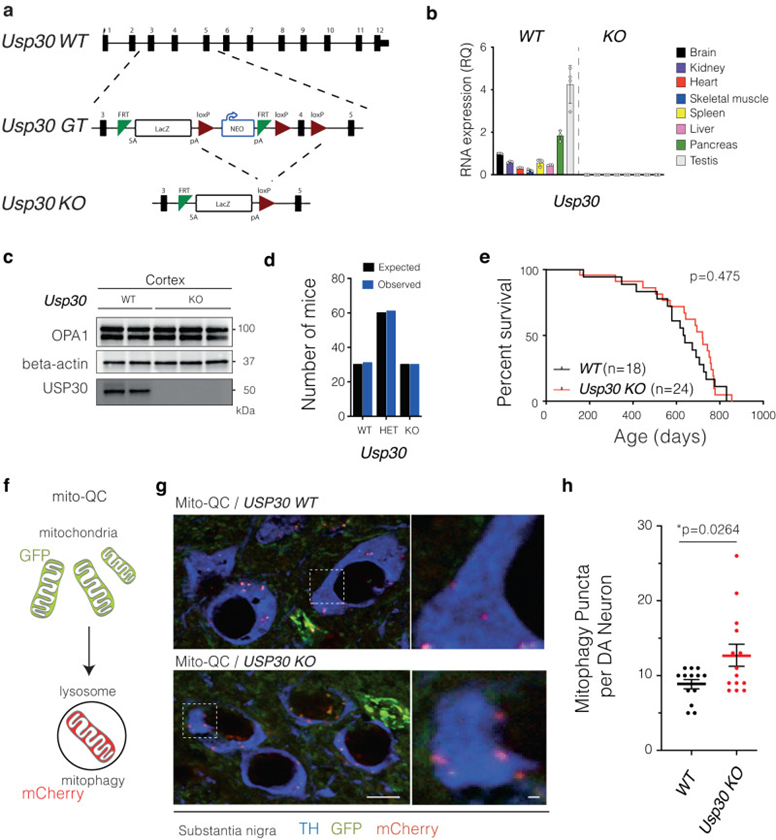
图1 Usp30 KO小鼠的产生与表征
2. USP30 KO可减轻AAV-A53T-SNCA小鼠模型中的多巴胺能神经元损失
为了验证USP30 KO小鼠DA神经元的自噬增强是否与DA神经元免受αSyn毒性的保护有关,作者使用了经过验证的AAV1/2-A53T-SNCA αSyn过表达PD小鼠模型,该模型在大鼠、小鼠和非人灵长类动物模型中显示多巴胺能神经变性和运动障碍。首先,为了确定αSyn的诱导是否影响线粒体自噬,作者测量了同侧(注射AAV-A53T-SNCA)SNpc内的线粒体自噬情况,并与对侧(未注射;NI),分娩后28周。USP30 KO小鼠对侧和同侧SNpc DA神经元的线粒体自噬点均显著增加。为了确定USP30缺失是否能保护USP30 KO小鼠免受αSyn诱导的DA神经元缺失,作者在注射后28周对同侧(注射AAV-A53T-SNCA)SNpc内与对侧(NI)部位进行了TH+神经元计数(图2a)。上述结果表明,USP30缺失可显著减轻αSyn过表达引起的DA神经元缺失(图2b)与WT对照组相比(图2b)或mito-QC小鼠(图2 b)。因此,USP30缺失可防止αSyn诱导的DA神经元损失。
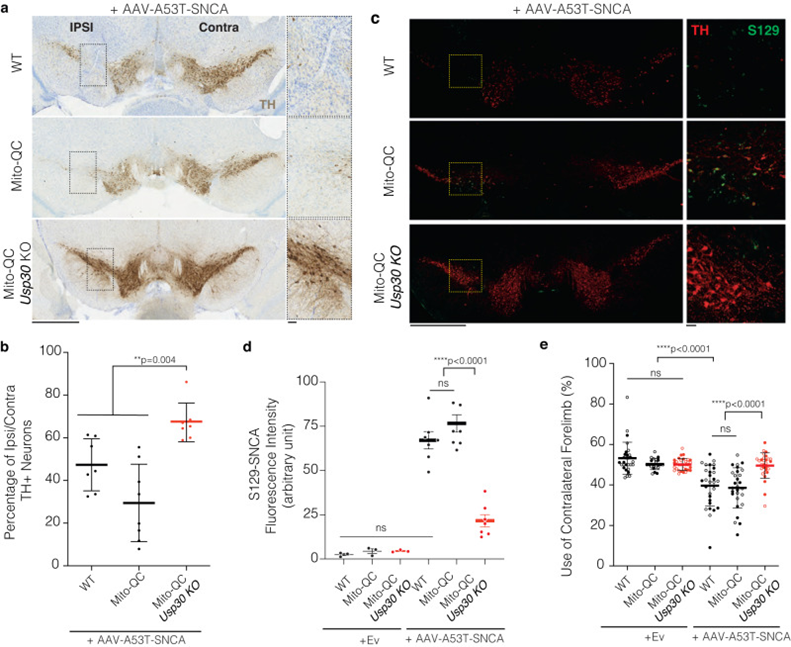
图2 在α-突触核蛋白诱导的PD小鼠模型中,Usp30 KO可改善DN神经元的存活,降低病理性αSyn,并防止运动缺陷
3. USP30 KO抑制αSyn病理和相关运动缺陷的发展
为了确定注射AAV-A53T-SNCA的USP30 KO小鼠的线粒体自噬上调是否与αSyn病理降低有关,作者用抗磷S129-αSyn对SNpc进行了免疫染色,这是一种在Lewy小体中发现的αSyn的病理形式。相比之下,注射AAV-A53T-SNCA的WT小鼠同侧SNpc有较强的磷酸化-s129-αSyn荧光免疫染色(图2c,d)与注射AAV-Ev小鼠相比,mito-QC AAV-A53T-SNCA小鼠(图2c,d)。值得注意的是,注射AAV-A53T-SNCA的小鼠多巴胺能神经元中磷酸化- s129 αSyn的强度在mito-QC/USP30 KO小鼠中显著降低(图2c, d)。
4. USP30 KO对α syn诱导的运动缺陷有保护作用
为了评估注射AAV-A53T-SNCA后28周多巴胺能神经元的损失是否与运动缺陷有关,并评估USP30 KO对运动功能的影响,作者在圆柱试验中测量了前肢的不对称使用,这对不对称多巴胺缺陷很敏感。单侧注射AAV-Ev不影响所有三个实验组(WT、mito-QC和mito-QC/USP30 KO)的雌雄小鼠的运动功能;图2f),从而排除了来自病毒或立体定向注射剂本身的任何非特异性作用。相反,在WT和mito-QC小鼠中单侧注射AAV-A53T-SNCA诱导运动功能障碍,表现为注射对侧前肢较少使用(与使用同侧前肢相比)(图2e)。值得注意的是,USP30 KO对雌性和雄性mitto - qc /USP30 KO小鼠α syn诱导的运动缺陷均有显著保护作用(图2e)。这些结果表明,USP30 KO可以缓解α syn诱导的运动缺陷。
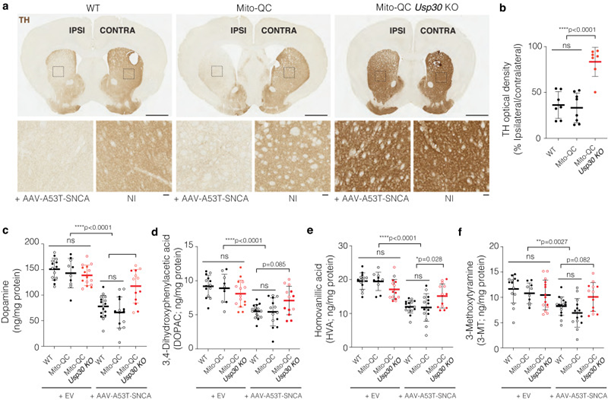
图3 在α-突触核蛋白为基础的小鼠模型中,Usp30 KO可防止纹状体TH+多巴胺能纤维的丢失,并保留多巴胺及其代谢物
5. USP30 KO可防止α syn诱导的纹状体多巴胺和TH+终端的丢失
为了测试USP30 KO对α syn诱导的DA神经突向纹状体的损失的影响,作者测量了脑切片纹状体中TH+终端的密度(图3a)。两种WT小鼠TH+纤维的相对光密度均显著降低(图3b)和mito-QC小鼠,但在USP30 KO小鼠注射AAV-A53T-SNCA后没有显著变化(图3b)。
通过TH染色,作者还观察到纹状体和SNpc的TH强度与WT和USP30 KO不同,即使在未注射侧也是如此。为了理解其中的原因,作者量化了注射AAV-A53T-SNCA或在同侧注射aav -空载体(Ev)的小鼠TH光密度与NI对侧的关系。这些数据表明,在注射AAV-A53T-SNCA的小鼠中,TH染色强度不仅在同侧受到影响,而且在对侧也受到影响(图3a,b)。在大鼠PD模型中,单侧注射AAV载体在SN中过表达αSyn后,双侧纹状体TH+末端受到影响。因此,USP30 KO小鼠的TH染色可能不会直接升高,相反,USP30 KO可以防止发生在同侧和对侧的异步诱导的TH损失。这一观察结果并没有改变作者的整体数据解释,因为在作者的分析中,作者比较了小鼠内效应(同侧与对侧)。
作者进一步分析了雌性和雄性小鼠同侧纹状体中多巴胺及其代谢产物的分子水平。在注射AAV-Ev的小鼠中,多巴胺及其代谢物,包括3,4-二羟基苯基乙酸(DOPAC)、3-甲氧基酪胺(3- mt)和同型香草酸(HVA)的水平在不同基因型中是相似的(图3 c-f)。注射AAV-A53T-SNCA引起WT和mito-QC小鼠多巴胺消耗(图3c),但在USP30 KO小鼠中没有(图3c)。此外,USP30 KO可以阻止多巴胺代谢物HVA (图3e)和3-MT (图3f)的下降,而DOPAC的下降趋势不显著(图3d)。这些结果表明,USP30 KO在以αSyn为基础的PD小鼠模型中可保护TH+纹状体终末的丧失和纹状体多巴胺的丧失。
6. 脑渗透USP30抑制剂MTX115325的验证
MTX115325是Mission Therapeutics公司开发的USP30抑制剂(USP30i),具有良好的口服生物利用度和中枢神经系统(CNS)穿透性(图4)。MTX115325(图4a)在生化荧光偏振分析中抑制USP30,IC50为12 nM,并在细胞中阻断泛素样探针进入酶活性位点,IC50为25 nM。在过表达PARKIN并受到线粒体毒素antiycin a和oligomycin a(A/O)攻击的人HeLa细胞系中,MTX115325增加了线粒体外膜蛋白TOM20(USP30底物)的泛素化,具有代表性的TOM20-UB浓度响应曲线如图4b所示。为了进一步研究MTX115325在体外对人多巴胺能神经元的药理作用,作者检测了IPSC衍生的多巴胺能神经元在10 nM、100 nM或1µM无任何外源刺激的情况下,在不存在或存在MTX115325的情况下,TOM20和TOM20泛素化的差异。为了评估对DUB和其他半胱氨酸蛋白酶的选择性,USP30i MTX115325在生化试验中对54种DUB和5种组织蛋白酶进行了筛选。作者证实,USP30i MTX115325抑制小鼠USP30的IC50为13 nM,显示出人和小鼠酶之间的等效效力。USP30i MTX115325在单次10 mg/kg剂量后的全血和前额皮质透析液中的时间浓度曲线,显示了两种组织曲线的紧密关系(图4c),以及前额皮质游离CMax为528 nM(在60分钟时间点)。小鼠探索性毒理学研究表明,MTX115325耐受性良好,在剂量水平高达300 mg/kg/天的两周后,无不良临床观察或病理发现。在稳定表达mito-QC的SH-SY5Y细胞中,MTX115325与ETC复合物III和V的亚最大抑制(0.1 mM a /O)联合孵育72小时,产生了浓度依赖性的线粒体自噬增加(图4e)。MTX115325在37 nM时使线粒体自噬增加22%,在1µM时与基线相比最大增加54%(图4f)。这些数据表明,MTX115325对USP30的抑制具有高度选择性、中枢神经系统渗透性和良好的耐受性,并且MTX115325在体外驱动成神经细胞瘤细胞系和IPSC来源的神经元的线粒体质量控制过程中,在存在和不存在外源刺激的情况下具有浓度依赖效应。
7. 在AAV-A53T-SNCA小鼠模型中,USP30抑制剂MTX115325可防止多巴胺能神经元丢失并保留纹状体多巴胺
为了测试USP30催化活性的抑制是否能再现USP30 KO小鼠对黑质纹状体系统的保护作用,作者在与USP30 KO研究密切相关的AAV-A53T-SNCA PD小鼠模型中测试了USP30i MTX115325 (WO 2021/249909 A1)。小鼠单侧立体定向注射编码AAV-A53T-SNCA的AAV1/2,未对侧注射(NI)后,每天两次口服15 mg/kg或50 mg/kg MTX115325,治疗10周后,取同侧和对侧纹状体测定多巴胺和代代物,取SN测定TH+神经元(仅50 mg/kg组)。例TH染色图像如图5a所示。与上述USP30 KO的作用一致,MTX115325抑制USP30可防止A53T αSyn诱导的TH+神经元损失(图5b)。以每只动物的对侧NI半球为对照,MTX115325 (50 mg/kg BID)处理动物的同侧TH+神经元比例为61.7%,而MTX115325 (50 mg/kg BID)处理动物的同侧TH+神经元比例为89.08%,表明USP30的药理抑制对αSyn诱导的神经元损失有显著保护作用。与这些对TH+神经元的影响一致的是,与对侧半球相比,MTX115325在50和15 mg/kg BID下,消除了同侧半球多巴胺和多巴胺代谢物HVA和DOPAC的损失,也消除了处理组之间同侧半球多巴胺和多巴胺代谢物HVA和DOPAC的损失(图5c-e)。当使用标准化数据比较治疗组间同侧半球的水平时,尽管平均多巴胺/HVA/DOPC估计表明,与50 mg/kg BID相比,15 mg/kg BID的疗效略弱,但它们不足以在该模型中明确建立MTX115325治疗的剂量反应效应。
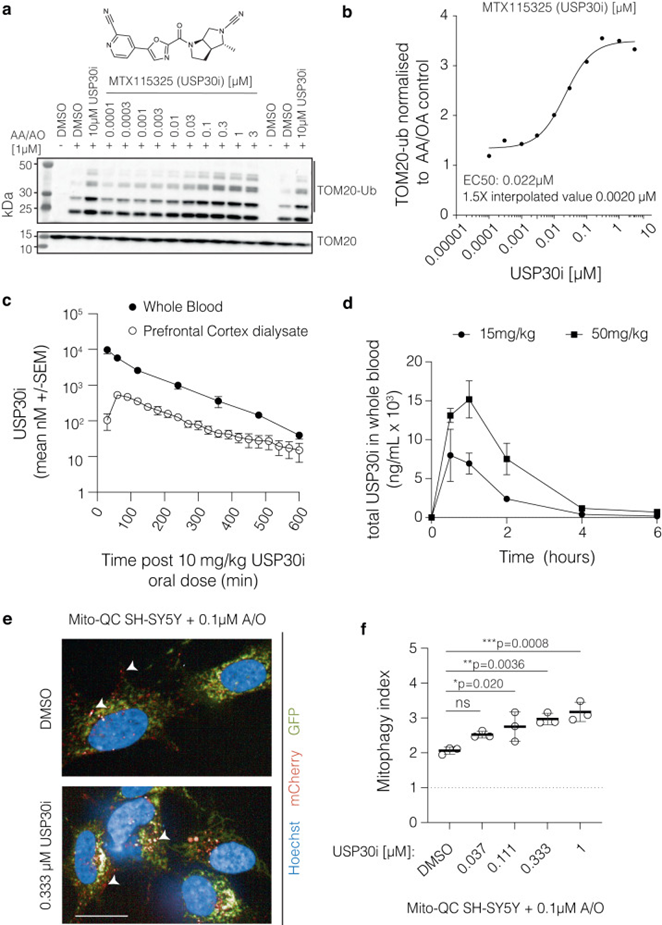
图4 小分子USP30抑制剂MTX115325对USP30的抑制作用及药代动力学验证
为了确认化合物暴露与研究中目标接触的稳定水平一致,在首次给药后0.5、1、2、4和6小时,即研究结束前7天,测量了血液样本中的MTX115325水平。MTX115325在15 mg/kg和50 mg/kg剂量下的血液Cmax分别为7546.9 ng/mL和16374.3 ng/mL,不同剂量下的暴露分别为13606 ng*h/mL和42959 ng*h/mL(图4d)。在给药方案持续时间内,估计的脑游离药物浓度将远高于TOM20泛素化(TOM20- UB)测定的EC50,剂量为50 mg /kg。
综上所述,这些结果表明,MTX115325对USP30的抑制作用再现了USP30 KO在αSyn - PD小鼠模型中保护TH+神经元丢失和纹状体多巴胺丢失的作用。
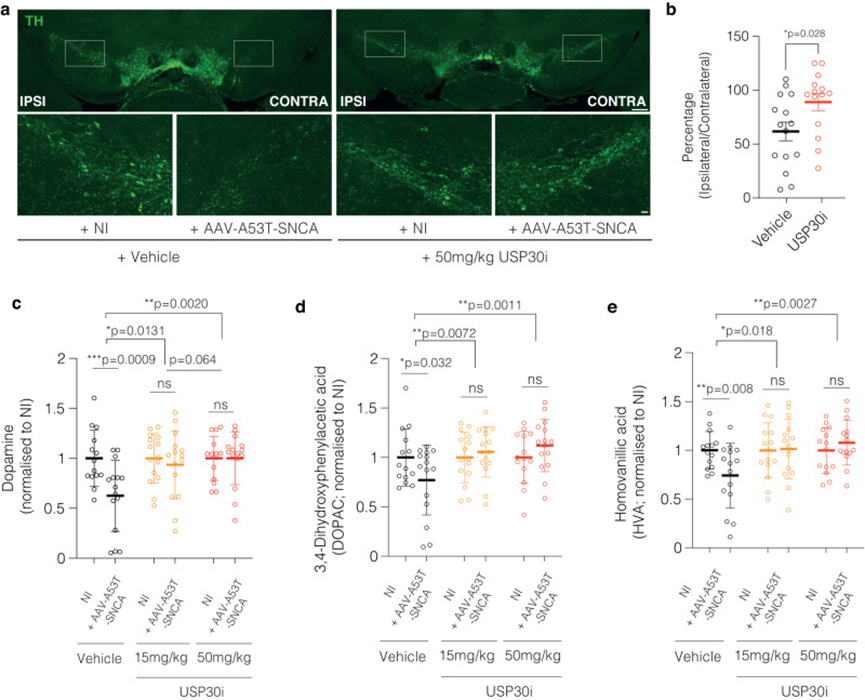
图5 在α-突触核蛋白为基础的PD小鼠模型中,MTX115325对USP30的药理抑制可防止多巴胺能神经元丢失和多巴胺耗损
结论:
总之,作者使用了一种通过USP30缺失来上调线粒体自噬的策略,使用药理学USP30抑制剂获得了类似的结果。这些减少USP30的策略导致线粒体自噬增强和对αSyn毒性的有效保护。这项工作验证了抑制USP30作为进一步测试PD潜在疾病改善作用的有希望的策略。
实验方法:
细胞培养、多巴胺能神经元培养、腺相关载体(AAV) 1/2立体定向注射、MTX115325剂量和在生活中的血液采样的化合物水平测量、行为评估、免疫组织化学和免疫荧光染色、线粒体自噬点与共定位分析、Western blot分析、多巴胺和多巴胺代谢物的测定、USP30生化荧光偏振测定、细胞USP30泛素探针结合试验、细胞TOM20泛素化试验、小鼠药代动力学及脑CETSA分析
参考文献:
Fang TZ, Sun Y, Pearce AC, Eleuteri S, Kemp M, Luckhurst CA, Williams R, Mills R, Almond S, Burzynski L, Márkus NM, Lelliott CJ, Karp NA, Adams DJ, Jackson SP, Zhao JF, Ganley IG, Thompson PW, Balmus G, Simon DK. Knockout or inhibition of USP30 protects dopaminergic neurons in a Parkinson's disease mouse model. Nat Commun. 2023 Nov 13;14(1):7295. doi: 10.1038/s41467-023-42876-1. PMID: 37957154; PMCID: PMC10643470.






