绘制和建模人类结直肠癌与肿瘤微环境的相互作用
结直肠癌(CRC)是全球第三大致死率和第四大确诊率最高的癌症,发展中国家和发达国家的发病率都在增加,死亡率下降方面只有微小进展,老年患者(65岁以上)居多。最近,人类结直肠癌的几个单细胞转录组谱揭示了TME内许多细胞群的身份。然而,这些了解是有限的,部分原因是数据集中缺乏癌细胞,以及缺乏可以直接测试癌细胞对巨噬细胞前体或TME其他细胞的影响。本文中,作者试图利用人类结直肠癌的单细胞转录组学分析来绘制人类结直肠癌细胞和TME细胞之间假定的相互作用。于2023年11月发布于《Nature Communications》,IF=16.6。
技术路线:

主要研究结果:
1、单细胞转录组学预测癌细胞和肿瘤微环境之间广泛的串扰
为了了解结直肠癌中癌- TME的相互作用,作者收集原发肿瘤、表型正常的邻近结肠组织和肝转移瘤。然后对手术样本进行单细胞转录组分析(scRNA-seq)和类器官培养并行处理(图1A)。总的来说,作者收集了16例不同肿瘤级别、分期和CMS类型的患者的肿瘤(图1B - d)。这些肿瘤中大多数(14/16)为微卫星稳定性(MSS),其中2例为微卫星不稳定性(MSI)(图1B)。来自肿瘤(类肿瘤)和邻近正常上皮(结肠腺)的类器官培养至少2个月,维持4-6代,然后使用类似于原发组织的方法和试剂进行scRNA测序(图1A, C, D)。作者从原发肿瘤中捕获了总共38,063个细胞,从正常邻近组织中捕获了11,221个细胞,从4个转移灶中捕获了5906个细胞。体外培养的正常类器官和类肿瘤细胞分别为24,156/20,855。基于scRNA-seq图谱的细胞类型分配表明,正如预期的那样,原代样品含有TME细胞(非上皮细胞),而类器官/类肿瘤培养仅由上皮细胞/癌细胞组成(图1E)。为了开始了解结直肠癌中肿瘤-TME的相互作用,作者初步评估了TME的组成。原发肿瘤包含多种细胞类型,包括免疫成分(巨噬细胞、树突状细胞、t细胞、B细胞、浆细胞和肥大细胞),以及非免疫细胞类型,包括内皮细胞、成纤维细胞和肌成纤维细胞,在患者中出现频率不同(图2A、B)。肿瘤上皮细胞群中的几个小簇表明,不同患者的癌细胞表达模式不同,可能反映了不同的突变景观。免疫细胞,尤其是巨噬细胞、T细胞和血浆/B细胞,在大多数患者中存在高丰度(图2B)。为了从空间上理解上皮微环境的相互作用,作者还使用CODEX (CO-Detection by indEXing)空间蛋白质组学在组织学切片中生成了细胞类型注释(图2C, D)。不出所料,CODEX分析显示,在正常邻近结肠和肿瘤切片中,上皮(或癌)细胞最有可能进行同型接触。然而,与正常细胞相比,癌细胞与来自微环境的细胞相互作用的倾向更高,这可能是由于正常组织结构的破坏以及基质和免疫成分的肿瘤浸润(图2D)。为了全局绘制这些不同细胞类型之间的分子互扰,作者进行了细胞-细胞通信分析(见方法),揭示了癌细胞与其微环境内细胞之间广泛的潜在受体-配体相互作用(图2E, F)。
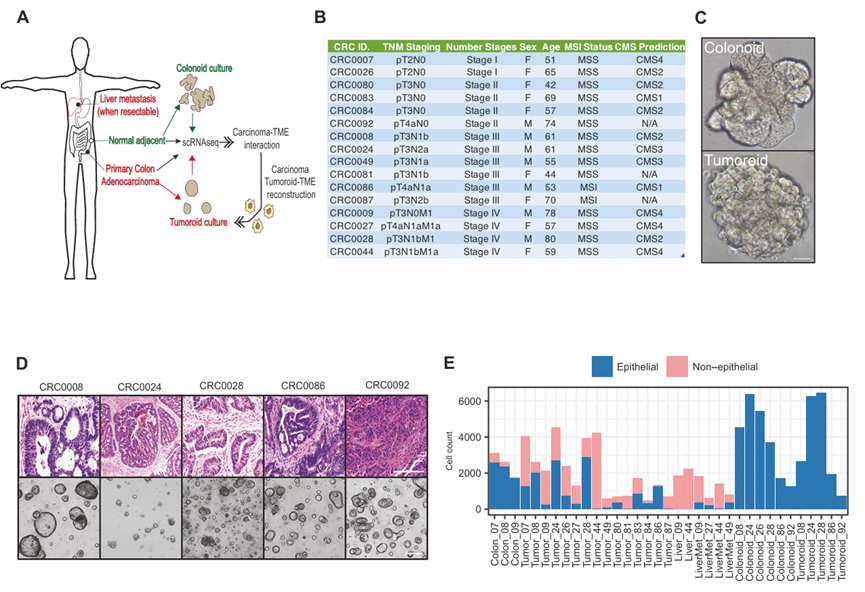
图1、实验设计概述:建立肿瘤类器官和单细胞转录组数据集
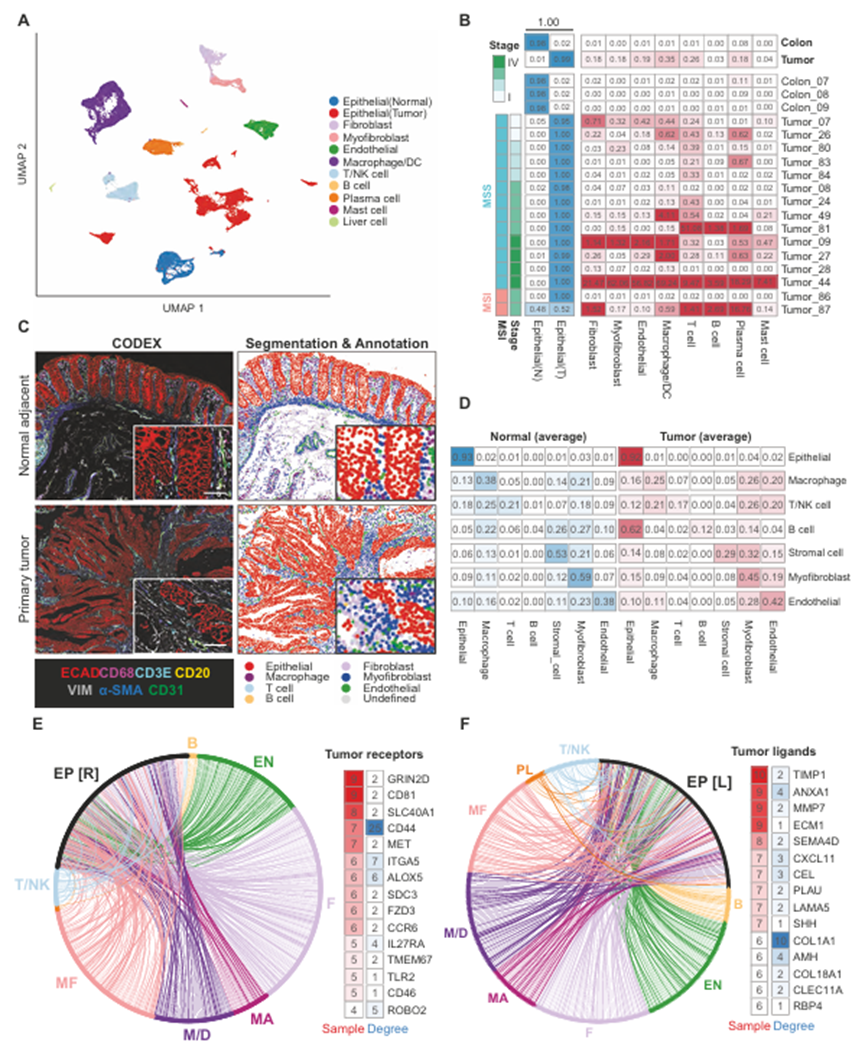
图2、在人类结直肠癌中定位癌-TME相互作用
2、类肿瘤培养改变细胞类型分布,抑制与上皮免疫串扰相关的基因表达程序
接下来,作者试图了解将癌细胞从体内肿瘤环境中移除并引入三维类器官培养如何改变其基因表达程序,特别是与TME通信相关的基因表达程序。作者最初专注于了解来自原代组织和长期类器官培养的上皮/癌细胞的特性。基于umap的单细胞转录组可视化和Pearson相关性不仅揭示了正常上皮细胞和癌细胞之间的差异,还揭示了原代细胞和培养细胞之间的差异(图3A, B)。在原发结肠和结肠腺样本中,患者正常上皮样本之间的转录特征有更多的一致性,而肿瘤/类肿瘤样本之间的一致性较少(图3B)。引人注目的是,类肿瘤细胞和结肠腺细胞的平均转录组彼此之间的相似性要大于它们在体内的同类细胞(图3B)。为了解释这一现象,作者检查了样本内的异质性,结果显示,当癌细胞从原发肿瘤中移除并维持在类肿瘤培养物中时,多样性会减少(图3C)。然后,作者检查了四种样本类型(原发性结肠、类器官、原发性肿瘤、类肿瘤)中转录特性更类似于隐底柱状干细胞(SC)、转运扩增祖细胞(TA)或成熟吸收性结肠炎细胞(CC)的细胞比例(图3D)。正如预期的那样,作者发现,相对于正常结肠炎,原发性正常邻近结肠中富集了分化的结肠炎细胞。它们有更多的干细胞和转运扩增种群。有趣的是,相对于它们在体内的同类,类肿瘤也会向干细胞和转运扩增的身份转变(图3D)。这些观察结果可能是由于营养和生态位细胞因子充满的培养条件驱动了干细胞相对于体内环境的自我更新和增殖。聚焦于癌细胞,作者发现,与原发癌细胞相比,在类肿瘤培养细胞中,被抑制的基因数量多于被激活的基因数量(图3E),以及在结肠腺培养细胞中,与正常邻近上皮细胞相比,被抑制的基因数量更多(图4C)。对这些下调基因的途径分析表明,类肿瘤/结肠腺培养细胞主要抑制参与与免疫系统沟通的基因表达程序。特别是那些与白细胞迁移和炎症有关的(图3F)。这一发现与这些长期培养中免疫细胞的缺失是一致的(图1D)。作者以正常邻近结肠和结肠体作为对照基线,比较了基因在体外和体内的log2倍表达变化,发现许多在体内癌细胞中上调的基因在体外也上调。然而,类肿瘤和结肠体在体外的差异远小于在体内的差异(拟合线性系数= 0.31 < 1,图3G),表明在培养中肿瘤特异性基因表达程序总体上受到抑制。有趣的是,作者发现受体和配体表达的抑制大于平均水平(p值= 0.024),这表明在进入类器官培养系统时,与细胞-细胞通信相关的基因程序受到了显著影响(图3G)。相反,与细胞分裂、模式和代谢相关的基因表达程序在培养中相对于体内组织通常被激活。这与在培养中观察到的干细胞和祖细胞状态的转变,以及从最终分化的吸收状态的转变是一致的(图3D, F)。尽管在体外培养中细胞类型分布的平衡发生了这些变化,但类肿瘤和结肠腺保留了在体内环境中观察到的上皮细胞类型和细胞类型身份的多样性,这表明培养本身并不改变上皮细胞身份。
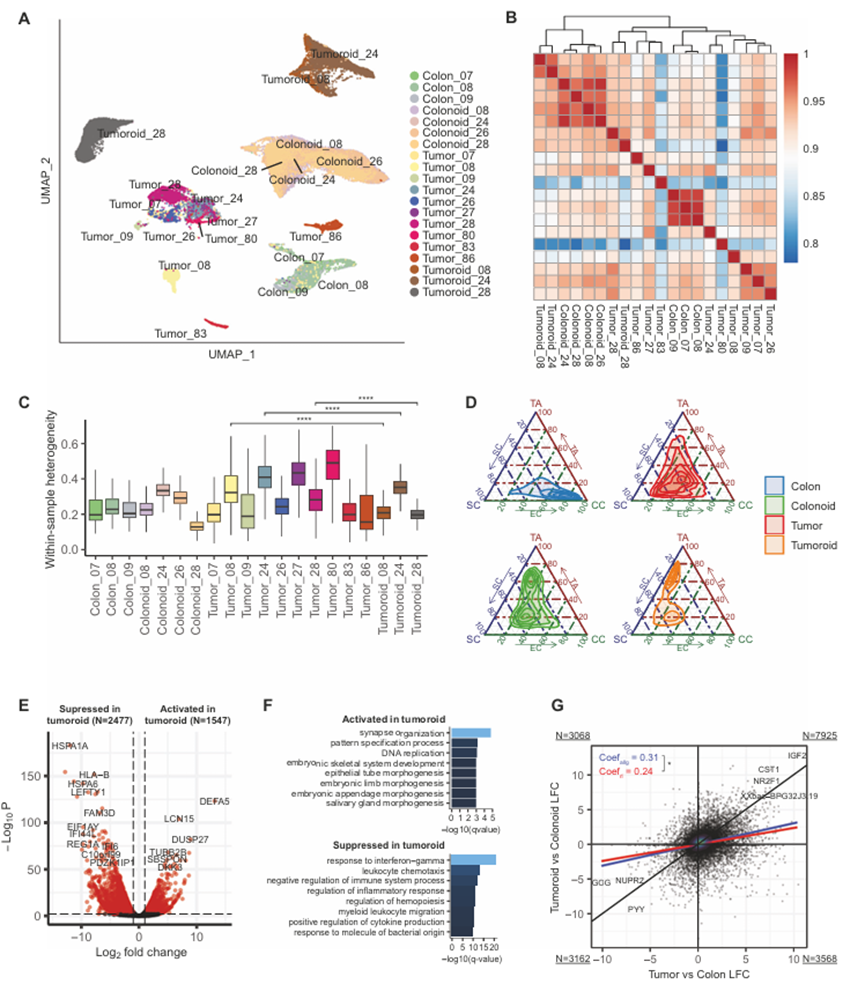
图3、对类器官培养的适应抑制了参与癌- TME通讯的基因表达程序
3、绘制细胞外基质相互作用及其在体内和体外的变化
除了免疫系统之外,TME的另一个关键组成部分是细胞外基质(ECM)。在图3所描述的肿瘤与类肿瘤的比较中,作者发现与ECM组织相关的基因本体(GO)在类肿瘤癌细胞中相对于体内癌细胞显著下调(调整后的p值= 3.5e−08)。肿瘤与结肠、类肿瘤与结肠之间的分析表明,与正常上皮细胞相比,与ECM组织相关的基因在癌细胞中高度上调(补充图6A, B)。在比较类肿瘤和结肠瘤时,与ECM重塑相关的差异表达基因(DEGs)相对较少,这表明与细胞外基质串扰相关的基因表达差异的主要驱动因素是体内和体外状态之间的差异,可能是由于从内源性ECM到基质的转。为了更详细地了解癌细胞和正常上皮细胞之间以及体内和体外环境之间ECM细胞相互作用的差异,作者基于matrixDB的ECM网络数据库进行了网络分析,该数据库从matrietr软件包中获得。作者计算了体内癌细胞或类肿瘤细胞之间的两两基因表达相关性,并将相关性绘制为ECM网络上的边缘颜色。与类肿瘤细胞相比,体内肿瘤细胞中ECM基因之间的总体相关性更高。与GO分析一致,ECM网络中多个基因的表达差异,包括胶原(COL1A1, COL1A2, COL3A1, COL4A1),纤维连接蛋白(FN1), Lumican (LUM)和骨连接蛋白(SPARC),在体内与在体外相比具有高度显著性。成纤维细胞,包括肌成纤维细胞,是ECM的主要生产者,它们在肿瘤样本中富集(图2B)。重要的是,除了这些人群的比例差异外,作者发现与正常成纤维细胞相比,caf中有几个基因上调。这些包括CTHRC1、INHBA、BGN和PDPN,所有这些已知都能促进肿瘤进展。
4、相关的人肿瘤、类肿瘤和小鼠CRC模型
考虑到TME,特别是免疫系统在结直肠癌发生和发展中的重要性,作者想知道在免疫系统完整的小鼠中,相对于常见的结直肠癌体内模型,人类类肿瘤模型在多大程度上代表了人类原发肿瘤。为此,作者询问各种小鼠CRC模型相对于人类类肿瘤模型如何很好地概括人类原发肿瘤。作者建立了家族性腺瘤性息肉病的Apcmin模型,炎症驱动型结直肠癌的AOM-DSS模型,以及内窥镜引导下将具有致癌性Apc、Trp53、Kras和Smad4 (APKS)突变的CRISPR/ cas9工程类肿瘤原位植入同基因小鼠结肠黏膜产生的侵袭性、转移性结直肠癌模型。与人类原发肿瘤一样,作者观察到在所有三种小鼠模型中,癌细胞群向干细胞样状态转移。然而,与人类不同,作者在小鼠肿瘤中没有观察到显著的群体向增殖瞬时扩增细胞状态转移。值得注意的是,尽管在培养中缺乏TME,但相对于小鼠模型,人类类肿瘤特异性转录组与人类原发性肿瘤特异性转录组的相关性更好。综上所述,这些发现表明,长期肿瘤类器官培养的主要影响是缺失了与肿瘤微环境细胞交流的基因表达程序。并且人类类器官模型可能在建模CRC方面提供了通常使用的免疫能力强的小鼠模型所没有的优势。
5、人类肿瘤富含致瘤性巨噬细胞状态,而缺乏抗原呈递和促炎性巨噬细胞状态
最近,一些研究已经开始阐明骨髓细胞,特别是巨噬细胞在人类结直肠癌肿瘤微环境中的身份和功能。肿瘤相关巨噬细胞(TAM)与免疫抑制有关,在某些肿瘤类型中,巨噬细胞消耗可以增强肿瘤对免疫检查点阻断的反应。TAMs表现出独特的转录基因表达程序,认为主要受TME的影响(例如,营养可利用性、缺氧、纤维化基质、CAFs和其他免疫细胞类型)。作者最初在体内来源的单细胞转录组数据中检查了髓系群体的身份和分布(图4A, B)。作者发现了大量巨噬细胞,包括与肿瘤(原发性或肝脏转移)或正常邻近组织(正常结肠或肝脏)相关的巨噬细胞。作者还发现了许多其他的髓样树突状细胞(DC)类型,包括效应T细胞运输和过继T细胞治疗所需的BATF3+ DC,引发细胞毒性T细胞反应的CD1c+ DC,肿瘤相关的LAMP3 + DC和LILRA4+浆细胞样树突状细胞。接下来,作者试图描述存在的主要巨噬细胞亚群。通过聚类和差异表达分析(见方法),作者确定了三个主要人群:IL1B+状态,SPP1+状态和C1QC+状态(图4C)。这些状态以基因群的共表达为特征,并以标志基因IL1B、SPP1和C1QC的表达命名。通过检查巨噬细胞中这些状态在不同样本类型中的分布,发现C1QC+状态在正常邻近结肠组织中最为普遍,在那里它与抗原呈递和适应性免疫反应的调节有关(图4D-F)。IL1B+状态在正常肝组织中最为普遍,并以炎症反应特征为特征(图4D-F)。IL1B+状态在正常肝组织中最为普遍,并以炎症反应特征为特征(图4D-F)。相比之下,SPP1+状态在肿瘤中相对于其他状态更为普遍,无论是原发性肿瘤与正常结肠、肝转移与正常肝脏、晚期肿瘤与早期肿瘤(图4F)。作者预测在这些状态下癌细胞和巨噬细胞之间广泛的受体-配体相互作用。SPP1+状态的特征是糖酵解基因表达程序、对氧水平的反应以及与ECM组织相关的基因表达程序(图4E)。重要的是,SPP1+巨噬细胞先前与适应性免疫反应的抑制有关,因此被认为是一种促肿瘤状态。与此一致,作者在微卫星稳定(MSS)肿瘤中发现了丰富的SPP1+巨噬细胞,相对于高突变的微卫星不稳定(MSI)肿瘤,通常被认为更具免疫抑制性,其中巨噬细胞优先处于炎性IL1B状态(图4G)。先前的研究表明,巨噬细胞向SPP1+状态的极化是TME特性的结果,包括氧张力、FAP+癌症相关成纤维细胞的存在和ECM组成,这与作者的途径分析一致(图4E)。有趣的是,SPP1本身编码骨桥蛋白,骨桥蛋白是一种分泌的ECM成分和CD44的配体,已知具有促肿瘤和免疫抑制活性。在TCGA数据集(COAD和READ)中检测SPP1及其受体CD44的表达显示,相对于正常组织,该受体-配体对在肿瘤中一致上调,而C1QC在TCGA肿瘤中的表达显著降低。与这些报道的SPP1和巨噬细胞在SPP1+状态下的功能一致,通过SPP1特征富集对结直肠癌TCGA转录组进行分层显示,当肿瘤具有高SPP1特征时,患者生存率显著降低(图4H)。鉴于这些结论主要来自单细胞转录组学分析,作者使用CODEX在肿瘤和正常邻近组织的组织学切片中寻找支持的空间证据。作者观察到,存在于组织学正常的结肠上皮中的巨噬细胞更可能是HLA-DQA1+ (C1QC+状态的代理标记物),而存在于肿瘤组织中的巨噬细胞更可能是SPP1+(图4I-K)。此外,单分子荧光原位杂交证实了SPP1在结直肠癌组织中肿瘤相关巨噬细胞中的表达(图4L)。总之,这些数据表明,肿瘤相关巨噬细胞主要处于SPP1+免疫抑制状态(特别是在MSS肿瘤中),肿瘤抑制促炎和抗原呈递状态。
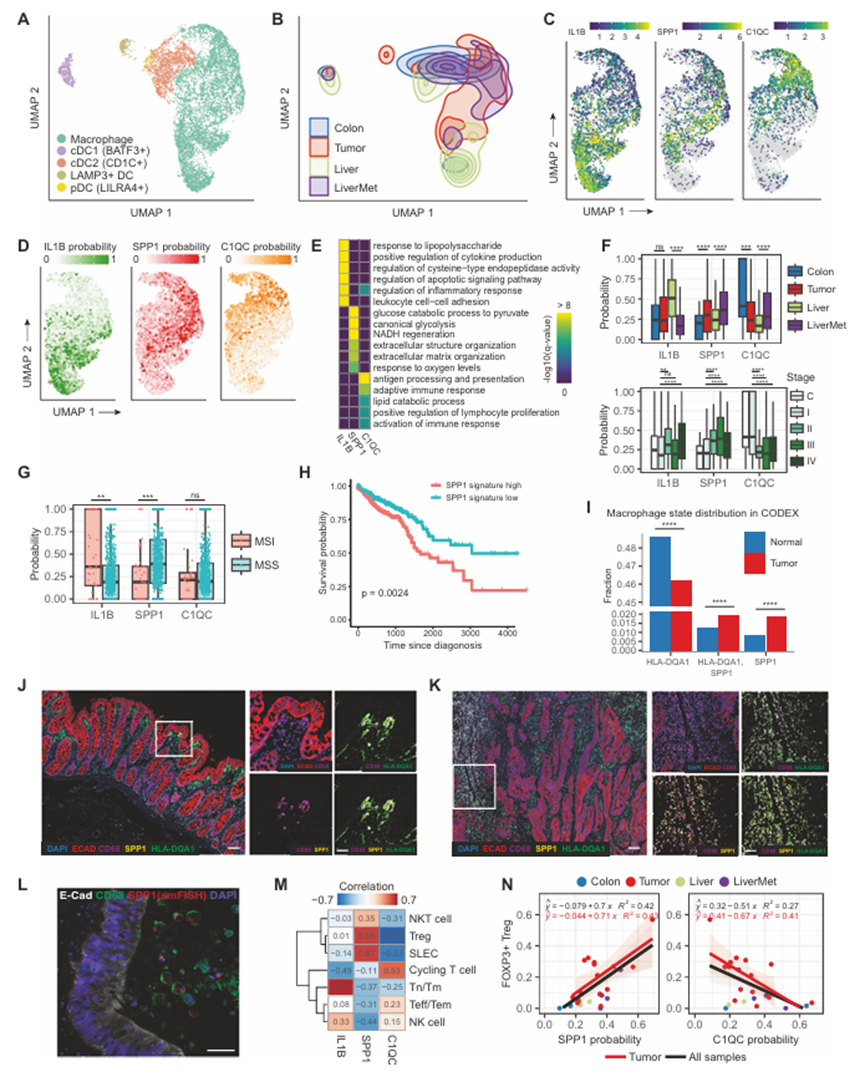
图4、人结直肠癌中的骨髓细胞和巨噬细胞状态
6、适应性免疫细胞及其与巨噬细胞状态的关系
适应性免疫细胞是肿瘤微环境的重要组成部分,人们对了解肿瘤和TME如何促进“冷”肿瘤的免疫抑制非常感兴趣。因此,作者在数据集中检查了T细胞和B细胞谱系。作者鉴定了主要的T/NK细胞亚群,包括幼稚T细胞或记忆T细胞(Tn/Tm, CCR7 +),调节性T细胞(Tregs, FOXP3 +),效应T细胞或效应记忆T细胞(Teff/Tem, GZMA/GZMB +),短寿命效应细胞(SLEC, KLRG1 +), NKT细胞(CD3 + NKG7 +)以及循环T细胞(MKI67 +), T-癌细胞双细胞簇和NK细胞。这些T/NK细胞亚群的分布因样本类型和肿瘤分期而异,肿瘤和肝转移样本显示出一些共性,尽管解剖位置不同。具体来说,作者观察到肿瘤组织中Tregs、Teff/Tem的富集,以及Tn/Tm和NK细胞相对于正常结肠/肝脏的减少。在晚期患者中,Tregs的比例也呈上升趋势,Teff/Tem群体减少,表明免疫抑制环境更加明显。对于几乎所有的T细胞亚群,基于一组已知的T细胞衰竭标志物计算的衰竭评分,当比较TME中的T细胞与邻近正常组织中的T细胞时,显示出显著的升高。最后,作者通过观察每个样本中处于不同状态的T细胞比例与巨噬细胞中IL1B/SPP1/C1QC平均状态概率之间的相关性,观察巨噬细胞状态与T细胞状态之间是否存在关联。如图4M、N所示,IL1B+炎性巨噬细胞状态与Tn/Tm和NK细胞比例高度相关。相反,SPP1+状态与Treg、SLEC和NKT细胞比例呈正相关,与Tn/Tm、Teff/Tem、NK细胞和循环T细胞比例负相关,与SPP1+巨噬细胞和骨桥蛋白本身在肿瘤免疫抑制中的作用一致。C1QC+状态概率几乎呈现相反的趋势。如果仅将肿瘤样本纳入分析,这一趋势更为显著(图4N)。这些观察结果与作者的研究以及更广泛的文献中的观察结果一致,即SPP1+巨噬细胞状态指示免疫抑制性TME。这进一步表明T细胞和巨噬细胞状态是高度协调的,可能是由于两种细胞类型之间的串扰。对B/浆细胞亚群进行了一组类似的分析。作者鉴定出naïve B细胞、循环/分化B/浆细胞和表达不同抗体的浆细胞亚群。在正常结肠中,B细胞主要以表达igha1的浆细胞的形式存在,参与维持肠道免疫。在大多数癌症患者中,存在向表达ighg1的浆细胞的转换。在计算与巨噬细胞状态概率的相关性时,在高SPP1+巨噬细胞特征的样本中观察到B细胞增殖和分化受到抑制(Pearson相关性= - 0.37),而在高C1QC+状态的样本中观察到相反的趋势(Pearson相关性= 0.47),这可能表明这些巨噬细胞在肿瘤TME中起着不同的作用。
7、结直肠癌小鼠模型概括了人类肿瘤中巨噬细胞状态的分布
最终,这些在人体组织中的分析为结直肠癌的肿瘤-免疫TME相互作用提供了有价值的见解,但是在人体系统中进行功能实验的平台严重有限,小鼠模型仍然是进行针对肿瘤-TME相互作用的功能分析的主要平台。因此,作者回到前面介绍的三种广泛应用的结直肠癌小鼠模型——家族性腺瘤性息肉病的Apcmin/+模型,炎症驱动的结直肠癌的AOM-DSS模型,以及内镜引导下原位植入的转移性结直肠癌的APKS类肿瘤模型(图5A)。与人类相似,这些小鼠模型显示出与正常小鼠结肠相似的TME组成,具有显著的髓系细胞浸润(图5A, B)。绘制小鼠模型中预测的受体-配体相互作用,并将这些相互作用与人类观察到的相互作用进行交叉对照,显示小鼠肿瘤仅捕获了人类中发现的约一半的受体和配体(图5C, D)。这可能与小鼠模型中相对于人类类肿瘤的DEG恢复的限制有关,与原发人类肿瘤相比。然而,尽管存在这种明显的局限性,但对小鼠巨噬细胞中人类组织中发现的状态的存在和分布的检查显示,IL1B +、SPP1 +和C1QC+状态都可以很容易地识别出来(图5E)。与人体组织一致,与正常结肠相比,三种小鼠肿瘤模型中SPP1+状态均丰富,C1QC+状态均受到抑制(图5F)。因此,虽然这些小鼠肿瘤模型并不能完全反映作者在人类中观察到的细胞类型分布和假定的癌- TME通讯,但它们似乎在很大程度上概括了与恶性肿瘤相关的巨噬细胞状态变化。
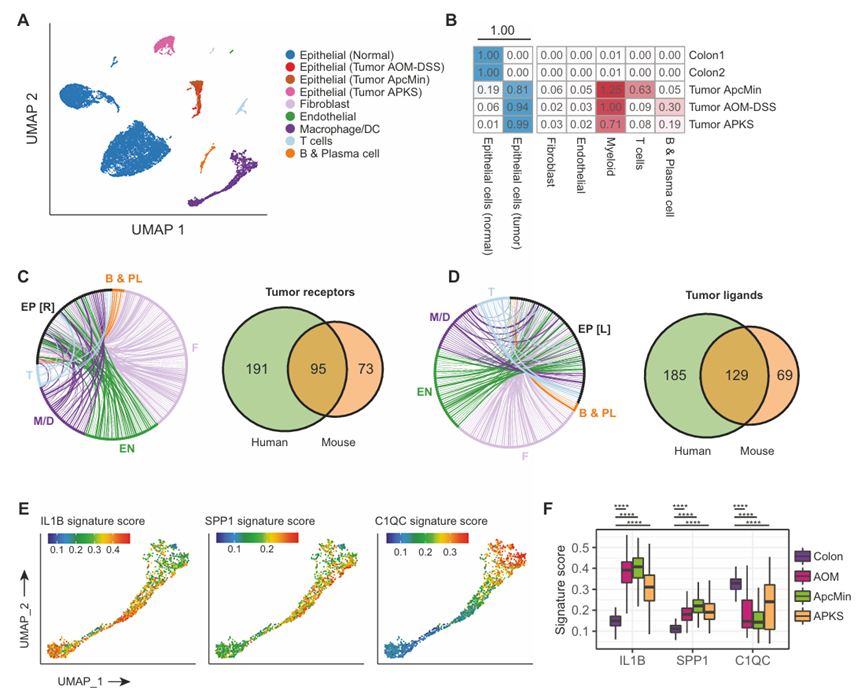
图5、小鼠结直肠癌模型再现了人类肿瘤相关巨噬细胞状态
8、癌细胞指示巨噬细胞进入致瘤前免疫抑制状态
TME与肿瘤内巨噬细胞极化有关,然而,癌细胞本身直接影响巨噬细胞身份的程度在很大程度上仍未被探索,特别是在结直肠癌中。因此,作者开始通过利用类肿瘤模型系统来解决癌细胞影响巨噬细胞极化的程度,该系统不含TME成分,并且缺乏TME串扰背后的基因表达程序。为此,作者通过人M-CSF刺激在体外产生人单核细胞来源的巨噬细胞,然后将这些巨噬细胞引入正常的类器官或类肿瘤培养物中,随后对培养物中的巨噬细胞和上皮成分进行单细胞转录组学分析(图6A)。作者观察到巨噬细胞向SPP1+状态的明显转变(图6B, C),这种转变在与来自5个不同患者的类肿瘤共培养的巨噬细胞中一致出现(图6C)。在一些患者来源的培养物中,IL1B+状态也适度诱导,同时抑制C1QC+状态,这在很大程度上反映了图4中观察到的肿瘤组织与正常相邻组织的体内状态(图6C)。有趣的是,患者28的癌细胞对巨噬细胞的存在没有反应,这表明可能延长培养时间可能导致对TAM的存在作出反应的转录程序的表观遗传抑制,和/或在这种类肿瘤系中骨桥蛋白受体CD44的低水平(图6B, D)。来自患者86和92的类肿瘤培养物对巨噬细胞的存在有反应,并且相对于来自患者28的无反应的癌细胞表达更高水平的CD44(图6C-E)。作者观察到巨噬细胞与类肿瘤共培养足以诱导巨噬细胞极化进入SPP1+状态,这引发了几个问题。TME的其他各个方面都与巨噬细胞极化有关,包括癌症相关成纤维细胞(CAFs)的存在,而癌细胞与CAFs在巨噬细胞中引发这种反应的相对贡献尚不清楚,癌细胞引发SPP1+极化反应的机制也不清楚。为了解决这些问题,作者对巨噬细胞单独进行了额外的共培养实验,巨噬细胞与类器官/类肿瘤共培养,与CAFs共培养,与CAFs和类器官/类肿瘤共培养,或与类器官/类肿瘤条件培养基共培养,然后进行单细胞转录组分析。在这里,作者使用患者8和24的类肿瘤和正常邻近类器官,观察到相对于癌细胞,CAFs诱导SPP1+巨噬细胞极化的能力有限,并且癌细胞和CAFs的存在都会引发最强的SPP1+巨噬细胞极化。有趣的是,将类肿瘤/类器官条件培养基应用于巨噬细胞培养并不足以诱导SPP1极化,而是诱导其向C1QC+免疫原状态极化,这表明SPP1极化需要巨噬细胞与上皮细胞直接接触。将巨噬细胞暴露于癌细胞培养(含或不含CAFs)的最明显结果是向SPP1+状态极化。SPP1基因产物骨桥蛋白是一种具有多效信号功能的细胞外基质蛋白。虽然TAM产生的骨桥蛋白有助于减弱对癌症的适应性免疫反应,但它具有广泛的癌细胞自主功能,包括促进上皮-间质转化(EMT),这与其与CD44和整合素αvβ3相互作用下游的癌症干细胞特性和转移倾向增加有关。因此,作者研究了癌细胞对共培养中巨噬细胞的反应性质。巨噬细胞的引入导致患者源性类肿瘤和正常邻近类器官中不同程度的差异基因表达,有趣的是,通常与癌细胞的细胞周期减少有关,但与巨噬细胞周期增加有关(图6F)。与巨噬细胞共培养后,类肿瘤和类器官中EMT特征基因表达增加(图6G),患者86和92中间充质标志物Vimentin上调(图6H)。这一发现与癌症诱导的巨噬细胞SPP1促进EMT的模型一致,可能为先前观察到的SPP1表达与结直肠癌转移之间的联系提供了机制基础。最后,作者询问巨噬细胞引入类肿瘤培养物在多大程度上再现了体内观察到的巨噬细胞-癌受体-配体串扰。将体外受体-配体相互作用叠加在体内癌细胞和巨噬细胞之间的完整相互作用组上(图6I),表明这些相互作用的一个子集在培养中重新建立(图6I),包括SPP1-CD44相互作用等。这种预测的SPP1-CD44相互作用通过近端结扎实验在类肿瘤-巨噬细胞共培养中得到了验证(图6J)。综上所述,本研究表明,人肿瘤源性类器官培养在体内抑制癌细胞与TME之间串扰的转录程序。然而,这一明显的局限性也为特异性肿瘤- TME相互作用的重点重建提供了机会,使这些相互作用在体内高度复杂的系统中进行功能评估的简化方法成为可能
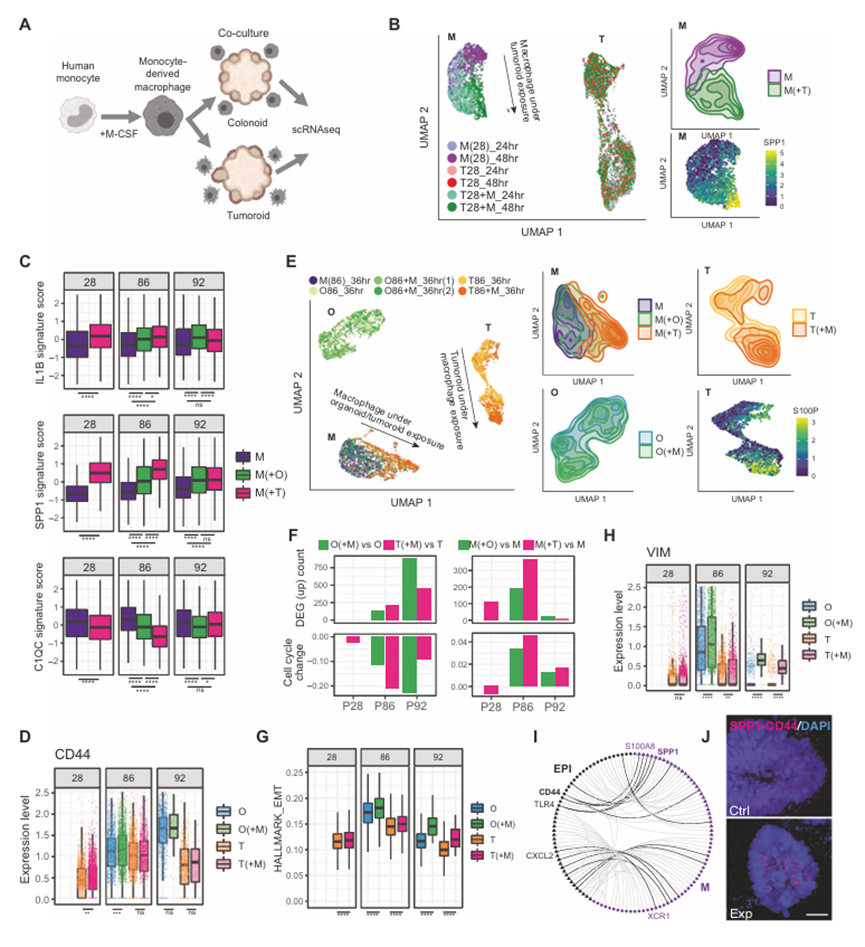
图6、在类肿瘤培养中重建癌-巨噬细胞相互作用
结论
本研究揭示了人类患者源性肿瘤类器官培养系统的缺点和优点,为利用这些系统进行结直肠癌研究和治疗开发提供了一个框架。
实验方法
单细胞测序、类器官培养、单分子荧光原位杂交。CODEX染色
参考文献
Li N, Zhu Q, Tian Y, Ahn KJ, Wang X, Cramer Z, Jou J, Folkert IW, Yu P, Adams-Tzivelekidis S, Sehgal P, Mahmoud NN, Aarons CB, Roses RE, Thomas-Tikhonenko A, Furth EE, Stanger BZ, Rustgi A, Haldar M, Katona BW, Tan K, Lengner CJ. Mapping and modeling human colorectal carcinoma interactions with the tumor microenvironment. Nat Commun. 2023 Nov 30;14(1):7915. doi: 10.1038/s41467-023-43746-6. PMID: 38036590; PMCID: PMC10689473.






