骨髓间充质干细胞衍生的含Dermcidin的迁移体增强肺巨噬细胞与LC3相关的吞噬功能,并预防中风后肺炎
肺炎是急性缺血性卒中(AIS)患者的主要死亡原因之一。抗生素虽然抑制感染,但由于对免疫系统的不良影响,未能改善卒中后肺炎患者的预后。目前的研究报道骨髓间充质干细胞(BM-MSC)下调卒中小鼠模型肺部的细菌负荷。对BM-MSC治疗的卒中模型进行的肺RNA测序表明,脑缺血后BM-MSC调节肺巨噬细胞的活性。机制上,BM-MSC通过释放迁移体促进肺巨噬细胞对细菌的吞噬作用。研究结果表明,BM-MSC具有抗感染和免疫调节的双重功能,是治疗卒中后肺炎的有效药物。该研究于2023年8月发表在《Advanced Science》,IF:15.1。
技术路线:
主要研究结果:
1. 骨髓间充质干细胞移植预防急性缺血性卒中和预防卒中后肺炎
成功分离人BM-MSC。为比较对AIS和卒中后肺炎的治疗效果,野生型(WT)雄性C57/Bl6小鼠接受60分钟短暂大脑中动脉闭塞(tMCAO),然后在再灌注后2小时接受BM-MS或广谱抗生素恩诺沙星(每日腹腔注射20 mg / kg)治疗(图1A)。与之前的报道一致,BM-MSC移植提高卒中后1 ~ 14日的生存率(图1B)。BM-MSC受者的神经功能缺损评分降低(图1C),梗死体积减小(图1D)。通过BM-MSC移植,神经元存活在两个3d(短期,图1E)和14d(长期,图1F)。此外,在tMCAO模型的纹状体(STR)和皮质(CTX)的MBP染色显示,BM-MSC保护白质的完整性(图1G,H)。因此,BM-MSC治疗的卒中模型显示,在tMCAO后3-14 d,通过滚筒试验(图1I)、粘连清除试验(图1J)和足部故障试验(图1K)评估的感觉运动功能改善。然而,与PBS处理的对照相比,抗生素治疗小鼠的卒中结局未显示显著改善(图1B-K)。为分析卒中小鼠的细菌感染情况,在tMCAO后3d分离支气管肺泡灌洗液(BALF)并进行细菌培养(图1L)。tMCAO后小鼠肺部感染普遍存在。预防性抗生素治疗限制了肺组织中的细菌生长(图1L)。同时,非特异性检测细菌存在的肺组织16S rRNA定量(图1M)和BALF中脂多糖(LPS)水平(图1N)表明,在抗生素治疗的小鼠中,细菌载量下降(图1L-N)。有趣的是,BM-MSC受体与抗生素治疗的小鼠在细菌感染方面表现出相似的局限性(图1L-N)。然而,尽管抗生素具有抗菌作用,但HE染色显示,恩诺沙星处理的小鼠出现了严重的肺部炎症,这与PBS处理的对照组相似(图1O)。需要注意的是,BM-MSC移植组的肺组织显示出有限的免疫细胞浸润和保留肺组织完整性(图1O)。结果表明,BMMSC对卒中后肺炎具有双重保护作用,即抑制细菌生长和促进肺部炎症消退。
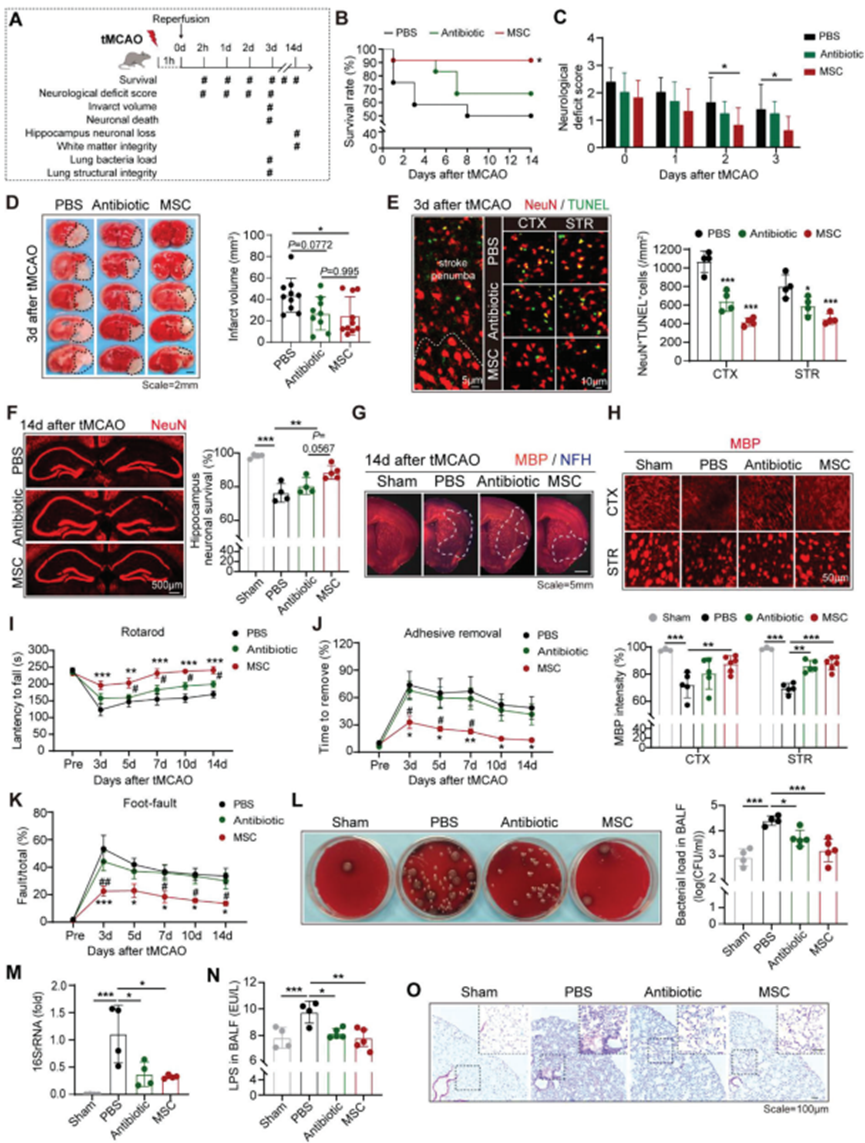
图1. BM-MSC移植可预防AIS并预防卒中后肺炎
2. BM-MSC转移通过巨噬细胞依赖的方式预防卒中后肺炎
在tMCAO后3d分离脑卒中模型小鼠的肺组织并进行大批量RNA测序(RNA-seq)。分析了PBS、抗生素和BM -MSC治疗的卒中小鼠之间的差异表达基因(DEGs)(图2A)。为探索BM -MSC转移的治疗机制,选择BM-MSC和PBS处理小鼠中上调的DEGs(图2Aa),抗生素和PBS处理小鼠中下调的DEGs(图2Ab),以及BM-MSC和抗生素治疗小鼠中上调的DEGs(图2Ac)的交集(图2B)。在交集的DEGs中发现巨噬细胞的特征基因,包括Ccr2(图2C)。通过Reactome通路分析进一步分析交集的DEGs。结果显示,在BM -MSC治疗的小鼠的肺中,多个抗原呈递相关通路上调(图2D)。免疫组织化学染色(Iba1,绿色)和荧光原位杂交(FISH)技术(EUB338,红色)对tMCAO模型的肺组织进行巨噬细胞标记。发现,BM-MSC治疗增强巨噬细胞对细菌的清除,因为细菌大部分保留在Iba1+细胞内(图2E)。相比之下,在接受抗生素治疗的小鼠中,尽管细菌负荷减少,但残留细菌仍未被巨噬细胞吞噬,这表明巨噬细胞的抗菌功能受到抗生素治疗的影响(图2E)。进一步耗尽循环单核细胞(图2F)和肺驻留巨噬细胞(图2F)联合氯磷酸二钠脂质体(75 mg kg - 1,腹腔注射,tMCAO前3d)(图2F)。值得注意的是,在单核细胞/巨噬细胞清除的小鼠中,BM-MSC未能对脑缺血提供进一步保护(图2G)。此外,BM-MSC的抗菌作用被逆转(图2H,I)。这些数据表明,巨噬细胞的功能在BM-MSC移植对AIS和卒中后肺炎的保护中是必不可少的。
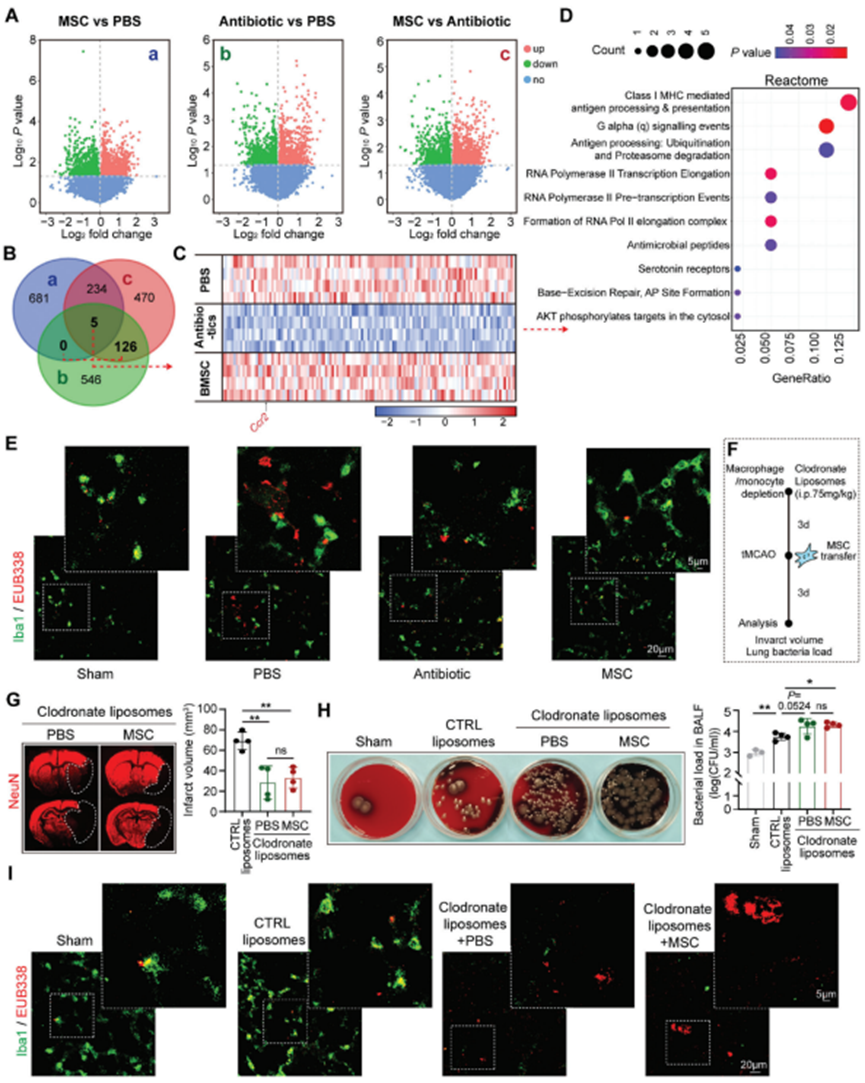
图2. 骨髓间充质干细胞转移促进巨噬细胞的细菌清除
3. BM-MSC通过增强LC3相关的吞噬作用促进巨噬细胞的细菌清除
评估BM-MSC处理后巨噬细胞的功能变化。如细菌16s rRNA的FISH所示,在BM-MSC转移小鼠中,细菌吞噬肺巨噬细胞的效率提高(图2E)。入侵的细菌被巨噬细胞通过LC3相关吞噬作用(LAP)识别和处理通过免疫染色,RUBCN (RUN结构域和含半胱氨酸丰富结构域的Beclin 1相互作用蛋白),LAP的特异性标志物,在BM-MSC受体的肺巨噬细胞中上调(图3A)。相应地,通过trans-well将骨髓来源的巨噬细胞(BMDM)与BM-MSC共培养(图3B)提高了它们对大肠杆菌的清除,而大肠杆菌是导致卒中后肺炎的主要病原体之一(图3C,D)。通过western blot发现BM-MSC共培养上调BMDM中的RUBCN表达,并促进下游与LC3相关的大肠杆菌的消化(图3D)。此外,当用大肠杆菌(e.c oli-BM-MSC)刺激BM-MSC来封闭卒中后肺炎的微环境时,BM-MSC吞噬BMDM的促进作用进一步增强(图3B-D)。在与E. Coli-BM-MSC共培养的小鼠BMDM和人巨噬细胞中,RUBCN显示出与BECN1的活跃组装,表明LAP进展(图3E-G)。敲低Rubcn抑制BMDM的LAP,E. Coli-BM-MSC对BMDM细菌清除的促进作用被消除(图3H,I),说明BM-MSC通过促进LAP增强巨噬细胞的杀菌功能。值得注意的是,恩诺沙星下调BMDM的细菌清除及其RUBCN的表达(图3C-E),这进一步证明与抗生素相比,恩诺沙星对BM-MSC的卒中后肺炎具有更好的保护作用。
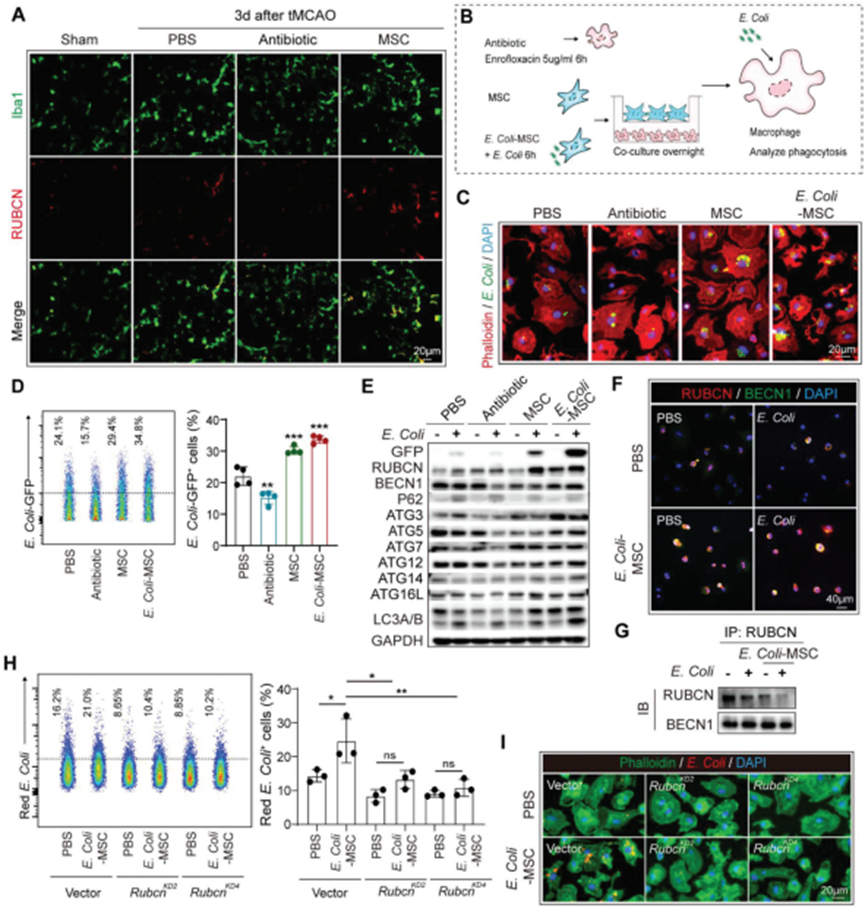
图3. BM-MSC通过增强LC3相关吞噬作用(LAP)促进巨噬细胞的细菌清除
4. BM-MSC通过释放迁移体促进巨噬细胞清除细菌
在共培养系统中,通过插入物将BMMSC与BMDM分离,但不影响它们的非接触交流(图3B)。BM-MSC的条件培养基(CM)或经大肠杆菌预处理的条件培养基(CM)均可增强BMDM对大肠杆菌 (GFP+)的吞噬作用(图4A),表明BM-MSC衍生的分泌因子促进BMDM对细菌的吞噬作用。BM-MSC衍生的CM被进一步分离为可溶性部分和细胞外囊泡(EVs),特别是由大肠杆菌预处理的BM-MSC产生的EVs,增强BMDM对细菌的吞噬(图4B,C)。在体内,BM-MSC注射后仅在肺内短暂停留约24小时(图4C)。BM-MSC在2天内从肺内回缩,而BM-MSC移植的抗菌作用至少在3天内仍然明显(图1I-K)。因此,作者推断是BM-MSC衍生的EVs对巨噬细胞发挥促吞噬作用。在BM-MSC受者的肺中发现了直径为500 ~ 3000 nm的EV富集,这与报告的新发现的迁移体EV的大小一致(图4E,F)。对从BMMSC CM和BM-MSC转移的卒中模型中分离的EVs进行的透射电子显微镜(TEM)分析显示,典型的偏小体形态为结合回缩纤维的大囊泡,并包含小囊泡(图4G,H)。此外,与BPS处理对照相比,BMMSC转移的卒中小鼠(tMCAO后3d)的肺组织的蛋白质印迹分析显示,C3ORF64、PIGK和PGCP的迁移体标志物表达增加,而外泌体标志物包括HSP70和HSP90的水平稳定(图4H)。免疫染色一致地显示,注射后0-3d, tMCAO受体肺内保留BM-MSC (WGA预染色,红色)来源的迁移体 (TSPAN4+,白色)(图4I)。
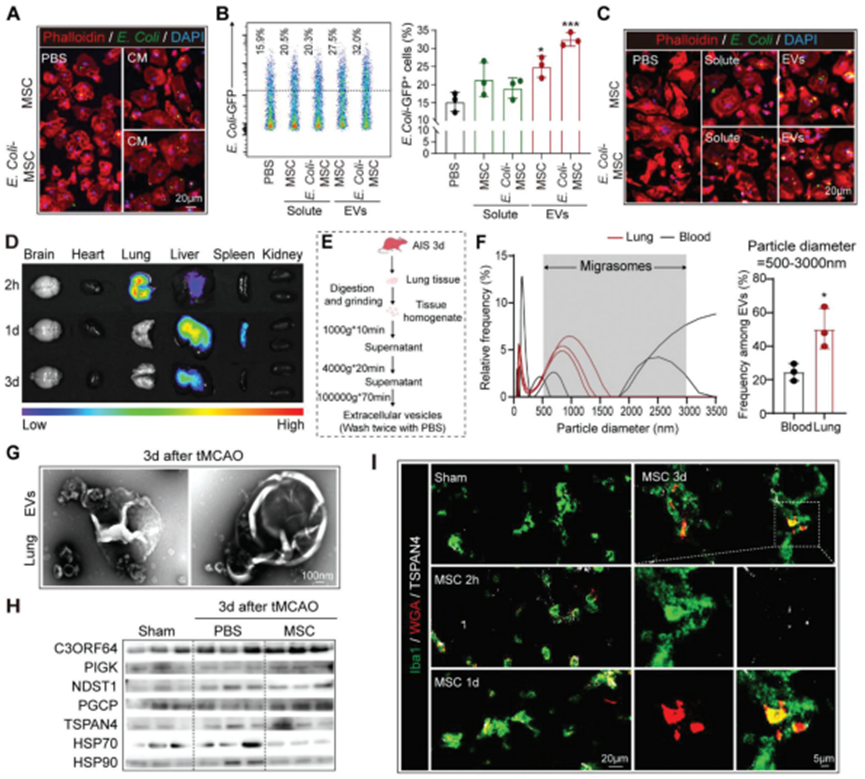
图4. BM-MSC转移通过释放迁移体预防卒中后肺炎
通过流式细胞术(图5A)和免疫染色(图5B)评估发现PBS-M和E. Coli-M均上调BMDM对GFP+ E. Coli的吞噬。为探索迁移体在BM-MSC提供的BMDM细菌清除增强中的必要性,将细胞松弛素D(CytD)应用于BM-MSC以抑制细胞迁移(图5C)。将不含迁移体的CytD处理的BM-MSC (CytD-EV)来源的EVs处理为BMDM。发现,CytD-EV既不能增强BMDM对GFP+大肠杆菌的吞噬作用(图5D-F),也不能上调其RUBCN的表达(图5F)。另一方面,BM-MSC衍生的迁移体的促吞噬作用与BM-MSC衍生的EVs相当(图5A,B)。在本研究中发现,接受迁移体处理的巨噬细胞在细菌清除方面的改善与接受含有迁移体的总EVs处理的巨噬细胞相似(图5A,B),而接受不含迁移体的EVs处理的巨噬细胞的吞噬增强较弱(图5G-I)。在动物实验中,无论是偏侧体还是偏侧体排除的EVs均有效缩小了梗死体积(图5J)。然而,在脑卒中后肺部感染的体内分析中发现,通过迁移体转移的tMCAO模型肺组织中的细菌生长(图5K)、肺组织16S rRNA浓度(图5L)、BALF中的LPS水平(图5M)和肺部炎症(图5N)减少,这与接受BM-MSC治疗的模型相似(图1L - O),并优于通过排除迁移体的EVs转移的模型(图5K - n)。因此,得出结论,BM-MSC通过释放迁移体促进巨噬细胞清除细菌,同时发挥杀菌作用。
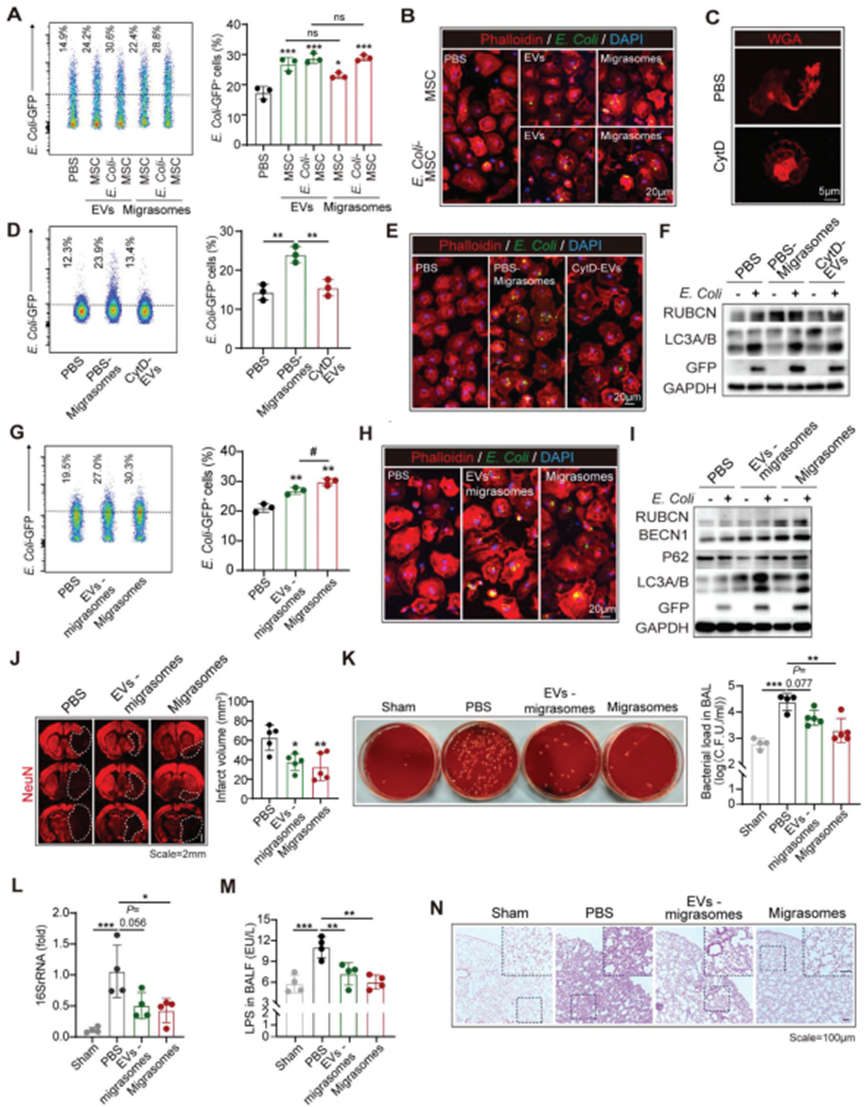
图5. BM-MSC通过释放迁移体促进巨噬细胞清除细菌
5. 皮离蛋白(DCD)被包装在BM-MSC衍生的迁移体中并改善巨噬细胞的细菌清除
分离培养骨髓间充质干细胞(BM-MSC)来源的迁移体,采用液相色谱串联质谱(LCMS/MS)分析迁移体的抗菌分子。在鉴定的成分中,抗菌蛋白皮离蛋白(DCD)值得关注(图6A)。通过免疫染色(图6B)和ELISA(图6C),验证DCD集中于BM-MSC衍生的迁移体。DCD在BM-MSC胞体中的浓度较低(图6B,C)。此外,通过ELISA(图6C)和QPCR(图6D)评估,发现大肠杆菌刺激上调BM-MSC中的DCD表达,这解释了大肠杆菌预处理的BM-MSC共培养和E. Coli对巨噬细胞的超活性作用。用DCD预处理BMDM,进行细菌清除实验。免疫染色表明DCD启动以剂量依赖性方式改善BMDM对大肠杆菌的吞噬或髓鞘碎片的清除(图6E,F),揭示DCD的促清除功能。同时,DCD促进E. Coli吞噬巨噬细胞后的LAP(图6G)。免疫染色评估发现RUBCN和BECN1、GFP+ E. Coli或和LC3A/B的共定位在DCD预处理的BMDM中上调(图6H)。需要注意的是,DCDKD 的BM-MSC来源的迁移体的pro-LAP功能被取消,这表明DCD在BM-MSC来源的迁移体的抗菌作用中不可或缺的作用(图6I,J)。
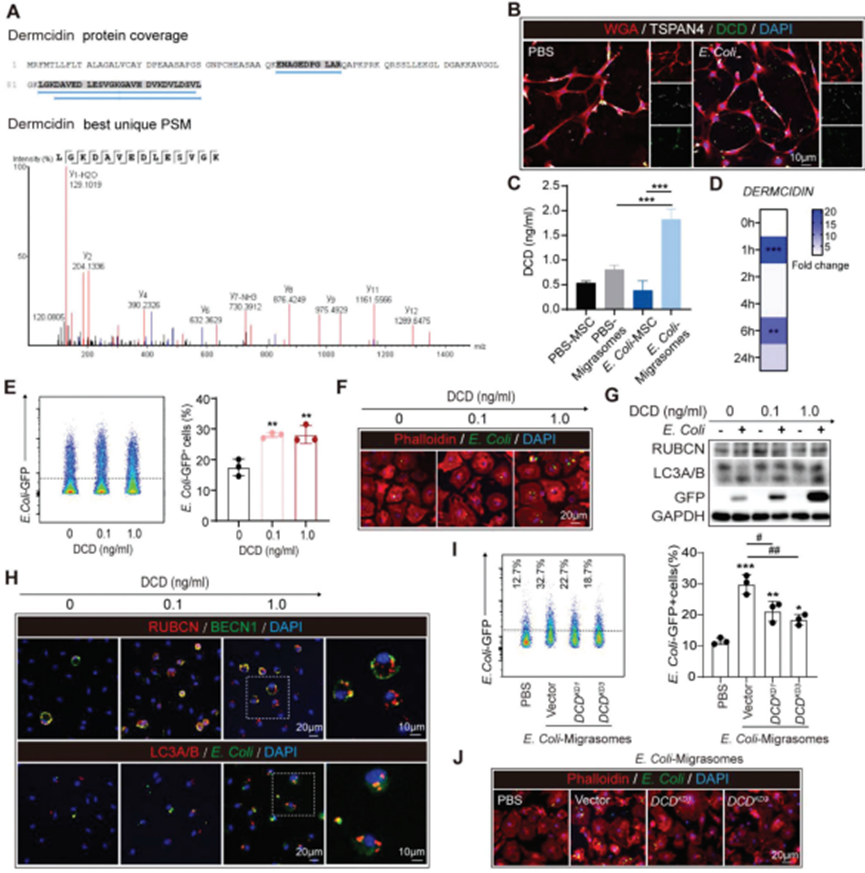
图6. BM-MSC衍生的迁移体含有皮离蛋白(dermcidin, DCD),可提高巨噬细胞的细菌清除
进一步研究DCD和含有DCD的BM-MSC衍生的迁移体的治疗潜力。我们发现,与年龄和性别匹配的健康对照(HC)相比,AIS患者(急性期,发病后0-3d)外周血中的DCD浓度上调(图7A)。有趣的是,外周血DCD水平与患者的梗死体积呈负相关(图7B - d),与δ NIHSS (7d-1d)呈正相关(图7B,E) 说明DCD有利于AIS的恢复。血浆DCD浓度高的AIS患者比DCD水平低的患者有更明显的肺炎发生率(图7F,G)。考虑到DCD和含DCD的巨噬细胞来源的迁移体的抗菌作用(图7H-J),推断DCD对肺炎的抗菌反应至关重要。使用BMDM、DCD和含DCD处理时BM-MSC衍生的迁移体均被BMDM吞噬(图7H)。通过流式细胞术分析(图7I)和免疫染色(图7J),发现与使用DCD蛋白处理的BMDM相比,使用BM-MSC来源的迁移体处理的BMDM显示出更强的细菌清除能力。因此,含有DCD的BM-MSC衍生的迁移体是一种治疗卒中后肺炎的有效疗法,其疗效优于之前所关注的DCD蛋白。
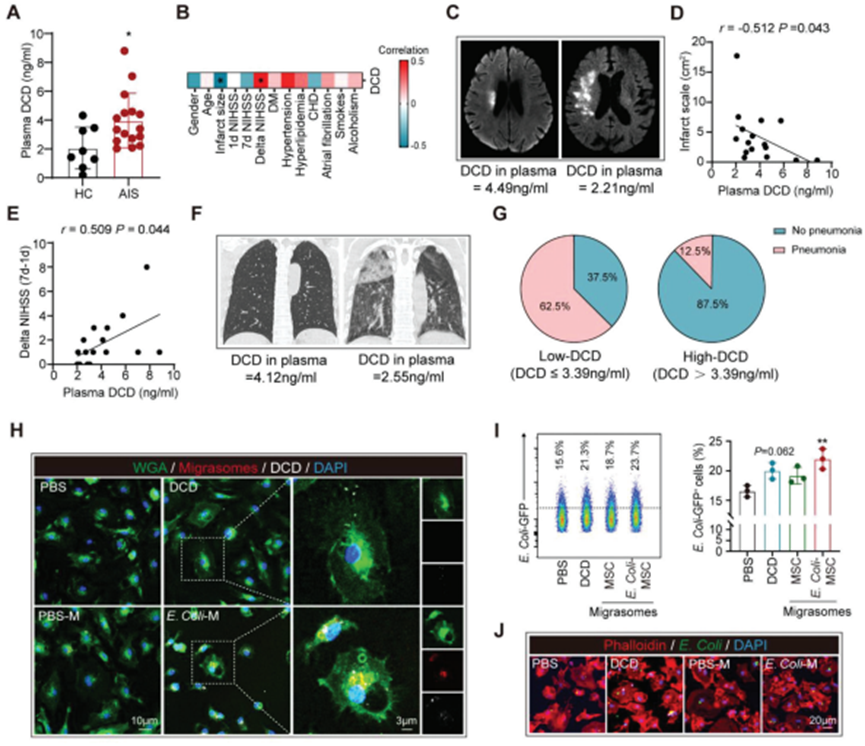
图7. DCD有利于AIS的恢复,含DCD的BM-MSC来源的迁移体可有效促进巨噬细胞的吞噬功能
结论
综上所述,本研究发现BM-MSC移植通过释放含DCD的迁移体,增强肺巨噬细胞的LAP,从而保护卒中后肺炎。BM-MSC不仅具有有效的神经保护作用,还具有抗菌和免疫调节功能,是治疗AIS和卒中后肺炎的潜在治疗方法,远超抗生素。
实验方法
人骨髓间充质干细胞(BM-MSC)的分离鉴定,骨髓间充质干细胞的成骨和成脂分化,急性缺血性脑卒中的小鼠模型,小鼠的BM-MSC移植和药物给药,神经功能评分,行为实验,梗死体积分析,支气管肺泡灌洗液(BALF)收集,原代小鼠骨髓源巨噬细胞(BMDMs)培养,人单核细胞富集和巨噬细胞分化,巨噬细胞耗竭,批量RNA测序和数据分析,组织学分析,FISH,BM-MSC的细胞外囊泡(EVs)和迁移体的分离和鉴定,液相色谱串联质谱(LC-MS/MS)分析,TEM分析,吞噬作用分析,体内MSC示踪实验,慢病毒感染BMDM和BM-MSC,免疫荧光染色,RT-PCR,免疫沉淀,WB,流式细胞分析,ELISA
参考文献
Li T, Su X, Lu P, Kang X, Hu M, Li C, Wang S, Lu D, Shen S, Huang H, Liu Y, Deng X, Cai W, Wei L, Lu Z. Bone Marrow Mesenchymal Stem Cell-Derived Dermcidin-Containing Migrasomes enhance LC3-Associated Phagocytosis of Pulmonary Macrophages and Protect against Post-Stroke Pneumonia. Adv Sci (Weinh). 2023 Aug;10(22): e2206432. doi: 10.1002/advs.202206432. Epub 2023 May 28. PMID: 37246283; PMCID: PMC10401184.






