附睾核糖核酸酶T2通过附睾体-精子相互作用参与弱畸形精子症和影响代际的代谢紊乱
附睾对于睾丸后精子的发育是至关重要的,这被称为精子成熟。在这个过程中,通过蛋白质和小的非编码RNA(sncRNAs)的交换,附睾与精子之间有了交流从而获得了受精能力。更重要的是,附睾上皮细胞分泌的附睾源外泌体将sncRNAs转移到成熟的精子中。这些单链RNA可以调节代际遗传,从而进一步影响后代的健康。近年来,精子成熟过程中sncRNAs与精子功能调控的联系和机制日益受到人们的关注。建立附睾特异性核糖核酸酶T2(RNaseT2)敲入(KI)小鼠模型,探讨其在精子受精能力发育中的作用。对RNase T2 KI雄性的精子参数进行了评估,并对其后代的代谢表型进行了表征。Pandora测序技术对精子sncRNAs的表达模式进行了分析和测序,以确定附睾部RNase T2对精子sncRNAs表达水平的影响。此外,在体外和体内都证实了RNase T2在附睾上皮细胞中的表达水平与环境应激的反应。RNase T2的过度表达会导致小鼠附睾头部严重的生育能力低下,并与弱畸精子症相关,并进一步导致后代获得性代谢紊乱,包括高血糖、高脂血症和高胰岛素血症。Pandora测序显示,与对照精子相比,RNase T2 KI精子中sncRNAs特别是rRNA衍生的小RNA(rsRNA)和tRNA衍生的小RNA(tsRNA)谱发生了改变。此外,环境压力上调附睾头中的RNase T2。
本文于2023年11月发表在《BMC Medicine》杂志上,IF=9.3
主要技术路线:
1、在精子成熟过程中,附睾头中的RNase T2可通过附睾小体(附睾衍生的外泌体)转移至精子
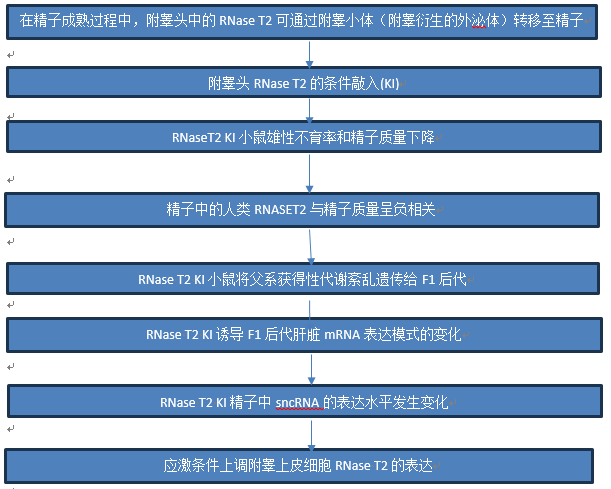
我们之前的研究报道了RNase T2在人和小鼠精子中的表达。在此,聚集的RNase T2位于精子的顶体后区域(图1A),在成熟过程中,外泌体通过附睾时与精子融合。免疫印迹分析表明,RNase T2蛋白在头精子首次进入附睾部时存在于中等水平,而在尾部精子中表达较丰富(图1B)。附睾成熟过程中精子中RNase T2水平的升高及其在精子中的定位特征表明,分泌的RNase T2在附睾转运过程中被转运到成熟的精子中。
随后,采用免疫印迹法和免疫荧光法研究RNase T2在小鼠睾丸和附睾中的表达规律。值得注意的是,据报道,核糖核酸酶T2在人类细胞和小鼠组织中以多种形式存在,即36 kDa条带代表全长、糖基化和分泌型,而27 kDa和31 kDa条带是蛋白水解物。在此,对小鼠睾丸和附睾中RNaseT2的免疫印迹法分析表明,RNase T2在近40 kDa处有预期的条带(图1C),代表其糖基化的全长形式。因此,我们的结果表明,RNase T2在附睾头的表达尤其高于在睾丸或附睾尾的表达(图1C)。同时,免疫荧光分析显示,附睾头RNaseT2主要分布在面对附睾上皮腔的主细胞的顶下区,这与附睾头的分泌特征一致(图1D)。
由于RNase T2定位于顶体后区域(图1A),附睾来源的外泌体在此处与精子融合,因此我们可以想知道外泌体是否介导RNase T2向精子的转移。通过聚合物沉淀分离附睾液中的外泌体,并通过透射电子显微镜、纳米颗粒跟踪分析和蛋白质印迹分析进行验证。通过纳米颗粒追踪分析检测到的这些附睾来源的外泌体的直径在50至150 nm范围内(图1E),这与外泌体的定义一致。通过透射电子显微镜观察到的外泌体的超微结构(图1F)显示出明显的双层膜结构,同时直径约为50至100 nm,这与纳米颗粒跟踪分析检测到的一致。此外,蛋白质印迹显示,分离的外泌体富含外泌体标记物TSG101和Flotillin 1,而它们不显示钙联蛋白(一种内质网蛋白)(图1G)。正如预期的那样,RNase T2存在于这些分离的附睾来源的外泌体中(图1G)。此外,RNase T2和外泌体富集的脂筏蛋白Caveolin 1的免疫荧光染色表明,这两种蛋白从头精子到尾精子的聚集显着更多,并且它们特别共定位于尾精子的顶体后区域(图1H)。RNase T2和Caveolin 1的共定位表明RNase T2可能通过外泌体递送过程转运到成熟的精子。
还研究了RNA-SET2与人精浆中外泌体之间的关联。蛋白质印迹和透射电子显微镜证实外泌体源自人精浆。此外,RNA-SET2的蛋白质印迹分析显示其存在于精液样本的不同部分中,即精子、精浆和从精浆中分离的外泌体。同时,胶体金标记和免疫电镜分析表明,RNA-SET2标记的免疫金颗粒主要局限于外泌体样囊泡,这些囊泡往往在精子的顶体后和中段区域与精子融合。免疫荧光分析显示,RNA-SET2与Caveolin 1在人精子中共定位,这与小鼠精子中的一致。综上所述,人类精子中的RNA-SET2可能是通过精子-外泌体相互作用从精浆衍生而来。
综上所述,这些结果表明RNase T2在附睾头高度表达,并至少部分以外泌体依赖性方式分泌到附睾液中。因此,它在附睾运输过程中被转运到成熟的精子中(图1I)。
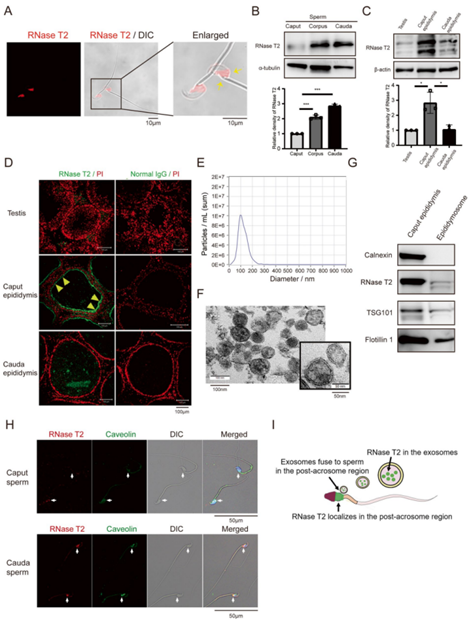
图1 附睾头中的RNase T2可以通过释放外泌体到精浆中转移到精子中
2、附睾头RNase T2的条件敲入(KI)
为了确定附睾头RNase T2对精子成熟的影响,构建了基于Rosa26-Cre的基因敲入小鼠模型。Rosa26-pCAG-STOP-RNase T2小鼠与附睾头的主细胞特异性Cre小鼠系(Lcn5-Cre)杂交。因此,在Rosa26-RNaseT2条件性敲入(KI)小鼠(rosa26-RNASET2loxP/loxP;Lcn5Cre+)中,Cre介导的条件性NeoSTOP片段的去除导致CAG启动子驱动的RNase T2在附睾头的主细胞中表达。免疫印迹和免疫荧光分析均证实RNase T2在KI小鼠附睾头和成熟精子中的表达显著增加,证实了RNase T2在这些KI小鼠中过表达。值得注意的是,免疫荧光分析表明,在RNaseT2 KI精子中,RNase T2主要聚集在精子头部的顶体后区域。RNase T2 KI雄性小鼠健康,发育正常。组织学分析也表明,与野生型(WT)小鼠相比,这些小鼠的睾丸和附睾体没有明显的缺陷。然而,对照组(Rosa26-RNASET2loxP/loxP,Cre阴性)小鼠和RNaseT2 KI小鼠的血清睾酮、抗精子抗体和附睾炎性细胞因子的浓度没有显著差异。提示该RNaseT2 KI小鼠模型适用于附睾头的RNaseT2功能的研究。
3、RNaseT2 KI小鼠雄性不育率和精子质量下降
为了评估RNase T2 KI小鼠的繁殖力,每只雄性小鼠与两只性成熟雌性小鼠交配1周,然后比较妊娠率和产仔数与WT和对照组小鼠的受孕率和产仔数。正如预期的那样,RNase T2 KI 雄性性行为活跃,并在雌性伴侣中产生阴道塞。在21天的怀孕期内,18只雌性与RNase T2 KI雄性交配,平均只有4只雌性怀孕并产下近3只幼崽(图2A)。与RNase T2 KI 雄性交配的雌性的妊娠率(4/18)和产仔数(2.67 ± 0.58, n=4, P < 0.05)均显着低于与WT雄性交配的雌性(妊娠率, 18/ 18;产仔数,8.61 ± 0.92,n=18)和对照雄性(怀孕率,17/18;产仔数,7.94 ± 1.98,n=17)(图2A)。因此,如此极低的妊娠率和产仔数清楚地表明,RNase T2 KI 雄性被认为反映了严重的生育能力低下。
计算机辅助精子分析(CASA)和形态学分析评估了附睾尾成熟精子的精子参数。结果表明,WT雄性、对照雄性和RNase T2 KI雄性之间精子浓度没有显着差异。然而,尽管RNase T2 KI小鼠的精子活力和前向运动在获能30分钟和60分钟期间稍大,但RNase T2 KI雄性小鼠的活动精子和前向活动精子的百分比明显低于WT和对照雄性(图2B,C)。这种活力的增加表明,RNase T2 KI精子对获能有反应,但仍处于相对较低的水平,远远不能满足受精的要求。
此外,质膜流动性、细胞内钙水平和线粒体活性被用来评估精子获能能力。用流式细胞术分析,WT精子和RNase T2 KI精子都有很高比例的部花青540(MC540)荧光信号。同时,荧光强度测定WT精子和RNase T2 KI精子细胞内钙离子水平和线粒体膜电位高氯酸四甲基罗丹明甲酯(TMRM)染色的结果无显著差异。另一方面,钙离子载体A23187诱导的RNase T2 KI精子顶体反应的发生率也与WT和对照精子相同。这些结果表明,RNase T2 KI精子的获能和顶体反应与WT精子相同。
值得注意的是,通过瑞氏-吉姆萨染色(图2E)进行评估发现,RNase T2 KI精子的精子头部畸形率(79.06±8.42%,n=20)显著高于WT精子(8.17±0.98%,n=16)和Rosa26/Cre-精子(6.86±1.74%,n=17)(图2D)。同时,电子显微镜分析显示,RNase T2 KI精子的精子头部有膨胀的细胞质(图2F),因此细胞质膜、顶体和细胞核彼此不贴合。RNase T2 KI精子中精子头部的这种严重畸形形态被称为畸形精子症。这种情况可能是精子活力差和男性生育能力低下的原因。另一方面,TEM图像表明,与对照小鼠相比,RNase T2 KI附睾头的精子表现出正常的形态。这种差异表明,RNase T2 过度表达可能会导致附睾成熟过程中的精子畸形。
此外,辅助生殖技术表明体内胞浆内单精子注射(ICSI)可以帮助RNase T2 KI精子受孕,而体外受精(IVF)则无效(图2G)。这种差异表明,RNase T2 KI精子可以使卵母细胞受精,但由于运动能力差而无法到达卵母细胞。
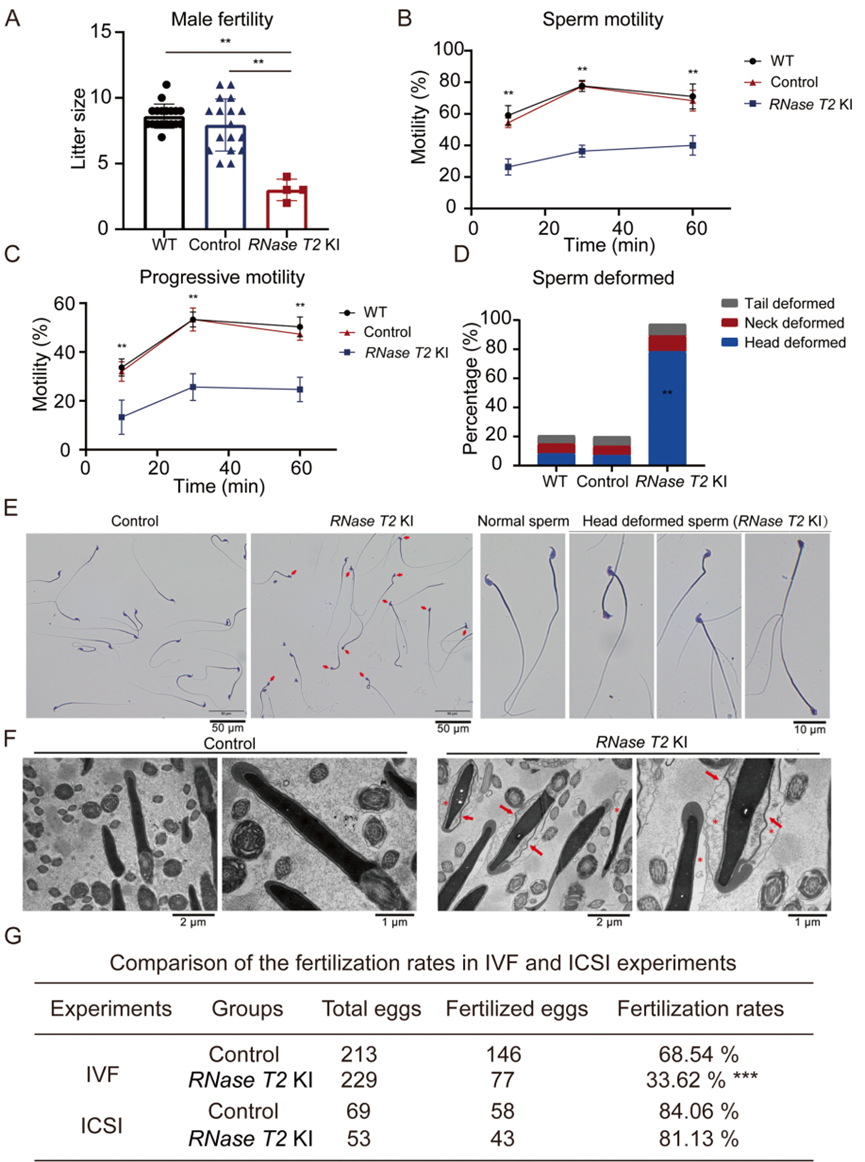
图2 RNase T2 KI 小鼠的雄性生育能力和精子质量较差
4、精子中的人类RNASET2与精子质量呈负相关
我们前期的研究表明,精液中RNase T2的表达与精子活力呈负相关。这种反比关系被认为是人类弱精子症的一个指标。在此,我们进一步表征了RNASET2与精子畸形之间的潜在相关性。每组的供体人群为63名健康男性和44名弱畸精子症男性。免疫荧光染色和流式细胞仪分析鉴定了人类精子中的RNASET2含量。荧光分析显示,与健康捐献者相比,弱精子症个体(n = 44)的精子被标记有更高的荧光强度(n=63,P<0.01)。
同时,进一步分析了不同精子群体中RNASET2的含量。每个精液样本中的两个精子群用Percoll梯度分离,即质量好的成熟精子用90% Percoll分离,质量差的未成熟精子用45% Percoll分离。免疫荧光分析显示,与90% Percoll分离的质量良好的精子相比,45% Percoll分离的质量较差的精子被更高的RNASET2荧光强度标记(n=16,P<0.01)。此外,免疫荧光分析还显示RNASET2强烈聚集在头部变形精子的顶体后区域,即小头(HS)、小锥形头(HST)、小无定形头(HSA)、小空泡头(HSV)、大头(HL)、大圆头(HLR)、大梨形头(HLP)、大不定形头(HLA)。
此外,ELISA检测精浆中RNASET2含量也显示,与健康精液标本(17.07±4.48 µg/mL,n=44,P<0.05)相比,弱畸精子症个体精浆中RNASET2表达量(24.43±4.39 μg/ mL,n=63)显着升高。
总的来说,结果表明,附睾头中RNase T2的过度表达导致精子头部形态更加严重的畸形,这可能进一步损害精子的活力和受精能力。
5、RNase T2 KI小鼠将父系获得性代谢紊乱遗传给F1后代
据报道,环境压力导致代际代谢异常。为了证实RNase T2诱导的弱畸精子症是否也介导代际遗传,将RNase T2 KI小鼠与WT雌性小鼠交配以产生第一代子代(F1)(图3A)。然后,分析了RNase T2 KI小鼠(RNase T2 KI-F1)和对照小鼠(Control-F1)后代的代谢表型。结果表明,RNase T2 KI-F1小鼠,无论是6周龄的雄性还是雌性,都比年龄匹配的对照F1小鼠显著重(图3B,C),同时,20周龄的RNase T2 KI-F1小鼠的血糖水平也显著升高(图3D,E)。由于雄性F1在体重和血糖水平上表现出更显著的变化,因此选择雄性后代进行以下实验。
随后,为了更广泛地研究后代的代谢表型变异,20周龄的雄性F1后代被用于以下实验。结果表明,RNase T2 KI-F1小鼠血清胰岛素和C-肽水平显著升高,而胰高血糖素水平显著下降(图3F-H)。难以降解的胰岛素原C肽片段是准确划分胰岛细胞功能的指标。我们的结果表明,RNase T2 KI-F1小鼠的葡萄糖代谢和高血糖受到破坏。此外,葡萄糖耐量试验(GTT)结果显示,RNase T2 KI-F1小鼠的血糖和胰岛素水平较高(图3I,J)。这些上升表明,与年龄匹配的对照F1小鼠相比,RNase T2 KI-F1小鼠的葡萄糖耐量受损。RNase T2 KI-F1小鼠的这种葡萄糖代谢紊乱的出现肯定源于RNase T2 KI小鼠的精子中的父系因素。然而,胰岛素耐量试验(ITT)结果在RNase T2 KI-F1小鼠和对照F1小鼠之间没有显著差异(图3K)。这一相似性与以前研究报告的一致。
糖平衡失调和脂代谢失调总是同时发生的。例如,胰岛素抵抗会导致血脂异常。因此,对RNase T2 KI-F1小鼠和对照F1小鼠的血脂水平进行了比较分析。在RNase T2 KI-F1小鼠中,它们的高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)、总胆固醇(T-CHO)、非酯化脂肪酸(NEFA)和甘油三酯(TG)水平上升。这些增加表明RNase T2 KI-F1小鼠出现了脂代谢紊乱和高脂血症(图3L-P)。由于瘦素和脂联素的水平反映了脂肪细胞的功能,我们还发现它们的血清水平在RNase T2 KI-F1小鼠中显著升高(图3Q,R)。几项研究证明,当身体脂肪百分比增加时,血清瘦素水平的升高会抑制进食并加速新陈代谢,而分泌的脂联素的增加也会改善胰岛素抵抗。因此,这些结果与我们的发现是一致的,即RNase T2 KI-F1小鼠的体重比对照F1小鼠的体重要重。
综上所述,我们的数据有力地证明了附睾头中的RNase T2在诱发子代遗传性代谢紊乱方面发挥了重要作用。
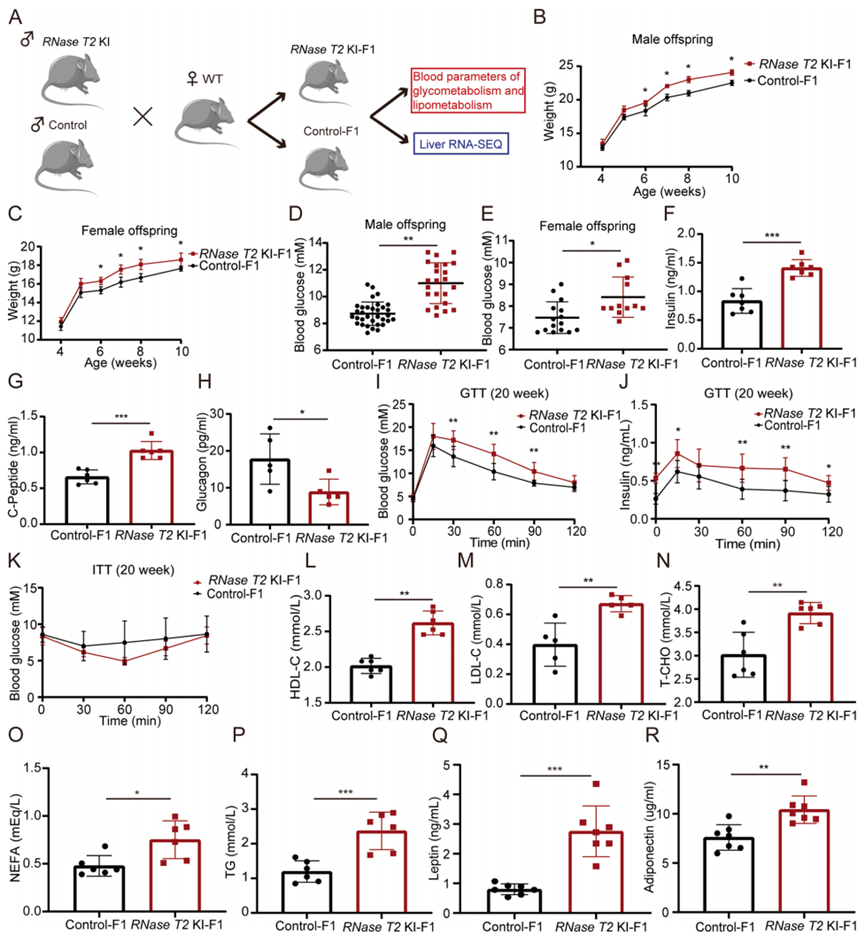
图3 RNase T2 KI 的 F1 发生糖脂代谢紊乱
6、RNase T2 KI诱导F1后代肝脏mRNA表达模式的变化
为了进一步探讨KI小鼠肝脏RNase T2功能的生物学影响,我们进行了RNA测序(RNA-seq)并比较了10周龄和20周龄RNase T2 KI小鼠和对照小鼠的肝脏基因表达谱(图4A-E)。结果显示,与对照F1小鼠相比,10周龄小鼠的肝脏中RNase T2 KI-F1小鼠的肝脏中有10个基因上调,而25个基因下调。然而,与对照组相比,20周龄时有57个基因上调,83个基因下调。基因本体(GO)功能分析证明的差异表达基因(DEG)在20周时在RNase T2 KI-F1和对照-F1之间的脂质代谢过程中富集(图4F)。此外,还测定了两组20周龄小鼠之间一些与葡萄糖和脂质代谢相关的DEGs的表达水平。胰岛素样生长因子结合蛋白1(IGFbp1)、胰岛素受体底物2(Irs2)、Perilipin-4(Plin4)、血管生成素样4(ANGPTL4)、锌指和含16个BTB结构域(Zbtb16)的表达通过RT-qPCR进一步证实(图4G)。由于Igfbp1和Irs2与胰岛素分泌和胰岛素信号转导有关,本研究的RT-qPCR结果证实RNase T2 KI-F1小鼠的Igfbp1和Irs2水平显著降低。相反,有助于脂滴形成和功能的Plin4水平反而显着增加(图4G),表明RNase T2 KI-F1小鼠中脂滴水平显着上调。
此外,数据的火山图显示了RNase T2 KI-F1发育过程中肝脏mRNA表达的差异(图4C)。10周龄的RNase T2 KI-F1和20周龄的RNase T2 KI-F1之间存在大量DEG。这些DEG还在20周时的RNase T2 KI-F1和对照-F1之间的DEG中鉴定出,例如Angptl4和Plin4。对10周龄RNase T2 KI-F1和20周龄RNase T2 KI-F1之间的DEG进行GO分析,揭示了它们参与葡萄糖和脂质代谢,特别是参与B型胰腺细胞发育、糖原生物合成的调节过程,以及类固醇代谢过程和胆固醇代谢过程的调节(图4H)。
总而言之,这些结果证实,头附睾中的RNase T2 KI表达可能会诱发后代的代谢紊乱,并且这种紊乱随着年龄的增长而变得越来越明显。这种关联表明附睾RNase T2参与介导代际遗传。
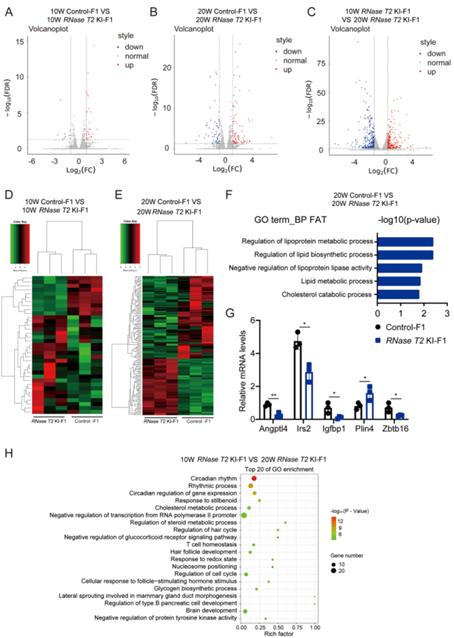
图4 RNase T2 KI诱导F1后代肝脏mRNA表达变化
7、RNase T2 KI精子中sncRNA的表达水平发生变化
我们更多地思考了RNase T2 KI-F1小鼠附睾头中RNase T2的表达如何促进代谢紊乱的遗传。为了解决这个问题,对从RNase T2 KI小鼠和对照小鼠中分离的精子进行了小RNA测序分析(图5A)。小RNA-Seq结果显示,两组总检测到的rRNA衍生小RNA(RsRNAs)的11.8%和总检测到的tsRNAs的15.3%发生了显著变化(5B、C)。同时,microRNAs(MiRNAs)和piRNAs的丰度变化分别只有5.98%和不到0.02%(图5D,E)。此外,在改变的1884个tsRNA中,有973个在RNase T2 KI小鼠的精子中上调,910个在精子中下调。
RNase T2是一种核糖核酸酶,参与单链RNA的生成,如tsRNAs和rsRNAs。tsRNAs最近被发现是表观遗传信息的代际载体。据报道,tsRNAs由几种核糖核酸酶处理,包括Dicer、ANG和RNase T2。在本研究中,我们使用RT-qPCR和免疫印迹法检测了这三种核糖核酸酶在附睾头中的表达水平(图5F,G)。结果表明,RNase T2在该组织中的表达显著高于Dicer和ANG(图5F,G)。因此,在RNase T2和KI精子中,sncRNAs的表达水平发生了变化,RNase T2可能是调节精子中sncRNAs水平的主要核糖核酸酶。
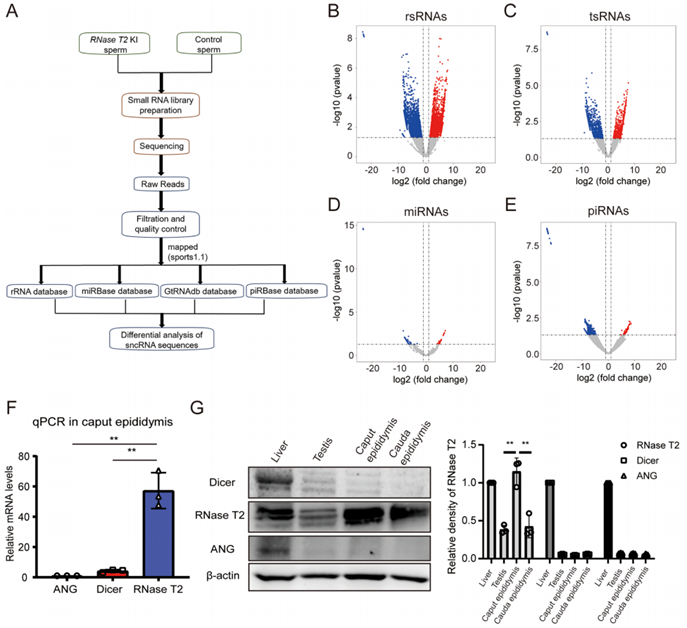
图5 RNase T2 KI精子中sncRNA表达水平的变化
8、应激条件上调附睾上皮细胞RNase T2的表达
多项研究表明炎症或氧化应激可以激活并诱导RNase T2核糖核酸酶活性。在这里,我们研究了体外和体内环境应激对附睾RNase T2表达的影响。一方面,对来自附睾头的原代附睾上皮细胞(EEC)进行了原代培养(图6A)并鉴定。免疫荧光分析显示EEC中的RNase T2与外泌体标记物Flotillin 1共定位(图6B)。这种关联表明外泌体可以介导RNase T2分泌。同时,蛋白免疫印迹分析证实从EEC培养基中分离的外泌体中存在RNase T2。此外,在炎症诱导剂脂多糖(LPS)和氧化应激诱导剂H2O2存在的情况下,EEC(图6C)和外泌体(图6D)中的RNase T2表达显着增加。另一方面,LPS处理上调了附睾头中RNase T2的表达(图6E、F)。此外,在炎症小鼠中,附睾来源的外泌体中其含量也有所增加(图6G)。
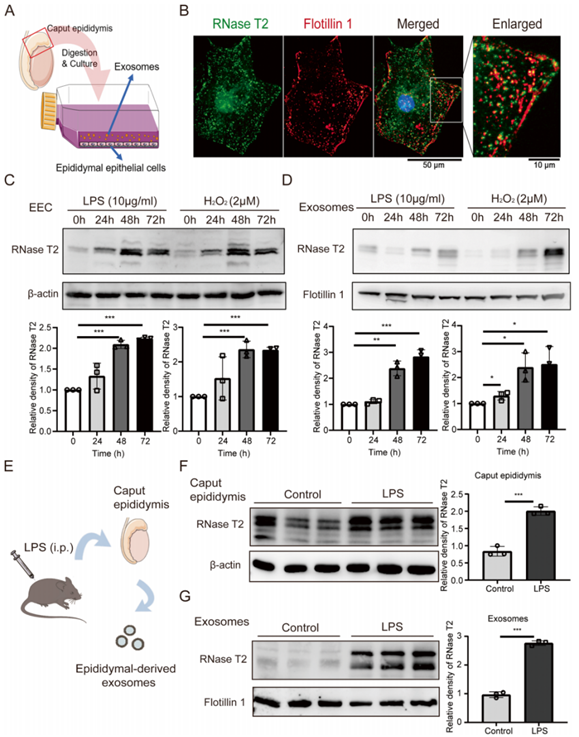
图6 应激条件会诱导附睾上皮细胞中RNase T2的上调
因此,这些结果表明,暴露于环境应激可以增加附睾上皮细胞和外泌体中附睾RNase T2的表达。
附睾RNase T2在诱导精子成熟和代际遗传中的重要性得到了证明。附睾头中过度表达的RNase T2会导致后代的弱畸精子症和代谢紊乱。
实验方法:
小RNA测序,肝脏转录组分析,蛋白质印迹分析,免疫荧光分析,外泌体提取及鉴定,透射电子显微镜分析,酶联免疫吸附测定,线粒体膜电位测定,RNA提取、逆转录和定量PCR分析,细胞的分离、培养及处理,流式细胞术,小鼠模型,组织学分析,生育能力评估,精子参数分析,体内葡萄糖耐量试验(GTT),体内胰岛素耐量试验(ITT),代谢指标分析
参考文献:
Ma Z, Li J, Fu L, Fu R, Tang N, Quan Y, et al. Epididymal RNase T2 contributes to astheno-teratozoospermia and intergenerational metabolic disorder through epididymosome-sperm interaction. BMC Med. 2023;21(1):453. Epub 2023/11/23. doi: 10.1186/s12916-023-03158-1. PubMed PMID: 37993934; PubMed Central PMCID: PMCPMC10664275.






