惊人的多层次蛋白组学发高分
弥漫型胃癌(DGC)和肠型胃癌(IGC)是胃癌(GC)的主要组织学类型。目前对DGC和IGC差异的分子机制了解甚少。在这项研究中,进行了包括蛋白质组、磷酸蛋白质组和转录因子(TF)活性分析在内的多层次蛋白质组学研究,涵盖了196例中国患者的DGC和IGC病例。综合蛋白质组学分析揭示了与DGC和IGC之间相反预后效果相关的ARIDIA突变,通过对它们相应蛋白质组的多样影响。系统比较和共识聚类分析分别基于细胞周期、细胞外基质组织以及免疫应答相关蛋白质表达的不同模式,确定了DGC和IGC的三个亚型。基于TF活性的亚型表明,DGC和IGC的疾病进展受SWI/SNF和NFKB复合物的调节。此外,推断的免疫细胞浸润和免疫聚类显示Th1/Th2比例是免疫治疗有效性的指标,在一个独立的GC抗PD1治疗患者组中得到验证。本研究的多层次蛋白质组学分析有助于更全面地理解GC,并能进一步推动精准医学的发展。本文于2023年2月发表在《nature communications》IF:16.6期刊上。
技术路线:

主要实验结果:
1、胃癌队列的全面蛋白质组学景观
本研究收集了196对原发性胃癌样本(DGC,n=83;IGC,n=102;混合型胃癌(MGC),n=11),以及来自未接受治疗的中国患者的正常对照组(NATs)。实验设计的示意图如图1a所示。多层次蛋白质组学数据使大家能够全面探索胃癌组织与正常对照组之间蛋白质表达的变化。蛋白质组的基因集富集分析(GSEA)表明,在肿瘤组织中,与DNA复制、细胞周期、细胞外基质组织和免疫应答相关的蛋白质明显上调,而与代谢(如脂肪酸β氧化、三羧酸循环(TCA)和氧化磷酸化)相关的蛋白质在肿瘤组织中明显下调(图1b)。转录因子活性分析的通路富集分析表明,在肿瘤组织中上调的转录因子涉及介导细胞周期、NF-κB信号通路和Ras信号通路,而在正常对照组中上调的转录因子涉及钙信号通路、葡萄糖素信号通路和cAMP信号通路(图1b)。磷酸蛋白质组的通路富集分析表明,肿瘤磷酸化蛋白涉及癌变相关的通路/过程,如细胞周期、TP53活性调控和DNA修复等,而正常对照组的磷酸化蛋白涉及生理功能,如囊泡介导运输、膜运输和葡萄糖代谢等(图1b)。这些分析表明,肿瘤组织在蛋白质组、转录因子活性和磷酸蛋白质组水平上的特征显示部分一致性,同时存在一些差异。
值得注意的是,所有三个数据集中涉及细胞周期的蛋白质均呈上调状态。细胞周期蛋白质的评估基于它们的变化表达模式(WAPAL、AHCTF1等)、磷酸化模式(CCNL1 T67、SMC4 S41等)和在胃癌肿瘤组织中推断的转录因子活性(SMARCA5、E2F3等)(图1c)。根据蛋白质组学特征比较了转录因子(TFs)的靶基因(TGs)在肿瘤组织和正常对照组中的表达。如图1d所示,TF-TG调控网络表明TGs的表达水平呈现出与组织特异性TFs相似的趋势。
为了探索激酶在胃癌中的作用,选择了在肿瘤组织和正常对照组之间表达变化较大的磷酸位点,而不同于其蛋白质表达变化。胃癌相关磷酸位点的激酶底物富集分析(KSEA)确定了多个激酶,包括CDK1、CDK2、CSNK2A1、CAMK2A、PAK1、MAPK1和MAPK3,在胃癌肿瘤组织中被激活(图1e)。这些激酶调节细胞周期以及GPCR信号通路和MAPK信号通路等多个致癌通路。进一步的研究发现,MAPK1、MAPK3和CDK1的表达、磷酸化和活性均有所增加;因此,这三个激酶可能成为胃癌患者的潜在药物靶点(图1f)。
因此,本研究迄今为止建立了中国胃癌患者的全面蛋白质组学景观。此外,这些数据集可作为一个多层次的资源,用于研究胃癌病理学和精准医学。
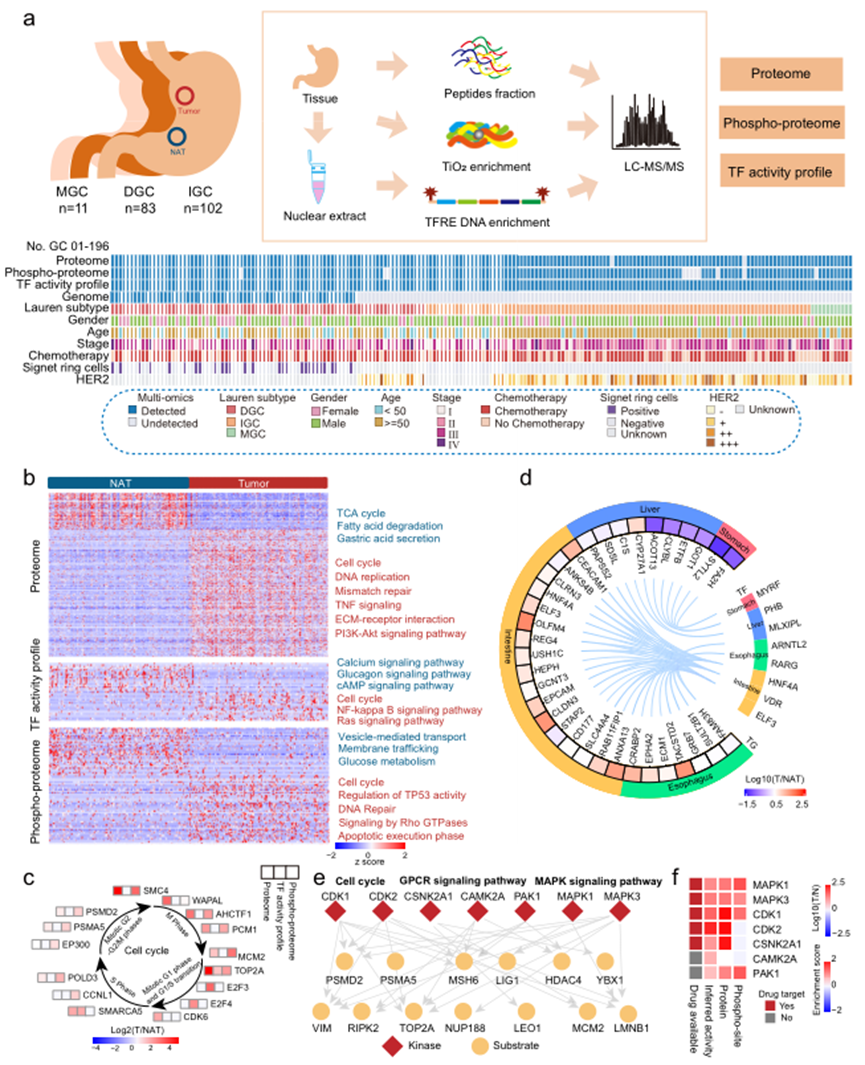
图1 人GC样品的多级蛋白质组学图谱
2、ARID1A基因突变在DGC和IGC中表现出不同的影响
为研究胃癌遗传信息的变化,对65例DGC患者中的274个癌症驱动基因和GC热点基因的突变频率进行了统计分析。图2a展示了至少有9%患者中检测到突变的13个基因。在这些基因突变中,TP53、CDH1、KMT2D、RHOA、ARID1A、APC和PIK3CA被检测为高频突变(10.8-47.7%),与先前的报告一致。为了探讨基因突变与预后结果的关联,基于生存结果计算了基因突变的风险比(HR)。发现患有ARID1A突变的患者预后不利(图2b)。
影响同一基因座位的基因表达水平的基因组变化被称为顺式效应,而影响另一基因座位的变化则被定义为反式效应。作者全面地表征了基因变化对蛋白质水平的顺、反式效应(图2c)。与顺式效应相比,蛋白质丰度的变化在许多反式效应中更为显著,并且这些变化具有生物学过程的倾向。一致地,患有CDH1突变的患者的细胞外基质蛋白质表达较低(图2c),显示了CDH1基因在细胞外基质组织中的功能。重要的是,只有三个基因显示了顺式效应:TP53、PIK3CA和ARID1A。患有TP53或PIK3CA突变的患者其相应蛋白质的丰度增加,而患有ARID1A突变的患者其ARID1A蛋白质表达较低(图2d)。作者还比较了ARID1A在7例患有ARID1A突变和野生型患者中的转录因子活性。发现ARID1A的转录因子活性在患有ARID1A突变的患者中也减少了(图2d)。这些结果表明ARID1A突变导致其蛋白质表达降低和转录因子活性减少。
作为唯一与不利预后相关的基因突变,作者进一步研究了ARID1A突变与癌症蛋白质组的变化之间的关系,即相关蛋白和通路的变化。挖掘了ARID1A的TGs数据。ARID1A主要被报道为转录抑制因子。因此,调查了在ARID1A突变患者中升高的TGs。GSEA分析显示在具有和不具有ARID1A突变的样本之间存在显著变化的通路。基于标准化富集分数,发现在ARID1A突变患者中,模式识别受体信号通路和TLR信号通路是富集最显著的通路(图2e–f)。在参与TLR信号通路的15个蛋白质中,CD14和PIK3AP1在ARID1A突变患者中显著上调(图2g,h)。此外,预后分析显示CD14是DGC中的不良预后蛋白质(图2i)。这些结果表明,患有ARID1A突变的患者具有不良预后,并且激活了CD14介导的TLR信号通路。而在IGC中的结果则相反。这些结果表明,ARID1A的突变在DGC和IGC之间产生了相反的预后效应,通过对它们相应蛋白质组的多样影响。因此,基于多层次蛋白质组学数据比较DGC和IGC是很重要的。
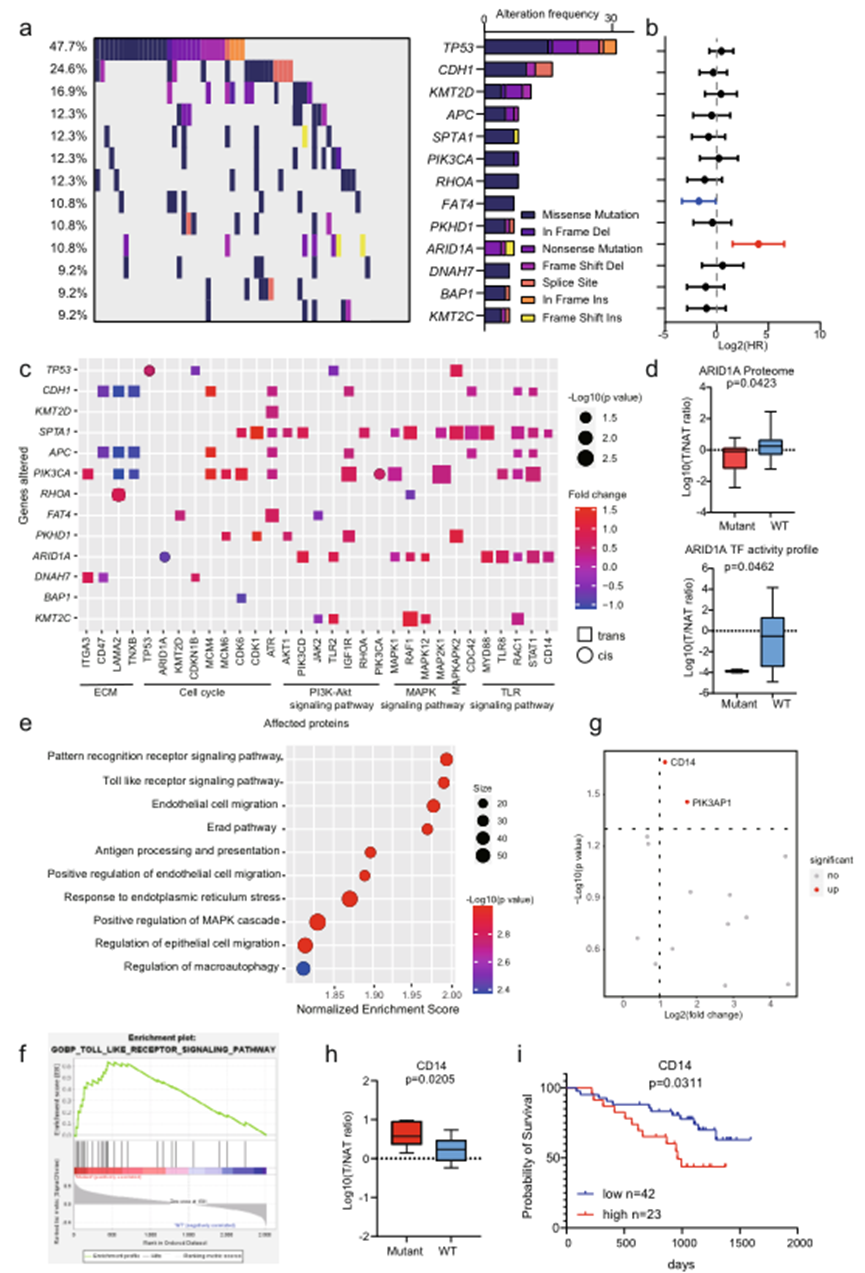
图2 DGC蛋白基因组学分析总览
3、综合多层次蛋白质组学研究DGC和IGC
Lauren分类包括DGC、IGC和MGC,其中前两种病理类型是主要的。在本研究的队列中,临床信息显示DGC的发展与年龄、肿瘤位置和淋巴血管侵袭显著相关(图3a)。与当前的临床知识一致,生存分析显示IGC患者的生存时间显著延长(图3b)。为了进一步研究DGC和IGC之间的肿瘤异质性,比较了多层次(蛋白质组、磷酸蛋白质组和转录因子活性)的差异表达。根据肿瘤组织与正常对照组的比值,发现DGC和IGC之间存在384个差异表达的蛋白质。其中,83个在DGC中上调,301个在IGC中上调(图3c)。
为了探索DGC中肿瘤微环境的不同效应,比较了DGC和IGC的xCell scores。DGC的微环境和免疫分数高于IGC(图3d),表明DGC中免疫细胞的浸润程度较IGC更高。随后,比较了在DGC和IGC肿瘤中普遍存在的免疫细胞,发现DGC肿瘤中CD4+ T细胞、CD8+ T细胞和巨噬细胞的浸润程度高于IGC肿瘤(图3e)。对于DGC患者,观察到RB1的磷酸化增加,TF活性降低,而E2F活性和CDK4/6水平在DGC中上调(图3f)。这种综合分析表明,在DGC中,RB1被磷酸化并促使与E2F的解离,增加了E2F的活性,并推动了细胞周期的进展。这些结果表明了利用CDK4/6复合物作为DGC的潜在药物靶点的可能性。
对于IGC患者,作者通过评估激酶活性、磷酸位点和蛋白质表达水平来全面调查DNA修复网络。包括MLH1、MSH3和MSH6在内的12个参与DNA损伤的蛋白质在IGC患者中上调(图3g)。进一步的研究显示,IGC患者中DNA损伤蛋白上的磷酸位点增加,包括PARP1、SMC3和SSRP1。此外,比较分析表明,IGC患者中磷酸化的ATM/ATR上调(图3g)。先前的研究表明,ATM/ATR作为DNA修复网络的核心组成部分,在DNA双链断裂事件中被激活以启动同源重组修复。因此,可以推断DNA损伤相关蛋白质可能成为IGC的潜在药物靶点。为了进一步验证这些发现,在TCGA队列中验证了DGC和IGC的潜在药物靶点。比较了CDK4/6和ATM/ATR的表达,并发现CDK4在DGC中的表达较高,而ATR在IGC中的表达较高(图3h)。此外,预后分析显示CDK4和ATR的表达分别与DGC和IGC的临床结果呈负相关(图3i)。这些结果证明了CDK4/6和ATM/ATR分别是DGC和IGC的潜在靶点(图3j)。
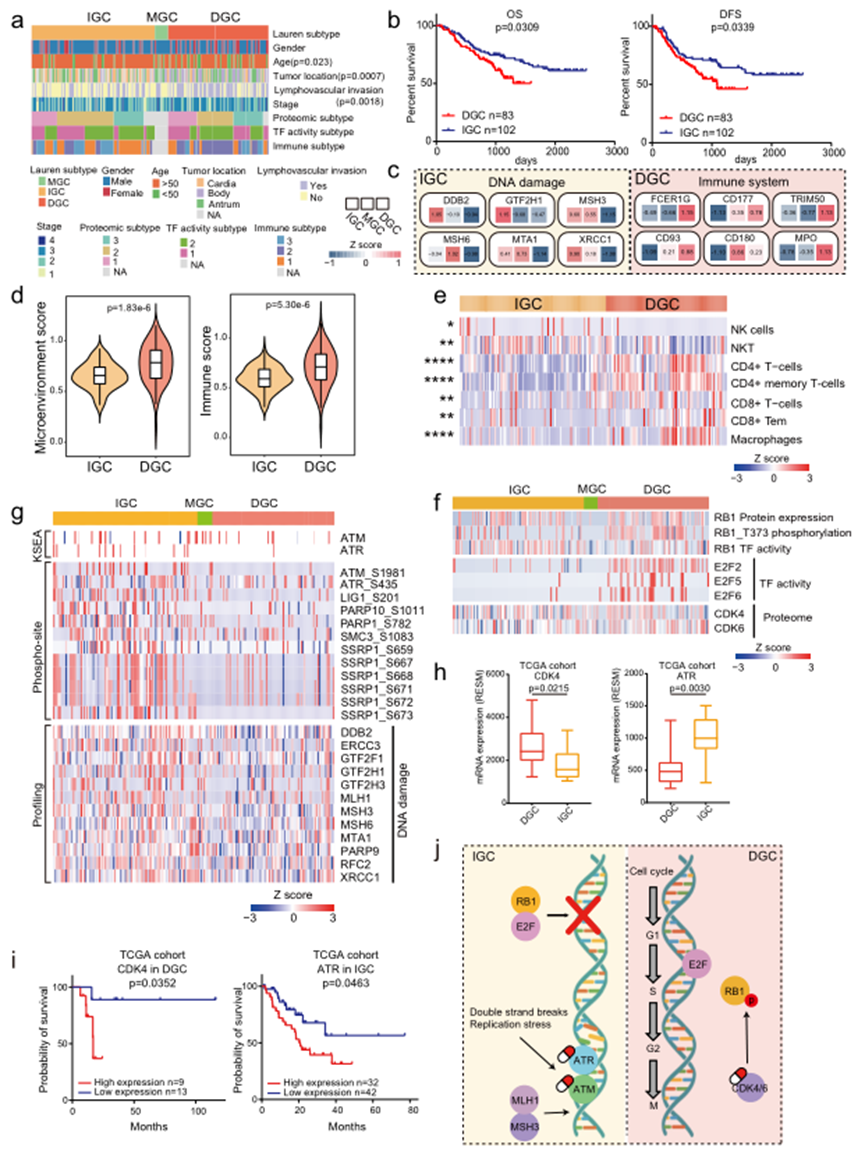
图3 综合多水平蛋白质组学分析显示DGC和IGC的致病机制不同
4、胃癌的蛋白质组学亚型及其与临床结果的关系
在临床上,肿瘤治疗在很大程度上依赖于组织学检查。越来越多的研究表明,在每种肿瘤组织学类型中都存在不同的分子亚型,这些亚型具有不同的预后和治疗靶点。基于DGC肿瘤组织与正常对照组中上调的蛋白质的共识聚类识别出三个DGC蛋白质亚型:DGC cluster 1(n = 23)、DGC cluster 2(n = 28)和DGC cluster 3(n = 28)。多变量Cox回归分析表明,这些亚型与临床结果显著相关,包括性别、年龄、TNM分期和化疗(图4a,b)。这一结果表明,蛋白质亚型划分可作为独立的预后预测因子。
这些亚型显示出明显的分子特征。分别在DGC和IGC聚类中鉴定了2367和3154个差异表达蛋白质。在六个亚型中,DGC cluster 1和IGC cluster 3以细胞周期(如CDK1/2和CDK6)和DNA复制(如ORCS3和AHCTF1)为特征;DGC cluster 2和IGC cluster 2以细胞外基质组织(如DMD和MUC5AC)、胶原形成和生物合成(如CD36、COL6A1和LAMA2)为特征;许多与免疫反应相关的蛋白质(如CD163、IDO1和ICAM1),以及调节中性粒细胞脱颗粒和补体级联的蛋白质(如FCER1G、IL 16和C5)在DGC cluster 3和IGC cluster 1中过度表达(图4c)。
ssGSEA分析进一步表明,细胞周期和免疫应答相关的信号通路的标准化富集分数(NESs)与DGC和IGC中不同的临床结果相关(图4d)。调节纺锤体装配和DNA复制中涉及的DNA解旋与DGC中的良好预后相关。然而,在IGC中,调节有丝分裂细胞周期和调节细胞周期相转变与不良预后相关。
由于细胞周期状态影响患者对辅助化疗的敏感性,作者比较了在每个亚型中接受辅助化疗和未接受辅助化疗的患者的预后。发现DGC cluster 1患者对辅助化疗不敏感,而IGC cluster 3患者对其敏感(图4e)。为了评估肿瘤细胞周期相如何影响患者对化疗的敏感性,进行了进一步的统计分析,发现DGC cluster 1患者中有最高比例的患者上调了S期标志性蛋白,而IGC cluster 3患者中有最高比例的患者上调了G2M期转变标志性蛋白(图4f)。进一步比较参与DNA复制和细胞分裂的关键蛋白质,发现这些蛋白质在DGC cluster 1和IGC cluster 3患者中具有相反的表达模式(图4g)。因此,化疗治疗策略应在考虑肿瘤细胞的细胞周期相的基础上制定。作者提出DNA复制过程中参与的蛋白质值得被视为DGC cluster 1的治疗靶点(图4g)。
比较DGC cluster 1和IGC cluster 3的磷酸蛋白组学揭示了亚型特异性激酶的激活,分别是CDK2和CDK1等(图4h)。由于细胞增殖状态和细胞周期相影响患者对化疗的响应,作者尝试基于CDK1和CDK2的表达水平来预测GC患者的化疗反应。在GC队列中,发现CDK1高表达和CDK2低表达水平的患者受益于辅助化疗(图4i),表明CDK1和CDK2水平可作为评估GC患者化疗反应的生物标志物。
总的来说,蛋白质亚型在DGC和IGC中展示了蛋白质特征与预后之间的相反关联,为临床中患者分层和治疗策略提供了指导。
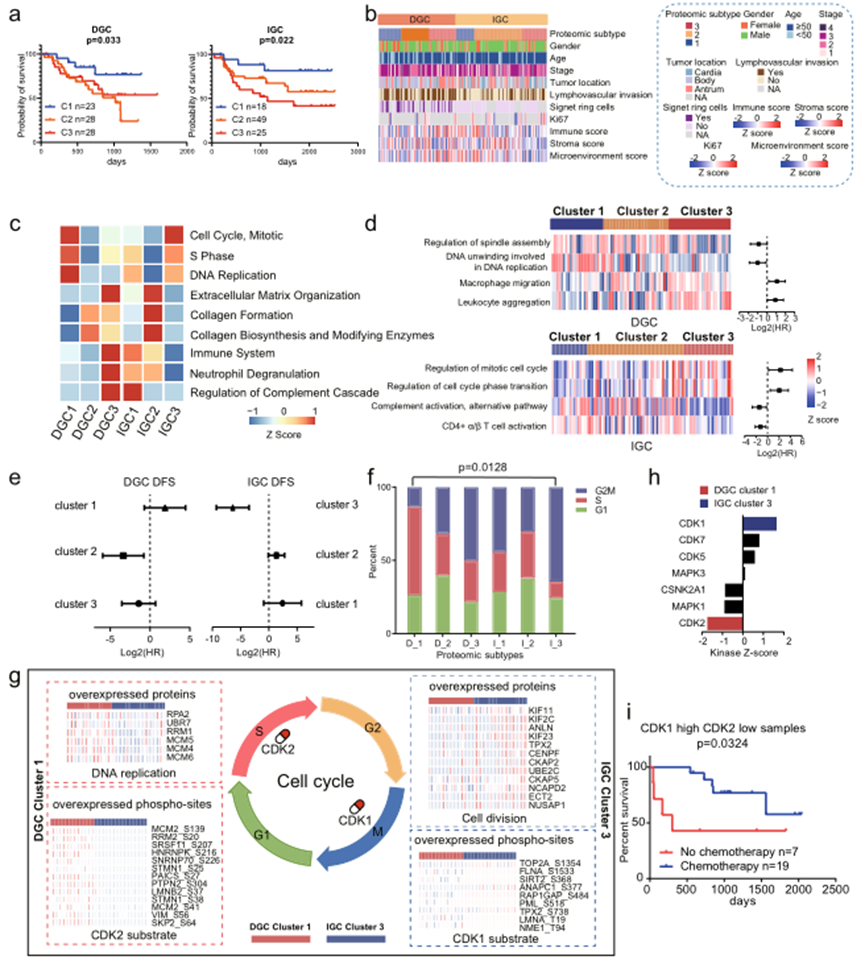
图4 胃癌的蛋白质组学亚型及其与临床结果的关系
5、TF活性谱及其临床相关性
我们对DGC和IGC的425个和396个在大于50%的DGC和IGC患者中检测到的TF进行了TF活性分析,分别在每个数据集中确定了两个亚型。对TF活性基础亚型的进一步分析显示它们与患者的生存显著相关,表明了聚类TF活性基础亚型的预后力量(图5a)。为了方便起见,TF活性基础亚型被指定为DGC TF cluster 1(n = 40)、DGC TF cluster 2(n = 43)、IGC TF cluster 1(n = 42)和IGC TF cluster 2(n = 60)。对TF活性基础亚型的临床特征进行评估,发现与DGC TF cluster 1比较,DGC TF cluster 2包括更多具有淋巴血管浸润的患者以及更高概率发生在胃窦(图5b)。IGC TF cluster 2包括比IGC TF cluster 1更少的I期GC患者。
随后,作者确定了每个TF活性基础亚型中的主控TFs(图5c)。在IGC TF cluster 1中主导的是NFKB2;在IGC TF cluster 2中主导的是SMARCE1和TFAP4;在DGC TF cluster 1中主导的是MLX和SMARCC1;在DGC TF cluster 2中主导的是NFKB1、RELA和IRF2。总体而言,NFKB复合物被提名为IGC TF cluster 1和DGC TF cluster 2中的主控TFs;SWI/SNF复合物被提名为IGC TF cluster 2和DGC TF cluster 1中的主控TFs。值得注意的是,对于DGC患者,DGC TF cluster 1具有更好的预后,而DGC TF cluster 2具有更差的预后;对于IGC患者,IGC TF cluster 1具有更好的预后,而IGC TF cluster 2具有更差的预后。这些结果显示了NFKB复合物和SWI/SNF复合物在DGC和IGC中的多样的预后相关性。
TGs的通路富集分析表明,主控TFs在不同的聚类中调节不同的生物学功能(图5d)。例如,在IGC TF cluster 1中,NFKB复合物参与了Rho蛋白信号转导和血小板活化,而在DGC TF cluster 2中,它参与了免疫应答、CAMs转化和细胞迁移。另一方面,SWI/SNF复合物参与了IGC TF cluster 2中的翻译和细胞周期进展,而在DGC TF cluster 1中参与了RNA剪接和DNA复制(图5e–f)。
作者提出,为什么主控TFs在不同的亚型中可以调控不同的基因集。由于磷酸化是调控TF活性的基本机制,作者探讨了磷酸化对主控TFs的影响,基于激酶-底物网络。作者比较了这些TFs的磷酸化水平,发现在DGC TF cluster 2中,NFKB1的S907、S937、S939和S941的磷酸化水平增加,而在IGC TF cluster 2中,TFAP4的S124的磷酸化水平增加(图5g)。随后,通过相关性分析筛选可能负责这五个磷酸化位点的激酶。发现33个激酶与这五个磷酸化位点有显著正相关(图5h)。基于TF活性亚型的信号传导网络如图5i所示。在DGC TF活性 cluster 2中,IKBKE的激酶活性与NFKB1的S941磷酸化位点呈正相关。这表明IKBKE激活了NFKB1,与先前的研究结果一致。在IGC中,ATM/ATR活性与TFAP4(磷酸化位于S124)显著正相关,与细胞分裂相关蛋白的表达相关。正如图3g所示,ATM/ATR在IGC中的活性高于DGC。这些观察结果表明ATM/ATR在通过激活TFAP4等不同下游TFs调控DGC和IGC发生中的细胞分裂可能发挥潜在作用。在这里,作者根据整合的多层次蛋白质组学数据(图5i)阐明了TF复合物在病理过程中的作用,并呈现了DGC和IGC亚型中的激酶-TF-靶基因网络。
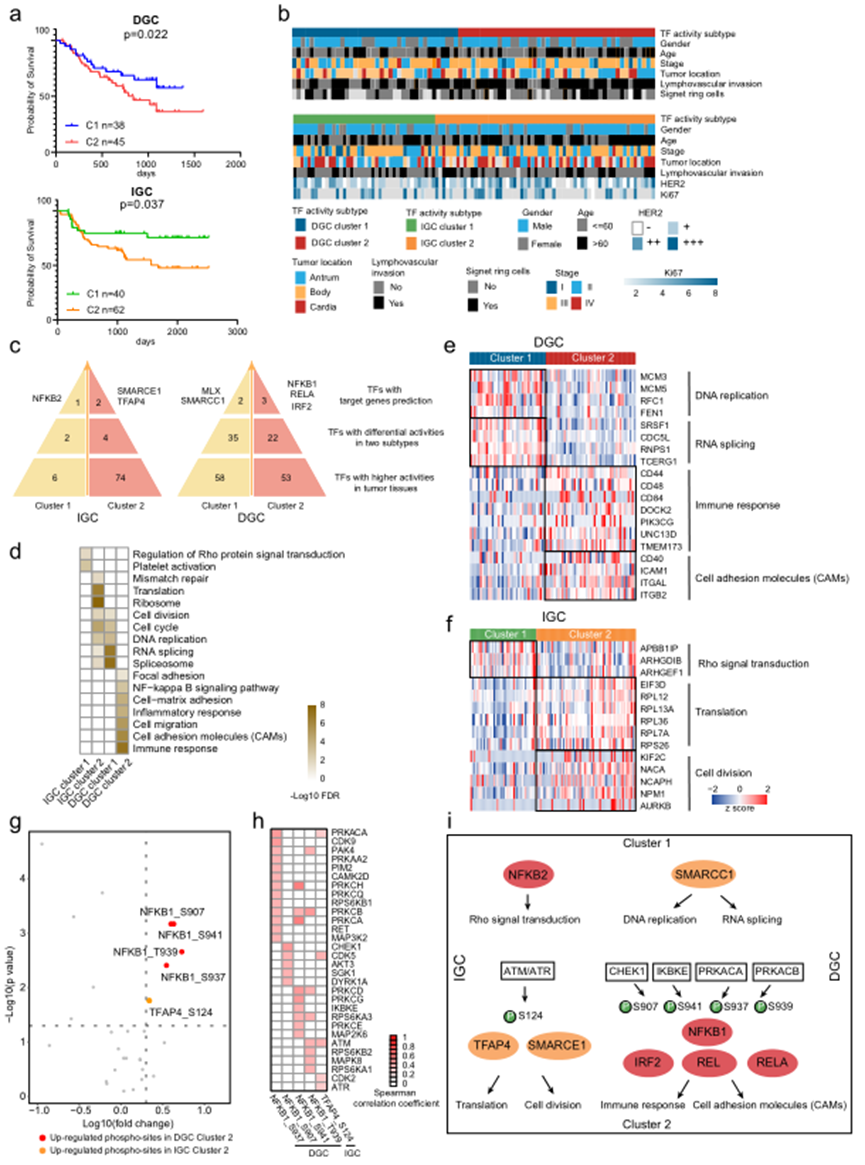
图5 基于TF活动概况的DGC和IGC亚型
6、多水平蛋白质组亚型的特征及其稳健性
图6a结果表明,基于TF活性的亚型、蛋白质组学的亚型和磷酸化蛋白质组学的亚型具有较高的分类一致性。此外,作者探讨了TF活性亚型和蛋白质亚型之间的关联。发现DGC蛋白质亚型cluster2的患者被分为两个TF活性亚型(TF活性亚型cluster1中的18名患者和TF活性亚型cluster2中的10名患者(图6b)。对于DGC蛋白质亚型cluster 2,进一步探讨了两个TF活性亚型之间的临床和分子差异。正如预期的那样,TF活性亚型cluster 2中的患者预后较差(图6c),具有较高的NFKB1 TF活性和较低的SMARCC1 TF活性(图6d)。进一步对TF活性的预后分析显示,NFKB1 TF活性与预后呈负相关,而SMARCC1 TF活性与预后呈正相关(图6e)。根据蛋白质组学数据比较了NFKB1和SMARCC1的TGs的表达(图6f,g)。发现SMARCC1的靶基因,涉及RNA剪接和DNA复制, 在TF活性亚型cluster 1中上调;NFKB1的靶基因,与免疫反应有关,在TF活性亚型cluster 2中上调。总体而言,综合亚型划分的结果表明,蛋白质亚型与TF活性分析相结合可用于预后预测和联合治疗策略的开发。
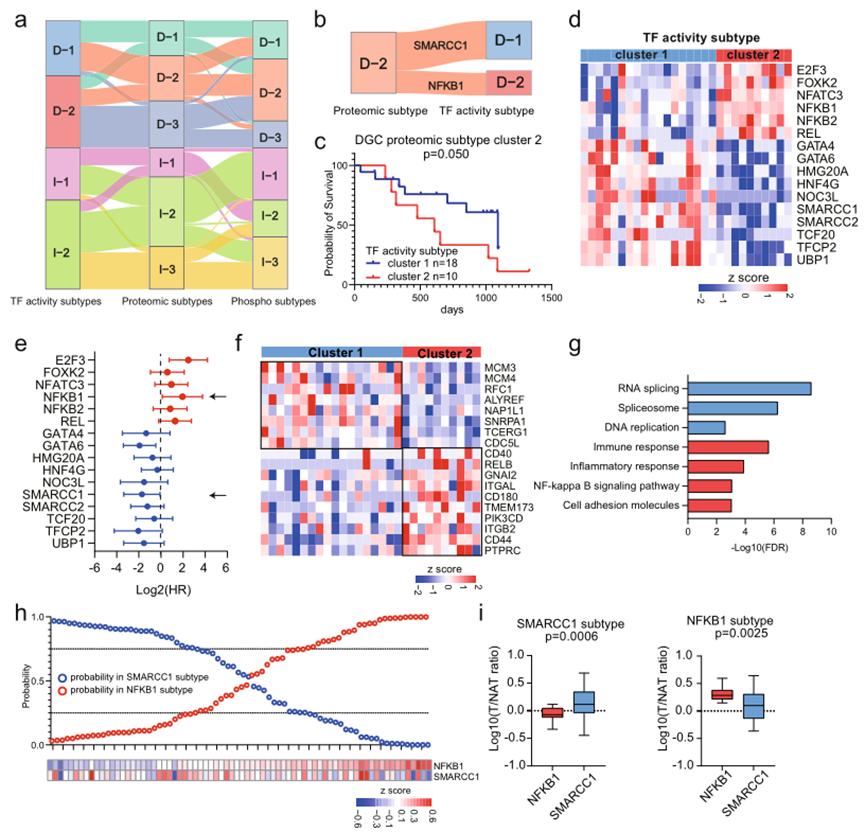
图6 多水平蛋白质组亚型的特征及其稳健性
7、GC免疫浸润的表征
为更好地理解GC肿瘤中免疫细胞浸润的概念,对蛋白质组学数据进行了xCell分析,推断了TME中多样性细胞类型的相对丰度(Fig. 7)。基于推断的细胞比例的共识聚类确定了以下三组具有不同免疫特征和基质特征的肿瘤集群:免疫cluster 1(n = 69),免疫cluster 2(n = 65),免疫cluster 3(n = 49;Fig. 7a, b)。作者发现免疫cluster 1具有较低的免疫和基质评分,并且上皮细胞的比例较高。正如预期的那样,ssGSEA分析表明在免疫cluster 1中上调了上皮细胞形态发生和有丝分裂细胞周期相转变的正调节。此外,上皮细胞的经典标志物,即EPCAM,KRT18,MUC1和CDH1,在免疫cluster 1中的表达高于其他cluster(Fig. 7a)。此外,巨噬细胞的经典标志物,即TLR2和ARG148,以及免疫治疗靶点,即FCGR1A,CD276和CD2720,在免疫cluster 2中的表达高于其他cluster(Fig. 7a)。至于免疫cluster 3,比其他cluster更高的基质评分,以及成纤维细胞,淋巴内皮细胞和微血管内皮细胞的比例较高。成纤维细胞增殖,ECM组装和基于肌动蛋白丝的运动的调节在免疫cluster 3中富集。内皮细胞的经典标志物,即DCN,在免疫cluster 3中的表达高于其他cluster(Fig. 7a)。因此,免疫亚型被定义为上皮亚型(cluster 1,冷瘤),免疫亚型(cluster 2,热瘤)和内皮亚型(cluster 3,Fig. 7b)。
多变量Cox回归分析显示,免疫亚型(cluster 1–3)在调整其他临床covariates后与预后相关(Fig. 7c, d)。有趣的是,在免疫cluster 3中,DGC和IGC患者表现出相反的预后趋势。对于IGC患者,免疫cluster 3有着最好的预后,而对于DGC患者,免疫cluster 3有着最差的预后(红线;Fig. 7c, d)。为解决这个问题,比较了在免疫cluster 3中DGC和IGC患者的免疫细胞浸润情况。共同淋巴祖细胞、NK细胞和Th2细胞在IGC患者中的水平高于DGC患者,而CD4+记忆T细胞、CD8+ T细胞和Th1细胞在DGC患者中的水平高于IGC患者(Fig. 7e)。DGC患者在免疫cluster 3中具有较高的Th1/Th2比率(Fig. 7f)。值得注意的是,对于所有GC患者,Th1/Th2比率与预后呈负相关(Fig. 7g),表明Th1/Th2比率可以作为GC患者的预后指标。
为验证Th1/Th2比率与免疫治疗有效性之间的关系,收集一组接受抗PD1治疗的GC患者,包括7例反应迅速的病例(部分缓解,PR)和7例反应不佳的病例(疾病稳定/进展,SD/PD)。收集了来自14名治疗前的GC患者的甲醛固定石蜡包埋(FFPE)肿瘤组织切片。总共测得了7705种蛋白质,平均每个样本鉴定了4575种蛋白质。通过基于蛋白质组学轮廓的xCell分析评估了这14个样本中的免疫细胞浸润。如图7h所示,计算了14个样本的Th1/Th2比率值。发现与非应答组相比,应答组的Th1/Th2比率显著更高(Fig. 7i)。这一结果表明,Th1/Th2比率可能是预测GC患者免疫治疗临床结果的指标(Fig. 7j)。因此,Th1/Th2比率与免疫治疗有效性之间的关系在一个独立的胃癌抗PD1治疗患者群中得到了进一步验证。
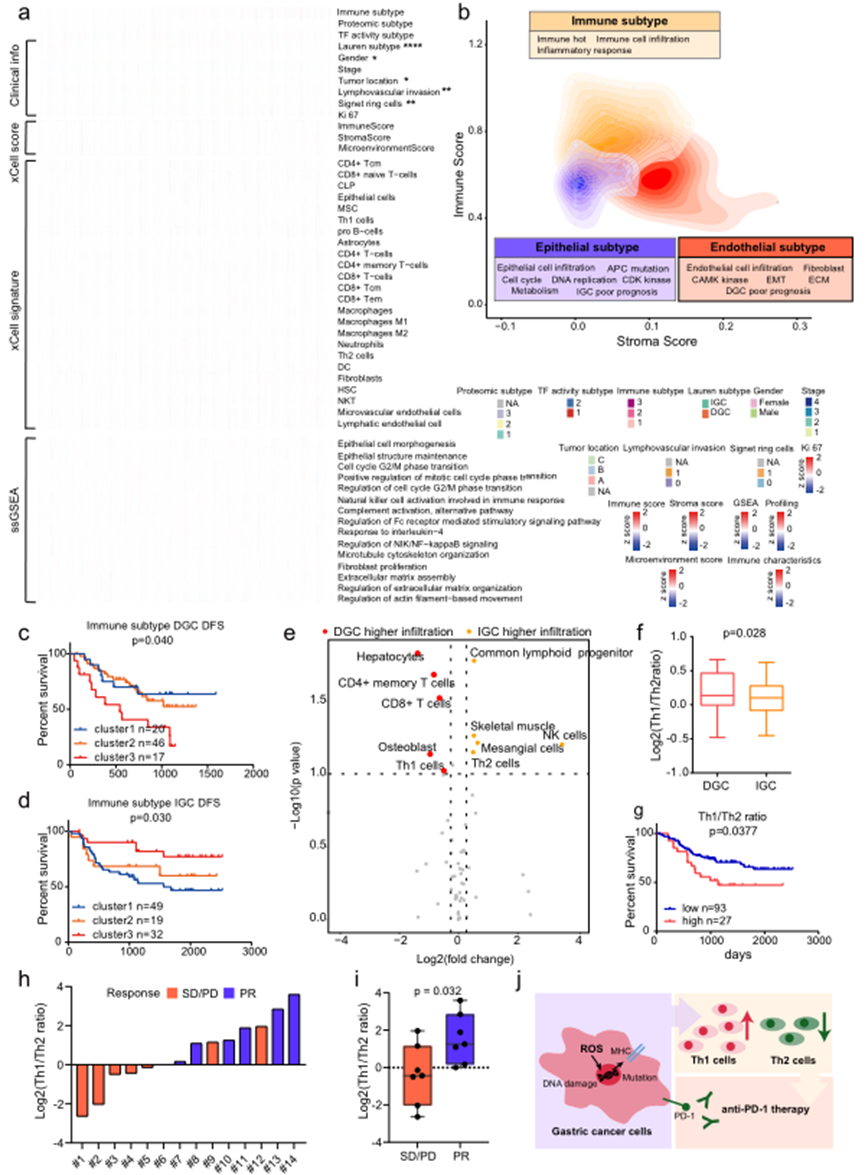
图7 GC免疫浸润的表征
实验方法
临床队列的构建,抗PD1患者组样本采集,细胞系的来源,靶向外显子组测序,蛋白质提取和胰蛋白酶消化,磷酸化肽的富集,核蛋白的提取,TFRE pull-down,LC-MS/MS和数据处理,生物信息学分析
参考文献
Shi W, Wang Y, Xu C, Li Y, Ge S, Bai B, Zhang K, Wang Y, Zheng N, Wang J, Wang S, Ji G, Li J, Nie Y, Liang W, Wu X, Cui J, Wang Y, Chen L, Zhao Q, Shen L, He F, Qin J, Ding C. Multilevel proteomic analyses reveal molecular diversity between diffuse-type and intestinal-type gastric cancer. Nat Commun. 2023 Feb 14;14(1):835. doi: 10.1038/s41467-023-35797-6. PMID: 36788224; PMCID: PMC9929250.






