外泌体lncAKR1C2编码的微蛋白通过调节脂肪酸代谢促进胃癌淋巴结转移
淋巴结转移(Lymph node metastasis, LNM)是胃癌传播的重要途径,常导致肿瘤进展,胃癌预后较差。尽管外泌体lncRNAs已被报道参与肿瘤的发展,但分泌的lncRNAs是否可以在受体细胞中编码肽仍然未知。在这里,我们发现了一个外泌体lncRNA (lncAKR1C2),它在临床上以不依赖于VEGF的方式与胃癌的淋巴结转移相关。胃癌细胞分泌的Exo-lncAKR1C2在体内可促进淋巴内皮细胞的管状形成和迁移,促进淋巴管生成和淋巴转移。通过比较LN转移灶与原发病灶的代谢特点,我们发现胃癌LN转移灶具有较高的脂质代谢活性。此外,外泌体lncAKR1C2在淋巴内皮细胞中编码一种微蛋白(pep-AKR1C2),并通过调节YAP磷酸化促进CPT1A的表达,从而增强脂肪酸氧化(FAO)和ATP的产生。这些发现强调了LNM的新机制,并提示外泌体lncAKR1C2编码的微蛋白可作为晚期胃癌的治疗靶点。本文于2023年10月发表于“Cell Death and Disease”(IF=9.0)上。
技术路线

结果
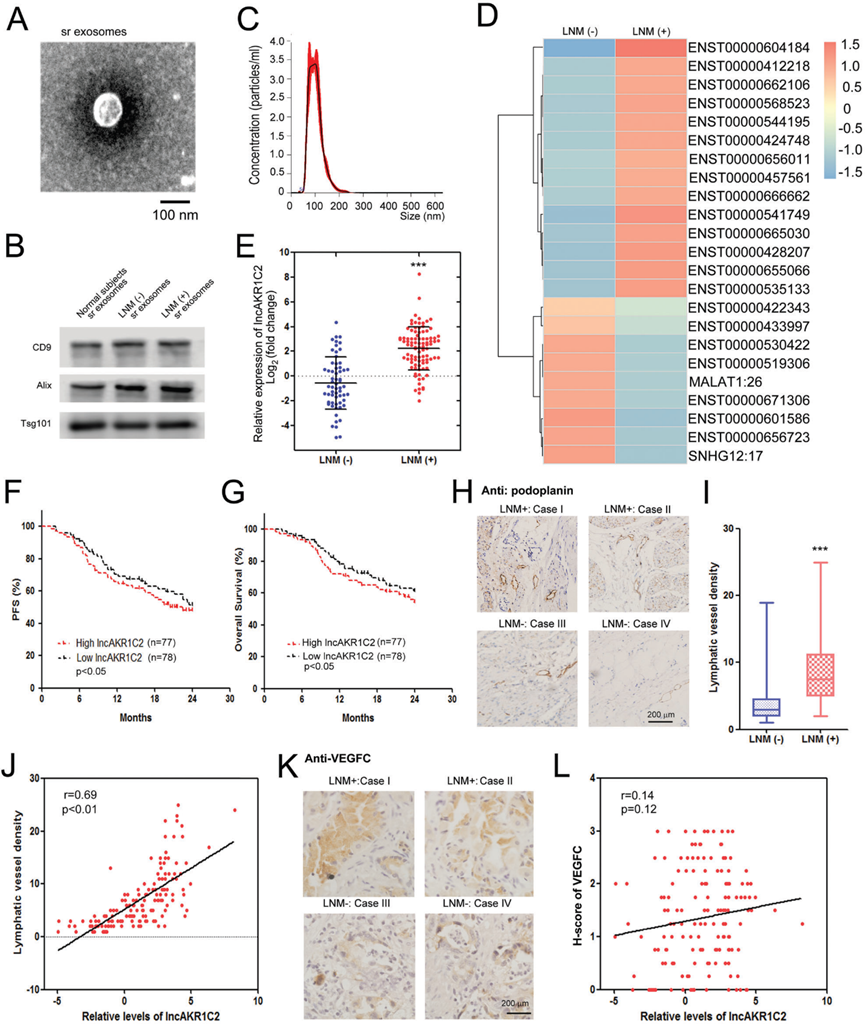
1)外泌体lncAKR1C2与胃癌淋巴结转移呈正相关
为了确定与LNM相关的外泌体lncRNA,我们在手术前分离II/III期GC患者的血清外泌体,并进行lncRNA-seq。通过透射电镜观察LNM-组和LNM+组的外泌体(图1A),并通过WB分析检测外泌体标志物CD9、Tsg101和Alix(图1 B)。外泌体的大小通过纳米跟踪分析确定,这些血清外泌体的直径约为30-150 nm(图1C)。高通量测序结果显示,与没有LNM的患者相比,LNM+组的一系列外泌体lncRNAs发生了显著变化。lncRNA ENST00000604184 (lncAKR1C2)的表达量最高(图1D)。扩大样本的进一步检测结果证实,与LNM-组相比,LNM+组的exo-lncAKR1C2表达量上调了8倍以上(图1E)。Kaplan-Meier分析显示,高水平的lncAKR1C2可预测较短的无进展生存期(PFS)(图1F)和总生存期(OS)(图1G)。使用anti-podoplanin抗体的免疫组化分析表明,LNM患者的淋巴管密度要高得多(图1H, 1I),lncAKR1C2水平与淋巴管密度呈正相关(图1 G)。尽管在胃癌合并LNM患者中VEGFC也上调(图1K),但VEGFC与lncAKR1C2之间没有显著相关性(图1L)。这些结果表明外泌体lncAKR1C2与胃癌中LNM相关,该过程可能不依赖于VEGFC。
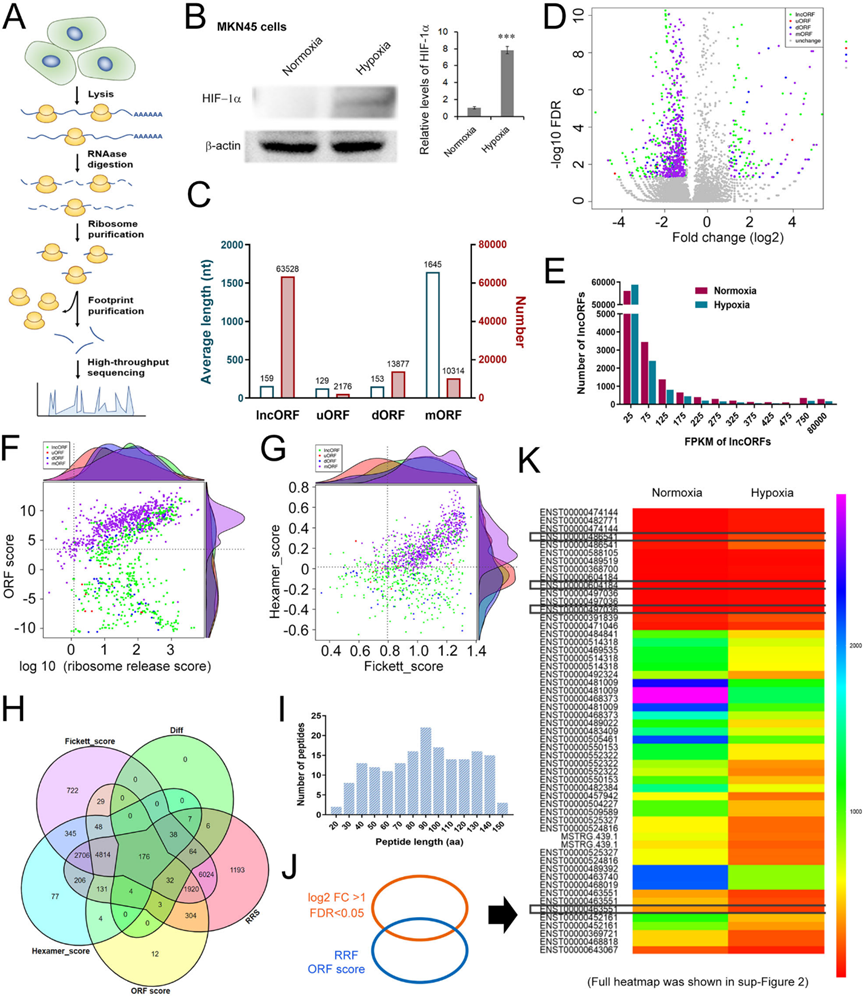
2)lncAKR1C2具有编码微蛋白的潜力
接下来,我们使用翻译组学分析了lncAKR1C2的特征。Rio-seq的流程图如图2A所示。由于缺氧是实体肿瘤的共同特征之一,我们比较了低氧和常氧条件下胃癌细胞lncRNA翻译组学的差异。缺氧诱导因子-1α (HIF-1α)在缺氧处理下的MKN45细胞中显著上调(图2B)。除了主要的蛋白质编码ORF (mORF)外,还鉴定了一些来自传统上被认为不能编码蛋白质的RNA的小于300个核苷酸(nt)的sORF,包括来自lncRNAs的lncORF、来自mRNA上游区域的uORF和来自mRNA下游区域的dORF。不出所料,lncORF、uORF和dORF的长度比mORF短得多,而lncORF的数量是mORF的6倍多(图2C)。这些ORF的折叠变化和错误发现率(FDR)如图2D所示,其中一组lncORF明显增加。所有鉴定的lncORF大部分小于125 FPKM(图2E),肽长度在30-140 aa之间(图2I)。ORF评分和RRS评分(核糖体释放评分)如图2F所示。Fickett评分和Hexamer评分如图2G所示。综合多个评分系统共筛选出176个 lncORFs (图2H)。图2J和图2K所示为这176个lncRNA表达的热图主体部分。综上,这些结果提示lncAKR1C2具有编码微蛋白的潜力。
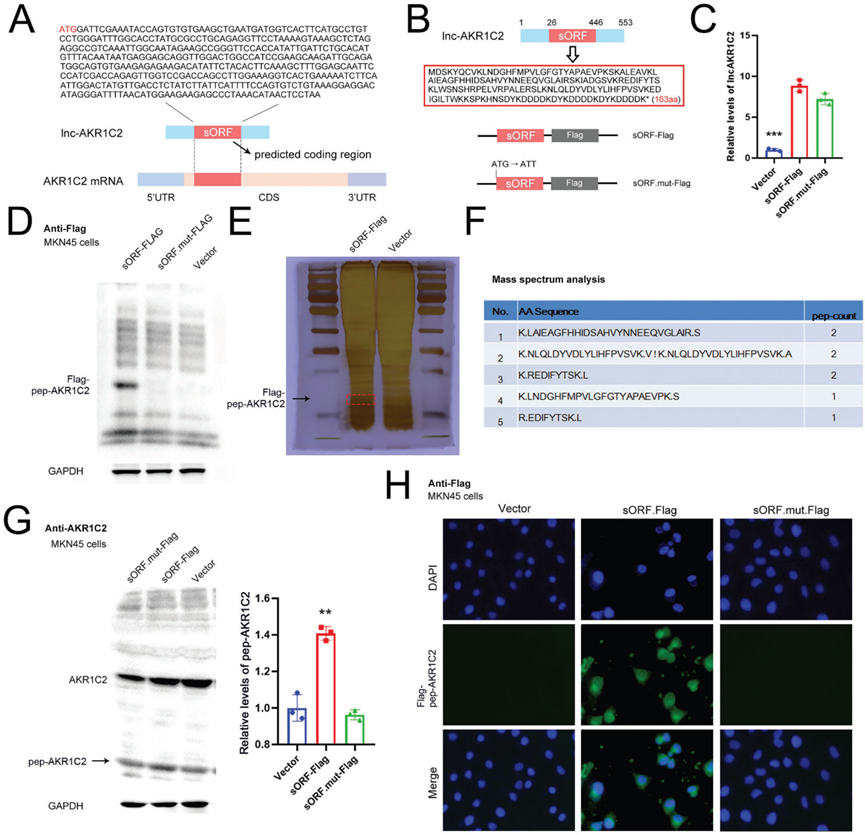
3)lncAKR1C2编码微蛋白在胃癌细胞中的检测
根据Ribo-Seq分析,选择了四个具有编码短肽潜力的lncRNA进行后续验证。为了检测lncRNA编码肽的表达,我们构建了包含4个lncRNA全序列的质粒。使用抗flag抗体进行WB分析,证实ENST00000486541和ENST00000604184 (lncAKR1C2)具有编码短肽的能力(补充图)。lncAKR1C2和AKR1C2 mRNA的预测编码区(sORF)如图3A所示,AKR1C2 mRNA的CDS区覆盖了sORF的全长。RNA-seq数据表明,lncAKR1C2具有编码163-aa短微蛋白的潜力(称为pep- AKR1C2),因此构建了具有突变初始密码子(ATG→ATT)的lncAKR1C2过表达质粒(图3B)。野生型(sORF-Flag)和突变型lncAKR1C2 (sORF.mutt-Flag)均导致lncAKR1C2 RNA水平升高(图3C)。但flag标记的pep-AKR1C2仅在sORF-Flag组中检测到(图3D)。我们使用银染色结合质谱(MS)对pep-AKR1C2进行分析,MS检测到的片段氨基酸序列与Ribo-Seq预测一致(图3E, 3F)。由于pep-AKR1C2是宿主基因(AKR1C2)的一部分,使用抗AKR1C2抗体也可以检测到pep-AKR1C2的表达(图3G)。最后,通过免疫荧光(IF)测定pep-AKR1C2的分布,pep-AKR1C2主要存在于细胞质中(图3H)。综上所述,这些结果表明lncAKR1C2在胃癌细胞中编码163-aa微蛋白。
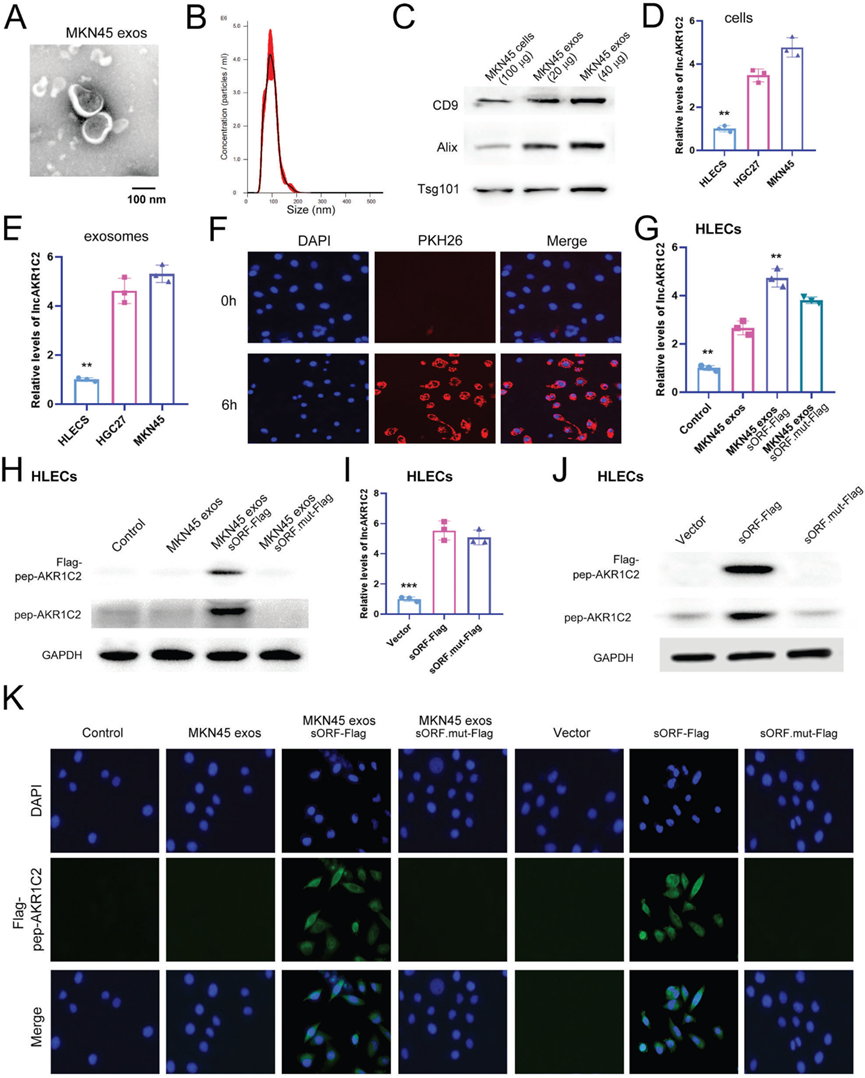
4)外泌体传递的lncAKR1C2编码淋巴内皮细胞中的一种微蛋白
临床分析数据表明外泌体lncAKR1C2与淋巴管生成和LNM有关,我们接下来检测了lncAKR1C2编码的pep-AKR1C2在人淋巴内皮细胞(HLECS)中的表达。通过透射电镜、NTA和WB分析观察MKN45细胞外泌体,大多数外泌体直径约为100 nm(图4A-4C)。通过比较lncAKR1C2在GC细胞和HLECS中的水平,我们发现lncAKR1C2在GC细胞和GC外泌体中都明显过表达(图4D, 4E)。MKN45细胞分别过表达野生型lncAKR1C2或突变型lncAKR1C2,并收集外泌体。这些外泌体用PKH26标记并与HLECS共培养,在6小时内观察到MKN45外泌体与HLECS融合(图4F),导致HLECS中lncAKR1C2显著上调(图4G)。如图4H所示,Flag-pep-AKR1C2仅在含有野生型sORF-Flag的MKN45外泌体处理的HLECS细胞中检测到,并且pep-AKR1C2在MKN45外泌体sORF-Flag组中增加,这表明外泌体lncAKR1C2可以在HLECS细胞中编码微蛋白。为了提供淋巴内皮细胞中pep-AKR1C2存在的直接证据,我们用野生型lncAKR1C2、突变型lncAKR1C2或空白载体转染HLECS。WB分析结果显示与外泌体处理组的效果相同(图41、4J)。此外,IF分析也表明pep-AKR1C2主要存在于HLECS细胞的细胞质中(图4K)。因此,这些数据表明GC分泌的exo-lnAKR1C2可以在淋巴内皮细胞中编码微蛋白,而pep-AKR1C2可能在细胞质中起作用。
5)淋巴管生成需要依赖外泌体lncAKR1C2的代谢向FAO转移
我们通过GC足垫植入模型和代谢组学分析来确定GC淋巴结转移的代谢特征(图5A, 5B)。图5C显示了原发性GC肿瘤(植入足垫)和LN代谢肿瘤的代谢组谱比较,LN转移中观察到更高水平的脂质代谢。正如预期的那样,用GC外泌体或lncAKR1C2处理的淋巴内皮细胞显示出更高的OCR和最大呼吸能力的增加(图5D, 5E)。然而,突变的lncAKR1C2对HLECS的OCR影响很小。为了评估外泌体lncAKR1C2在脂肪酸代谢中的作用,将HLECS细胞用油酸(OA)处理24小时,然后在低糖培养基中再培养48小时,以充分利用脂肪酸。MKN45外泌体和lncAKR1C2显著促进了HLECS细胞对OA和ATP的利用,特别是在过表达野生型lncAKR1C2的MKN45外泌体中(图5F, 5G)。在MKN45外泌体组中,HLECS细胞形成的环的数量和迁移细胞的数量都有所增加,并且在使用野生型lncAKR1C2过表达的MKN45外泌体处理时,数量最多。转染lncAKR1C2也显示出类似的效果(图5H)。这些结果表明GC分泌的lncAKR1C2促进淋巴管内皮细胞的形成和迁移。
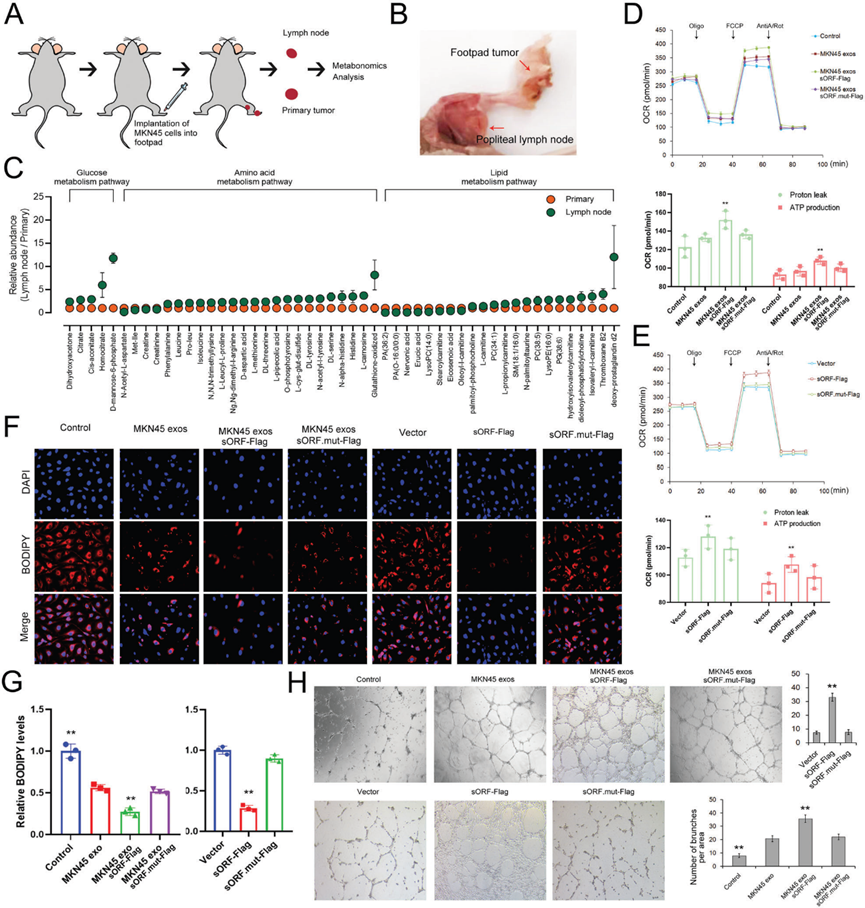
6)LncAKR1C2编码的微蛋白通过YAP途径促进淋巴内皮细胞中CPT1A的表达
为了探索pep-AKR1C2介导脂肪酸代谢和淋巴管生成的潜在机制,我们采用co-IP结合LC-MS/MS对与pep-AKR1C2相互作用的蛋白进行鉴定。质谱法检测到的63种蛋白,其中包括Hippo通路核心蛋白之一YAP (yesassociated protein)(图6A)。MKN45外泌体和lncAKR1C2对YAP总表达(t-YAP)影响不大,但显著降低了磷酸化的YAP水平(p127-YAP)(图6B),这反过来促进了YAP进入细胞核(图6C)。随后,通过免疫荧光共定位分析也验证了YAP与pep-AKR1C2之间的直接相互作用(图6D)。考虑到近年来已有研究报道了YAP与CPT1A之间的关系,我们也检测了CPT1A在HLECS细胞中的表达。GC分泌的外泌体lncAKR1C2显著上调了CPT1A mRNA和蛋白水平(图6E, 6F)。此外,lncAKR1C2对脂肪酸利用和ATP产生的影响被证明依赖于CPT1A(图6G, 6H)。这些数据表明,外泌体lncAKR1C2编码的pep-AKR1C2通过降低YAP磷酸化来促进与FAO相关的CPT1A表达。
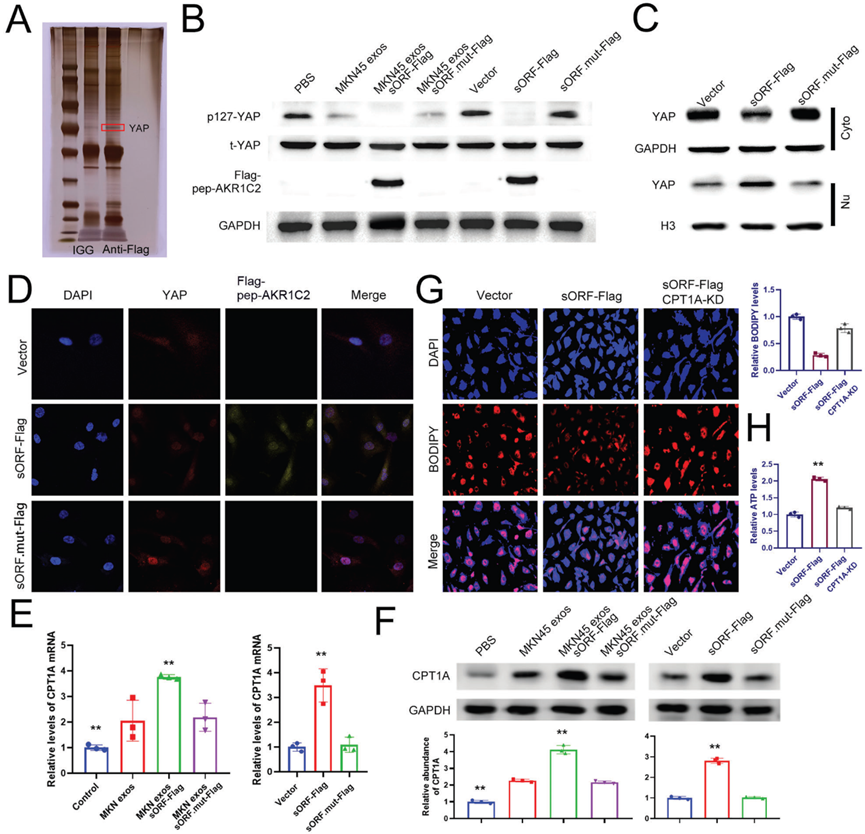
7)外泌体lncAKR1C2促进体内淋巴转移
为了进一步研究外泌体lncAKR1C2对淋巴结转移的影响,我们建立了腘窝淋巴转移模型。将上述处理过的MKN45细胞植入裸鼠足垫,第40天切除肿瘤和腘窝淋巴结(图7A)。in Vivo Imaging System显示,lncAKR1C2过表达可显著促进淋巴结转移,lncAKR1C2下调可显著抑制淋巴结转移和原发肿瘤生长(图7B,7C)。lncAKR1C2野生型组的淋巴结体积和重量也最高(图7D,7E)。透射电镜检测小鼠血清外泌体,如图7F所示。与体外实验一致,野生型lncAKR1C2,而非突变型lncAKR1C2,增强了胃癌的肿瘤发生和淋巴管生成(图7G, 7H)。从机制上看,上调外泌体lncAKR1C2通过编码微蛋白促进淋巴结中CPT1A的表达(图7I-K)。因此,这些结果提供了GC-exo-lncAKR1C2编码微蛋白促进淋巴转移的体内证据。
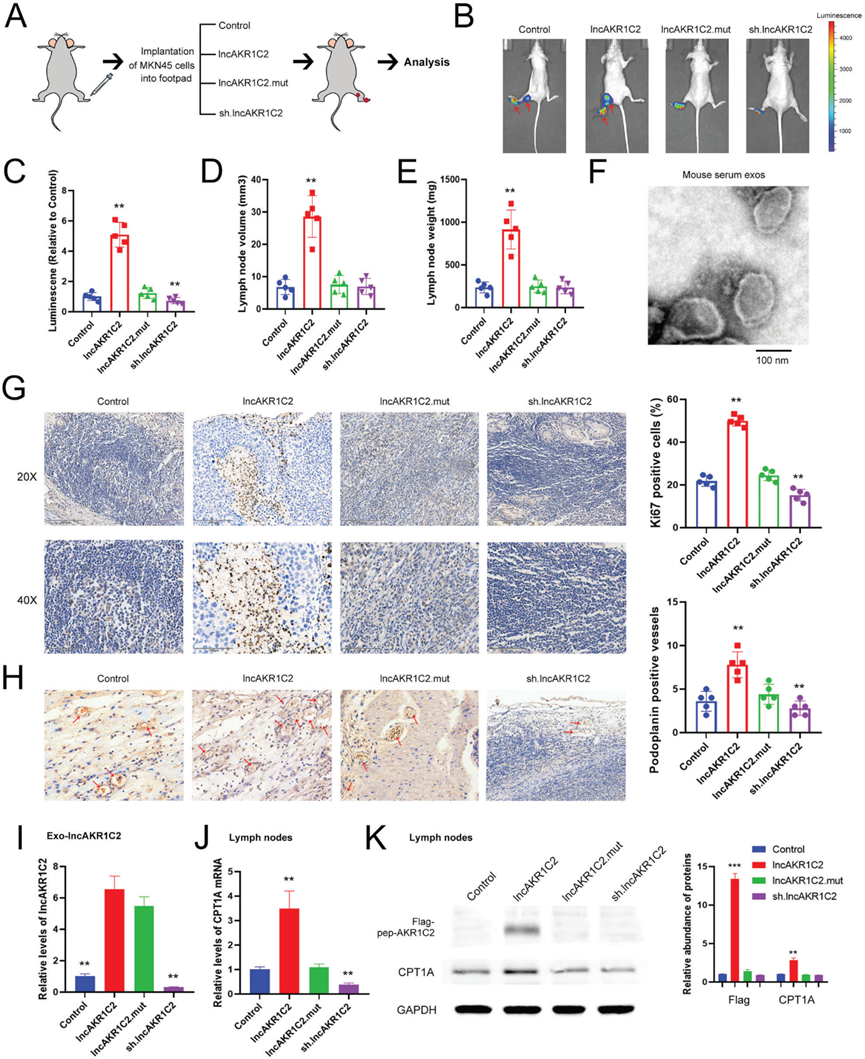
8)lncAKR1C2在肿瘤发生中的体内作用
我们通过皮下异种移植模型研究了lncAKR1C2在体内的作用。用慢病毒感染MKN45细胞,使其过表达野生型或突变型lncAKR1C2,或敲低lncAKR1C2,然后将这些细胞用于小鼠肿瘤植入(图8A)。结果表明,野生型lncAKR1C2而非突变型lncAKR1C2增强了肿瘤生长,而下调lncAKR1C2抑制了小鼠模型中的肿瘤发生(图8B, 8C)。lncAKR1C2组的肿瘤直径、体积和重量也更大(图8D-8F)。在WT lncAKR1C2组中也观察到更高水平的增殖标志物Ki67,而lncAKR1C2的敲低导致Ki67水平急剧下降,突变组和对照组之间没有显著差异(图8G)。最后,我们提供了一个示意图来展示GC分泌的lncAKR1C2编码的微蛋白在促进淋巴内皮细胞脂质代谢和淋巴转移中的生物学作用(图8H)。

结论:
GC来源的exo-lncAKR1C2编码的微蛋白通过调节YAP磷酸化和CPT1A表达促进淋巴管生成和LN转移,这依赖于淋巴内皮细胞向脂肪酸氧化的代谢转变。我们的研究结果为研究外泌体递送的非编码RNA提供了见解,并强调了靶向lncAKR1C2在胃癌中的诊断和治疗潜力。
实验方法:
外泌体分离,TEM,NTA,PKH26染色,质谱,FA定量,ATP定量,WB,qRT-PCR,核糖体测序,RNA测序,免疫沉淀,免疫荧光,IHC,动物实验。
参考文献:
Zhu KG, Yang J, Zhu Y, Zhu Q, Pan W, Deng S, He Y, Zuo D, Wang P, Han Y, Zhang HY. The microprotein encoded by exosomal lncAKR1C2 promotes gastric cancer lymph node metastasis by regulating fatty acid metabolism. Cell Death Dis. 2023 Oct 30;14(10):708. doi: 10.1038/s41419-023-06220-1.






