ELF5通过稳定肾细胞癌中的WDTC1来抑制血管生成
膳食来源的营养素通过提供能量和生物合成构件以及作为调节分子发挥作用,与人体生理有着千丝万缕的联系。然而,人体循环中的营养物质影响特定生理过程的机制仍不清楚。在这里,作者使用基于血液营养素化合物库的筛选方法来证明膳食十八碳烯酸(TVA)在体内直接促进效应CD8+T细胞功能和抗肿瘤免疫。TVA是母乳中富集的反式脂肪酸的主要形式,但人体不能内源性产生TVA。人类循环中的TVA主要来自反刍动物来源的食物,包括牛肉、羊肉和牛奶、黄油等乳制品,但人类或小鼠分别只有19%或12%的膳食TVA被转化为鲁美尼克酸。在机制上,TVA使细胞表面受体GPR43失活,GPR43是一种被其短链脂肪酸配体激活的免疫调节G蛋白偶联受体。因此,TVA拮抗GPR43的短链脂肪酸激动剂,导致cAMP-PKA-CREB轴的激活,从而增强CD8+T细胞功能。这些发现表明,与宿主内肠道微生物群来源的短链脂肪酸不同,饮食来源的TVA代表了一种宿主-外源性CD8+ T细胞重编程的机制。因此,TVA在肿瘤治疗中具有转化潜能。本文于2023年11月发表于《Nature》,IF: 64.8;Q1。
技术路线:
主要实验结果:
1、增强T细胞功能的营养素
作者利用初始筛选(1a)确定了增强由CD3和CD28抗体(抗CD3/CD28)刺激的Jurkat T细胞活化的营养素(图1a,顶部)。使用Screen 1b筛选可挽救表达PD - L1的人H596肺癌细胞共培养诱导稳定表达PD-1的Jurkat T细胞PD-L1-PD-1依赖性耗竭的营养素(图1a,底部)。TVA排在首位,并进一步证实其可以增强小鼠和人类原代T细胞的IL-2产生,并挽救共培养表达PD - L1的人类癌细胞诱导的Jurkat T细胞的PD - L1 - PD -1依赖性耗竭。
2、膳食TVA增强抗肿瘤免疫
作者发现TVA通过T细胞发挥作用。此外,与喂食对照饮食的小鼠相比,在喂食富含TVA饮食的同系小鼠中,免疫原性B16F10细胞的肿瘤生长潜力显著减弱(图1b,顶部)。相比之下,喂食富含CVA的饲料或对照饲料的对照组B16F10细胞的肿瘤生长潜力没有差异(图1b,底部)。数据表明TVA通过调节CD8+T细胞来促进抗肿瘤免疫。
3、TVA增强CD8+T细胞功能
流式细胞术分析显示,TVA饮食导致肿瘤浸润淋巴细胞(TILs)中的CD8+T细胞群增加,而对照CVA饮食没有这一结果。相比之下,TILs中的CD4+ T细胞群未发生改变(图1d)。
TVA饮食导致B16F10肿瘤和dLNs中浸润的CD45+白细胞中CD8+T细胞的百分比较高,但脾脏中未出现这一情况(图1e)。耗竭标志物PD-1(图1f)的表达水平降低,膳食TVA减少了肿瘤和脾脏中CD8+T细胞的耗竭,但在dLNs中无此作用。对具有其他代表性标记的肿瘤浸润CD8+ T细胞的进一步分析表明,膳食TVA促进CD8+ T细胞功能,增加细胞因子水平,包括TNF(图1g),增殖标志物Ki-67,共刺激受体ICOS和细胞溶解分子GZMB(图1h),以及茎样CD8+T细胞存活标记TCF1(图1i)。总之,这些结果表明,膳食TVA促进肿瘤浸润的CD8+T细胞的聚集和功能。
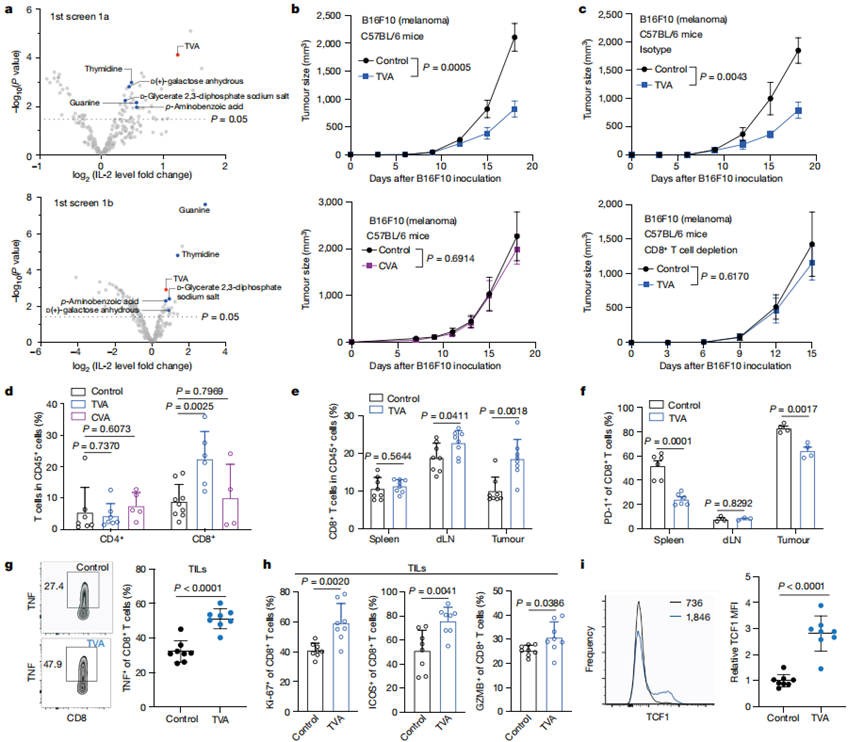
图1 膳食TVA通过效应物CD8+T细胞增强抗肿瘤免疫
4、TVA信号通过GPCR-CREB轴
接下来,作者确定TVA是在细胞外还是细胞内发挥作用。作者使用整合的时间机制研究来研究TVA对人类或小鼠原代CD8+T细胞的影响,包括:(1)酮乙氧基辅助的单链DNA测序(KAS-seq)方法,通过捕获全局转录动力学来确定TVA对细胞的初始(20分钟- 2小时)效应;(2)磷酸化抗体芯片识别早期(40 min-24 h)细胞信号通路的变化;(3)RNA测序(RNA-seq)方法(24 h),用于全转录组分析。通过对基因组水平的KAS-seq结果进行功能富集,发现TVA处理的CD8+T细胞中富集程度最高的基因体具有GPCR活性(图2a)。与这一发现一致的是,早在TVA处理后40分钟,作者就观察到跨转录因子CREB(GPCRs的共同下游效应因子)的磷酸化增加(图2b)。
值得注意的是,TVA处理增强了在效应性CD8+T细胞功能中富集的基因E2F(图2c)的表达,与增强的CD8+T细胞功能和增殖相关。TVA处理还上调了Creb1(编码CREB)以及Prkacb和Prkaca(分别编码cAMP依赖性蛋白激酶A (PKA)的催化亚基α和β)的表达(图2d)。综上所述,这些结果表明TVA增强CD8+T细胞功能是通过GPCR-CREB途径介导的,正反馈增强PKA和CREB在基因水平的表达。
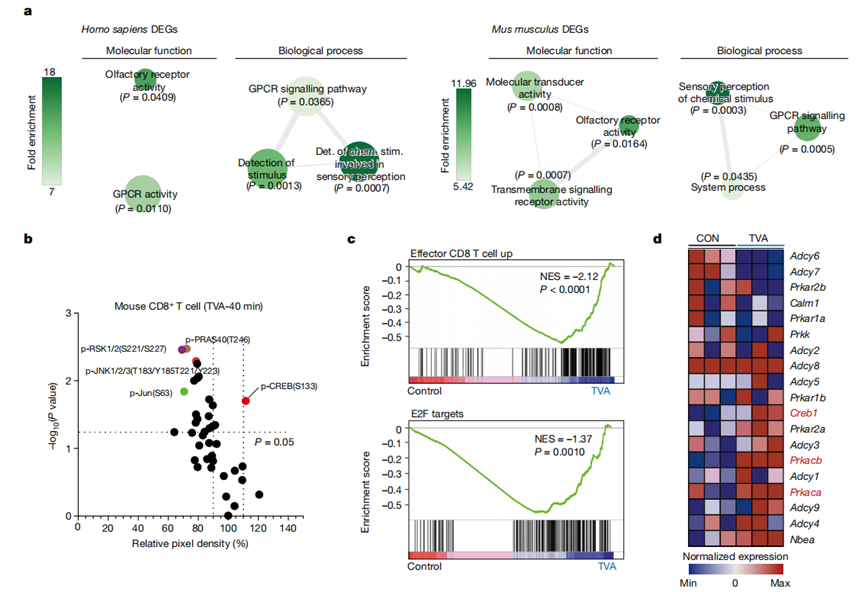
图2 TVA通过GPCR-CREB轴具有调节功能
5、TVA的作用需要CREB
作者使用CD8+T细胞和Creb1敲低对照细胞,在TVA存在或不存在的情况下,用非靶向对照(siNTC)短抑制RNA(siRNA)处理。主成分分析表明,在TVA存在和不存在的情况下,使用靶向Creb(siCreb1)的siRNA处理的细胞可被分组在一起,并与siNTC对照细胞组或使用TVA处理的对照细胞组分离(图3a)。GSEA分析显示,敲低CREB逆转了与效应性CD8+ T细胞功能和细胞增殖相关的TVA依赖的基因集上调,包括E2F(图3b)。
为了进一步确定TVA - CREB的下游靶点,作者表征了仅在siNTC + TVA组与其他三个组相比上调或下调的基因(图3c,左侧)。共312个上调基因富集在11个GO类别,包括细胞周期、细胞增殖、细胞分裂、T细胞聚集、T细胞活化、T细胞差异分化和细胞因子产生(图3c,右上)。相比之下,共有139个下调基因被富集在8个GO类别中,包括凋亡和染色质组织(图3c,右下)。为了进行功能验证,作者选择了4个在细胞增殖和T细胞功能中至关重要的上调基因。这些基因包括Il18(与细胞增殖、T细胞活化和细胞因子产生相关)、Ebi3(与细胞增殖和T细胞活化相关)、Tbx21(与T细胞活化和细胞因子产生相关)和Ilf2(与细胞增殖、T细胞活化和细胞因子产生相关)。作者还测试了Foxo4和Bcl6,它们是与凋亡相关的GO分类中的关键基因。
如图3d所示,与siNTC处理的对照细胞相比,通过siCreb1敲低Creb1的表达有效地逆转了TVA依赖的细胞数量和凋亡,以及CD8+T细胞中Ki-67、IL-2、TNF和IFNγ水平的变化。敲低Il18、Ebi3、Tbx21、Ilf2、Foxo4或Bcl6部分逆转了TVA依赖性细胞数量的变化(图3d,左)。Bcl6、Foxo4或Ebi3的敲低部分逆转了CD8+T细胞凋亡群中的TVA依赖性变化,而Il18、Tbx21或Ilf2的敲低没有这种作用(图3d,中)。敲低Il18、Tbx21、Ilf2或Ebi3部分逆转了Ki-67水平的TVA依赖性变化,而敲低Bcl6或Foxo4没有这种作用(图3d,右)。总之,这些结果确立了不同的CREB靶基因对CD8+T细胞中不同的TVA依赖变化的功能贡献。
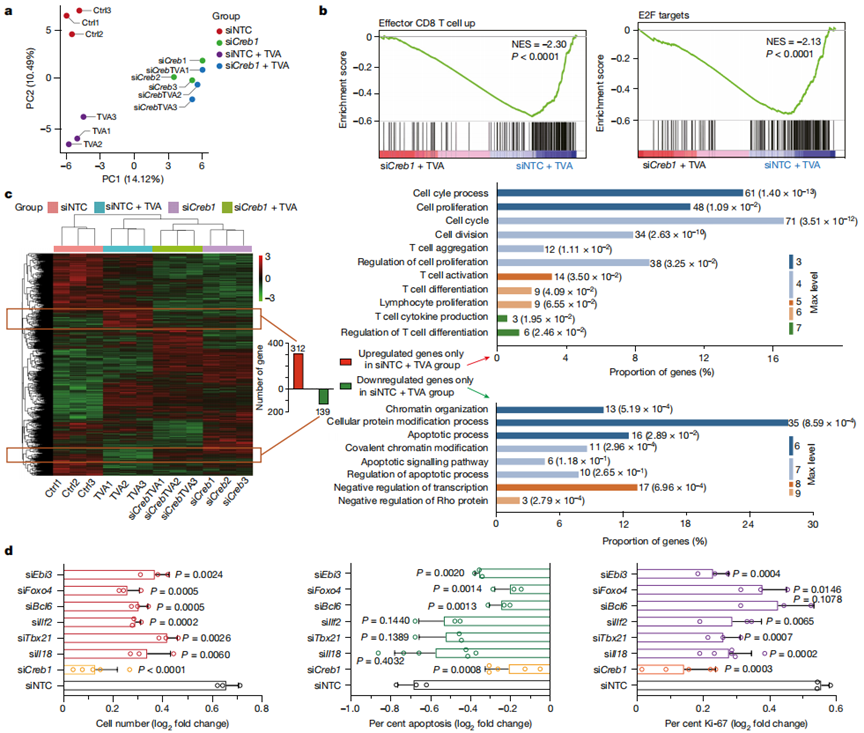
图3 TVA对CD8+ T细胞的作用主要通过CREB及其靶基因集介导
6、TVA使结合SCFA的GPR43失活
为了确定TVA的GPCR靶点,作者通过siRNA介导的敲低筛选了6个已知的脂肪酸结合GPCRs,其中,只有敲低GPR43才能消除原代小鼠CD8+T细胞中TVA增强的TNF水平(图4a)。使用siRNA介导的GPR43敲低的OT-I T细胞和使用CRISPR-Cas9敲低GPR43的OT-I T细胞(图4b)获得了类似结果。这些数据表明,GPR43在CD8+T细胞活化中具有抑制作用,TVA可能减弱GPR43的功能。这可能部分解释了活化的CD8+T细胞对TVA治疗敏感的原因。
接下来,作者对TVA进行了构效关系(SAR)研究。SAR研究的结果表明,双键(1),酸基(2)和长度至少16个碳(3,4,13,15和16)是维持TVA生物活性的关键。此外,将双键的位置从C11-C12转移到C9-C10(6),或添加一个C9-C10双键(7),都会增强TVA的生物活性,表明C9-C10双键可能是最适合TVA生物活性的双键。对9、10、14和17的SAR结果也表明,末端链可以进行修饰,得到的TVA衍生物保留了70-80%的生物活性。接下来,作者使用经TVA探针3处理的小鼠CD8+T细胞进行了光亲和标记研究。重氮嘧啶使之能够共价光交联到接触蛋白残基并且炔基使之能够连接报告子(生物素)并探测TVA结合蛋白靶点。使用链亲和素珠下拉的生物素标记蛋白的蛋白质印迹显示TVA探针与GPR43之间的结合(图4c)。
作者接着发现,通过降低TNF(图4d)水平评估,将醋酸SCFA浓度增加至20 mM可减弱CD8+T细胞活化。20 μM TVA有效地逆转了这一读数。相比之下,2 μM TVA足以逆转20 mM醋酸盐对CD8+T细胞的抑制(图4e)。相反,20 μM TVA预处理增强的CD8+ T细胞活化不能被20 mM醋酸盐逆转。这些结果表明,TVA可能通过拮抗GPR43的SCFA激动剂结合并失活GPR43。
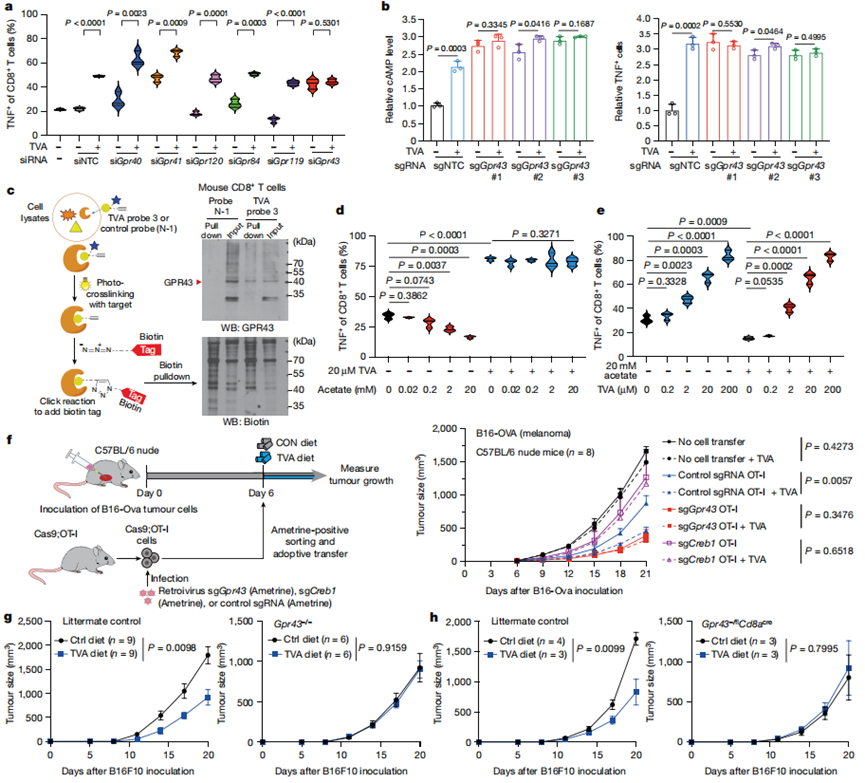
图4 TVA使SCFA结合的GPR43失活
7、TVA活性的GPR43要求
作者首先使用表达cas9的小鼠OT-I T细胞检测过继性细胞治疗(ACT)小鼠模型。作者使用接种了表达同源抗原(B16-OVA)的小鼠B16F10黑色素瘤细胞的同系小鼠作为OT-I T细胞的受体,以确定抗肿瘤免疫(图4f,左)。使用对照单向导RNA(sgRNA)过继转移OT-I细胞导致肿瘤生长降低,使用富含TVA的饮食进一步降低了肿瘤生长(图4f,右)。相比之下,使用CRISPR - Cas9介导的Gpr43敲除过继转移OT-I细胞显著降低了肿瘤生长,而TVA饮食无法进一步抑制肿瘤生长(图4f,右)。与这些发现一致,与对照OT-I细胞相比,采用CRISPR - Cas9介导的Creb1敲除的OT-I细胞过继转移导致小鼠的抗肿瘤效应减弱,并且对TVA饮食无应答(图4f,右)。
接下来,作者使用接种小鼠B16F10细胞的全身Gpr43敲除(Gpr43 - / -)小鼠进行同系小鼠模型实验。作者发现Gpr43 - / -小鼠的GPR43缺乏(通过Gpr43 mRNA水平在CD8+和CD4+T细胞以及B细胞中得到证实)消除了在同窝对照小鼠中观察到的TVA饮食依赖性肿瘤生长减少(图4g)。
CD8+T细胞中Gpr43的条件性敲除消除了在同窝对照小鼠中观察到的TVA饮食依赖性肿瘤生长的减少。综上所述,这些结果表明TVA需要CD8+T细胞中的GPR43来增强CD8+T细胞的功能,从而在体内产生抗肿瘤免疫。
8、TVA拮抗SCFAs对cAMP的作用
培养液中的SCFAs激活CD8+ T细胞中的GPR43,并使其易于发生TVA介导的失活。因此,作者比较了TVA和SCFAs对CD8+T细胞cAMP信号传导的相反作用。作者首先研究了SCFAs是否通过GPR41和GPR43以及pH感应器GPR65抑制CD8+ T细胞活性,因为与TVA等长链脂肪酸不同,SCFAs可溶于水并降低管腔pH。GPR65可被低pH激活,并通过Gαs发出信号,增加cAMP的产生以及随后CREB的磷酸化和激活。CD8+ T细胞活性的增加可被SCFA部分抑制。相比之下,敲低GPR65导致CD8+T细胞活性下降,而SCFA进一步降低,而敲低GPR41, GPR43和GPR65则完全消除了SCFA对CD8+T细胞的作用。相比之下,TVA在两种检测中均显示出最小的影响。总之,SCFAs抑制总体CD8+ T细胞活性,即GPR41和GPR43介导的cAMP负性调节可拮抗GPR65对cAMP水平的积极作用。
相比之下,作者发现TVA饮食不会改变来自对照或TVA饮食喂养的小鼠的血清和TIF样本中的pH,并且在来自具有不同TVA血清水平的一组淋巴瘤患者的人类初级血清样本中没有检测到pH的显著差异(详细描述见图5d)。最后,在使用表达Cas9的OT-I T细胞的ACT小鼠模型中,CRISPR - Cas9介导的Gpr65敲除导致肿瘤生长下降,然而,TVA饮食进一步降低了肿瘤生长(注意到前4个对照组来自图4f中描述的相同实验)。这些结果表明,在体外和体内,TVA不会降低pH值,也不会通过GPR65发出信号来增强CD8+T细胞功能,这支持作者的假设,即TVA使GPR43失活,并拮抗SCFAs对cAMP的总体负面影响。
9、TVA可增强基于T细胞的疗法
膳食TVA联合抗PD -1抗体(免疫检查点抑制剂治疗的代表)显示出对B16F10肿瘤生长的协同抑制作用(图5a)。作者接下来测试了TVA对博纳吐单抗(blinatumomab)疗效的影响,博纳吐单抗是一种靶向B细胞上的CD19和T细胞上的CD3的双特异性T细胞衔接器。在博纳吐单抗存在的情况下,TVA以剂量依赖性方式显著增强了人外周血单个核细胞(PBMCs)对人B-ALL RS4;11细胞的体外杀伤效率(图5b)。此外,TVA增加了来自3例42 ~ 47岁淋巴瘤患者原代T细胞的嵌合抗原受体(CAR)T细胞的体外扩增(图5c)。值得注意的是,在一项回顾性临床研究中,作者发现,对CAR-T细胞疗法有应答的淋巴瘤淋巴瘤患者组的血清TVA水平高于对CAR-T细胞疗法无应答的患者组(图5d)。这些发现与以下观点一致:通过膳食摄入TVA可能提高对T细胞免疫疗法的临床应答。
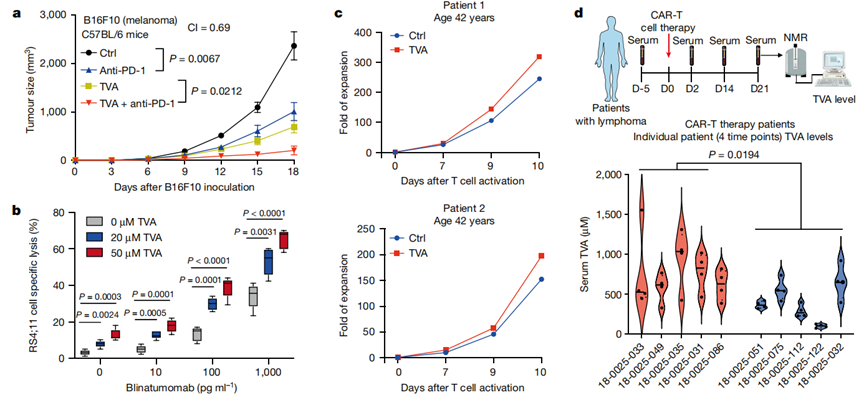
图5 TVA增强了多种基于T细胞的抗癌疗法的有效性
结论:
作者的研究结果揭示了人类饮食进化过程中的一种机制,即生物体外的TVA通过外源性调节重新编程CD8+T细胞,从而使GPR43失活,这与作为GPR43激动剂的肠道微生物群来源的生物体内SCFAs不同。TVA具有很高的转化潜力,可以作为一种膳食元素,改善多种抗肿瘤疗法的临床疗效,如免疫检查点抑制剂,T细胞衔接器,CAR-T和T细胞受体T细胞疗法。作者的研究支持补充TVA是一种比改变饮食更有针对性和有效的方式,有利于抗肿瘤免疫。GPR43-CREB机制可能对CD8+T细胞具有细胞类型特异性。最后,由于TVA与SCFAs相比体积较大,可能结合到一个不同的位点并作为负变构调节剂发挥作用。需要进一步的研究来阐明TVA使GPR43失活的潜在结构和分子机制。
实验方法:
PD-1+ Jurkat T细胞系构建;循环营养库筛选;小鼠肿瘤模型;饮食方案;抗体介导的T细胞耗竭;分泌细胞因子水平;Pmel-1杀伤实验;细胞增殖实验;核磁共振法提取和定量TVA水平;CD45+肿瘤浸润性白细胞分离;小鼠TIL分离;小鼠脾淋巴细胞分离;小鼠dLNs淋巴细胞分离;主要CD8+或CD4+T细胞分离和激活;流式细胞术;抗体;微生物组16S测序;[13C1]气相色谱-质谱法分析TVA代谢通量;细胞培养处理;KAS-seq和数据分析;实时定量PCR;RNA介导的细胞siRNA干扰;RNA测序;[13C]脂肪酸的体外示踪;海马脂肪酸氧化试验;小鼠OT-I细胞的CRISPR编辑;Pull-down试验鉴定交联蛋白-TVA复合物;与Blinatumomab共培养试验;CAR-T细胞扩增试验。
参考文献:
Fan H, Xia S, Xiang J, Li Y, Ross MO, Lim SA, Yang F, Tu J, Xie L, Dougherty U, Zhang FQ, Zheng Z, Zhang R, Wu R, Dong L, Su R, Chen X, Althaus T, Riedell PA, Jonker PB, Muir A, Lesinski GB, Rafiq S, Dhodapkar MV, Stock W, Odenike O, Patel AA, Opferman J, Tsuji T, Matsuzaki J, Shah H, Faubert B, Elf SE, Layden B, Bissonnette BM, He YY, Kline J, Mao H, Odunsi K, Gao X, Chi H, He C, Chen J. Trans-vaccenic acid reprograms CD8+ T cells and anti-tumour immunity. Nature. 2023 Nov 22. doi: 10.1038/s41586-023-06749-3. Epub ahead of print. PMID: 37993715.






