肿瘤来源的细胞因子CHI3L1诱导中性粒细胞胞外诱捕网促进三阴性乳腺癌的T细胞排斥
免疫疗法彻底改变了癌症治疗,并正在迅速成为癌症治疗的基石。尽管免疫检查点阻断(ICB)在多种癌症类型中取得了成功,但其在三阴性乳腺癌(TNBC)患者中的有限成功凸显出研究者需要更好地了解肿瘤免疫微环境(TIME)及其调节因子。通过分析T细胞数量及其空间分布,TNBC根据CD8+细胞毒性T细胞浸润的模式被细分为不同的亚型。阐明T细胞的基质限制机制是刺激T细胞介导的免疫和改善患者结局的关键。信号转导和转录激活因子(Stat)家族是调控TIME的一个关键信号通路。事实上,在表达与Cre重组酶(MIC)相关的多瘤病毒中T(PyMT)癌基因的多西环素诱导的基因工程小鼠模型(GEMM)中,乳腺上皮STAT3的消融并不影响肿瘤的启动,而是促进免疫介导的肿瘤消除。MIC模型通过不同的组织学阶段发展乳腺肿瘤,模拟人类乳腺癌从增生到转移癌的进展。然而,STAT3缺陷的病变会消退,并被CD8+ T细胞和M1巨噬细胞驱动的稳健免疫应答消除。免疫抑制的确切STAT3依赖机制仍不清楚。在肿瘤细胞中,与免疫抑制相关的一个直接STAT3转录靶点是细胞因子几丁质酶-3样1(CHI3L1)。CHI3L1是乳腺癌疾病侵袭性和肿瘤分级的生物标志物。CHI3L1可使巨噬细胞极化为M2状态,并促进多种实体癌的转移。然而,其对其他免疫细胞的作用以及在TNBC中的作用仍有待探索。该研究发表在《Immunity》,IF:32.4。
技术路线:

主要研究结果:
1. 在STAT3缺陷的病变中CHI3L1表达降低
为了阐明STAT3依赖的免疫抑制机制,使用RNA测序比较了野生型和STAT3缺陷的MIC病灶在多西环素诱导后2周的转录谱。在STAT3缺陷性病变中表达差异最大的基因是CHI3L1,它编码分泌的细胞因子CHI3L1(图1A),而CHI3L1是STAT3的直接靶点,具有明确的免疫抑制特性。分别使用qPCR和免疫印迹证实了CHI3L1在mRNA和蛋白水平的差异表达(图1B-D)。由于CHI3L1可由多种细胞类型产生,研究者利用RNA原位杂交确定了野生型MIC病变中CHI3L1的细胞来源。大多数CHI3L1 mRNA在增生的上皮细胞中检测到,而这一信号在STAT3缺陷的病变中丢失(图1E,F)。相比之下,基质细胞很少表达CHI3L1,其表达不受上皮中STAT3缺失的影响(图1G)。因此,在MIC GEMM中,CHI3L1主要由增生的上皮细胞以STAT3依赖的方式产生。
癌症基因组图谱分析表明,CHI3L1表达在许多人类癌症中升高,包括肺癌、结直肠癌、食管癌、胶质母细胞瘤和基底乳腺癌等。由于基底肿瘤是典型的三阴性肿瘤,研究者使用免疫荧光染色检测了CHI3L1在不同的TNBC免疫亚型中的表达。CHI3L1表达在SR亚组中最高(图1H,I)。在SR亚型中,CHI3L1表达遵循双峰分布,即一些肿瘤高表达CHI3L1,而其他肿瘤低表达CHI3L1(图1I)。对三阴性乳腺癌样本进行活化p-STAT3染色,观察到CHI3L1表达和p-STAT3之间呈正相关(图1J-L)。CHI3L1水平升高的SR肿瘤有较高的p-STAT3(图1J)。
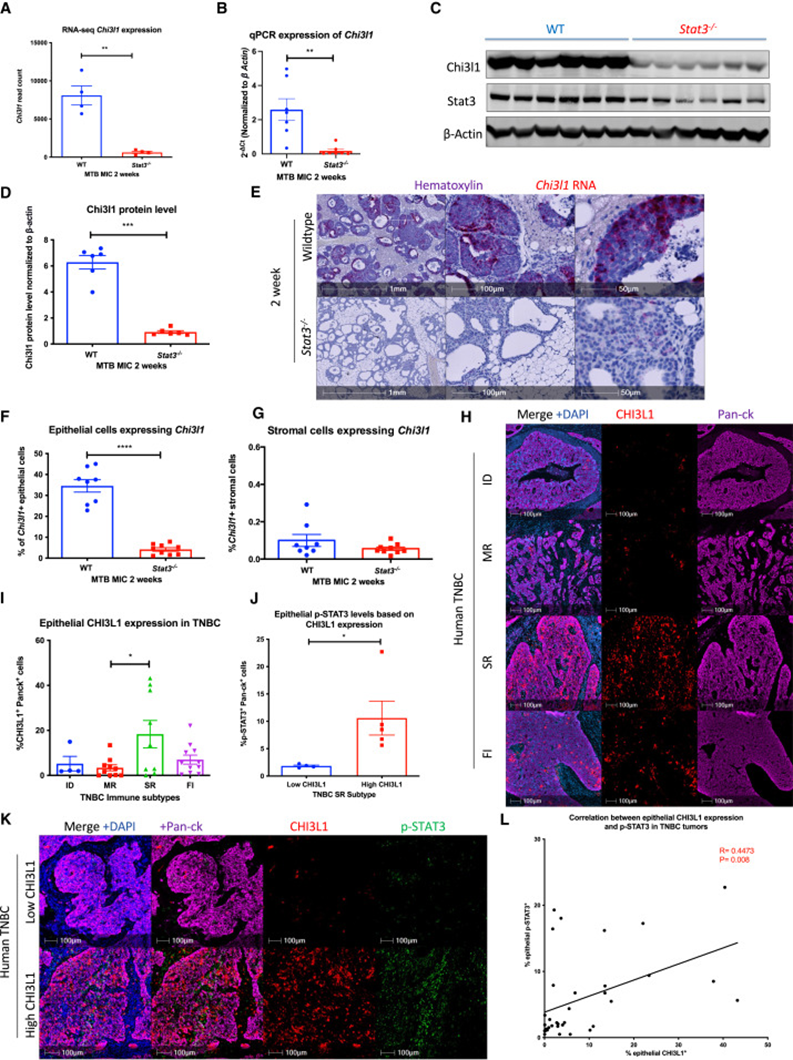
图1 CHI3L1是STAT3依赖的肿瘤衍生因子
2. CHI3L1表达与多种癌症类型中T细胞的间质限制相关
由于SR肿瘤的特征是肿瘤巢内排除CD8+ T细胞,因此研究者研究了CHI3L1是否可能是促进这一现象的肿瘤衍生因子。通过将针对CHI3L1的RNA荧光原位杂交(FISH)与CD4和CD8的免疫荧光染色相结合,研究者观察到辅助性和细胞毒性T细胞在空间上局限于间质,无法浸润WT MIC乳腺中的CHI3L1+病灶(图2A-D)。CD4+和CD8+ T细胞与CHI3L1+细胞的距离均随着CHI3L1转录本的增加而增加,表明存在潜在的剂量依赖性排斥(图2B,D)。与此一致,对TNBC肿瘤进行的免疫组织化学(IHC)分析表明,细胞毒性T细胞和辅助性T细胞位于CHI3L1+肿瘤的远端(图2E-G)。研究者还观察到CHI3L1在TNBC中的异质性表达;同一肿瘤有CHI3L1高表达区域,而CHI3L1阴性区域和CHI3L1表达区域显示T细胞基质限制(图2E)。在TNBC肿瘤中,CHI3L1表达与辅助性T细胞和细胞毒性T细胞的肿瘤浸润呈负相关(图2H,I)。
接下来,研究者评估了其他癌症类型中CHI3L1表达和T细胞排斥之间的关系。多器官癌组织芯片的多重免疫荧光分析表明CHI3L1在肺癌中表达。与研究者在TNBC中的观察结果一致,CHI3L1+肺肿瘤区域排除了细胞毒性T细胞和辅助性T细胞(图2J-L)。研究者观察到CHI3L1水平与浸润的T细胞呈负相关(图2K,L)。尽管样本量较小,但在结肠癌中也观察到类似趋势(图2J)。综上所述,这些数据表明,依赖CHI3L1的T细胞间质限制是这些上皮癌的共同特征。
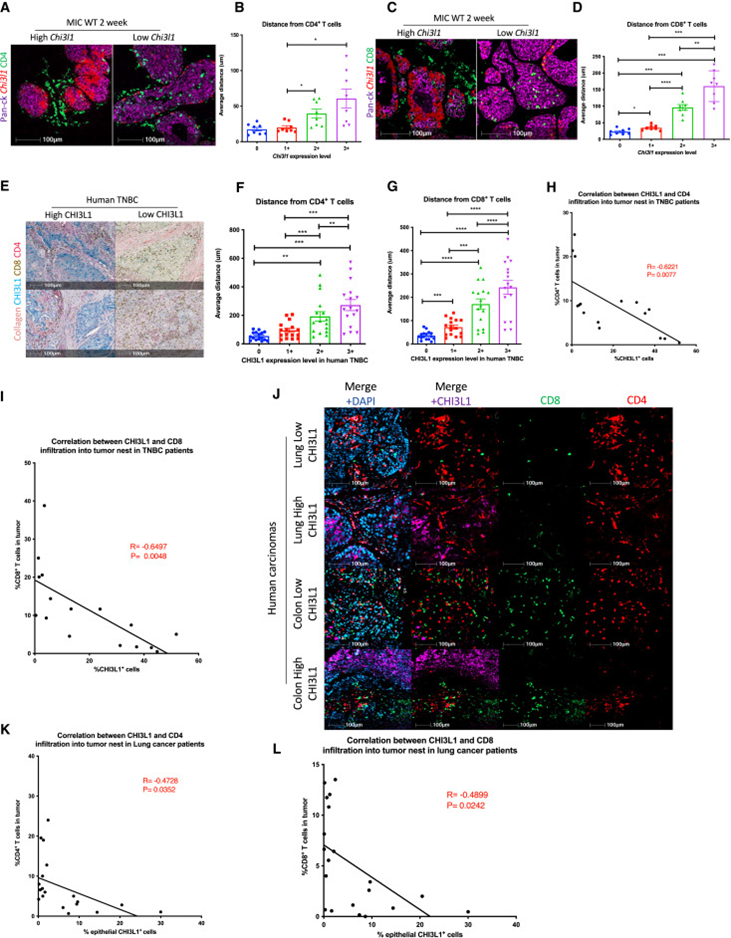
图2 T细胞被排除在CHI3L1+肿瘤中
3. CHI3L1的缺失破坏了乳腺肿瘤的发生,延缓了肿瘤的进展
为了阐明CHI3L1在乳腺肿瘤发生中的作用,研究者利用基于crispr的基因编辑技术产生了Friend virus B CHI3L1缺陷(CHI3L1-/-)动物(图3A)。在雌性MIC CHI3L1完整和缺陷小鼠队列中,通过多西环素治疗2周诱导肿瘤,研究者观察到STAT3缺陷系统的整体免疫变化。使用免疫印迹分析证实CHI3L1蛋白缺失,并且STAT3表达或活化没有随之增加(图3B),表明STAT3活性在chi311缺陷背景中是完整的。
对2周诱导的乳腺的组织学分析显示,CHI3L1缺失后,乳腺上皮增生减少(图3C-F)。与CHI3L1完整的乳腺中观察到的充满的导管上皮内瘤样结构相比,CHI3L1缺陷的乳腺导管有明显的管腔,上皮总量减少(图3C-F)。虽然CHI3L1+/+小鼠在诱导后6周出现可触及的肿瘤,但CHI3L1-/-小鼠有残留增生,上皮内容物总量减少(图3G-J)。研究者一致观察到,在CHI3L1-/-小鼠中,可触及的乳腺肿瘤发生延迟(图3I,J)。综上所述,这些观察结果表明CHI3L1在乳腺肿瘤的发生和发展中起着关键作用。
考虑到模型的生殖细胞系性质,有必要研究上皮而非间质室中的CHI3L1缺失是否导致了肿瘤进展的延迟。研究者将未经多西环素处理的CHI3L1缺陷乳腺移植到同系CHI3L1完整受者(CHI3L1-/- TX WT)清除后的乳腺脂肪垫中诱导2周。在该模型中,只有供体上皮缺乏CHI3L1,而CHI3L1的基质来源完整(图3K)。受体乳腺组织学表型为MIC CHI3L1缺陷的腺体,其中导管有明显的空腔(图3L,M)。相比之下,移植到CHI3L1缺陷宿主(WT TX CHI3L1−/−)中的CHI3L1+/+ MIC乳腺表现出充满的导管上皮内肿瘤结构(图3K-M)。因此,上皮细胞是CHI3L1的主要来源,而基质细胞中CHI3L1的缺失不能解释对肿瘤进展的影响。
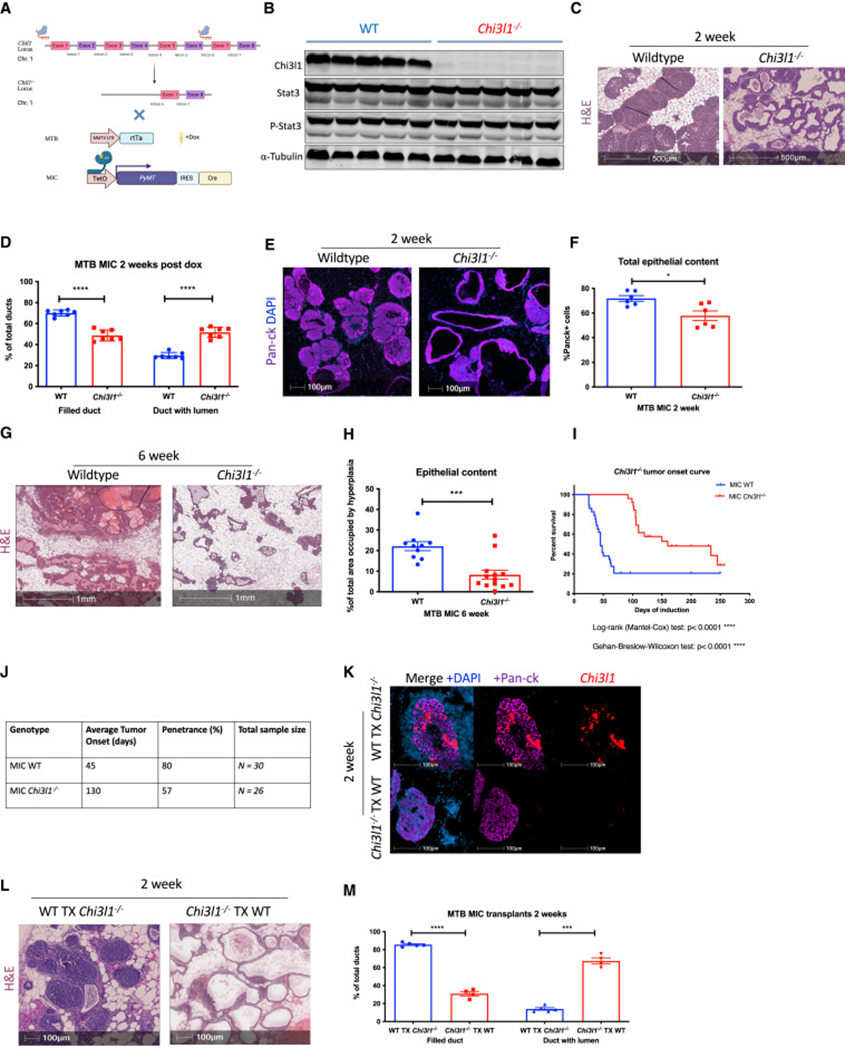
图3 CHI3L1消融扭曲了乳腺肿瘤的发生,延缓了肿瘤的进展
4. CHI3L1产生免疫抑制的TIME,从而驱动肿瘤进展
鉴于STAT3缺陷的MIC小鼠表现出由主动免疫应答驱动的肿瘤进展严重延迟,研究者评估了在CHI3L1-/-小鼠中观察到的乳腺肿瘤发展缺陷是否与主动抗肿瘤免疫应答相关。通过免疫荧光染色,研究者观察到与CHI3L1+/+乳腺相比,CHI3L1-/-乳腺中的总免疫细胞(CD45+)增加(图4A,B)。与CHI3L1促进巨噬细胞向M2状态极化的作用一致,研究者观察到在CHI3L1消融后,M2巨噬细胞(F4/80+ CD206+)丢失,M1巨噬细胞(F4/80+ p-Stat1+)相应增加,但巨噬细胞总计数无变化(图4C-G)。此外,与CHI3L1+/+乳腺相比,CHI3L1−/−乳腺富含总T细胞(CD3+细胞)、细胞毒性T细胞(CD3+ CD8+)和辅助性T细胞(CD3+ CD4+)(图4H-N)。研究者还观察到通过PD1和颗粒酶B表达评估的T细胞活化增加(图4H-P)。需要注意的是,PD1是T细胞活化的标志物,但在其配体PD-l1存在的情况下也可表明T细胞耗竭。在该模型中,PD1的表达遵循与颗粒酶B(经典的T细胞活化标志物)相似的模式。总体而言,研究者的数据表明,CHI3L1缺失后观察到的肿瘤进展延迟与活化的CD8+、CD4+ T细胞和M1巨噬细胞参与的主动抗肿瘤免疫应答的募集相关。
综上所述,这些药理学和遗传学数据表明,CHI3L1是一种主要的免疫抑制细胞因子,通过驱动M2巨噬细胞极化、抑制T细胞募集和活化来支持肿瘤进展。
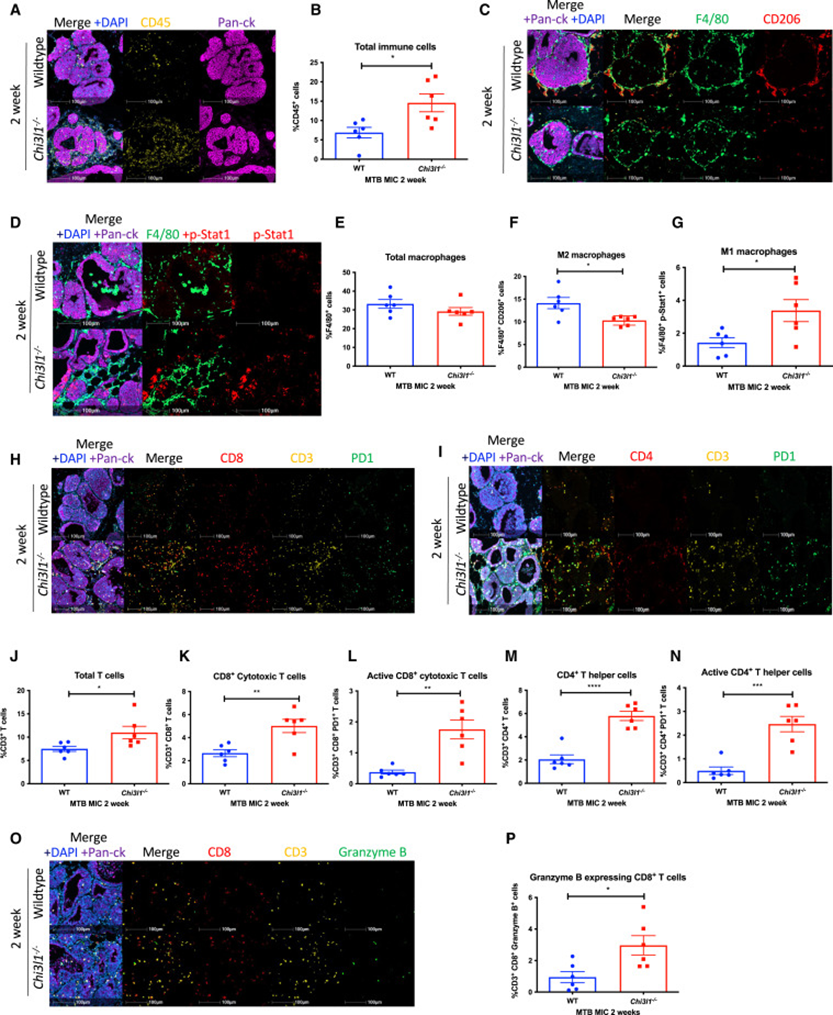
图4 CHI3L1消融改变了肿瘤免疫微环境
5. CHI3L1介导T细胞间质限制促进肿瘤生长
鉴于研究者观察到表达CHI3L1的病变周围的T细胞排斥,研究者对CHI3L1消融后的T细胞进行了多重免疫荧光空间分析。对CHI3L1缺陷性病变所做的分析表明,与CHI3L1完整性病变相比,肿瘤巢浸润的细胞毒性T细胞及其活化的对应细胞增多(图5A-C)。对于在CHI3L1缺陷型增生性病变中显著富集的辅助性T细胞,研究者也观察到类似结果(图5D-F)。与基因消融一致,抗CHI3L1治疗富集了肿瘤浸润的细胞毒性T细胞和辅助性T细胞(图5G-L)。
鉴于T细胞排斥会导致对免疫疗法的耐药,研究者接下来评估了CHI3L1缺失可否改善对pd1阻断的应答。为了实现这一目标,研究者将CHI3L1完整和缺陷的PyMT肿瘤移植到同系小鼠的乳腺脂肪垫中,并使用抗PD1或IgG2a对照进行治疗。与之前的报告一致,CHI3L1-精通的PyMT肿瘤对抗PD1耐药(图5M,N)。相比之下,CHI3L1缺陷的肿瘤对抗PD1的应答改善,这一点可以通过其较慢的生长速度来证明(图5M)。
为了评估针对CHI3L1的治疗靶点是否对免疫治疗应答产生类似影响,研究者使用抗CHI3L1中和抗体、抗PD1或两者联合治疗了CHI3L1阳性的PyMT肿瘤。虽然抗CHI3L1单药治疗未影响肿瘤生长,但研究者观察到与抗PD1联合治疗有显著的协同反应,导致肿瘤生长较慢(图5N)。综上所述,这些数据表明CHI3L1促进T细胞的基质限制,靶向CHI3L1是一种可行的治疗策略,以增强T细胞浸润和改善ICB反应。
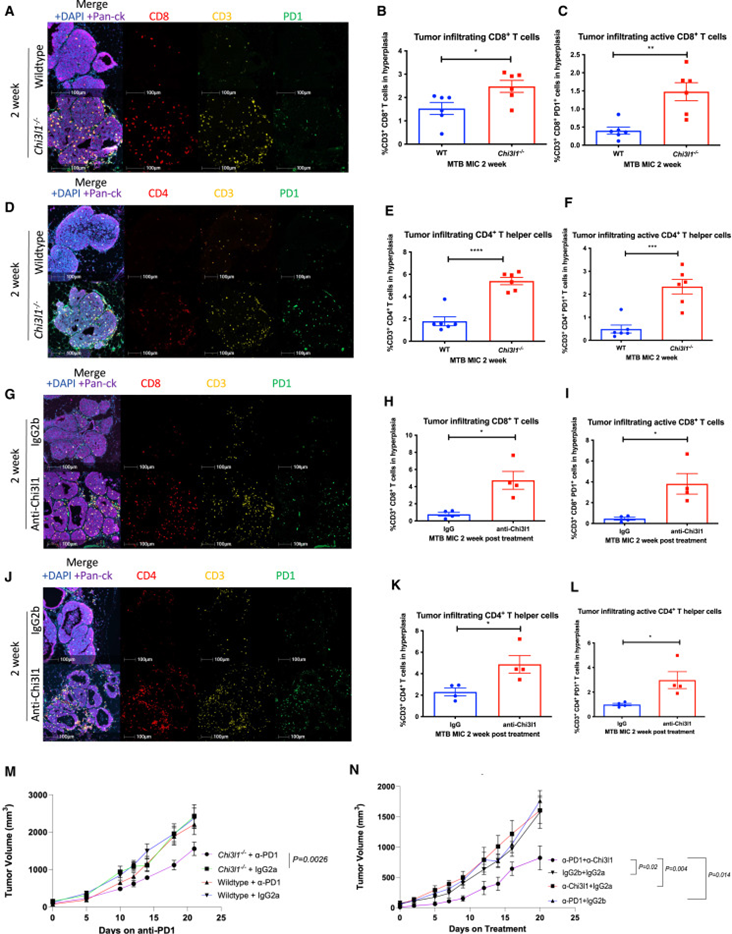
图5 基因和药物消融CHI3L1可缓解T细胞的基质限制,并改善对免疫治疗的应答
6. CHI3L1促进中性粒细胞募集和NET形成
除了改变适应性免疫细胞外,中性粒细胞还通过NETosis促进免疫抑制。NETs通过在肿瘤周围形成物理屏障,在癌症进展、免疫抑制、转移和T细胞排斥中发挥重要作用。为了评估CHI3L1对中性粒细胞的影响,研究者将Ly6G作为中性粒细胞的一般标志物,同时将髓过氧化物酶(MPO)和瓜氨酸化H3(CitH3)作为NETosis的标志物。CHI3L1缺失减少了总中性粒细胞和接受NETosis的中性粒细胞(Ly6G+ MPO+ CitH3+)(图6A-E)。这一点在免疫印迹分析中得到了进一步证实。此外,人类TNBC的IHC分析表明CHI3L1表达和中性粒细胞之间呈正相关(图6F,G)。
虽然这些结果表明CHI3L1在中性粒细胞募集和NETosis中具有潜在的功能作用,但研究者使用小鼠中性粒细胞和人类早幼粒细胞白血病细胞系(HL-60)在体外独立地验证了这一点。为了实现这一目标,研究者对小鼠中性粒细胞进行了transwell迁移实验,以评估其向含有重组小鼠CHI3L1(rmCHI3L1)或PBS对照的培养基的迁移。结果显示对rmCHI3L1的强烈迁移反应(图6H,I)。这些数据表明CHI3L1是一个强的趋化刺激,促进中性粒细胞募集。
为了进一步研究CHI3L1在NET形成中的作用,在rmCHI3L1存在的情况下培养原代小鼠中性粒细胞。通过免疫荧光染色检测到rmCHI3L1刺激导致了CitH3-DNA复合物的挤出(图6J-L)。综上所述,这些发现表明CHI3L1在中性粒细胞募集和NETosis中起着关键作用。
对人TNBC和MIC样本进行的免疫荧光分析表明,CD8+ T细胞与CHI3L1+上皮被一层MPO+细胞分离(图6M,N),这表明正如之前证明的那样,中性粒细胞密切促进T细胞排斥。
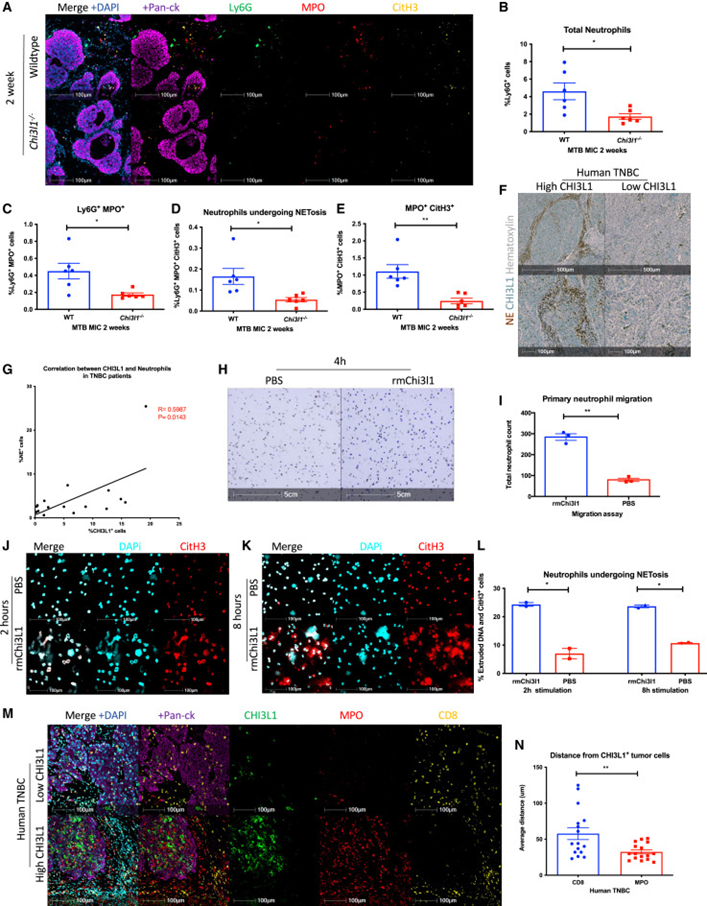
图6 CHI3L1促进中性粒细胞募集和NET形成
7. CHI3L1诱导的间质限制是通过NETosis介导的
诱导2周时的组织学分析表明,与CHI3L1缺陷的乳腺相似,与igg2a治疗的对照小鼠相比,清除中性粒细胞的MIC腺体的导管上皮内瘤变减少(图7A,B)。中性粒细胞清除组的大多数导管有空腔,而对照组的导管充满(图7A-C)。鉴于CHI3L1促进巨噬细胞极化,以及它们在T细胞排斥中的作用,因此评估巨噬细胞是否参与了CHI3L1的促肿瘤功能至关重要。与之前的报道一致,抗csf1r(集落刺激因子1受体)或抗f4 /80抗体治疗减少了巨噬细胞频率,但未影响乳腺导管增生(图7A-C)。此外,抗Ly6G治疗减少了总体增生面积(图7A-C)。这些数据表明,巨噬细胞在诱导乳腺病变中是不需要的,而中性粒细胞是CHI3L1在MIC GEMM中促肿瘤功能的主要中介。
为了进一步研究中性粒细胞在T细胞基质限制中的作用,研究者对中性粒细胞缺失的乳腺和对照乳腺进行CHI3L1的RNA FISH分析,并结合CD4和CD8染色。此外,之前观察到的CHI3L1+病变周围的T细胞排斥在清除中性粒细胞后消失(图7D-G)。综上所述,研究者的结果表明,肿瘤来源的CHI3L1协同中性粒细胞介导T细胞排斥。
为了评估NETosis的相对作用,研究者用DNA酶、蛋白质精氨酸脱亚胺酶4抑制剂(PAD4i)、GSK484或溶剂对照处理MIC小鼠。与抗Ly6G治疗的乳腺类似,研究者观察到PAD4i和dnase治疗的乳腺增生减少,导管未闭上皮内瘤变增加(图7H-J)。与抗Ly6G治疗相似,抑制NETosis使T细胞不再被排斥出CHI3L1+病变(图7K-N)。与之前的研究一致,不受PAD4i或DNase处理影响的中性粒细胞功能不会促进CHI3L1介导的T细胞排斥。这些发现支持CHI3L1直接诱导NETs促进T细胞排斥的观点(图7O)。
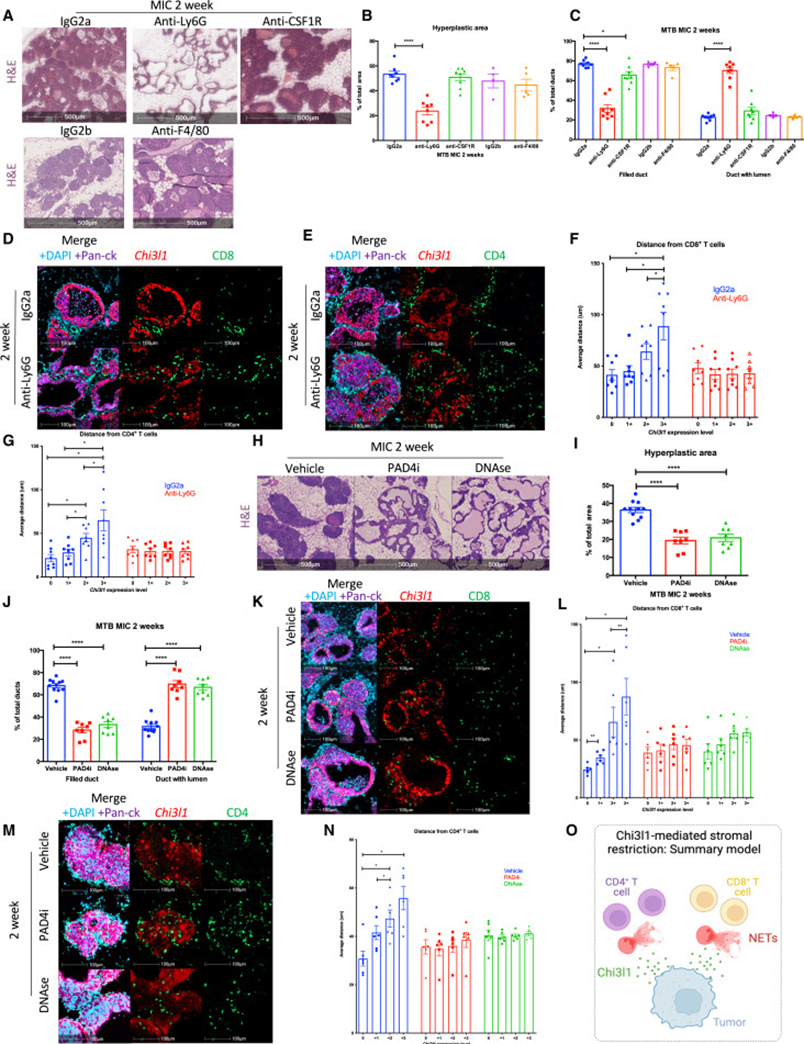
图7 靶向中性粒细胞消除了CHI3L1诱导的T细胞间质限制,扭曲了肿瘤发生
结论:
该研究表明,分泌的细胞因子CHI3L1产生的免疫抑制TIME在M2巨噬细胞和中性粒细胞中丰富,但缺乏活化的T细胞。此外,CHI3L1可直接诱导NETosis,将T细胞排除到间质中,阻止其向肿瘤浸润。未来的临床引入CHI3L1靶向治疗有可能重新激活抗肿瘤免疫反应和增强T细胞浸润,从而改善ICB反应。
实验方法:
小鼠模型,细胞培养,小鼠乳腺移植试验,小鼠药物治疗,RNA测序,定量逆转录酶PCR(qRT-PCR),免疫印迹,多重荧光免疫组化,流式细胞分析,跨孔迁移测定,酶联免疫吸附
参考文献:
Taifour T, Attalla SS, Zuo D, Gu Y, Sanguin-Gendreau V, Proud H, et al. The tumor-derived cytokine CHI3L1 induces neutrophil extracellular traps that promote T cell exclusion in triple-negative breast cancer. Immunity. 2023 Nov 18:S1074-7613(23)00483-1. doi: 10.1016/j.immuni.2023.11.002.






