单细胞RNA测序和空间转录组学揭示实验性蛛网膜下腔出血后脑膜淋巴功能障碍的发病机制
蛛网膜下腔出血(SAH)是脑卒中中一种致命的亚型,死亡率和致残率都很高。脑膜淋巴血管(mLVs)是一种新发现的颅内液体运输系统,经证实可将脑脊液中渗出的红细胞引流至颈部深部淋巴结。然而,许多研究报道了mLVs的结构和功能在几种中枢神经系统疾病中受到损伤。SAH是否可引起mLVs损伤及其机制尚不清楚。本文应用单细胞RNA测序和空间转录组学,结合体内/体外实验,研究SAH后mLVs的细胞、分子和空间模式的改变。首先,研究证明SAH诱导mLVs损伤。然后,通过测序数据的生物信息学分析,发现血栓反应蛋白1 (THBS1)和S100A6与SAH结局密切相关。此外,THBS1-CD47配体受体对被发现通过调节STAT3/Bcl-2信号通路在脑膜淋巴内皮细胞凋亡中起关键作用。这些结果首次揭示了SAH后mLVs损伤的情况,并提供了一种基于mLVs通过破坏THBS1和CD47相互作用来保护SAH的潜在治疗策略。该文章于2023年5月发表在《Advanced Science》,IF:15.1。
技术路线:
技术路线图
主要研究内容:
1. SAH后不同时间进程mLVs变化的单细胞转录组图谱
为了研究SAH后mLVs是否受损,作者通过向交叉前池注射自体血建立实验性SAH模型。该模型是探索中枢神经系统淋巴功能的理想模型,因为它不需要完全暴露于颈部解剖结构,可以避免对mLVs的直接影响。此外,在SAH建模后的不同时间,将荧光珠注射到大池内(i.c.m),以进一步评估mLVs的引流功能。结果显示,早在SAH后3小时,dCLNs的微珠引流就显著减少,并且引流障碍一直持续到损伤后72小时(图1B)。对于dCLNs的上游路径,在SAH后24和72 h, mLVs中也出现了引流减少和结构损伤(图1I)。
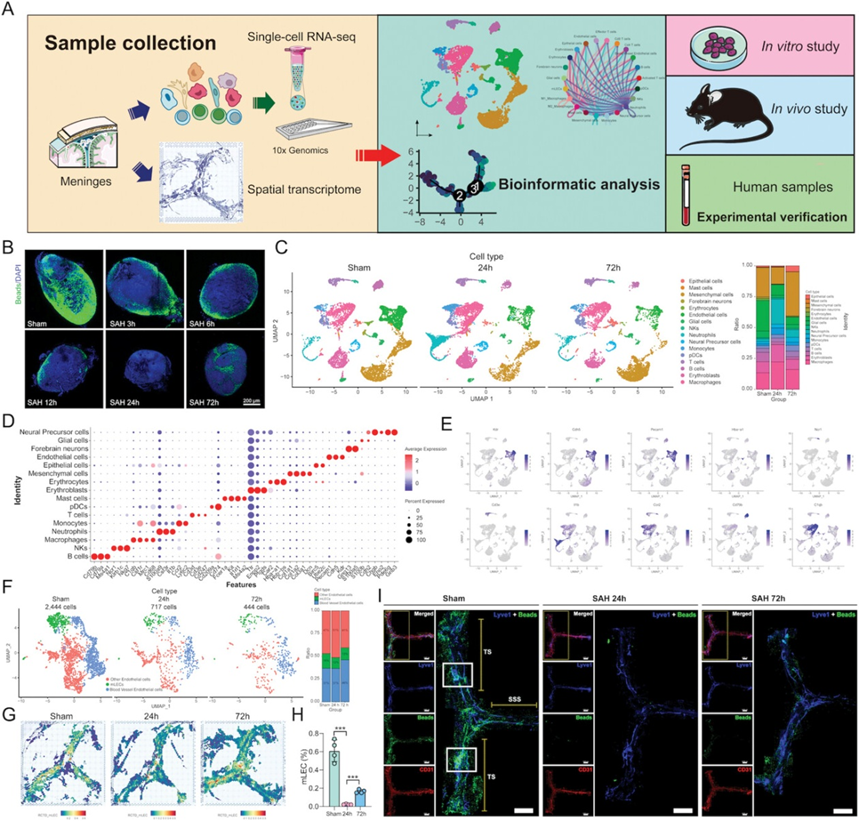
图1 SAH后不同时间序列mLVs变化的单细胞转录组图谱
为了全面阐明SAH后mLVs的细胞组成变化,作者对不同组(Sham组,SAH 24 h组,SAH 72 h组,每组10只小鼠)的小鼠进行了scRNA-seq (10× Genomics)(图1A)。在原始scRNA-seq数据和相邻的序列分析中排除受损或死亡细胞和假定的细胞双链后,共保留30只小鼠的25 536个细胞转录组,其中9891个细胞来自sham组,8262个细胞来自SAH 24 h组,7383个细胞来自SAH 72 h组(图1C)。然后,作者根据测序深度和线粒体reads计数对基因表达进行归一化,并基于细胞间高可变表达基因应用主成分分析(PCA)。为了纠正批次效应,作者将scRNA-seq数据与Seurat整合方法进行整合。在此基础上,采用统一流形逼近投影(UMAP)嵌入空间和基于图的聚类方法对细胞簇进行识别。用众所周知的标记对聚类进行注释。细胞分为16种主要细胞类型(图1C-E),包括以Cd79A、Cd79B和Ms4a1为标记的B细胞,以Ncr1、Klrb1c和Nkg7为标记的NKs,以C1qb、Cd68、Csf1r和Mrc1为标记的巨噬细胞,以S100α9、IL1β和Csf3r为标记的中性粒细胞,以Ccr2和Ly6c2为标记的单核细胞,以Cd3d、Cd3e和Cd247为标记的T细胞,以Cd209a和Cd74为标记的pDCs,以Fcer1a、Kit和Ms4a2为标记的肥大细胞,以Ttr、Enpp2和Ptgds为标记的红细胞,以Car2、Hba-a1、Hbb-bs为标志的红细胞,以Col1a1、Col1a2、Col3a1、DCN为标志的间充质细胞,以Birc5、Ube2c为标志的上皮细胞,以Pecam1、Cdh5、Kdr为标志的内皮细胞,以Gng13、S100α5为标志的前脑神经元,以S100b、Cdh2为标志的胶质细胞,以Cdh2、Pde6g、Gnb3为标志的神经前体细胞。尽管假手术组和SAH组的mLVs中都出现了所有16种主要细胞类型(图1C),但每种细胞类型的动态变化是不同的。同时,鉴于mLECs来源于内皮细胞,作者进一步对内皮细胞进行了聚类分析,得到了三个亚簇。该结果显示,在SAH后24 h, mLVs比例最小(图1F),说明此时mLVs损伤可能是最严重的。
同样,流式细胞术分析显示,SAH后CD45-CD31+LYVE1+细胞(mLECs)数量下降,并且在SAH后24 h发生最严重的损伤(图1H)。此外,在几项神经功能测试中,与假手术组相比,受伤小鼠的改良Garcia评分较低,Tturn和Ttotal延长,缺陷延长,恢复延迟。综上所述,这些结果表明,SAH引起小鼠急性期mLVs结构和引流功能的损伤,并引起神经功能的丧失。
2. 空间图谱的反卷积和细胞类型相互作用的可视化
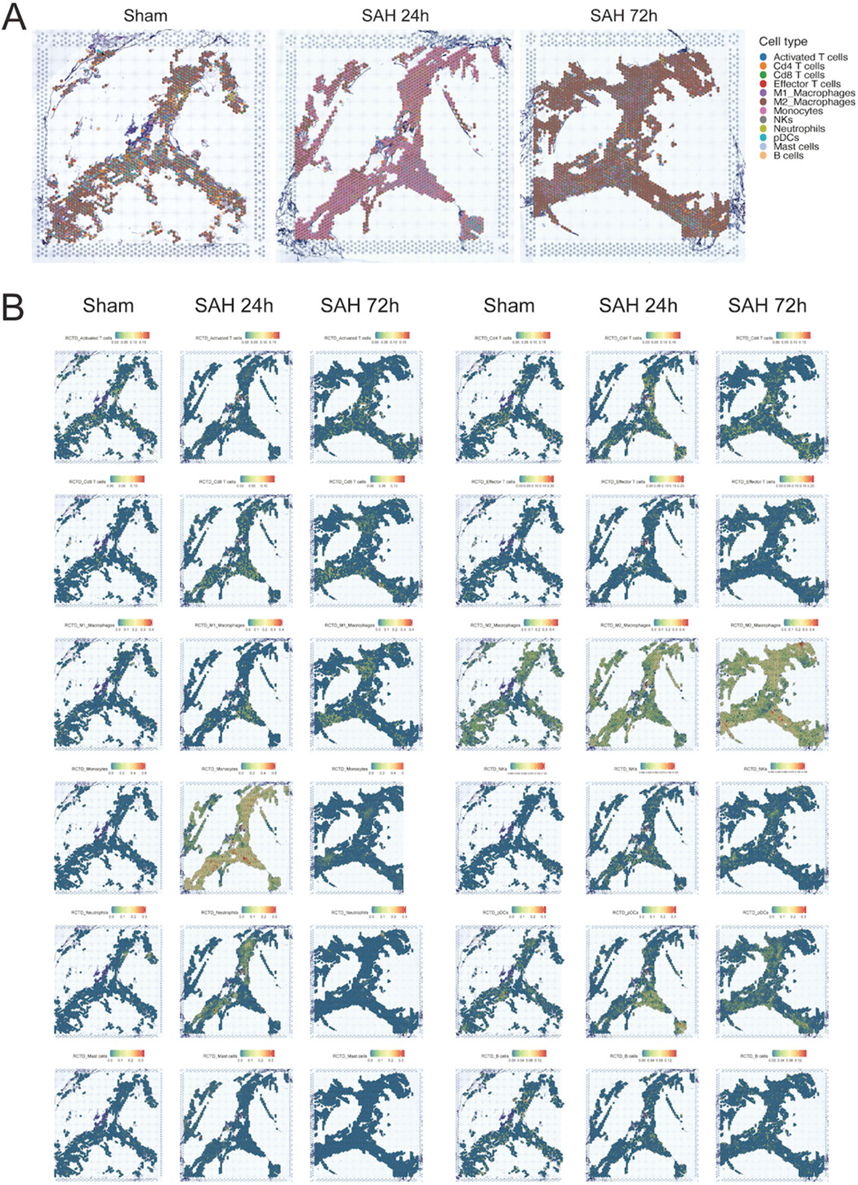
图2 SAH后mLVs空间图谱的反卷积
如上所述,scRNA-seq数据丢失了每个细胞的空间特征。因此,作者随后结合ST来提高测序数据的完整性,揭示所有细胞的空间分布。经苏木精和伊红(H&E)染色和明场成像,mLVs切片发现明显的组织学特征。采用Seurat方法进行标准质量控制和降维,通过t分布随机嵌入(T-SNE)实现可视化。基于每个簇中的差异表达基因(DEGs),逐步进行细胞聚类,构建ST图谱。在最近的一项研究中提到,作者同样使用RCTD软件对每个组织覆盖点进行反卷积,进一步重建了窦解剖的分层和分段结构。预测的12个免疫细胞簇的定位证实了它们在特定区域(如上矢状窦[SSS],横窦[TS]和热点)的富集。作者在SSS和TS上绘制了每个点内每个细胞簇的比例作为代表性饼图(散点饼)。有趣的是,损伤后浸润到mLVs的免疫细胞发生了明显的变化。与正常mLVs相比,浸润单核细胞在SAH后24小时显著增加,成为所有细胞簇中的主要细胞群。虽然72 h时浸润的巨噬细胞最多,以M2亚型为主,但在热点部位聚集的单核细胞和M1型巨噬细胞明显增多(图2A)。
为了进一步探讨脑膜免疫微环境的改变,作者试图将每个细胞的scRNA-seq数据映射到ST,以准确揭示SAH后免疫细胞对mLVs的浸润。免疫细胞浸润在SAH后24 h以单核细胞为主,72 h以巨噬细胞为主。中性粒细胞浸润在24 h达到峰值,72 h恢复到正常水平(假手术)。T细胞浸润在损伤后不同时间进程中逐渐增加,而B细胞浸润相对稳定。损伤后NKs和pDC的浸润也持续增加(图2B)。这些结果反映了随着SAH的发展,mLVs在不同阶段的细胞变化。
3. 细胞间通讯分析揭示THBS1-CD47配体受体对激活与mLVs损伤相关
鉴于免疫炎症一直被认为是SAH发病的关键病理机制,作者的研究结果揭示了sham组和SAH组浸润免疫细胞的差异,作者想知道免疫微环境的动态重塑是否在mLVs损伤中起重要作用。mLECs分布预测的可视化显示,损伤后24 h mLECs损伤最严重(图3A)。因此,作者首先研究了所有细胞类型之间的细胞间通信,以可视化整体情况。通过多种学习和定量对比,Cell Chat确定了每个细胞簇之间差异过表达的配体和受体。总共检测到4239对显著的L-R对,进一步将其分类为2258条信号通路。通过统计检验,随机排列细胞的组标签,然后重新计算相互作用概率,确定显著的相互作用。
接下来,作者开始寻找mLECs和其他细胞类型之间的关系。确定了几个对mLECs的输出或输入信号模式贡献最大的信号(图3B)。综上所述,损伤后24 h时mLVs损伤最为严重,单核细胞在这段时间内以浸润细胞为主,说明单核细胞与mLVs的相互作用可能在mLVs功能障碍中起关键作用。因此,通过关注mLECs和单核细胞之间的通信,作者发现THBS信号通路特别积极地参与所有信号模式。作者进一步探索了基于THBS信号作用于mLECs的潜在L-R对,并计算了这些L-R对的贡献。其中,L-R对“THBS1-CD47”在细胞间通讯中表现出最强的相互作用(图3C)。为了进一步评估THBS1-CD47 L-R对的空间分布,作者使用了专门用于分析空间通信的技术stLearn,该技术可以将细胞的空间信息与所有预测的通信结合起来,发现L-R对的区域特异性。结合邻近点之间的L-R共表达富集和细胞类型密度富集,发现组织内的热点,细胞类型之间的相互作用最有可能发生。结果显示,THBS1-CD47 L-R对在SAH后24小时显著激活(图3D)。
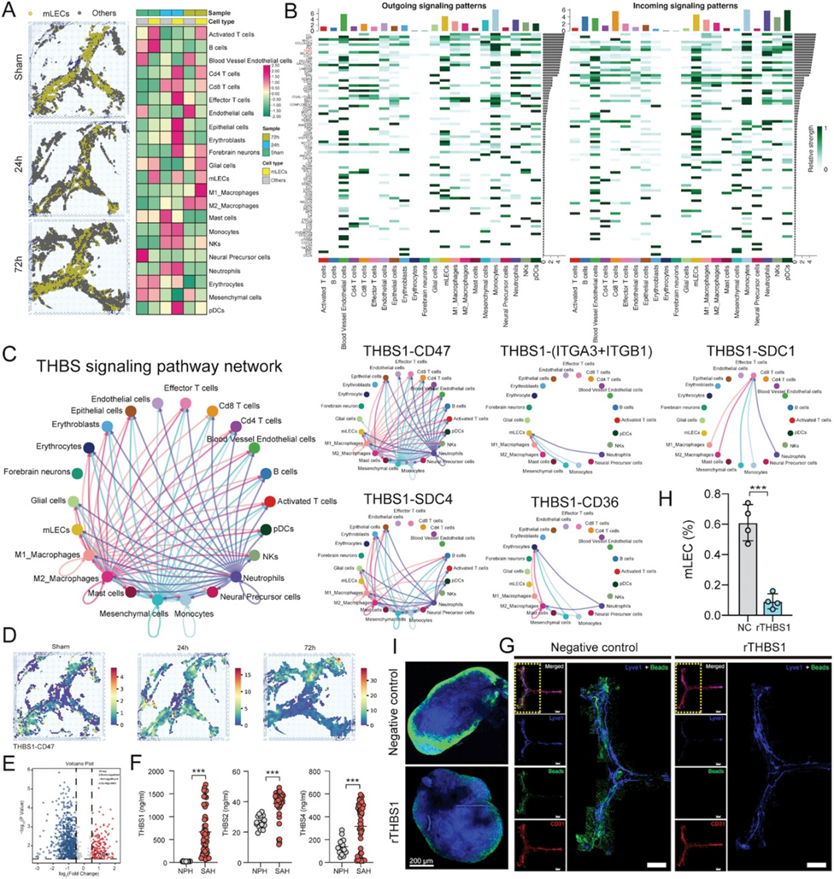
图3 mLVs内部和周围的细胞间通信网络
4. THBS1损害脑膜淋巴引流,加重神经功能障碍
在发现THBS1-CD47 L-R对可能与mLVs损伤相关后,作者想要评估SAH后THBS1的影响。作者使用Proteome Xchange Consortium (PXD030593)的质谱蛋白质组学数据检测SAH后内源性THBS1的改变。质谱测定的SAH患者脑脊液中差异表达蛋白显示THBS1蛋白显著上调(作者以正常压力脑积水(NPH)患者脑脊液样本作为对照组,图3E)。鉴于人类THBS家族有THBS1、THBS2和THBS4三种亚型,作者使用ELISA试剂盒再次检测了SAH患者脑脊液样本中所有THBS亚型的表达,以验证THBS1是否是THBS的关键成员。正如作者所料,尽管THBS2和THBS4水平也升高,但与NPH组相比,SAH后THBS1的表达增加最多(图3F)。此外,较高的THBS1水平与SAH患者较差的临床预后密切相关(图6F)。
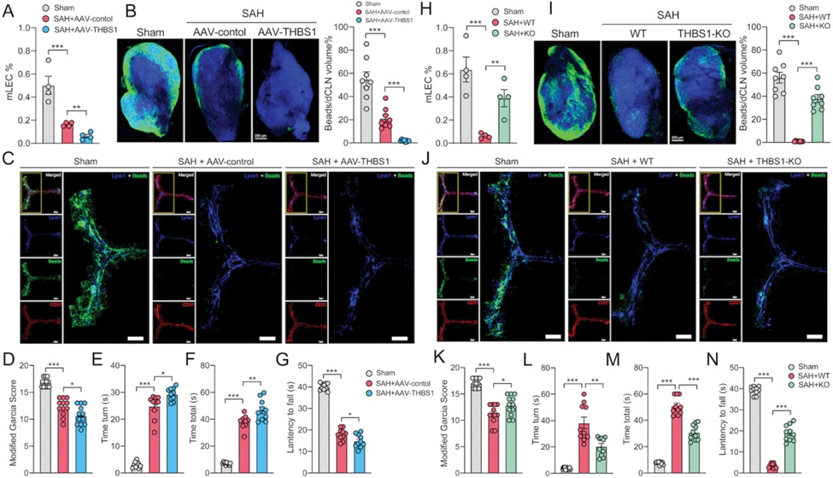
图4验证THBS1对SAH后mLVs功能的影响
然后,作者进行了体内实验,探讨THBS1在SAH后mLVs损伤中的作用。首先,将低剂量小鼠重组THBS1蛋白注入小鼠大池,观察mLVs功能的变化。与阴性对照(NC)小鼠相比,重组THBS1 (rTHBS1)蛋白处理导致mLVs和dCLNs中的小珠聚集减少(图3G,I),mLVs的mLECs数量减少(图3H)。其次,作者通过将AAV-THBS1注入小鼠大池构建THBS1过表达小鼠,并培养THBS1-KO小鼠进行进一步研究。与AAV对照相比,SAH后使用AAV-THBS1治疗的mLVs损伤更严重(图4A-C)。相反,THBS1-KO部分逆转了SAH引起的mLVs损伤(图4H-J)。此外,神经功能测试也给出了类似的结果。THBS1过表达加重了SAH引起的神经功能缺损,而敲除THBS1可改善神经功能(图4D-G, K-N)。更重要的是,与THBS1敲除的结果一致,用THBS1抗体阻断THBS1后,mLVs和神经功能损伤也得到逆转(图5A-G)。综上所述,这些结果证明THBS1上调导致SAH后mLVs结构和引流功能受损,从而加重神经行为功能障碍。
5. 干扰THBS1-CD47相互作用通过抑制STAT3/ BCL2介导的mLECs细胞凋亡促进mLVs修复
既往研究报道THBS1通过与其受体CD47结合抑制内皮细胞增殖和趋化作用。同样,作者的研究结果预测了THBS1-CD47 L-R对在mLVs损伤中发挥重要作用,并证明了THBS1在SAH后的损伤作用。因此,作者继续研究CD47的功能。与igG处理相比,在SAH后24小时用抗体阻断CD47可减轻脑膜淋巴功能障碍(图5A-C)。相应的,神经功能也明显改善(图5D-G)。
接下来,为了进一步研究THBS1-CD47相互作用诱导损伤的潜在机制,作者进行了GSEA分析。结果显示,损伤24 h后mLECs细胞凋亡通路明显激活(图5H)。Tunel染色显示SAH后细胞凋亡明显激活。THBS1过表达进一步促进了mLVs的凋亡,而THBS1阻断导致Lyve1+Tunel+细胞减少。人单核细胞与LECs体外共培养证实,在血红蛋白(150µm)刺激下,共培养体系上清中THBS1含量显著增加,说明单核细胞是SAH后THBS1分泌的来源之一。流式细胞术分析显示,与对照组相比,经THBS1中和抗体预处理的共培养体系中LECs的凋亡明显减少。然而,mLVs损伤的确切机制尚不清楚。
研究表明THBS1-CD47相互作用通过干扰内皮细胞发育所必需的VEGF/VEGFR2信号诱导内皮细胞凋亡。此外,VEGFR2抑制通过抑制骨肉瘤STAT3/BCL-2信号通路促进骨肉瘤细胞凋亡。因此,作者假设THBS1-CD47相互作用是否可以通过抑制STAT3/BCL-2信号传导来治疗mLECs凋亡。首先,共免疫沉淀(COIP)证实了LECs中THBS1和CD47之间的相互作用。其次,在原发性mLECs中,rTHBS1处理后,随着Bax的表达增加,pSTAT3和BCL-2的表达呈剂量依赖性显著降低(图5I),表明rTHBS1处理通过抑制STAT3/BCL-2信号通路的激活促进mLECs凋亡。最后,在SAH小鼠mLVs样本中,pSTAT3和BCL-2水平在SAH后24 h达到峰值,然后在72 h下降,这与GSEA结果一致(图5J)。THBS1敲除或阻断THBS1/CD47均可显著增加pSTAT3和BCL-2的表达(图5K,M),而THBS1过表达则相反(图5L)。综上所述,这些研究结果证实THBS1-CD47 L-R对通过STAT3/BCL-2信号通路促进mLVs凋亡,抑制这种相互作用可能有助于减轻mLVs损伤。
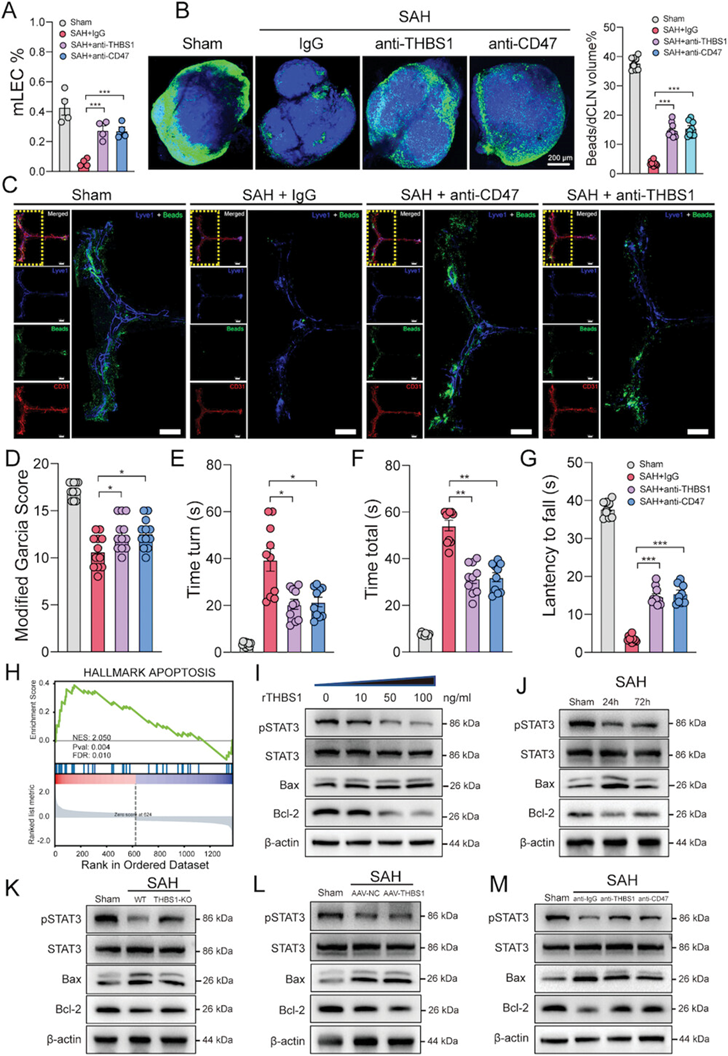
图5干扰THBS1-CD47相互作用通过抑制STAT3/ BCL2介导的mLECs细胞凋亡促进mLVs恢复
6. 拟时序分析显示SAH后mLECs的改变痕迹
此外,作者对不同样本中的所有mLECs进行了拟时序分析,以揭示SAH后EBI阶段mLECs的变化轨迹(图6A)。用真实分组信息标记mLECs后,作者发现SAH后24 h mLECs的损伤模式与上述发现一致。然而,出乎意料的是,与假手术组和24小时组相比,72h的mLECs似乎具有完全不同的细胞状态或特征(图6B)。考虑到mLECs损伤在SAH后72 h得到部分改善(图1I),作者想知道mLECs的自我修复机制或其他细胞间相互作用是否在这一过程中起作用,这值得进一步的努力和探索。DEG分析显示SAH后过度表达最多的基因(图6C,D)。S100α6和Cldn5的表达沿轨迹逐渐升高(图6E)。既往研究报道S100A6在乳腺癌中破坏淋巴内皮细胞紧密连接,增加中性粒细胞的跨内皮迁移,提示S100α6可能是SAH后mLECs损伤的潜在生物标志物。
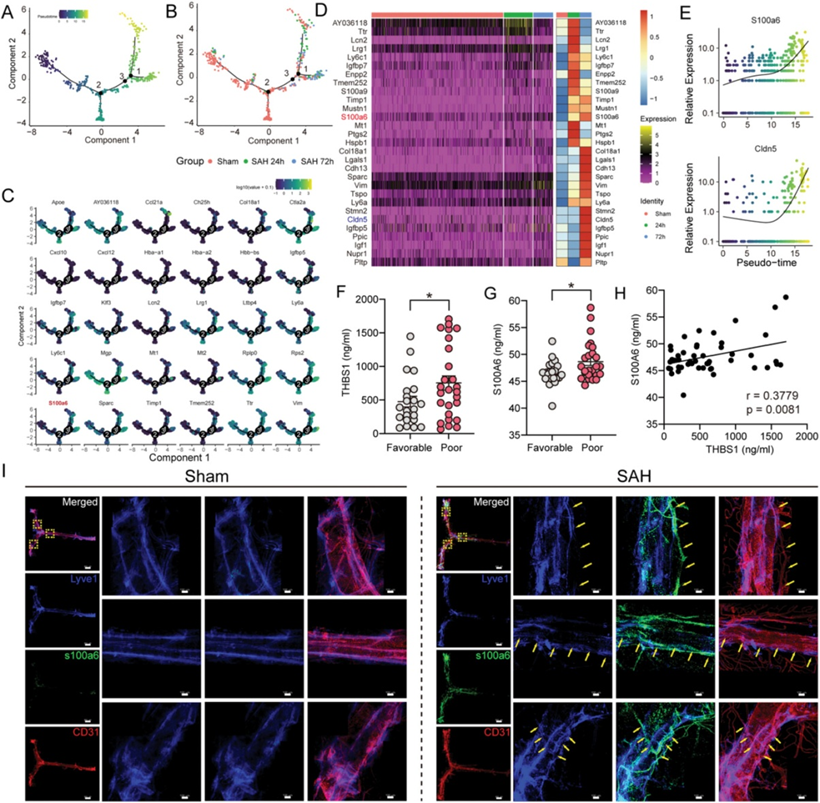
图6 细胞轨迹分析显示了mLECs的进化过程
然后作者对mLVs进行免疫荧光染色,以确定S100α6在SAH后的变化。与未损伤组相比,损伤24 h后脑膜S100α6表达明显增加,Lyve1+S100α6+阳性细胞增多,而Lyve1+细胞减少(图6I)。相反,敲除THBS1后,S100α6的表达也显著降低。此外,通过ELISA检测,作者证实S100A6在SAH患者脑脊液样本中的表达较对照组增加。预后分析显示,S100A6表达越高,预后越差(图6G)。同时,S100A6和THBS1的表达呈线性关系(图6H),说明两者都可能是SAH后的合适预测因子。综上所述,作者的数据表明S100α6可能是脑膜淋巴损伤的一种新的生物标志物,进一步补充了mLVs注释领域的空白。
结论:
作者首次阐明了SAH后早期mLVs的空间和细胞变化。作者发现随着周围免疫微环境的重塑,mLECs群体发生了显著的变化。同时,THBS1的过表达和THBS1-CD47的相互作用可能通过STAT3/BCL-2信号通路导致mLECs凋亡。综上所述,作者的研究结果可能为后续的SAH相关研究和基于受损mLVs改善的SAH干预治疗策略提供新的视角。
实验方法:
临床样本收集和患者信息、人脑脊液质谱分析、ELISA测定、SAH诱导、大池内注射、神经学评分和行为测试、神经学评分、挂线测试、dCLNs清除、免疫荧光、流式细胞术、原代脑膜淋巴内皮细胞培养、THP1条件培养基制备、免疫共沉淀、Western Blot分析、单细胞RNA测序、阅读比对,质量控制和聚类分析,细胞-细胞通讯分析,空间转录组测序和数据处理。
参考文献:
Wang X, Zhang A, Yu Q, Wang Z, Wang J, Xu P, Liu Y, Lu J, Zheng J, Li H, Qi Y, Zhang J, Fang Y, Xu S, Zhou J, Wang K, Chen S, Zhang J. Single-Cell RNA Sequencing and Spatial Transcriptomics Reveal Pathogenesis of Meningeal Lymphatic Dysfunction after Experimental Subarachnoid Hemorrhage. Adv Sci (Weinh). 2023 Jul; 10(21):e2301428. doi: 10.1002/advs.202301428. Epub 2023 May 21. PMID: 37211686; PMCID: PMC10375135.






