IgSF11的缺乏通过抑制早期软骨下骨的改变来减轻小鼠骨关节炎
骨关节炎(OA)是一种退行性关节疾病。虽然它的典型特征是关节软骨破坏,但它影响到关节的所有组织,因此也伴随着局部炎症、软骨下骨改变和持续性疼痛。然而,作者对骨性关节炎进展过程中潜在的软骨下骨动力学的了解很贫乏。在这里,作者通过一个小鼠模型展示了免疫球蛋白超家族11(IgSF11)在骨性关节炎软骨下骨重建中的作用。特别是,在内侧半月板(DMM)诱导的OA不稳定后,IgSF11迅速通过分化的破骨细胞表达,并在软骨下骨中上调。在小鼠中,IgSF11缺乏不仅可以抑制OA软骨下骨的变化,还能阻止软骨破坏。OA软骨下骨中表达IgSF11的细胞被发现参与破骨细胞成熟和骨吸收,并与关键破骨细胞分化因子核因子κ-B(RANK)受体激活剂共定位。因此,作者的研究表明,阻断OA的早期软骨下骨变化可以改善OA的关节软骨破坏。本文于2023年12月发表于期刊《Experimental & Molecular Medicine》,IF=12.8
主要技术路线:
主要研究成果:
1、IgSF11在小鼠OA的软骨下骨(SB)中快速表达
由于最近的研究表明IgSF11是破骨细胞成熟所必需的,因此作者首先证实破骨细胞生成诱导的核因子κ-B (RANK)配体受体激活剂(RANKL)刺激增加了骨髓来源的巨噬细胞(BMM)中IgSF11的表达。事实上,IgSF11蛋白表达上升,并在第1天达到峰值(图1a)。然后,作者检查了DMM手术诱导OA后1或2周小鼠的SB中是否表达了IgSF11。DMM是一种广泛使用的动物模型,用于研究OA中的软骨退化和SB动力学。WT小鼠SB的qRT-PCR显示,SB中IgSF11 mRNA表达在1周时上升,然后在2周时下降(图1b)。因此,在OA诱导后,IgSF11在SB中迅速上调。
值得注意的是,软骨细胞不表达IgSF11;对接受和未接受DMM手术诱导的OA的WT小鼠的关节组织进行免疫荧光分析表明,如果IgSF11表达,它总是在SB而不是软骨中(图1c、d)。当作者对接受全膝关节置换手术的OA患者受损和未受损的软骨进行免疫组织化学分析时,也观察到了这种现象。因此,OA中IgSF11的表达仅限于SB。
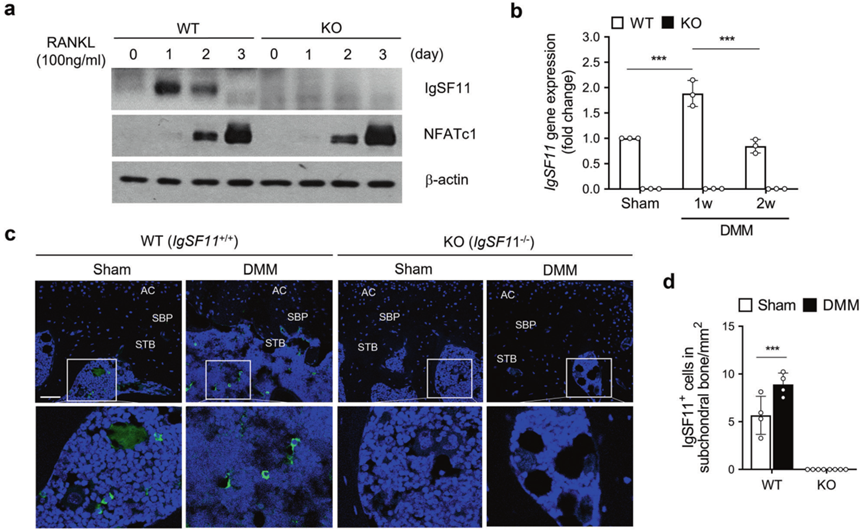
图1 IgSF11表达在体外迅速上调,可分化破骨细胞和骨关节炎软骨下骨
2、遗传性IgSF11缺失减轻骨性关节炎关节软骨退变
为探讨IgSF11在骨性关节炎发病机制中的作用,作者采用骨髓瘤手术诱导WT和IgSF11缺失(IgSF11−/−)小鼠骨性关节炎。为观察关节软骨和软骨下骨的逐渐变化,分别于1、2、4、8周处死小鼠,取关节。OARSI分级显示,在2周、4周和8周时,IgSF11−/−小鼠的关节软骨破坏程度明显低于WT小鼠,但在1周时则不然(图2a,b)。因此,在骨性关节炎的软骨破坏中需要IgSF11。
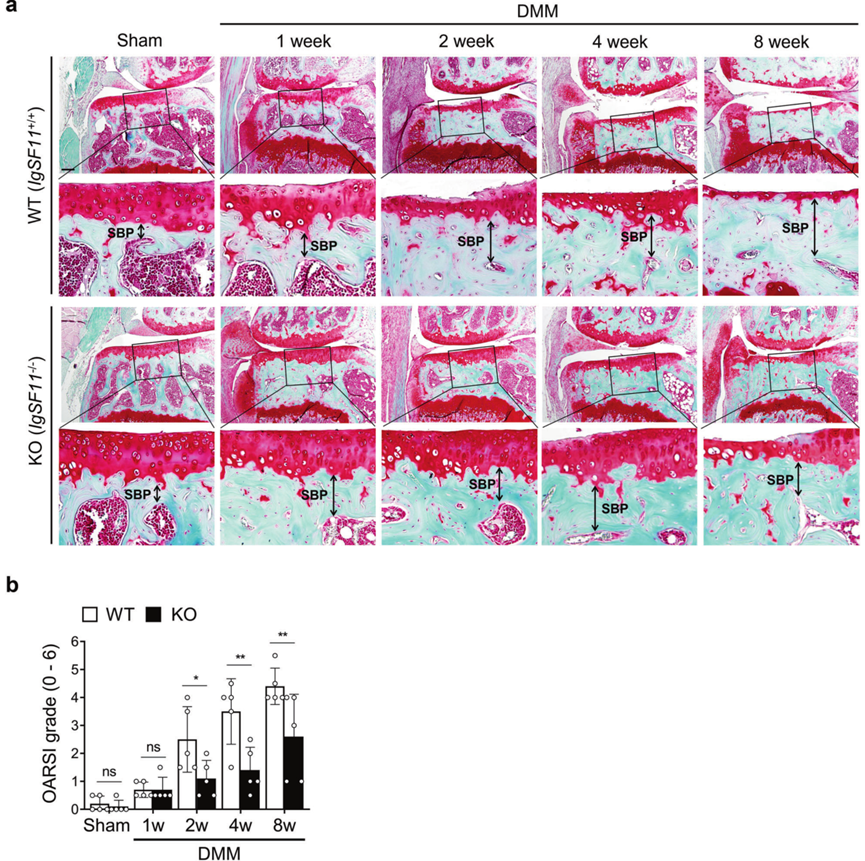
图2 IgSF11−/−小鼠在骨性关节炎诱导后软骨破坏减轻
3、IgSF11−/−小鼠在骨性关节炎诱导后不久的SB中显示较少的破骨细胞活性
破骨细胞是SB重塑的关键调节细胞。它们还与关节中的许多细胞相互作用,包括成骨细胞、软骨细胞和免疫细胞。特别是,人们认为虽然成骨细胞在OA中诱导SB硬化,但该过程实际上是由破骨细胞启动的。由于作者发现(1)IgSF11在OA诱导后不久在SB中上调,(2)分化的破骨细胞在体外表达IgSF11,以及(3)IgSF11−/−小鼠在整个OA过程中表现出较低的关节软骨退化,作者推测SB中表达IgSF11的破骨细胞促进OA中的关节软骨破坏,并且这种作用很早就开始了。
为了检验这一假设,作者研究了IgSF11缺失对OA期间破骨细胞和成骨细胞活性的影响。事实上,破骨细胞标记物TRAP的染色显示,与WT小鼠相比,IgSF11−/−小鼠在DMM手术后1周表现出显着较低的破骨细胞活化(图3a、b)。此外,与WT小鼠相比,IgSF11−/−小鼠从2周开始就有较少的成骨细胞(图3c)。这一发现支持这样的观点,即表达IgSF11的破骨细胞在OA诱导后不久就会诱导骨吸收,并且该过程随后激活成骨细胞,然后形成过多的骨。
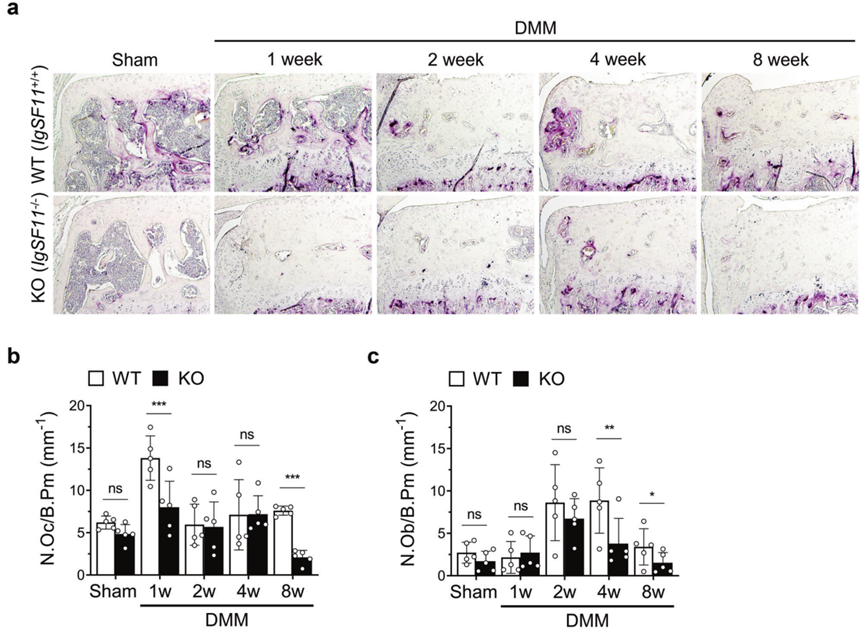
图3 IgSF11−/−小鼠在骨性关节炎诱导后不久即表现出破骨细胞活性降低
4、IgSF11基因敲除可减少小鼠骨性关节炎中SB的变化
图2a所示的组织学分析表明,虽然IgSF11缺失与OA后期SB板(SBP)增厚减少有关,但IgSF11−/−小鼠的SBP在第一周似乎更厚。为了在定量水平上证实这些发现,作者用组织学评分系统测量了骨性关节炎患者的SBP厚度。作者还测量了另外两个关键变量,即骨体积(BV/TV)和骨赘成熟度。事实上,IgSF11−/−小鼠在1周时表现出更大的SBP增厚,尽管这种变化没有统计学意义。然而,从2周开始,基因敲除的小鼠的SBP明显变薄(图4A)。在骨体积和骨赘成熟方面也观察到了类似的差异(图4b,c)。这些差异可能是由于IgSF11−/−小鼠的破骨细胞活性较低所致:这一现象导致了破骨细胞:成骨细胞失衡,最初导致SBP中更多的骨形成而不是骨吸收。然而,后来,腔隙的缺乏意味着成骨细胞没有被激活,也不会导致SBP增厚。
小鼠OA中SB结构的变化与破骨细胞释放活性TGF-β相关,从而诱导间充质干细胞中的Smad2/3磷酸化。这个过程导致它们增殖并分化为osterix+骨祖细胞,从而加速异常骨形成和血管生成。为了确定IgSF11敲除是否会干扰这一过程,作者使用抗pSmad3和抗osterix进行了免疫组织化学分析。事实上,在IgSF11−/−小鼠的SB中,这两种标志物在第1周和第2周时均下降(图5a-c)。因此,IgSF11敲除减弱了小鼠OA的早期SB变化。
作者通过另一种OA动物模型(即自发性年龄诱导的OA)证实了IgSF11在OA软骨破坏中的重要性。当作者检查6个月和12个月大的WT和IgSF11−/−小鼠的关节软骨和SB时,作者发现IgSF11缺失与12(但不是6)个月龄的关节软骨破坏显著减少相关。IgSF11基因敲除也与6个月时SBP增厚和骨体积增加有关,但在12个月时SBP变薄和骨体积变小。此外,作者观察到,随着WT小鼠在6个月龄时开始发展为骨性关节炎,它们在SB中的IgSF11表达上升。在12个月龄建立骨性关节炎时,这种表达已经正常化。这些发现都与作者对DMM手术诱导的骨性关节炎的观察结果相似(图2和图4),表明IgSF11不仅在创伤后骨性关节炎中指示SB重建和关节软骨破坏,而且在年龄相关的骨性关节炎中也是如此。
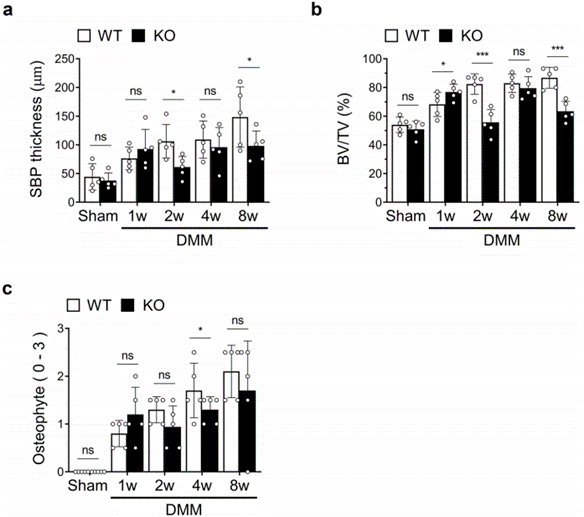
图4 IgSF11−/−小鼠在OA后期表现出较少的软骨下骨增厚
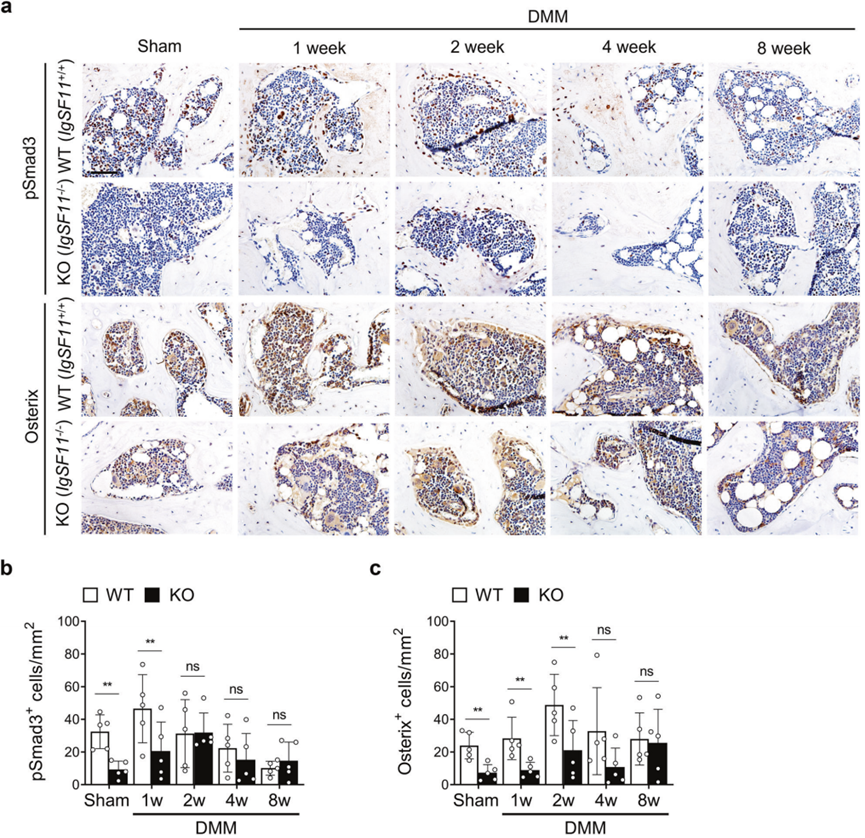
图5 IgSF11−/−小鼠在骨关节炎软骨下骨中表现出TGF-β信号减弱
5、破骨细胞中IgSF11敲除可减少OA中软骨细胞的分解代谢
SB和软骨之间的动态细胞和分子相互作用在关节稳态和OA发展中发挥着重要作用。特别是,OA中破骨细胞的异常形成和由此产生的SB重塑与软骨基质中软骨细胞分解代谢的增加和合成代谢的减少密切相关。潜在机制至少部分涉及破骨细胞释放生物活性分子。因此,为了测试IgSF11是否可以介导破骨细胞塑造软骨细胞分解代谢/合成代谢的能力,作者从naïve WT和IgSF11−/−小鼠中分离破骨细胞祖细胞,诱导它们分化为破骨细胞,收获它们的条件培养基(OC-CM),然后用OC-CM培养WT原代关节软骨细胞。正如预期的那样,WT CM显着上调软骨细胞中基质降解酶Mmp3和Mmp13的mRNA表达。相反,来自IgSF11−/−破骨细胞的OC-CM对软骨细胞分解代谢的促进作用比WT OC-CM弱(图6)。因此,IgSF11敲除不仅损害了破骨细胞吸收骨的能力,而且还削弱了它们释放增加软骨细胞分解代谢的分子。
为了在体内测试这一发现,作者使用针对MMP3、MMP13、COL2A1和聚集蛋白聚糖的抗体对患有DMM手术诱导OA的WT和IgSF11−/−小鼠的软骨进行免疫组织化学分析。事实上,随着疾病的进展,WT小鼠的软骨细胞越来越多地表达MMP3和MMP13,而当IgSF11被敲除时,这种效应在很大程度上被阻断。相反,随着疾病的进展,WT软骨细胞表达的COL2A1和聚集蛋白聚糖水平降低,并且这种现象在IgSF11−/−小鼠中得到了很大程度的改善。因此,WT破骨细胞可能会产生刺激软骨细胞分解代谢的分子,而这个过程依赖于IgSF11。这些发现共同支持了以下观点:IgSF11促进(1)破骨细胞吸收和SB重塑,以及(2)破骨细胞介导的软骨细胞调节及其对OA软骨的破坏。
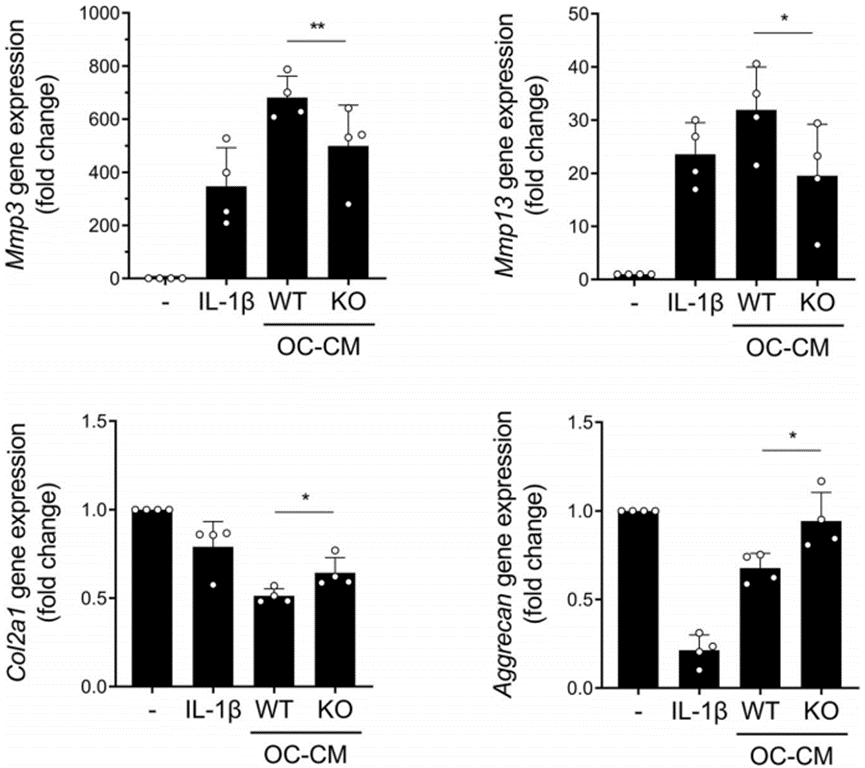
图6 IgSF11缺失会阻断破骨细胞分泌体增强体外软骨细胞分解代谢的能力
6、SB中表达IgSF11的细胞与RANK共定位
为了确定表达IgSF11的细胞在DMM手术诱导的骨性关节炎WT小鼠SB中的确切位置和形态,作者用IgSF11和破骨细胞分化和功能的经典标志物进行了双重免疫荧光染色。这些标记物是RANK,它是破骨细胞分化所必需的关键破骨细胞受体;识别M-CSF并促进破骨细胞分化成熟的CSF-1R;TRAP,破骨细胞在骨吸收过程中分泌的;CTSK,是骨吸收过程中破骨细胞释放的一种关键的I型胶原蛋白酶;Atp6v0d2,它是破骨细胞特异性质子泵的重要组成部分,在骨吸收过程中介导细胞外酸化。WT小鼠在骨关节炎诱导后1周,RANK与表达IgSF11的细胞共存。这些细胞主要位于骨髓中,呈圆形,有一个或两个核(图7a,b)。然而,CSF-1R、TRAP、CTSK和Atp6v0d2大部分位于SB表面,并不与表达IgSF11的细胞共定位。值得注意的是,qRT-PCR显示IgSF11敲除显着降低了早期OA SB中的RANK mRNA表达(图7c)。SB中RANK+IgSF11+细胞的骨髓位置及其形态表明表达IgSF11的细胞不是成熟的破骨细胞。尽管如此,考虑到表达IgSF11的细胞也表达RANK,很明显IgSF11参与OA中的破骨细胞成熟和骨吸收。
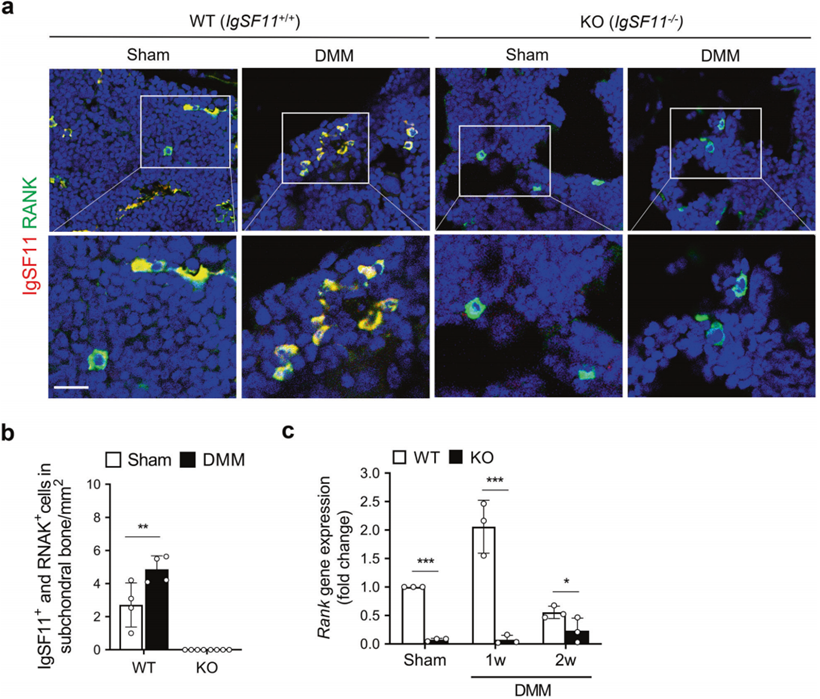 图7 患有OA的WT小鼠软骨下骨中表达IgSF11的细胞与RANK共定位
图7 患有OA的WT小鼠软骨下骨中表达IgSF11的细胞与RANK共定位
作者的研究表明阻断OA的早期软骨下骨变化可以改善OA的关节软骨破坏。此外,在DMM诱导的OA不稳定后,IgSF11迅速通过分化的破骨细胞表达,并在软骨下骨中上调。IgSF11缺乏不仅可以抑制OA软骨下骨的变化,还能阻止软骨破坏。OA软骨下骨中表达IgSF11的细胞被发现参与破骨细胞成熟和骨吸收,并与关键破骨细胞分化因子核因子κ-B(RANK)受体激活剂共定位。作者的发现为OA的治疗提供了新的策略。
实验方法:
WB、组织学和免疫组织化学、免疫荧光染色、qRT‒PCR
参考文献:
Kim GM, Kim J, Lee J-Y, Park M-C, Lee SY. IgSF11 deficiency alleviates osteoarthritis in mice by suppressing early subchondral bone changes. Experimental & Molecular Medicine. 2023. doi: 10.1038/s12276-023-01126-6.






