PD-1- CD45RA+效应记忆CD8 T细胞和CXCL10+巨噬细胞 与晚期肝细胞癌中阿特朱单抗加贝伐单抗的反应相关
阿特朱单抗加贝伐单抗 (atezo/bev) 的组合极大地改变了晚期 HCC (aHCC) 的治疗格局,在一些患者中实现了持久的缓解。使用单细胞转录组学,我们描述了接受 atezo/bev 治疗的 aHCC 患者的肿瘤内和外周免疫环境。来自具有持久反应的患者的肿瘤富含 PDL1+ CXCL10+ 巨噬细胞,并且根据细胞-细胞相互作用分析,表达高水平的 CXCL9/10/11,并预计会吸引外周 CXCR3+ CD8+ 效应记忆 T 细胞 (CD8 TEM) 进入肿瘤。基于 T 细胞受体共享和伪时间轨迹分析,我们提出 CD8 TEM 优先分化为克隆扩增的 PD1- CD45RA+ 效应记忆 CD8+ T 细胞(CD8 TEMRA),具有明显的细胞毒性。相比之下,在无反应者中,CD8 TEM 仍冻结在其效应记忆状态。最后,在应答者中,CD8 TEMRA 显示出与血液高度共享的 T 细胞受体,这与他们的巡逻活动一致。这些发现可能有助于了解 aHCC 中对 atezo/bev 反应的可能机制。
该研究于2023年11月发表在《Nature communications》,IF:16.6。
技术路线:
结果:
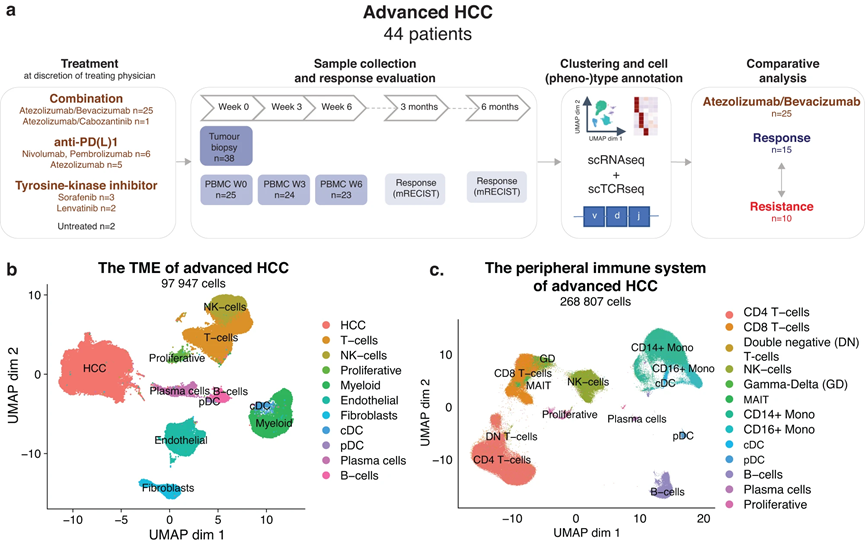
1、晚期HCC的肿瘤微环境和外周免疫系统
对 38 名aHCC 患者进行了治疗前组织活检,进行了scRNA-seq(图 1a),从 97,947 个单细胞中获得了高质量的转录组数据(图 1b)。随后的降维和聚类分析确定了几个簇,根据标记基因表达分配给 T 细胞和 NK 细胞 (30%)、B 细胞 (5%)、髓系细胞 (12%) 和基质细胞类型 (12%)。我们还鉴定了一个增殖簇,主要由增殖的 T 细胞和一大群 HCC 癌细胞(40%)组成,表达与正常肝功能相关的基因(ALB、HP、FGA、FGB)和肝癌(AFP、SPINK1、GPC3、AKR1C1)。同样,对连续治疗(第 0-3-6 周)PBMC 样本(n = 72,来自 25 名 aHCC 患者)进行单细胞分析,产生了 268,807 个 PBMC 的高质量转录组数据,并注释为各自的使用标记基因识别细胞类型(图1c)。这些数据共同提供了接受全身疗法治疗的 aHCC 患者的 TME 和外周免疫系统的独特细胞图谱,并为未来的研究工作提供了宝贵的资源。
2、肿瘤内 T/NK 细胞组成不同于外周 T/NK 细胞组成
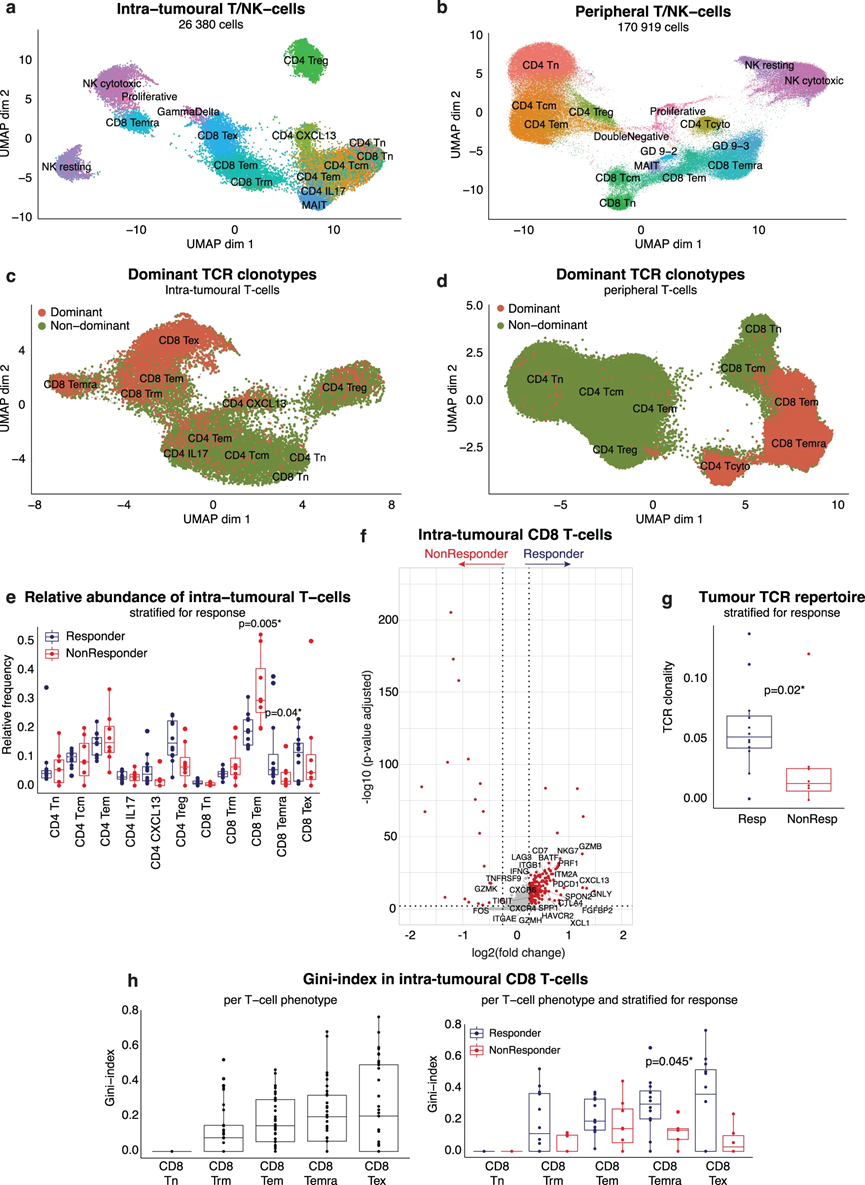
首先,我们更详细地探索了 TME 和外周血的 T/NK 细胞划分。分别对总共 26,380 个肿瘤内 T-/NK 细胞和 170,919 个外周 T-/NK 细胞(PBMC 的 64%)进行亚聚类,我们鉴定了 CD4 T 细胞、CD8 T 细胞和自然杀伤细胞的几种表型细胞(NK细胞)(图2a,b)。值得注意的是,CD4(CD4 CXCL13)和CD8(CD8 TEX)“耗尽”T细胞是TME所独有的,其特征是PDCD1(PD1)和其他已知耗尽标记物的最高表达。根据典型标记基因(CX3CR1、SPON2、FGFBP2)的表达,我们在TME和外周血中鉴定出了CD45RA效应记忆CD8 T细胞(CD8 TEMRA)。我们使用 TotalSeq-C 数据证实了它们在蛋白质水平上的 CD45RA 表达。重要的是,CD8 TEMRA 在表型上相似,并且聚集在细胞毒性 NK 细胞附近,但根据其 CD8(CD8A、CD8B)的表达和有效 TCR 序列的检测进行区分。
结合scRNA-seq和scTCR-seq,我们在TME中鉴定出17,842个T细胞携带12,690个独特的TCR,而115,711个外周T细胞携带90,188个独特的TCR序列。我们根据相同的 TCR 序列鉴定了 TCR 克隆型,并将显性克隆型定义为由 >5 个 T 细胞共享的 TCR。在肿瘤内 T 细胞中,优势克隆型集中在效应细胞(CD8 TEM、CD8 TEMRA)和“经历过抗原”的 T 细胞簇(CD8 TEX、CD4 CXCL13;图 2c)内,而非优势克隆型主要发现于初始、记忆或调节性 T 细胞亚型。同样,主要的外周 T 细胞克隆型与肿瘤中的表型对应物一致,集中在外周效应 T 细胞内(CD8 TEM、CD8 TEMRA、CD4 TCYTO;图 2d)。
简而言之,虽然表型不同,但 CD8 效应 T 细胞(CD8 TEM、CD8 TEMRA)和 CD8 耗竭 T 细胞(CD8 TEX)在肿瘤和外周血中均具有显性 T 细胞克隆型特征。
3、克隆扩增的 CD8 TEMRA 与阿特朱单抗/贝伐单抗的反应相关
为了确定与 atezo/bev 反应相关的 CD8 T 细胞表型,我们比较了有反应者和无反应者之间肿瘤和外周免疫系统的几个特征,包括 i) 肿瘤内 CD8 T 细胞的丰度,ii)肿瘤和外周 TCR 库以及 iii) 肿瘤和血液之间 TCR 共享的程度。
首先,比较有反应者和无反应者之间 TME 中各种 T 细胞表型的相对丰度,我们发现 CD8 TEMRA 在有反应的肿瘤中更丰富(p = 0.04),而 CD8 TEM 在无反应者中增加(p = 0.005;图2e)。值得注意的是,尽管CD8 TEX表达了最高水平的治疗靶点PDCD1(PD1),但它们在TME中的存在并没有根据反应而不同(图2e)。 TME 中 CD8 T 细胞的差异基因表达揭示了细胞毒性基因(GZMB、GNLY、PRF1、GZMH)和典型 CD8 TEMRA 标记(FGFBP2、FCGR3A)的上调,表明 CD8 TEMRA 可能在实现对 atezo/bev 的持久反应中发挥重要作用(图2f)。相比之下,无反应的肿瘤更具记忆性(FOS),并且 GZMK(一种典型的 CD8 TEM 标记物)上调(图 2f)。其次,有反应的肿瘤的特点是具有更多克隆性的治疗前 TCR 库,而无反应者则表现出更丰富、更多样化的非克隆基线 TCR 库(图 2g)。计算基尼指数时,考虑到 TCR 均匀度(1-克隆性)和 TCR 丰富度,对于每个 CD8 T 细胞表型,肿瘤内 CD8 TEM、CD8 TEMRA 和 CD8 TEX 的克隆扩增程度最高(图 2h 左)。重要的是,当对atezo/bev的反应进行分层时,与无反应者相比,有反应的肿瘤中的CD8 TEMRA具有显着更高的基尼指数(p = 0.045;图2h右)。相反,在比较应答者与非应答者时,我们没有检测到 CD8 TEM 和 CD8 TEX 克隆扩增的显着差异。这些发现表明,治疗前存在于 TME 内的克隆扩增的 CD8 TEMRA 可能有助于 aHCC 中对 atezo/bev 的反应。
4、TCR 共享证实 CD8 TEMRA 是 aHCC TME 中的关键效应 T 细胞
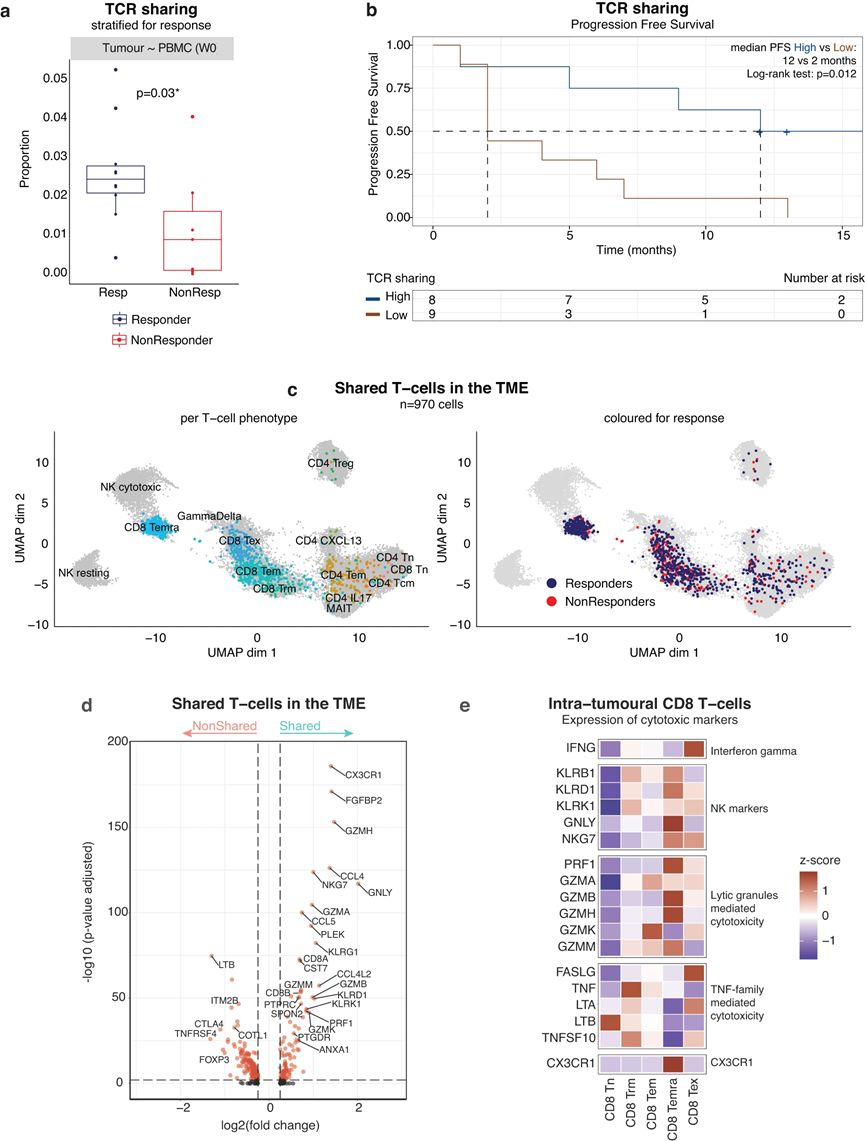
由于与外周血T细胞共享相同TCR序列的肿瘤内T细胞更有可能具有肿瘤反应性,因此我们在17例接受atezo/bev治疗的患者中探索了肿瘤和PBMCs之间共享的TCR,其中10例对atezo/bev有反应。我们特别关注治疗开始前(PBMC第0周)肿瘤和外周血中存在的TCR序列,假设这些共享的TCR代表了针对肿瘤和由肿瘤驱动的基线免疫反应。共检测到403个独特的共享的,可能是“肿瘤特异性”的TCRs,约占肿瘤中检测到的所有TCRs的7.1%,而在外周血中检测到的所有TCRs的0.6%。为了校正每个样本中检测到的T细胞数量,我们计算了共享TCR相对于PBMCs中检测到的TCR总数的比例,发现应答者显示出更高程度的TCR共享(平均2%;P = 0.03;图3 a)。在共享外周T细胞的比例中检测到类似的趋势。重要的是,TCR共享的增加与显著较长的PFS相关(中位PFS为12个月vs 2个月;P = 0.012;图3b),支持我们的假设,即TCR共享可能确实鉴定了肿瘤内真正靶向肿瘤的部分T细胞。
将这些共享TCRs与TME中的T细胞表型联系起来(图3c左),发现大多数代表CD8 T细胞,集中于CD8效应亚型(CD8 TEM和CD8 TEMRA)。事实上,63%的CD8 TEMRA和22%的CD8 TEM在治疗前的外周血中也检测到TCR,而CD8 TEX在治疗前的外周血中也检测到TCR (13%)。与这些发现一致,差别基因表达表明,在共享TCRs的肿瘤内T细胞(n = 970个共享T细胞)中,CD8 (CD8A和CD8B)和细胞毒性标记(GZMA、GZMB、GZMH、GNLY、PRF1)以及典型的CD8 TEMRA标记(CX3CR1、SPON2、FGFBP2)过表达。相反,只在肿瘤中发现的携带TCR的T细胞富集了耗竭标志物(CTLA4)和调节基因(FOXP3、TNFRSF4;图3 d)。重要的是,虽然共有的CD8 TEM存在于治疗有效组和治疗无效组的TME中(分别占所有瘤内CD8 TEM的18%和8%),共有的CD8 TEMRA几乎只出现在治疗有效组的肿瘤中(在所有瘤内CD8 TEMRA中,治疗有效组为57%,而治疗无效组为6.1%;图3c右)。
CD8 TEMRA被描述为“近期激活的”CD8效应记忆T细胞。不表达PDCD1或其他传统上与抗原经历相关的标记物。相反,它们在抗原刺激后重新表达CD45RA。它们被认为是一种哨兵样T细胞表型,在抗原频繁接触的炎症部位巡逻。基于它们高表达的细胞毒性标记(PRF1, NKG7, GZMA, GZMB, GZMH, GNLY;图3e),其依赖于T细胞及其靶细胞和指导其迁移到炎症组织的组成性表达受体之间的直接相互作用(CX3CR1)。
5、与肿瘤抗原的相互作用驱动肿瘤内向 CD8 TEMRA 分化
为了深入了解 TME 中 CD8 TEMRA 的起源,我们使用 Slingshot 计算了肿瘤内 CD8 T 细胞的伪时间轨迹。我们认为 CD8 初始 T 细胞(CD8 TN)是轨迹的根源,因为它们具有最高的 TCR 丰度。与之前的报道一致,初始 T细胞连接到TEM细胞,然后分成三个不同的轨迹,将初始 T细胞和TEM T细胞连接到TRM、TEMRA和TEX(图4a左)。 TCR 丰富度沿着每条轨迹下降。 CD8 TEM显示大多数TCR克隆型与TEX重叠,但也与TEMRA和TRM重叠(图4b),而属于不同谱系的T细胞之间几乎没有TCR重叠,这支持了三种轨迹的有效性。沿每个轨迹分析标记基因证实了它们的功能注释。
当绘制沿每个轨迹的 T 细胞密度时,我们发现响应者和非响应者之间存在显着差异。应答者中的肿瘤内 CD8 T 细胞能够进化为更加分化的表型,这种效应在 TEMRA 轨迹中最为明显,而无应答者似乎冻结在假时间的早期阶段(p < 0.001;图 4c) 。沿着有反应的肿瘤的 TEMRA 和 TEX 轨迹,基尼指数稳步增加。重要的是,当评估沿着 CD8 轨迹的共享 T 细胞的密度时(图 4a 右),我们发现这些细胞在应答者的 TEMRA 轨迹末端明显富集(图 4d)。相比之下,沿着 TEX 轨迹,在 TEM 阶段,应答者和非应答者的 T 细胞密度都达到最大。
然后,我们使用 TradeSeq 来识别沿 TEMRA 与 TEX 轨迹差异表达的基因组(使用 diffEnd 测试)。来自 REACTOME 或“GO:生物过程”基因集的总共 13 条途径和 46 条途径分别在 CD8 TEMRA 和 TEX 轨迹中显着富集。重要的是,TEMRA轨迹以与先天样免疫相关的途径为主(图4e),反映了它们作为通过直接细胞毒性消除癌细胞的有效效应T细胞的作用。相比之下,TEX 轨迹富含涉及 IFNG 信号传导以及免疫细胞激活和分化的途径。为了了解哪些因素驱动这种双重分化,我们再次使用 TradeSeq 评估轨迹分歧点之前和之后表达模式的差异(使用 EarlyDEG 测试),并发现总共 333 条途径被富集。重要的是,涉及抗原结合的途径排名最高,表明进一步分化需要与抗原直接相互作用(图4f)。
最后,为了研究治疗中的免疫反应,我们使用了治疗前 PBMC 和 TME 中存在的共享 TCR 克隆型,将它们与外周血中的表型联系起来,并在治疗期间(第 0-3-6 周)采样的 PBMC 中跟踪它们在治疗过程中的演变。首先,在 TME 中表征 CD8 TEMRA 的 422 个独特 TCR 主要在外周 CD8 TEMRA 中发现。治疗前,它们占应答者所有 CD8 外周 T 细胞的 18%(6575 个外周 CD8 T 细胞中的 1183 个),而在无应答者中仅占 2%(图 4g 左)。追踪治疗期间的演变,有反应者的 TCR 共享程度仍然很高(6 周后为 18.6%),而我们没有观察到无反应者有任何显着变化(第 6 周为 1.6%;图 4g 左)。这与 TME 中 CD8 TEX 中发现的 1065 个独特 TCR 形成鲜明对比,在应答者和非应答者中,在不到 1% 的 CD8 外周 T 细胞中发现了这些 TCR(图 4g 右)。此外,在治疗期间,在肿瘤内 CD8 TEX 中发现的这些 TCR 并未出现在外周血中。
总而言之,这些数据表明,虽然 CD8 TEM 存在于应答者和非应答者的 TME 中,但在受到肿瘤抗原刺激后,CD8 TEM 更有可能在应答者中分化为 CD8 TEMRA,从而可能导致直接抗-肿瘤细胞毒性。此外,CD8 TEMRA 在应答者中显示出与 PBMC 显着的 TCR 共享,并且在使用 atezo/bev 治疗后继续这样做,这与它们的巡逻表型一致。相比之下,从 CD8 TEM 到 CD8 TEX 的肿瘤内分化在atezo/bev 的应答者和无应答者中同样发生,并且 CD8 TEX 在治疗前不与血液共享 TCR,在atezo/bev 治疗期间也不会出现。
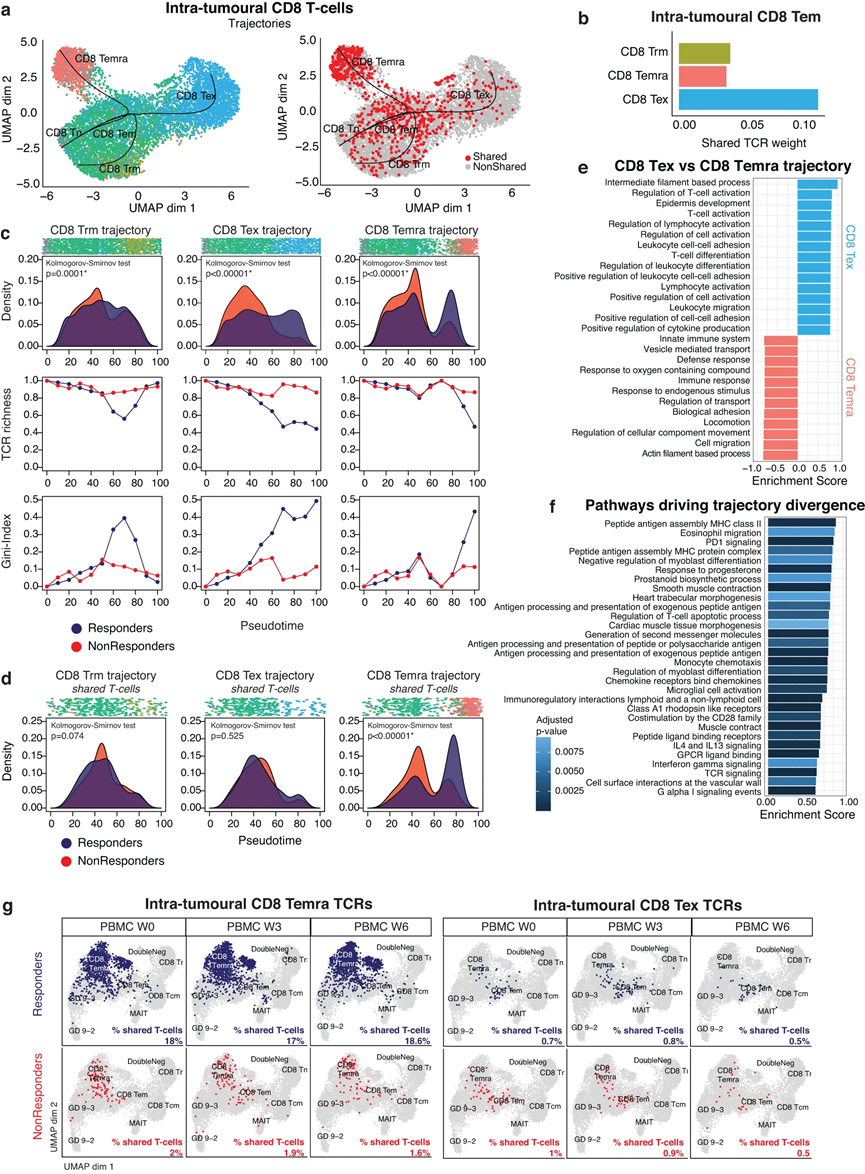
6、表达促炎性 PDL1 的 CXCL10+ 巨噬细胞与反应相关
虽然肿瘤内 CD8 TEMRA 与随后对 atezo/bev 的反应相关,但它们不表达 PDCD1 (PD1)。因此,我们想知道 aHCC 中 atezo/bev 的真正靶点是否可能在表达 PDL1 的细胞中找到。 TME 中 CD274 (PDL1) 的表达普遍较低,但在髓系细胞中可清晰检测到。因此,我们将 11,678 个髓系细胞亚聚类为单核细胞/巨噬细胞 (n = 10 609) 和树突细胞 (DC;n = 764)。在单核细胞/巨噬细胞区室中,我们鉴定了几种与肿瘤相关的巨噬细胞(TAM)亚型(图5a),其中大多数表达高水平的抗炎标志物,表明aHCC中主要是免疫抑制性基线TME。然而,我们还发现了促炎性CXCL10+ TAM,其特征是参与T细胞募集(CXCL9、CXCL10)和干扰伽玛信号传导(STAT1、IDO1、GBP1)的基因高表达。
比较有反应和无反应肿瘤之间各种 TAM 亚型的相对丰度,我们发现无反应者具有更高丰度的表达 TREM2 的巨噬细胞,这些巨噬细胞之前被鉴定为 HCC 肿瘤中的免疫抑制性巨噬细胞,它们的存在与抗 PD1 疗法的耐药性有关。差异基因表达显示,有反应的肿瘤巨噬细胞区室中涉及 T 细胞募集(CXCL9、CXLC10)和干扰素-γ 活性(GBP1、STAT1)的基因富集,而无反应者则富集免疫抑制标记物(GPNMB、CCL18;图5b)。有反应的肿瘤还表现出较高水平的 CCL2,这是一种有效的单核细胞吸引趋化因子,但也参与将其他免疫细胞招募到 TME 中。最后,应答者表现出较高的 SPP1 表达,此前该表达与肺癌 CPI 单一疗法的应答相关。其他通路分析证实,响应肿瘤的巨噬细胞在促炎通路中富集。重要的是,平均而言,应答者的髓系细胞表达显着更高水平的 CD274(图 5c 顶部)。更具体地说,CD274 表达在 Macro CXCL10 中最高,而源自响应肿瘤的 Macro CXCL10 显示出更高的 CD274 表达(图 5c 底部)。 Macro CXCL10 中 CD274 (PDL1) 的高表达也与较长的 PFS 相关(中位 PFS 为 13 个月与 3 个月;p = 0.035;图 5d)。总而言之,对 atezo/bev 的反应与治疗前 TME 中激活的、促炎的、表达 PDL1 的骨髓成分相关。
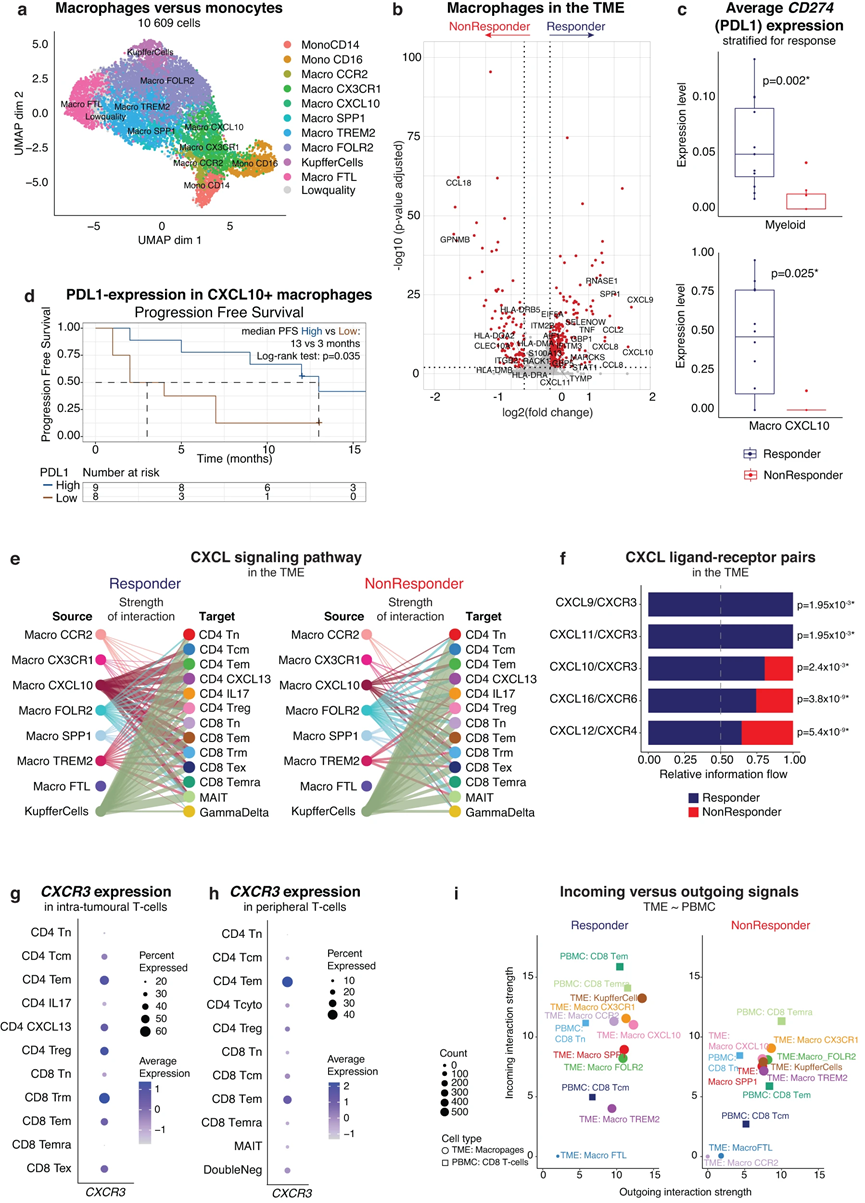
7、表达 PDL1 的 CXCL10+ 巨噬细胞将效应记忆 T 细胞招募到 TME 中
肿瘤相关巨噬细胞与外周 T 细胞招募至 TME 相关。因此,我们使用 CellChat 来预测髓系细胞和 T 细胞之间的受体-配体相互作用。首先,分别计算应答者和非应答者 TME 中免疫细胞类型之间的显着相互作用,我们发现总体而言,应答者表现出更多的相互作用可能性。重点关注 CXCL 信号通路网络,我们发现所有患者的肝脏驻留巨噬细胞和 T 细胞之间都存在预测的相互作用,无论反应如何。相反,与无反应者相比,有反应的肿瘤显示出更多可预测的CXCL10+巨噬细胞和T细胞区室之间的相互作用(图5e)。虽然CXCL12/CXCR4相互作用几乎完全起源于Kupffer细胞,在应答者和非应答者中均发现,但与非应答者相比,CXCL9/10/11和CXCR3配体-受体对在应答者中显着富集(图5f) 。
在TME中,CXCR3在几种激活的T细胞亚型(即CD4 CXCL13和CD8 TEX,以及CD4 TEM和CD8 TEM,图5g)中显着表达,但不在CD8 TEMRA中表达,并且沿着TEMRA轨迹,CXCR3表达达到其峰值位于效应器记忆状态。在外周T细胞中,CXCR3主要在效应记忆T细胞中表达(图5h)。基于这些发现,我们假设 CXCR3 与其配体 CXCL9/10/11 之间的相互作用在将外周 CD8 效应记忆 T 细胞 (CD8 TEM) 招募到 TME 中起着重要作用。为了证实这一点,我们再次使用 CellChat 探索肿瘤内巨噬细胞和外周 CD8 T 细胞之间的受体-配体相互作用。事实上,考虑到所有细胞间通讯网络,我们发现 CD8 外周 T 细胞是应答者中最主要的信号“接收器”(图 5i),与无应答者中的表型对应物相比,传入信号的水平更高肿瘤。此外,在CXCL信号通路内,与无反应者相比,有反应者的肿瘤内CXCL10+巨噬细胞与外周CD8 TEM之间有更多预测的相互作用。
总体而言,这支持了以下观点:肿瘤内髓样区室(其特征是应答者中 CXCL9/10/11 表达上调)可能参与 TME 中 CXCR3+ 效应记忆 T 细胞的招募和激活,可能发挥作用在确定对 atezo/bev 的反应中发挥作用。
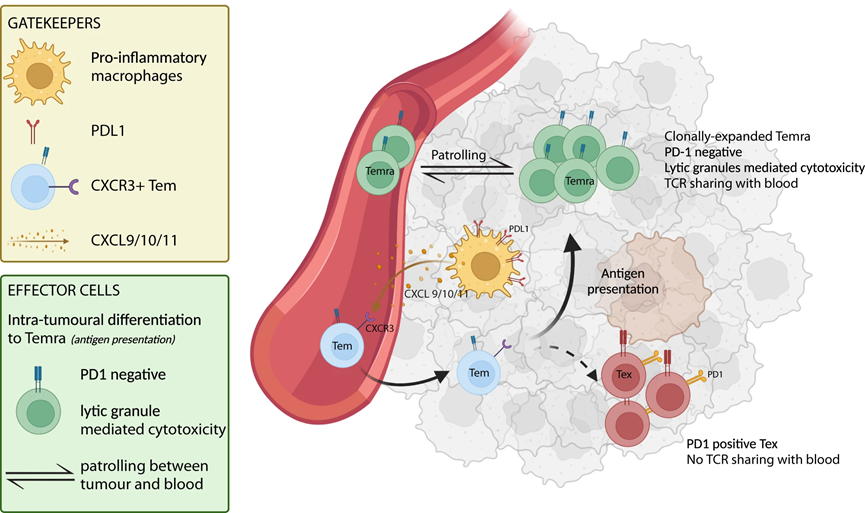
8、CD8 TEMRA 和 CXCL10+ 巨噬细胞作为 aHCC 中阿替珠单抗/贝伐单抗反应的预测生物标志物
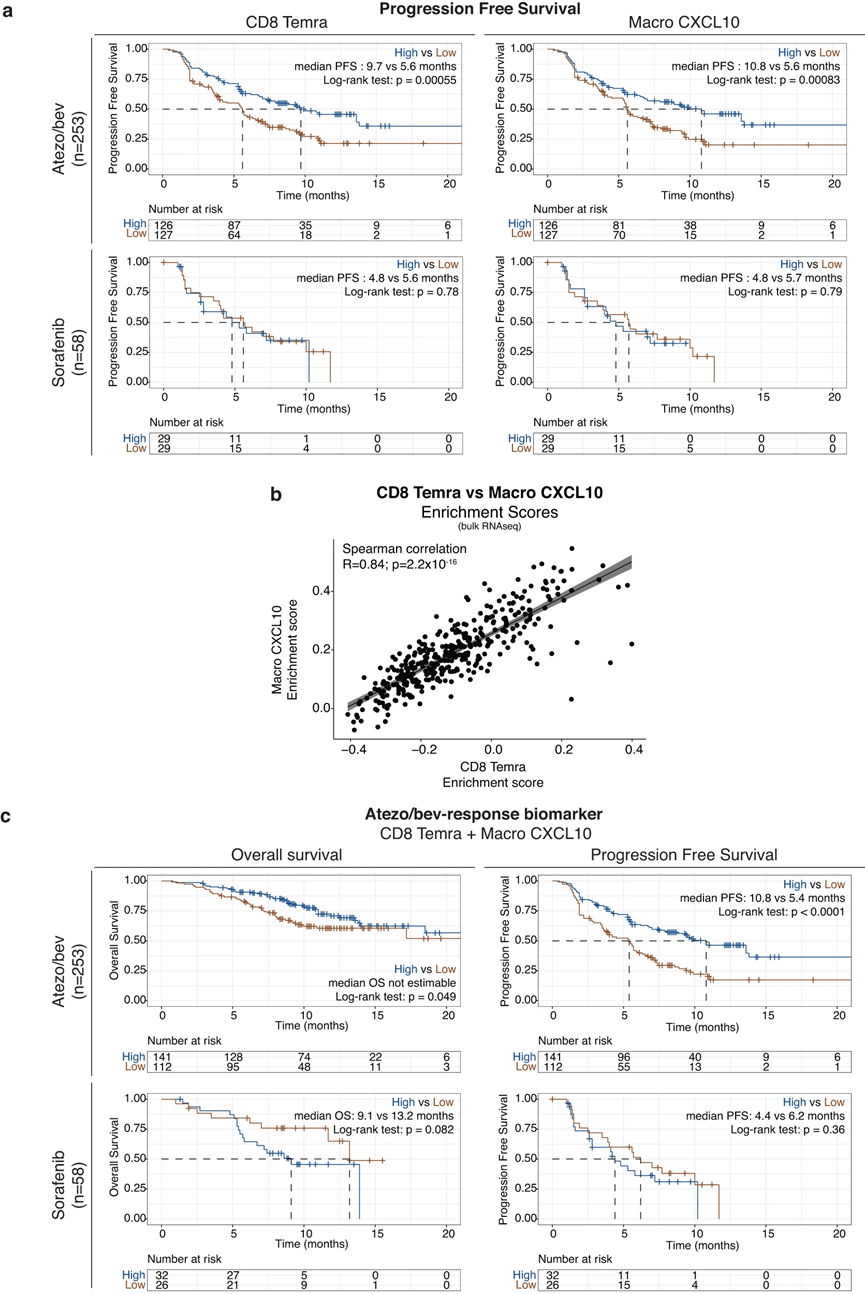
使用 scRNAseq,我们确定了克隆扩增的细胞毒性 CD8 TEMRA 作为可能的效应细胞,驱动对 atezo/bev 的反应,而 CXCL10+ 巨噬细胞 (Macro CXCL10) 可能作为看门人,负责招募启动的效应记忆外周 T 细胞(图 6)。接下来,我们的目的是验证这些单细胞衍生的发现,并探索 CD8 TEMRA 和 Macro CXCL10 作为 aHCC 中 atezo/bev 反应的预测生物标志物的潜力。通过计算接受 atezo/bev (n = 253) 与索拉非尼 (n = 58) 治疗的 aHCC 患者的 311 例治疗前肿瘤活检的转录组数据中每个样本的 CD8 TEMRA 和 Macro CXCL10 富集评分,我们发现高 CD8 TEMRA 和 Macro CXCL10 富集评分在atezo/bev治疗的患者中,CXCL10富集评分与显着较长的PFS相关(图7a顶部),但在索拉非尼治疗的患者中则不然(图7a底部)。此外,TME 中 CD8 TEMRA 和 Macro CXCL10 的存在密切相关(R = 0.84;p < 0.00001;图 7b),支持它们一起填充 aHCC 的 TME 的观点。事实上,将 CD8 TEMRA 和 Macro CXCL10 标记基因组合到单个基因集中,我们发现“atezo/bev 反应生物标记物”富集得分较高的 atezo/bev 治疗患者的 OS 和 PFS 显着延长(p = 0.049、 p < 0.0001),在索拉非尼治疗的患者中未观察到这种关联(图7c)。综上所述,aHCC 患者治疗前 TME 中 CD8 TEMRA 和 Macro CXCL10 的联合存在与 atezo/bev 治疗结果的改善相关,特别是验证了单细胞衍生的发现并强调了 'atezo 的潜在价值“/bev-反应生物标志物”作为 aHCC 中对 atezo/bev 反应的预测生物标志物。
实验方法:
scRNA-seq、T 细胞库分析、细胞表面表位分析、TotalSeq-C、V(D)J 分析、TCR 共享、轨迹推断分析、CellChat。
参考文献:
Cappuyns, S., Philips, G., Vandecaveye, V. et al. PD-1- CD45RA+ effector-memory CD8 T cells and CXCL10+ macrophages are associated with response to atezolizumab plus bevacizumab in advanced hepatocellular carcinoma. Nat Commun 14, 7825 (2023).






