肿瘤相关纤维化损害非小细胞肺癌的免疫监视和对免疫检查点阻断的反应
非小细胞肺癌(NSCLC)是癌症相关死亡的主要原因。免疫检查点阻断改善了许多非小细胞肺癌患者的生存,但大多数患者无法获得长期益处。了解导致非小细胞肺癌免疫监视降低的因素对改善患者预后至关重要。在这里,作者发现人类非小细胞肺癌含有大量的纤维化,这与T细胞浸润减少有关。在小鼠非小细胞肺癌模型中,纤维化的诱导导致肺癌进展加快,T细胞免疫监视功能受损,免疫检查点阻断效果失效。与这些变化相关,作者观察到纤维化导致树突状细胞数量和功能受损,巨噬细胞表型改变,这可能导致免疫抑制。在癌症相关成纤维细胞中,col13a1表达群体中的明显变化表明,这些细胞产生趋化因子来招募巨噬细胞和调节性T细胞,同时限制树突状细胞和T细胞的招募。通过转化生长因子-β受体信号传导靶向纤维化克服了纤维化的影响,增强了T细胞反应,提高了免疫检查点阻断的疗效,但仅在化疗的背景下。总之,这些数据表明,非小细胞肺癌的纤维化导致免疫监视降低和对检查点阻断的反应性差,并突出了抗纤维化治疗作为克服免疫治疗耐药性的候选策略。该文与2023年6月发布于《Science Translational Medicine》,IF=17.1。
技术路线:
主要研究结果:
1、人类非小细胞肺癌组织纤维化TME
为了确定纤维化对非小细胞肺癌的影响,作者首先表征了人类非小细胞肺癌中反应性基质的定位和相对丰度。为了分析反应性纤维化,作者首先对NSCLC TMAs进行了胶原三色染色和α -平滑肌肌动蛋白(α-SMA)的免疫组织化学(IHC)分析,α-SMA是活化成纤维细胞的标志。作者确定,与正常对照肺组织相比,NSCLC的TME中纤维化量增加,这可以通过胶原沉积增加(图1A和B)和活化的CAFs(图1、C和D)来定义。此外,在肿瘤细胞巢周围经常可见成纤维细胞(图1C)。考虑到获取TMA的抽样偏差,作者接下来对作者机构获得的I期和II期非小细胞肺癌切除样本的苏木精和伊红(H&E)染色切片进行了自动组织分析(图1E和F)。作者确定,按面积计算,肿瘤相关间质平均约占切除样本的50%,范围从14.1到82.9%(图1G)。这些数据表明,大多数非小细胞肺癌存在大量的肿瘤相关纤维化和结缔组织增生。为了更好地了解这种肿瘤结缔组织增生与肿瘤免疫的关系,作者评估了T细胞浸润情况。作者进行了CD8和CK7双免疫组化染色,以确定CD8+ T细胞与肿瘤细胞的接近程度,并将其与来自每个样本的基质数量进行比较。作者发现基质的数量,无论是以基质面积还是胶原密度计算,都与CK7+肿瘤细胞50 μm内CD8+ T细胞数量的减少相关(图1,H至J)。这些数据表明,肿瘤相关纤维化的增加可能会影响非小细胞肺癌的T细胞数量。
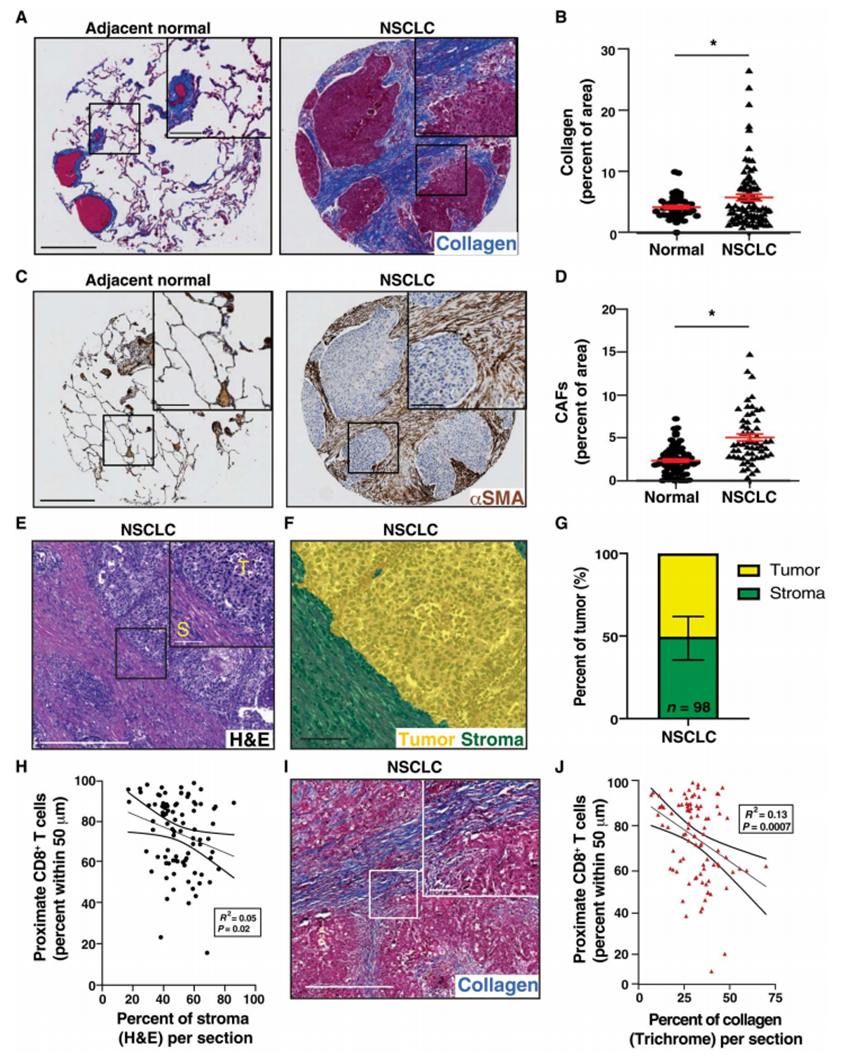
图1、人类非小细胞肺癌组织存在反应性纤维化
2、反应性纤维化驱动肺腺癌进展
为了确定纤维化在肿瘤免疫监测和肿瘤进展中的作用,作者评估了几种非小细胞肺癌小鼠模型的纤维化。其中包括常用的基因工程小鼠模型(GEMMs) KrasLSL-G12D;Trp53fl/fl (KPL)小鼠,它们被给予气管内单次腺病毒- Cre重组酶诱导转化。作者还使用了Lewis肺癌(LLC)的原位模型,以及在气管内腺病毒- Cre重组酶(KPL86)治疗9个月后,从Trp53杂合null (KPL GEMM)的肺中提取的细胞系。与人类非小细胞肺癌相比,在所有这些模型中,作者发现胶原沉积最少(图2A-C)。为了模拟反应性纤维化可能对肿瘤进展和免疫的影响,作者使用了两个实验系统。其中包括气管内给药博来霉素(Bleo)或异硫氰酸荧光素(FITC)。Bleo诱导肺泡上皮细胞损伤,导致自由基和氧化应激增加,最终在2 - 4周内导致炎症和反应性纤维化。FITC导致肺泡和血管损伤加重,在2 ~ 3周内导致纤维化。Bleo或FITC胶原蛋白增加,所评估的三色的染色,淀积瘤旁和肺实质,以及肿瘤相关αSMA +三个模型的成纤维细胞(图2A-C)。通过流式细胞术,作者观察到在纤维化环境中CD45 - EpCAM - CD31 - CAFs的数量增加。在所有评估的模型中,Bleo或FITC诱导反应性纤维化导致肿瘤进展加快,包括KPL GEMMs和原位LLC和KPL86模型(图2D-I)。总之,这些数据表明反应性纤维化可能是肿瘤进展的强大驱动因素。
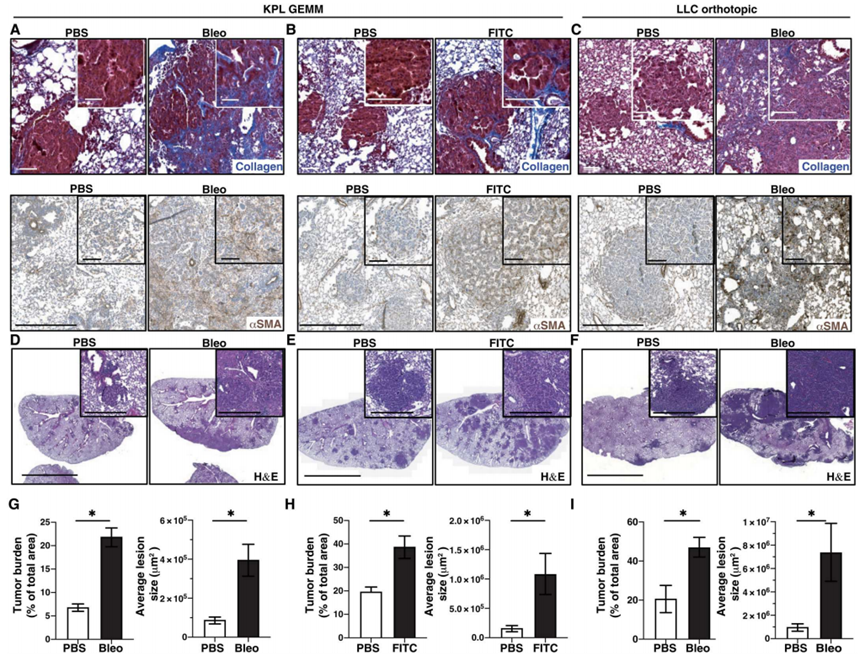
图2、反应性纤维化促进非小细胞肺癌小鼠模型的癌症进展
3、纤维化损害免疫监视和T细胞介导的肿瘤控制
鉴于T细胞介导的肿瘤控制的重要性,以及作者在人类非小细胞肺癌中观察到纤维化与T细胞负相关,作者试图确定纤维化是否会损害T细胞免疫。免疫组化对T细胞的分析显示,来自KPL GEMMs以及LLC和KPL86原位模型的bleo诱导的纤维化肿瘤中CD8+ T细胞数量减少(图3A-D)。同样,FITC诱导的反应性纤维化也减少了KPL GEMMs肿瘤内CD8+ T细胞的数量。流式细胞术分析发现,纤维化小鼠的PD-1+ CD8+ T细胞和Foxp3+ CD4+ treg增加。为了评估纤维化对肿瘤控制的作用是否可能是T细胞介导的,在原位LLC模型中,无论是否存在Bleo, CD4+和CD8+ T细胞都被耗尽。在没有Bleo的情况下,作者发现T细胞的耗竭导致肿瘤负荷的增加,这表明在该模型中T细胞能够抑制肿瘤的生长(图3E)。相反,在Bleo存在的情况下,作者发现T细胞的消耗并没有进一步增加肿瘤负荷(图3E)。这些数据表明,纤维化至少在一定程度上通过损害T细胞来促进肿瘤生长。为了评估纤维化对免疫监测的影响,作者使用了KPL GEMMs,这些GEMMs在Cre-recombinase的控制下,也表达与绿色荧光蛋白(GFP) (KPLOG)融合的卵清蛋白(OVA)(图3F)。在由此产生的肿瘤中,作者观察到与KPL小鼠相比,KPLOG小鼠的CD8+ T细胞显著(P = 0.02)增加,这表明诱导了T细胞免疫(图3G和H)。在该模型中,与免疫监视在肿瘤控制中的作用一致,表达OG抗原的KPLOG小鼠衍生的肿瘤比OG−KPL小鼠的肿瘤小(图3I和J)。OG新抗原表达对免疫介导的肿瘤控制的影响被取消,OG+和OG−KPL小鼠的肿瘤负荷同样加速(图3I和J)。这些数据表明,纤维化损害了新抗原驱动的T细胞介导的肿瘤控制。与作者之前的观察结果一致,纤维化减少了KPLOG小鼠肺和肿瘤内CD8+ T细胞的数量(图3K和L),同时增加了Foxp3+ Tregs。对ova特异性葡聚糖+ T细胞的流式细胞术显示,纤维化肺(图3M)和KPLOG GEMMs的引流淋巴结中抗原特异性CD8+ T细胞减少(图3N)。总之,这些数据表明,在纤维化的情况下,T细胞启动受损。当FITC诱导纤维化时,作者观察到对肿瘤负荷和CD8+ T细胞定位的类似影响,证实这是一种纤维化介导的对T细胞介导的肿瘤控制的损害,而不是对T细胞功能的bleo特异性影响(图30-R)。
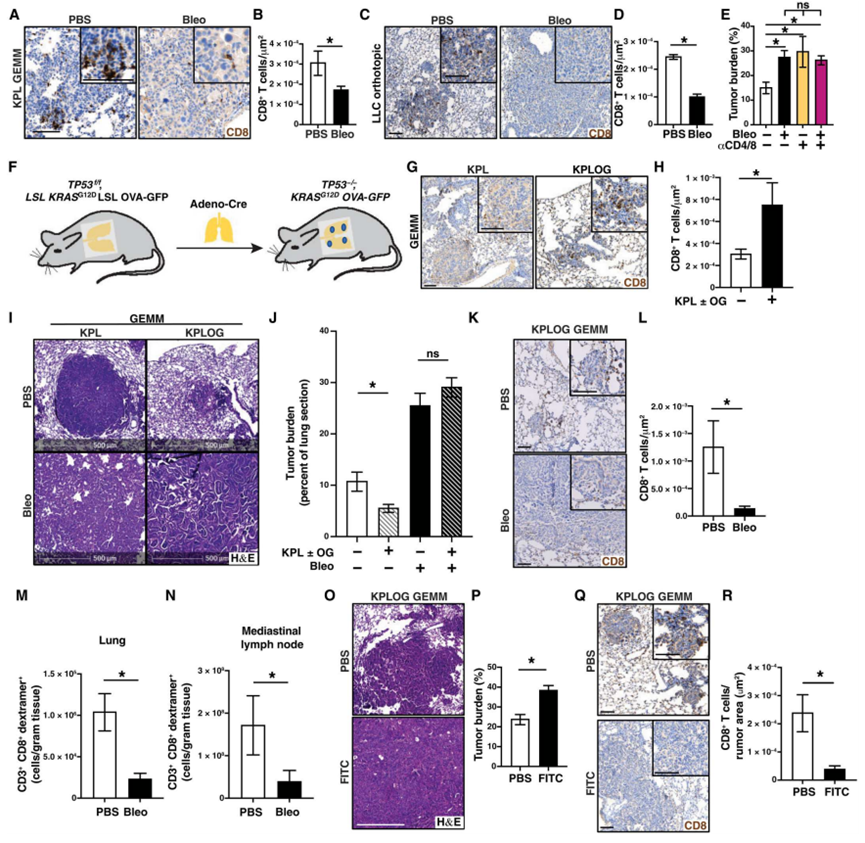
图3、反应性纤维化损害非小细胞肺癌模型的免疫监视
4、在非小细胞肺癌模型中,纤维化损害检查点阻断疗效
鉴于作者观察到抗原特异性T细胞减少和免疫监视,作者下一步试图确定纤维化是否会损害免疫检查点抑制剂的功效。为了评估这一点,作者评估了不同治疗环境下KPL86原位荷瘤小鼠的肿瘤负荷。如上所述,诱导纤维化导致肿瘤负荷的增加(图4A和B)。与标准化疗治疗非小细胞肺癌(卡铂和培美曲塞)导致相当于减少肿瘤负荷不管时间(图4A和B)。然而,在纤维化后,检查点阻断与化疗相比没有额外的益处,这表明纤维化TME取消了检查点阻断的功效(图4A和B)。这些数据表明,纤维化TME中T细胞免疫的改变限制了免疫检查点阻断的益处。
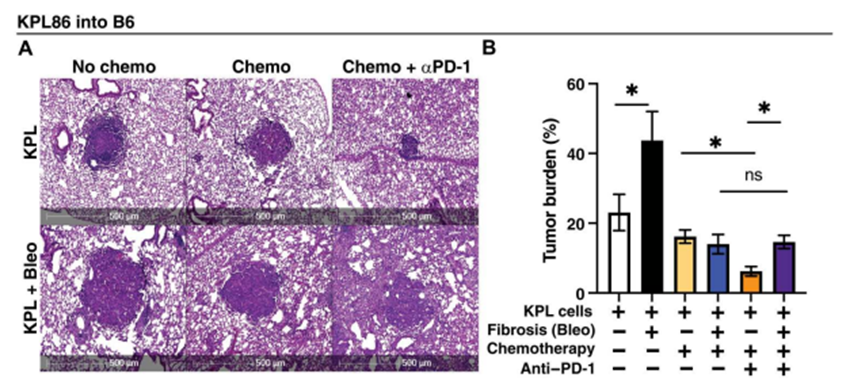
图4、反应性纤维化损害对免疫检查点封锁的反应
5、肺纤维化导致骨髓反应改变
为了更好地理解纤维化如何导致免疫抑制性TME,作者首先分析了肿瘤浸润的骨髓细胞。在肺中,巨噬细胞和常规树突状细胞(cDC)是抗原呈递的主要介质,这些细胞的功能障碍导致免疫监视改变。因此,作者对有无实验性纤维化的荷瘤小鼠的肺髓系室进行了评估。在KPL GEMMs和LLC原位模型的肺肿瘤中,作者发现实验性纤维化增加了总巨噬细胞和CD206+巨噬细胞的数量,但没有改变Ly6G+中性粒细胞的数量(图5A和B)。为了更好地表征这些巨噬细胞的定位,作者对F4/80进行了免疫组化染色,结果显示实验性纤维化诱导肿瘤巢和周围肺实质中巨噬细胞浸润增加(图5C)。作者接下来进行了CyTOF分析。与流式细胞术结果一致,作者观察到间质和肺泡巨噬细胞中CD206的表达增加(图5D-F)。作者还观察到,纤维化肺TME的两个巨噬细胞亚群表达的主要组织相容性复合体II (MHC-II)减少,但MHC-I和PD-L1增加,这表明表型被激活但可能被抑制(图5E-F)。这些数据表明,纤维化肺TME不仅导致巨噬细胞数量增加,而且改变其表型。接下来,作者通过单细胞RNA测序(scRNA-seq)评估肺巨噬细胞 (图5G)。这些亚群中转录变化最明显的是肺泡巨噬细胞(图5G)。与先前的数据一致,纤维化肺的肺泡巨噬细胞高度表达Mrc1 (CD206)和Arg1(精氨酸酶1。接下来,作者鉴定了差异表达基因(DEGs)并进行了基因集富集分析(GSEA)。与停留在纤维化TME一致,作者观察到来自bleo启动肺的肺泡巨噬细胞中整合素和SMAD2/3信号的增加。作者还发现纤维化肺的肺泡巨噬细胞Ccl3、Ccl4和Cxcl9表达降低,但Ccl5、Ccl6、Ccl9和Ccl17表达升高(图5H)。综上所述,这些数据表明纤维化导致巨噬细胞表型的改变,从而影响细胞毒性T细胞、Treg和cDC的浸润和功能。由于传统的流式细胞术、CyTOF和scRNA-seq方法分析了整个肺,包括肿瘤和非肿瘤区域,作者接下来寻求特异性地询问肿瘤相互作用的巨噬细胞。为了解决这个问题,作者使用表达可溶性mCherry (mCher+)的KPL86肿瘤细胞。该系统允许表征存在于肿瘤巢内的细胞,这些细胞将从周围环境中吸收mCher,而那些不存在于肿瘤巢中的细胞将保持mCher阴性(mCher -)(图5I)。使用该系统,作者发现来自纤维化肺的肿瘤相互作用肺泡巨噬细胞的MHC-I、PD-L1、PD-L2和T细胞免疫球蛋白和粘蛋白结构域-3 (Tim3)的表达增加(图5I)。在mCher -肺泡巨噬细胞中未观察到这些变化。总之,这些数据表明肿瘤相互作用巨噬细胞可能有助于T细胞功能障碍。接下来,作者试图确定巨噬细胞亚群在纤维化加速肿瘤进展中的作用。为了消耗肺泡巨噬细胞,作者采用气管内氯膦酸钠脂质体;为了消耗间质巨噬细胞,作者采用腹腔内抗集落刺激因子1 (CSF1)抗体(IP αCSF1)。作者观察到,在氯膦酸盐处理的小鼠中,肺泡巨噬细胞显著(P = 0.0001)减少,但间质巨噬细胞没有减少,而IP αCSF1对肺泡巨噬细胞没有影响,但显著(P < 0.00001)减少了间质巨噬细胞的数量。导致纤维化肺中肿瘤负荷显著(P = 0.01)减少,但在没有实验性纤维化的情况下不影响肿瘤进展(图5J)。与肿瘤进展的变化类似,肺泡巨噬细胞的消耗恢复了CD8+ T细胞和Clec9a+ cDC浸润,与非纤维化肺相当(图5K和L)。这些数据表明,纤维化诱导的肺泡巨噬细胞的变化在驱动肿瘤进展和抑制肿瘤免疫方面特别重要。鉴于cDC在启动抗肿瘤免疫应答中的作用,作者进一步对其进行了表征。在KPL GEMMs中,作者观察到Bleo诱导小鼠肺TME中CD103+ cDC1s和CD11b+ cDC2s的表达减少(图5M)。CyTOF表征显示MHC-I和MHC-II以及cDC1s中的共刺激分子CD80和CD86的表达减少(图5N)。作者也发现了类似的cDC2s变化。scRNA-seq分析显示,来自纤维化肺的cDC1s中的toll样受体、白细胞介素-6 (IL-6)、IL-12和CD40信号通路特征减少,这些细胞也表现出同种异体移植排斥反应和炎症反应减少。接下来,作者使用可溶性mCher系统表征了肿瘤相互作用和非肿瘤相互作用的cdc。作者发现实验性纤维化导致mCher+ cDC1上MHC-II、CD80和CD86的表达降低,而mCher - cDC1s上这些表达没有变化(图50)。免疫检查点Tim3的表达增加,而参与抗原摄取的Tim4在纤维化肺肿瘤的mCher+ cDC1s上表达减少(图50)。综上所述,这些数据表明纤维化会损害cDC1向TME的浸润,并可能损害肺肿瘤内cDC1的功能。
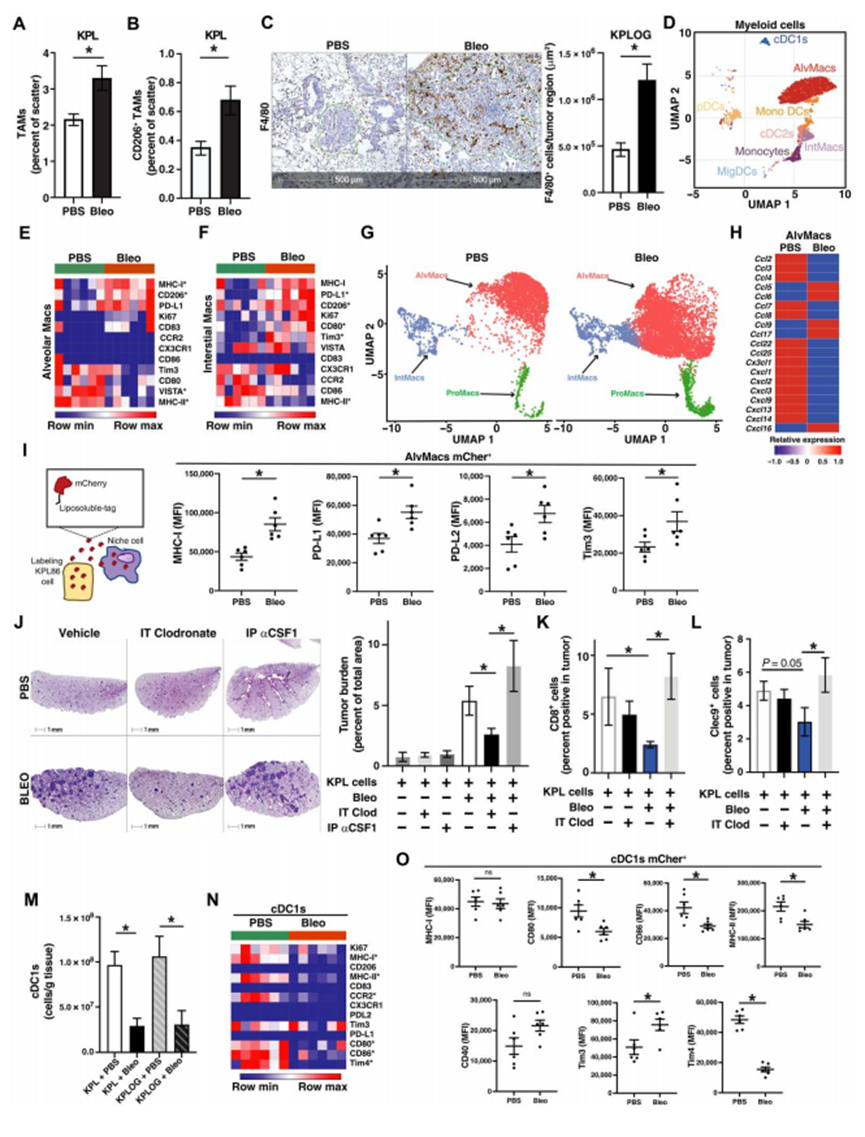
图5、反应性纤维化改变骨髓反应
6、成纤维细胞表型的改变有助于非小细胞肺癌的免疫抑制TME
作者之前观察到,与健康组织相比,非小细胞肺癌中CAF的数量增加。为了进一步表征这些细胞,作者用流式细胞术分析了PBS或Bleo处理的小鼠肺,再次发现纤维化肺中CD45 - EpCAM - CD31 - CAFs数量增加(图6A)。当作者分析特异性CAFs的标志物时,作者发现成纤维细胞活化蛋白α (FAP+)和CD90+ (Thy-1) CAFs在纤维化肺中增加(图6B和C)。CD90+和FAP+ CAFs与NSCLC患者的生存率降低有关。总之,这些数据表明,在这些肺癌相关纤维化模型中,总CAF增加,但CAF表型有一些特异性改变。最近,使用scRNA-seq更好地阐明了NSCLC中CAFs的异质性。为了更好地了解纤维化肿瘤模型中CAFs的分子和功能异质性,作者从经过和未经过Bleo处理的KPL GEMM荷瘤小鼠中分离了CD45 - EpCAM - CD31 -细胞,并进行了scRNA测序。对CAFs进行UMAP分析,发现10个簇均表达关键识别基因,如Col1a1。作者分析了这些标记的10个集群,将它们分为三个不同的集群。在肺间充质细胞中鉴定出表达acta2的[肌成纤维细胞(Myofib)]、表达col14a1的(Col14)和表达col13a1的(Col13)成纤维细胞(图6D)。将pbs处理与bleo处理的肿瘤肺进行比较,发现Col13+成纤维细胞和Myofib相对增加,Col14+成纤维细胞减少(图6E), Col13+成纤维细胞转录转移(图6F)。特定的成纤维细胞亚群可能在TME内促进免疫抑制中发挥作用。鉴于在诱导纤维化后在Col13成纤维细胞群体中观察到的改变,作者将重点放在这一群体上,并询问它们是否表现出可能影响TME免疫组成的改变的趋化因子或细胞因子谱。差异基因表达分析发现,Ccl6、Cxcl12和Cxcl16在成纤维细胞中表达上调,而这些细胞先前被认为与bleo诱导的肺纤维化有关(图6G)。作者还发现了几种趋化因子的变化,表明纤维化诱导了免疫抑制微环境。例如,与观察到的巨噬细胞和Treg的变化一致,作者注意到与骨髓细胞组织浸润(Ccl4和Ccl9)和Treg募集(Cxcl12)相关的趋化因子增加(图6G)。Ccl19,一种cDC浸润的化学引诱剂,在从纤维化肺分离的Col13成纤维细胞中减少。参与细胞毒性T细胞募集的趋化因子,如Cxcl10在纤维化模型中减少,表明CAF的变化可能导致免疫抑制(图6G)。接下来,作者试图测试来自bleo诱导的纤维化肺的成纤维细胞是否可以调节巨噬细胞表型。为了实现这一目标,作者使用Transwell系统将来自对照或暴露于蓝光下的肺的原代成纤维细胞与骨髓源性巨噬细胞(bmdm)共培养。作者发现,与对照组相比,来自纤维化肺的成纤维细胞诱导Arg1、Mrc1 (CD206)和Il6的表达更高。这些数据表明,来自纤维化肺的活化成纤维细胞可能通过调节巨噬细胞来促进免疫抑制。为了在体内测试活化的成纤维细胞的影响,作者使用了血小板衍生生长因子受体α+ (PDGFRα+)细胞的遗传耗损,因为PDGFRα+在Col13+和Col14+成纤维细胞中表达,但在α sma +成纤维细胞中不表达。将Pdgfratm1.1(cre/ERT2)(PDGFRα- creert2)小鼠与lox-stop-lox (LSL) -白喉毒素受体(DTR)小鼠杂交,可诱导DTR在PDGFRα+细胞上表达。连续5天服用他莫昔芬,然后单剂量白破毒素导致PDGFRα细胞的有效耗竭,而αSMA细胞没有观察到变化(图6H和I)。在耗竭PDGFRα+细胞(包括Col13+成纤维细胞)后,Bleo处理小鼠的肿瘤负荷明显减轻(图6J)。流式细胞术显示肺泡巨噬细胞减少(图6K),瘤内CD8+ T细胞数量增加(图6L)。这表明PDGFRα+成纤维细胞,包括Col13+成纤维细胞,在肺肿瘤纤维化的免疫浸润改变中发挥作用。与已知的bleo诱导的肺纤维化一致,过度代表分析发现,与pbs处理的Col13+成纤维细胞相比,bleo处理的TGFβ反应途径增加(图5)。尽管几乎所有的CAF亚群都有表达TGFβ应答信号的细胞,但Col13+成纤维细胞有一个大的阳性信号,这表明这是表达TGFβ的主要CAF亚群。作者通过免疫组化(IHC)证实bleo处理肺中tgf - β升高(图5p)。总之,这些数据表明,除了推动特定CAF亚群的增加外,纤维化还将其表型转向更具免疫抑制性。
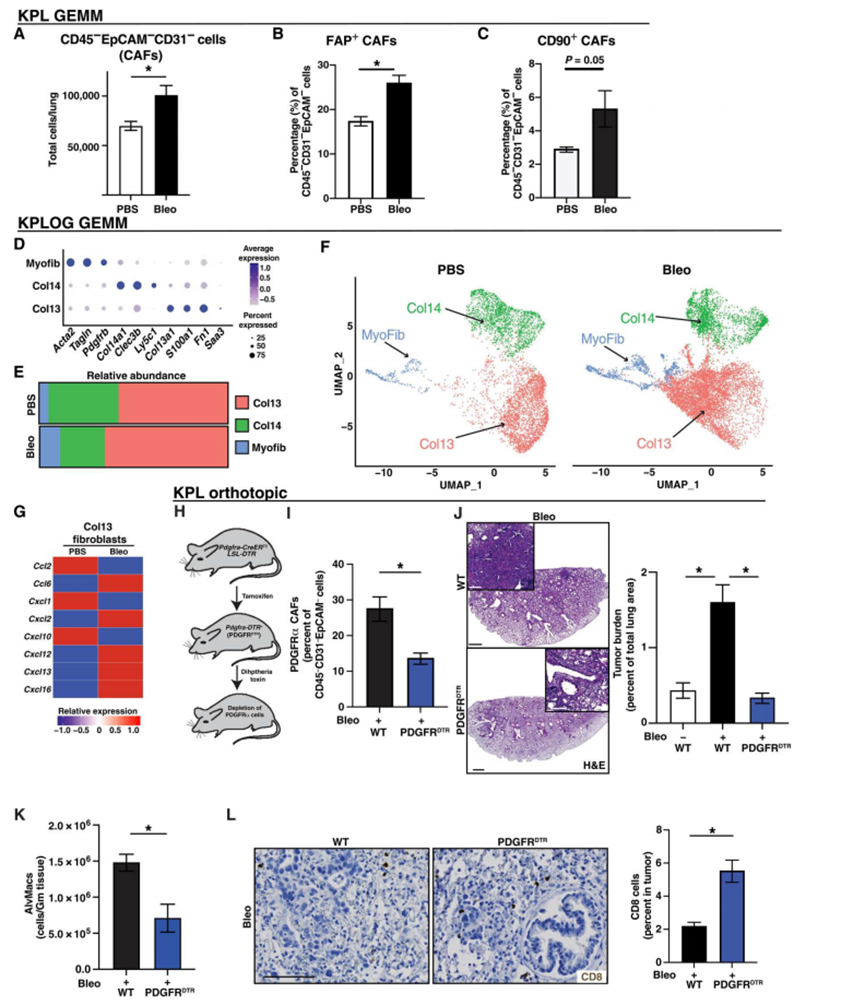
图6、CAF的表型改变改变了纤维化TME中免疫细胞的募集,并增强了TGFβ的表达
7、靶向转化生长因子β受体-1 (TGFβRI)信号仅在联合化疗时才能恢复免疫检查点疗效
TGFβ在肺纤维化的发病机制中得到了很好的证实,作者证实,通过气管内递送表达TGFβ1血清型6的腺相关病毒(AAV), TGFβ在肺中的表达可以通过胶原沉积来诱导纤维化。此外,肺AAV-TGFβ1表达导致肿瘤负荷和CD206巨噬细胞浸润增加,肿瘤内CD8+ T细胞减少与Bleo或fitc诱导的实验性纤维化模型相当。接下来,作者试图确定作者是否可以逆转在作者的模型中观察到的肺纤维化的致瘤表型。为此,作者评估了几种目前用于治疗人类肺纤维化的药物,包括尼达尼布和吡非尼酮。然而,在肿瘤相关纤维化建立后给予这些药物,这些药物未能改变胶原- 1沉积的数量(图7A)。由于作者已经观察到Bleo暴露的成纤维细胞中TGFβ信号反应增加,并且肺部TGFβ过表达重现了在Bleo或FITC治疗的纤维化肺中观察到的表型,因此作者试图使用一种工具化合物TGFβRI抑制剂Ly364947靶向这一途径。作者发现,在诱导纤维化后给予Ly364947,能够大部分减少肺内I型胶原的数量(图7A)。此外,虽然纤维化显著(P = 0.017)减少了CD8+ T细胞的数量,但Ly364947治疗使肺CD8+ T细胞数量恢复到基线水平(图7B)。相比之下,尼达尼布和吡非尼酮的CD8+ T细胞频率与纤维化肺相似(图7B)。与这一发现一致的是,与对照、尼达尼布或吡非尼酮处理的小鼠相比,Ly364947治疗荷瘤小鼠对纤维化肺肿瘤负荷的影响不大(图7C)。为了确定TGFβRI抑制剂Ly364947是否能够与非小细胞肺癌的标准治疗协同作用,作者用以下治疗方案治疗纤维化、肿瘤肺小鼠:Ly364947单独治疗、Ly364947联合抗PD-1免疫球蛋白G (IgG) (PD-1)、卡铂+培美曲塞联合PD-1 (Chemo/PD-1)或Chemo/PD-1 + Ly364947。单独使用Ly364947治疗可使肿瘤负荷略有下降(图7D和E)。与对照相比,Ly364947与PD-1或Chemo联合使用均未能改善肿瘤负荷(图7D和E)。与对照组相比,Chemo/PD-1显著(P = 0.0002)降低了肿瘤负荷(图7D和E)。然而,将Chemo/PD-1与Ly364947联合使用可将肿瘤负荷降低至接近基线(无纤维化),并恢复肿瘤浸润的CD8+ T细胞,这表明添加Ly364947可增强Chemo/PD-1的疗效(图7D和E),这是非小细胞肺癌患者的标准治疗方法。作者只观察到在实验性纤维化存在的情况下,将TGFβ r1抑制加入Chemo/PD-1对肿瘤负荷和CD8+ T细胞和cle9α + cDC1浸润的益处,这表明在没有纤维化相关的TGFβ的情况下,信号传导可能没有达到临界阈值(图7F至H)。为了探索这些发现在人类样本中的实用性,作者分析了POPLAR和OAK临床试验中使用atezolizumab治疗转移性NSCLC患者的数据。作者发现,在Col13+ CAFs中观察到的TGFβ反应特征与这些患者的总生存率提高相关(图7I)。此外,来自Col13 CAFs的前50个基因的基因标记与M2巨噬细胞增加(图7J)、M1巨噬细胞减少(图7K)、树突状细胞活化(图7L)和CD8+ T细胞相关。总之,这些数据表明,这些TME元素在接受免疫检查点阻断的患者中可能是重要的。
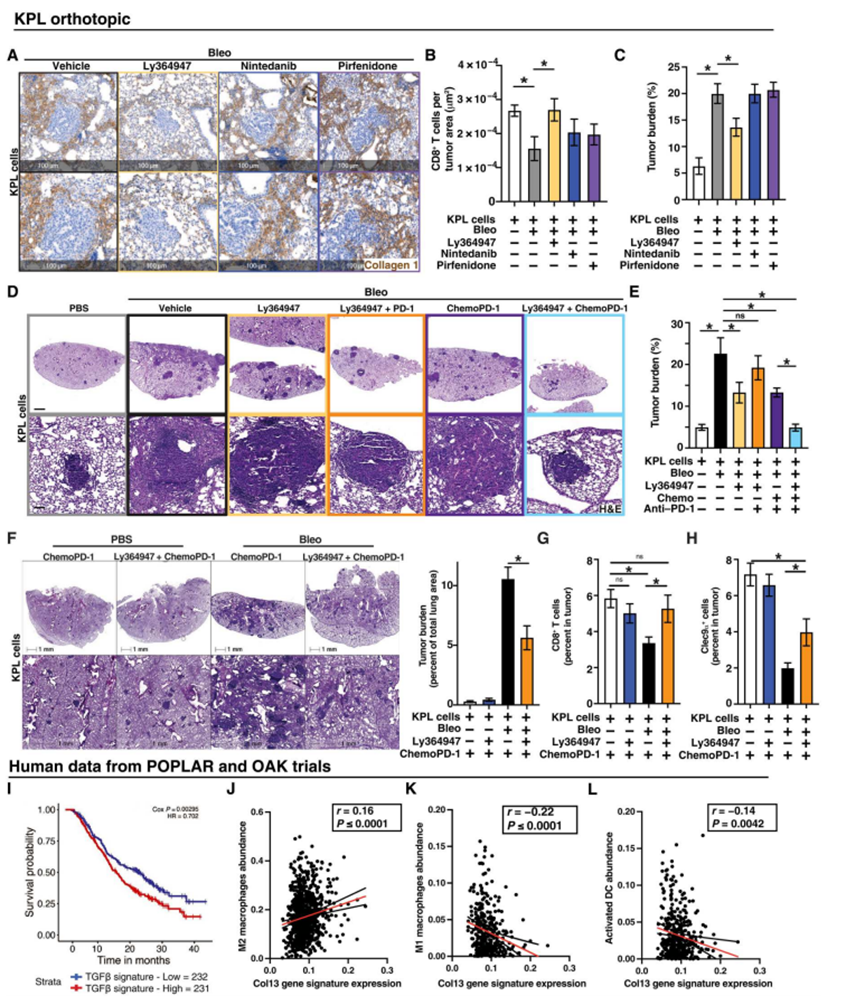
图7、靶向TGFβRI信号通路可提高化疗联合检查点阻断的疗效。
结论
总之,这些数据表明,在非小细胞肺癌中,纤维化通过降低抗肿瘤免疫导致肿瘤进展。纤维化诱导成纤维细胞和肿瘤相关巨噬细胞的改变,从而损害树突状细胞和T细胞反应,最终降低了最佳检查点治疗效果所必需的抗肿瘤免疫反应。因此,针对这种纤维化TME的治疗策略可以改善人类NSCLC对化疗和免疫治疗的反应。
实验方法
流式细胞术、质谱流式细胞技术、单细胞测序、IHC
参考文献
Herzog BH, Baer JM, Borcherding N, Kingston NL, Belle JI, Knolhoff BL, Hogg GD, Ahmad F, Kang LI, Petrone J, Lin CY, Govindan R, DeNardo DG. Tumor-associated fibrosis impairs immune surveillance and response to immune checkpoint blockade in non-small cell lung cancer. Sci Transl Med. 2023 Jun 7;15(699):eadh8005. doi: 10.1126/scitranslmed.adh8005. Epub 2023 Jun 7. PMID: 37285399.






