METTL1-WDR4 tRNA甲基化的结构与机制
特异性的、受调控的RNA修饰对于正确的基因表达是重要的。转运RNA(tRNA)富含各种化学修饰,影响其稳定性和功。tRNA第46位的7-甲基鸟苷(m7G)是一种保守修饰,可调节稳态tRNA水平以影响细胞生长。METTL1-WDR4复合体在人类中负责m7G修饰,并且METTL1-WDR4的失调与脑畸形和多发性癌症有关7-22。在这里,作者展示了METTL1和WDR4如何协同识别RNA底物并催化甲基化。METTL1-WDR4的晶体结构和METTL1-WDR4-tRNA的低温电镜(Cro-em)结构表明,复合蛋白表面通过形状互补识别tRNA肘部。METTL1-WDR4-tRNA与S-腺苷蛋氨酸(SAM)或S-腺苷同型氨酸(SAH)的低温电镜结构以及METTL1晶体结构通过揭示多种状态下的活性位点,为进一步了解催化机制提供了新的见解。METTL1末端与tRNA、催化环和WDR4C端的构象变化相结合,作为m7G甲基化的激活开关。因此,作者的结构模型解释了METTL1 N端翻译后修饰如何调节甲基化。该研究阐明了METTL1修饰m7G的核心和调控机制,为理解其对生物学和疾病的贡献提供了框架。该研究于2023年1月发表于《Nature》上,IF=64.8。题为“Structures and Mechanisms of tRNA Methylation by METTL1-WDR4”。
技术路线
研究内容
1. METTL1-WDR4复合体的架构
为了研究人METTL1甲基转移酶的机制,作者首先用纯化的重组蛋白重组了酶的活性。作者能够分离METTL1和METTL1-WDR4复合物(图1a),但作者不能单独纯化WDR4,可能是因为WDR4在细菌中表达时需要METTL1才能正确折叠。对于RNA底物,作者选择了tRNALys(tRNA-Lys-TTT-3),因为其具有或不具有修饰或结合蛋白的稳定结构。此外,tRNALys在多种哺乳动物细胞系中被m7G46一致修饰,甲基化依赖于METTL11,12,33的存在。在体外甲基化实验中,不含WDR4的纯化METTL1不支持任何可检测到的tRNA甲基化,但METTL1-WDR4复合物可以强有力地催化tRNALys的修饰。电泳迁移率转移试验(emsa)表明,METTL1本身不能很好地结合tRNA,但在WDR4的存在下,三元配合物在低纳摩尔范围内很容易观察到亲和力(图1b,1c)。因此,作者成功地用tRNALys重建了METTL1-WDR4的甲基化活性。
为了建立人类METTL1-WDR4复合体的三维模型,作者使用每个多肽(METTL120-265和WDR41-389)的截断结构获得晶体,因为较长的结构没有结晶(图1b)。蛋白质复合体的整体结构与酵母复合体(Trm8-Trm82)相似,但WDR4和Trm82之间观察到更多的差异,可能是由于相对较低的序列一致性(~23%)(图1d。WDR4的C端螺旋在作者的结构中是新解析的;由于螺旋与对称分子进行晶体接触,它相对于β-螺旋桨结构域的位置可能是灵活的。在形成络合物后,METTL1和WDR4共埋藏了约1746 A2的表面积,其中包含许多疏水相互作用。极性残基如WDR4的R170和E167以及METTL1的K143稳定了域间接触(图1c,1d)。这些残基的取代降低了酶的活性,表明观察到的分子间相互作用对METTL1-WDR4的最佳活性很重要(图1e)。在原始侏儒症患者的R170位点观察到WDR4的纯合突变,这表明m7G46修饰活性的降低可能表现为一种主要的大脑异常。因此,METTL1和WDR4形成了一个稳定的复合物,具有复杂的分子间相互作用,这对优化甲基转移酶活性很重要。
作者只能在没有SAM或SAH的情况下结晶METTL1-WDR4复合体。为了更好地理解METTL1的催化功能,作者确定了甲基转移酶结构域与SAM(2.25A)和SAH(1.93A)复合物的晶体结构(图1e)。这两个结构彼此对齐良好(RMSD,0.15A),并且与先前沉积在蛋白质数据库中的结构和作者的METTL1-WDR4复合物结构对齐良好(图1f,1g)。SAM/SAH的腺嘌呤碱基与I108、M142和A141侧链排列的疏水口袋吻合,并与N140和附近的肽主链形成氢键(图1f)。更多的氢键稳定了核糖羟基与E107之间的相互作用。SAM/SAH的氨基与G84和L160的主链羰基形成极性接触,羧基与T238的羟基和E240的主链氨基形成氢键。为了从生物化学角度探讨催化口袋,作者引入了关键相互作用残基的单丙氨酸取代,并测定了体外甲基化活性。失去观察到的侧链相互作用对甲基化是有害的(图1g)。因此,通过METTL1-SAM、METTL1-SAH和METTL1-WDR4复合体的高分辨率晶体结构和定点诱变研究,作者深入了解了人类m7G写入复合体是如何形成并与甲基供体相互作用的。
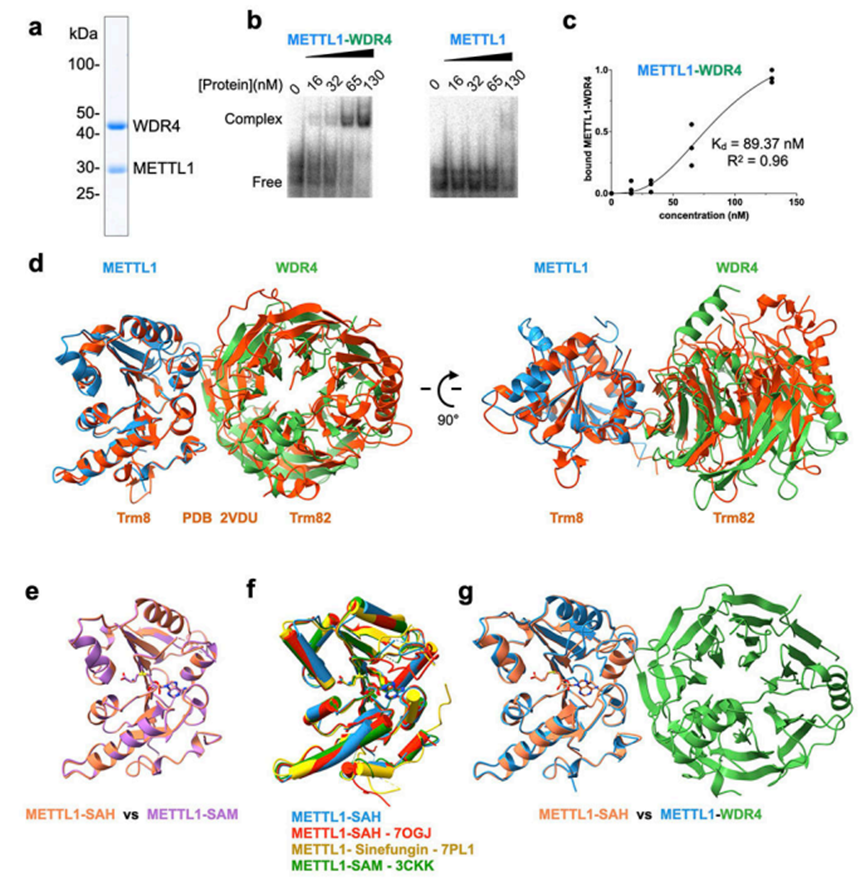
图1 METTL1-WDR4蛋白纯化及tRNA复合体重组
2. METTL1-WDR4-tRNA的低温电镜结构
为了研究METTL1-WDR4复合物如何与底物tRNA结合,作者确定了METTL1-WDR4-tRNAlys复合物的低温电镜结构,不含辅助因子(辅因子,3.72A)、含SAM(4.05A)和含SAH(3.53A)(图2a-2c)。与结晶实验不同,作者可以使用全长构建METTL1,但由于聚集,作者必须截断WDR4的C端23个残基。为了稳定SAM结合的复合物,作者使用METTL1 D163A代替野生型来防止催化(图1g,2b)。最终的冷冻电镜图显示了清晰定义的蛋白质结构域以及结合的tRNA的构象,揭示了分子间相互作用是如何形成的,并随着辅因子结合状态而变化。METTL1-WDR4复合物的复合表面通过形状和电荷互补实现特异性RNA结合。稳定的辅因子METTL1-WDR4-tRNA复合物与METT1-WDR4复合物的晶体结构保持相同的结构域间取向(RMSD,0.83A)(图5a)。在RNA存在的情况下,作者可以在SAM结合位点附近看到更多的长环(“催化环”),但结构变化是局部和有限的(图5b)。与METTL1-WDR4结合的tRNALys的构象也与未结合的tRNALys(相同序列但完全修饰)和tRNALys在不相关的蛋白RNA复合物中未修饰的另一种结构相似。因此,为了形成载脂蛋白METTL1-WDR4-tRNA复合物,蛋白质和RNA底物在结合时很少发生诱导折叠,这表明不需要明显的构象改变就可以形成稳定的特异性蛋白质-RNA复合物。
虽然整个域架构看起来很相似,但是当SAM或SAH结合METTL1-WDR4时,会发生局部构象变化。一个明显的变化是WDR4的C端螺旋在SAH绑定状态下变得更加有序(图2c),螺旋趋于柔韧。在载脂蛋白和SAM结合状态下仅观察到弱螺旋密度。然而,在RNA和SAH的存在下,WDR4的C端螺旋明显变得更加稳定,从而与tRNA和METTL1接触,进一步加强了蛋白-RNA复合物。当所有三种低温电镜结构叠加时,在辅因子和SAH结合态之间观察到最极端的构象差异,而SAM结合结构通常显示中间状态。METTL1锚定在WDR4上,向tRNA靠近,当与辅因子结合时,tRNA发生轻微扭曲(图2d);相邻的催化环挤压到SAM/SAH结合结构中的tRNA中(图2e)。因此,尽管这三种状态与tRNA在预先形成的METTL1-WDR4复合体上的对接在很大程度上相似,但辅因子结合诱导了局部构象变化。
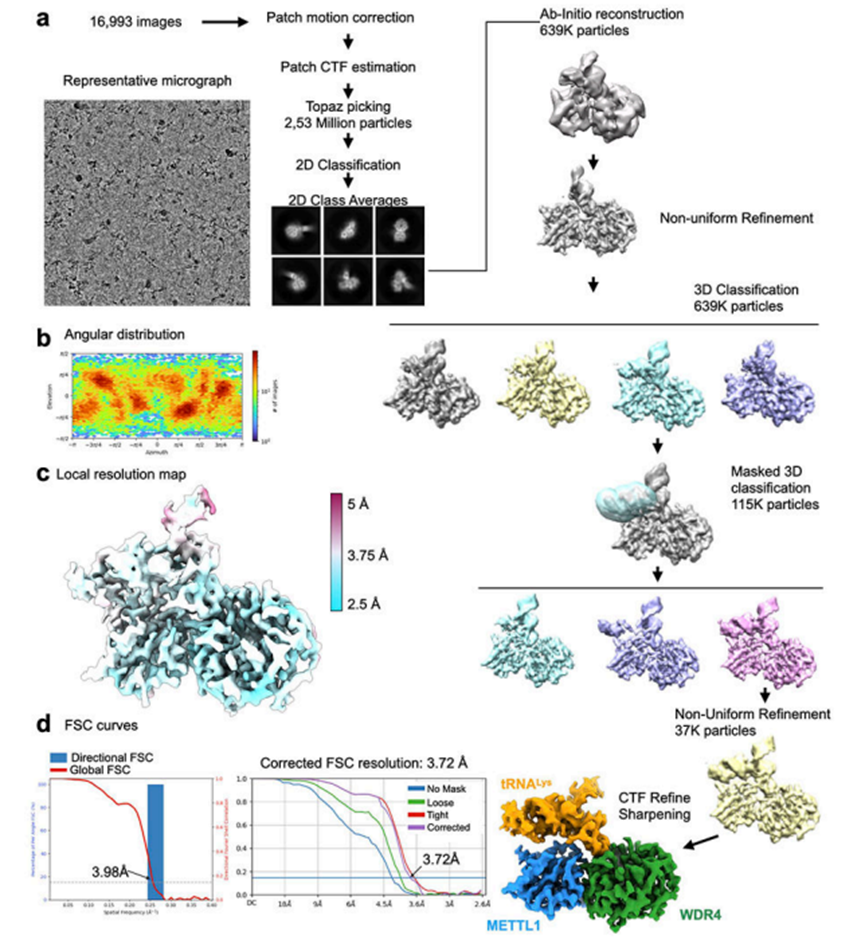
图2 METTL1-WDR4-tRNALys结构的低温电镜数据处理
3. METTL1-WDR4的tRNA形状识别
在三种低温电镜结构中,在SAH结合状态下观察到最广泛的RNA-蛋白相互作用(图3a)。大多数依赖于辅助因子的接触是由METTL1进行的,WDR4在所有三种结构中都与tRNA保持类似的相互作用,即使是与刚性的C端螺旋。因此,与METTL1-RNA结合界面(apo:234A2,SAM:650A2,SAH:1422A2)相比,三种状态下WDR4-RNA结合界面的面积更恒定。METTL1-WDR4上的RNA结合表面与基本斑块重叠良好,这与强核酸结合蛋白的预期一致(图3b)。这些RNA结合表面的残基在不同物种之间也相对保。
在所有三种结构中,蛋白质-RNA的接触都涉及tRNA核心“肘”区——D环和T环相遇的地方(图3c)。接吻环相互作用形成了tRNA的独特三级结构,RNA折叠由WDR4(界面I)和METTL1(界面II)形成的复合表面识别。tRNA弯头由WDR4的M147、R165和T364以及METTL1的D32提供的疏水和pi堆叠相互作用杯化(图3d)。WDR4的C端螺旋与d臂有额外的接触,包括通过F365的环堆叠。此外,t臂磷酸主链与来自WDR4和METTL1的两个基本侧链簇进行了几个有利的接触(图3d,e)。在大多数情况下,用单丙氨酸取代破坏磷酸相互作用并不足以引起酶活性的显著变化,但是肘部尖端附近的R165A和M147A突变会导致甲基化显著降低,这表明检测tRNA肘部的独特结构特征对于正确识别底物至关重要(图3f)。截断WDR4C端螺旋或在其中间引入F365A突变可减少甲基化,这表明螺旋-RNA接触也有助于有效结合。METTL1中的碱基残基簇属于催化环,它改变SAM/SAH结合状态的构象,以保持与tRNA的接触,尽管RNA构象发生了一些扭曲(图2g,2h)。METTL1的K167似乎对生产催化至关重要-氨基夹在处于SAHbound状态的C48和A50的两个磷酸盐之间(图3e,3f)。几乎所有RNA与蛋白质的接触都是静电相互作用,这可能是因为甲基转移酶必须通过它们的三级折叠来识别许多不同的tRNA序列。因此,METTL1-WDR4和tRNA可以通过形状和电荷互补最低限度地形成稳定的复合物,但伴随辅因子结合的局部重排对于优化酶活性至关重要。
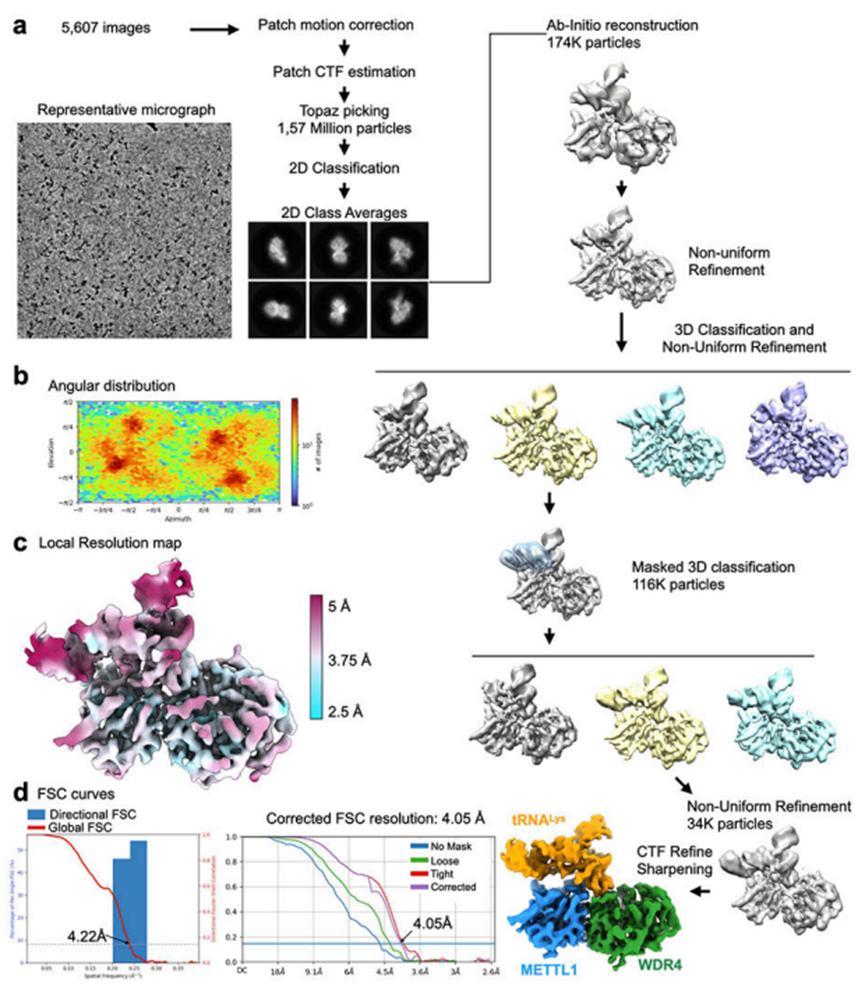
图3 METTL1-WDR4-tRNALys-SAM结构的低温电镜数据处理
4. 深入了解METTL1的催化机制
在METTL1-WDR4-tRNA的载脂蛋白结构中,RNA结构与分离的tRNA41的结构非常相似。维持tRNA的自由构象与一些甲基转移酶不同,甲基转移酶需要撬开D环和T环的相互作用,从而导致tRNA42的部分展开。事实上,可变环只与载脂蛋白状态的蛋白质部分相互作用,在界面处有明显的间隙(图4a)。为了支持G46甲基化,鸟嘌呤碱基仍然需要从埋在其他碱基之间的螺旋结构中脱离出来,并通过有利的氢键网络稳定下来。作者观察到在辅因子状态下tRNA的构象异质性最大,特别是在靠近可变环的反密码子臂附近。为了分离出最稳定的tRNA构象,作者不得不在最初的3D分类和改进后,在反密码子臂附近使用掩膜来改进图谱。观察到的异质性表明,与METTL1-WDR4结合的tRNA会呼吸并形成替代构象,其中大多数构象并不普遍,无法重建。因此,尽管METTL1、WDR4和tRNA在这三种状态下都能形成稳定的复合物,但在载脂蛋白状态下,tRNA的构象更加灵活。
在SAH结合结构中,可变环展开,将G46碱基释放到催化口袋中,导致更密切的蛋白质-RNA接触(图4b)。随着G46的翻转,反密码子臂也相对于tRNA的其余部分扭曲(图4c)。为了使G46碱基的释放在能量上有利,A21和A9环之间留下的空隙被METTL1的R24侧链填充。扭曲的RNA构象由附近额外的碱性残基支持,如R22(带环的pi-pi和pi-阳离子)和K243(带磷酸主链)(图4d,4e)。在SAH结合状态下得到的RNA构象似乎在整个颗粒中更均匀(与载脂蛋白状态不同),因为不需要面罩来获得具有独特tRNA结构的低温电镜图。
G46的N7位置距离SAM中会提供甲基的硫~5A,表明SAH结合结构更接近活性构象(图4f)。鸟嘌呤环有三个酸性残基(D163、D199和E240),侧链面向碱基的距离在4A以内(图4e)。D163最接近激活N7,但靠近较大环的D199和E240侧链对于鸟嘌呤去质子化以耗散甲基化获得的正电荷也很重要。用丙氨酸取代三个酸性残基中的任何一个都不利于甲基化活性(而附近的E239A突变的影响可以忽略不计),这表明它们都可能对催化作用有重要贡献(图4g)。此外,R24在RNA螺旋中替代G46对酶活性也至关重要。因此,作者揭示了关键的分子元素高产m7G甲基化,R24插入tRNA茎中以帮助G46碱基翻出,甲基受体最接近D163以激活,而更多的酸性残基-d199和e240-围绕鸟嘌呤支持催化。
作者研究了可变环的序列如何有助于m7G修饰,因为它在改变构象时与蛋白质产生了很大的接触。作者对tRNALys可变环中的嘌呤引入了过渡突变,发现G45或G46突变时甲基化受到抑制,尽管G44突变对甲基化没有显著影响(图4h)。为了在不破坏tRNA折叠的情况下更广泛地搜索突变,作者使用其他人类tRNA作为底物测量甲基化活性(图4i,图6c)。大多数甲基化tRNA在可变环33中包含RGGUY序列。然而,在tRNAgln中重构RGGUY基序(通常折光到m7G修饰)只能部分恢复催化活性,这表明除了可变环序列外,还有其他特征涉及底物识别。在作者的低温电镜结构中,只有少数核碱基直接接触METTL1-WDR4,并且它们在不同tRNA之间的差异似乎与甲基化效率的变化无关。此外,甲基化效率与EMSA测量的RNA亲和力无关,这表明复合物形成后的事件可能决定了甲基化水。从这些实验中,作者得出结论,可变环的序列和tRNA支架的其余部分对于确定m7G修饰的倾向都很重要。
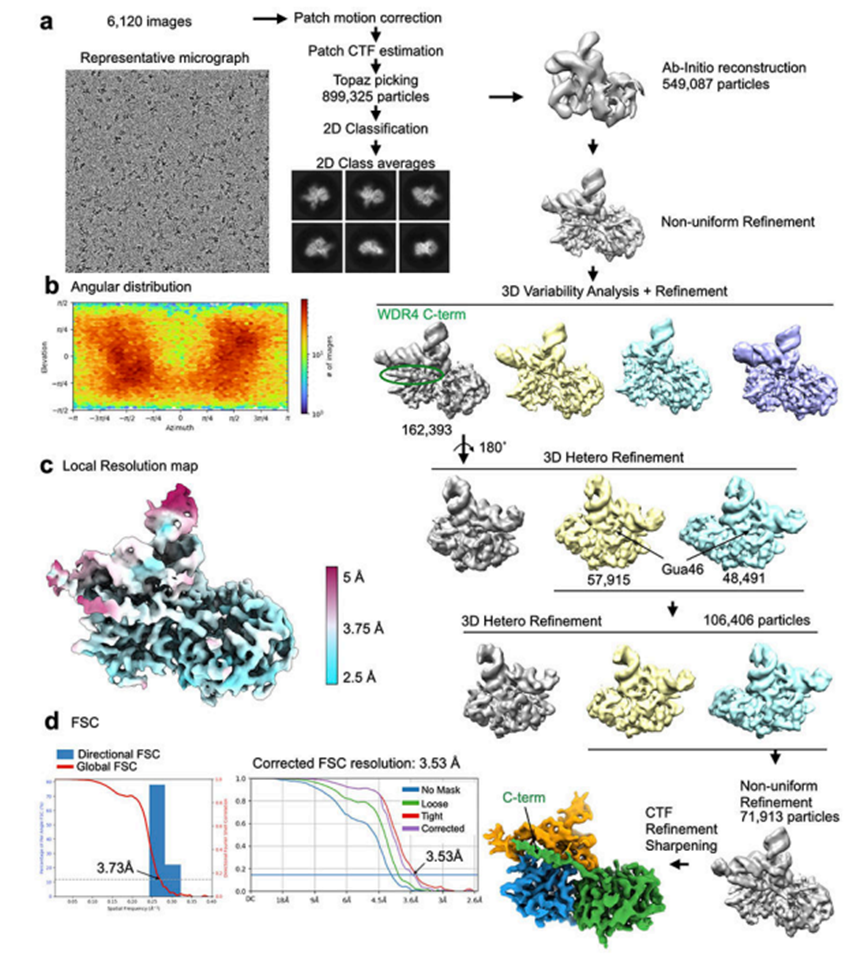
图4 METTL1-WDR4-tRNALys-SAH结构的低温电镜数据处理
5. METTL1 N端发挥催化作用
当作者比较辅因子和SAH结合状态下METTL1-WDR4-tRNA的结构时,METTL1的N附近的冷冻电镜图谱随着辅因子的增加变得更加突出,使作者能够扩展氨基酸P16-D32的模型(图5a,5b)。这个区域在作者这里报道的其他结构中是无序的。在METTL1-WDR4-tRNASAH复合体中,METTL1的n项通过SAH和d臂之间的狭窄通道,这可能解释了为什么肽只有在RNA和辅因子存在时才变得有序(图5c)。
METTL1 N-端与tRNA、催化环和WDR4的C端螺旋进行重要的特异性接触,以协调催化袋附近的四元配合物组装。METTL1 N项中的R22和R24已经讨论了它们从螺旋堆积中释放G46的能力(图4f-g和5c)。SAM/SAH结合袋进一步稳定了在疏水的腺苷环结合袋中的P29对M142的n项填料。METTL1 N项也支持挤出的催化环构象——p29和M30分别与W173和K172的脂肪族部分发生疏水相互作用(图3e和5d)。此外,N-端的H26位于靠近催化袋的位置,与D163和甲基化鸟嘌呤的主链在氢键距离内。为了获得SAM结合结构,作者使用了催化不活跃的METTL1D163A。突变D163可能也扰乱了其稳定有序n项的能力,这可能是作者只能部分解决n项到H26的原因。由于催化环挤压在SAM和SAH结合状态下是相似的,因此辅因子的存在似乎足以触发某些构象变化。综上所述,METTL1 N-端结合辅因子与更广泛的RNA-蛋白接触,其中G46在催化口袋中得到了适当的结合。
折叠的METTL1 N项也促进了WDR4C端螺旋的排序。Y20和Y21的两个酪氨酸环定位良好,可以与R378和Y371发生pi-pi相互作用,使得C端螺旋定位更加有利(图5e)。由于WDR4的C端螺旋也与RNA结合(图3d),通过METTL1 N-端固化其构象将导致更稳定的蛋白质-RNA复合物。因此,当METTL1 N端和WDR4 C端同时有序时,两者共同提供了一个更扩展的RNA结合位点。考虑到METTL1 N端在稳定复杂结构中发挥的多重作用,作者测试了接触如何影响酶活性。作者发现,干扰与催化环或WDR4C端螺旋有利相互作用的突变都显著降低了甲基化活性,突出了METTL1 N项在组织观察到的构象变化以获得最佳甲基化效率方面的重要性(图5f)。因此,作者的结构和生化数据表明,METTL1 N项作为一个开关,协调对高产m7G写入重要的多个分子事件。METTL1 N-端位于催化中心的中心,支持突出的催化环构象,稳定SAM结合袋,加强WDR4-RNA相互作用,激活G46碱基的释放。
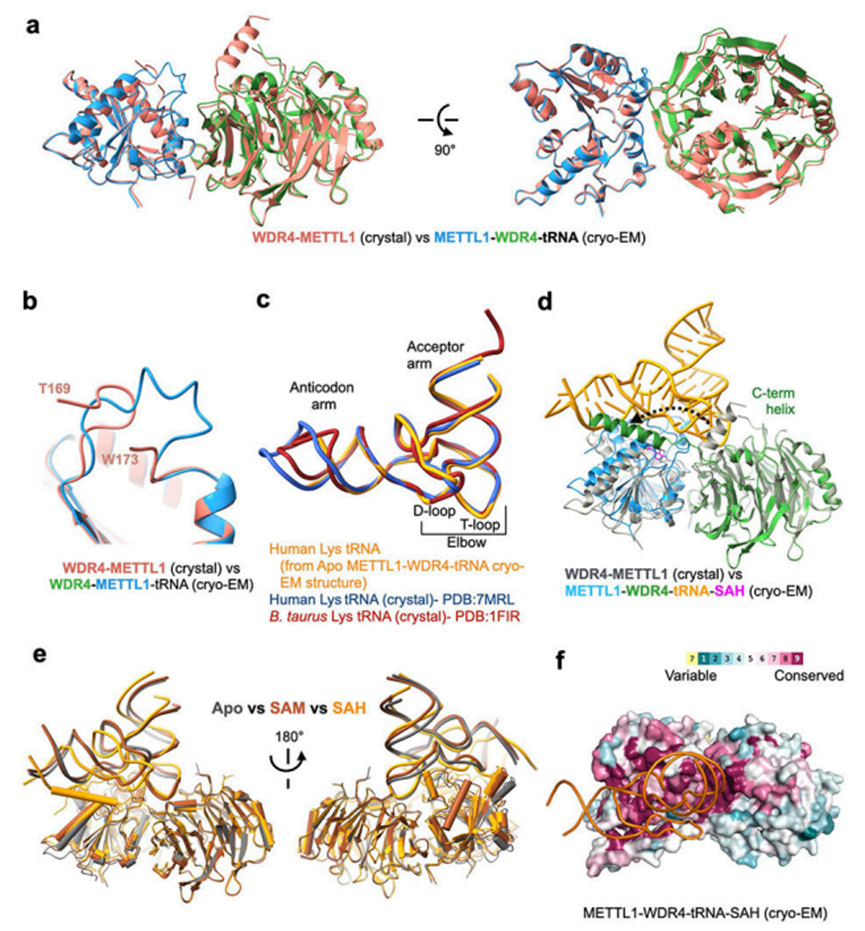
图5 包含METTL1-WDR4- tRNA复合物的结构构象变化
先前的研究表明,METTL1 N-端中的S27被AKT等关键信号激酶磷酸化,使该酶失活。在作者的METTL1-WDR4tRNA-SAH结构中,S27位于SAH和RNA主链之间,最靠近U20的磷酸基(~5A)。S27的磷酸化很可能由于空间碰撞和电荷排斥而产生碰撞(图5g)。事实上,当作者使用METTL1S27E模拟磷酸化时,作者观察到体外甲基化活性显著降低(图5h)。当作者截断METTL1的前19个氨基酸时,有类似的酶活性损失,突出了METTL1 N-端对生产甲基化的积极贡献。大多数tRNA对METTL1 N-端的截断或突变很敏感。然而,敏感程度各不相同,某些tRNA(如tRNACys和tRNATrp)不受相同程度的影响,而其他tRNAVal(如tRNAVal)对n项的变化反应更灵敏。总之,作者的数据表明,METTL1的N端调控m7G 46甲基化活性,它通过协调SAM结合、RNA结合以及tRNA和METTL1-WDR4的构象变化而起作用,在结合辅因子和tRNA之间变得有序。同时,催化环向tRNA延伸,WDR4 C端螺旋对METTL1 N端呈刚性,以加强对外部tRNA肘部的控制。同样的METTL1 N-端也通过取代螺旋核中的G46(通过R24)激活tRNA,释放鸟嘌呤翻转并插入含有SAM和三个对催化至关重要的酸性残基的活性位点,在N7位置进行甲基化。当可变环展开时,序列rgg46y可能有助于定位修改后的碱基的最佳位置。METTL1 N端的截断或修饰(如S27的磷酸化)抑制了催化口袋的正常组织,这为m7G修饰如何在翻译后调节提供了结构解释。有趣的是,METTL1 N端仅调控tRNA的一个子集。因此,通过不同背景下METTL1的分子快照,作者阐明了METTL1特异性甲基转移酶功能和调控的机制。
实验方法
蛋白表达与纯化;蛋白质结晶;X结晶衍射分析;RNA体外转录;体外甲基化试验;电泳迁移率转移试验;低温电镜样品制备和数据收集






