胶质瘤来源的ANXA1通过促进抗炎肿瘤微环境抑制对TLR3配体的免疫应答
高度免疫抑制性肿瘤微环境(TME)和血脑屏障的存在是高级别胶质瘤(HGG)患者诱导有效免疫应答的两大障碍。在本注册临床试验(NCT03392545)中,作者试图通过颅内注射poly(I:C)增强复发性HGG患者的局部固有免疫应答,以建立强大的抗肿瘤免疫应答。在随访过程中,12例(44.4%)患者达到肿瘤控制和生存获益,被认为是本研究的反应者。作者发现poly(I:C)处理后,TME中的T细胞受体(TCR)谱发生了重塑。基于肿瘤样本的RNA-seq分析,膜联蛋白A1(ANXA1)在无反应患者的肿瘤细胞中表达显著上调,并在蛋白水平进一步验证。体内外实验表明,ANXA1通过其表面受体甲酰肽受体1(FPR1)诱导M2样巨噬细胞和小胶质细胞产生,建立Treg细胞驱动的免疫抑制性TME,并抑制poly(I:C)促进的抗肿瘤免疫应答。ANXA1/FPR1信号轴可通过促进抗炎和Treg驱动的TME抑制胶质瘤患者的固有免疫反应。ANXA1可作为poly(I:C)治疗反应的可靠预测因子,预测准确率达92.3%。鉴于这些显著的发现,本研究揭示了胶质瘤免疫治疗的新视角。本文于2023年12月发表于《Cellular & molecular immunology》,IF: 24.1;Q1。
技术路线:

主要实验结果:
1、HGG患者的治疗和预后
本研究纳入了一个包含27例患者的队列。在术前和术后阶段进行了全面的采样程序,以获取肿瘤样本、脑脊液(CSF)和外周血(图1A)。从北京天坛医院获取患者的基因及临床资料。
在27例患者中,1例(3.7%)达到完全缓解(CR),9例(33.3%)达到部分缓解(PR),2例(7.4%)达到疾病稳定(SD),15例(55.6%)达到疾病进展(PD),因此疾病控制率为44.4%(图1B)。将达到CR、PR或SD的患者定义为有反应者,而出现PD的患者定义为无反应者。有反应者的中位无进展生存期和总生存期分别为221.0天和441.0天,显著长于无反应者(P < 0.05)(图1C和D)。
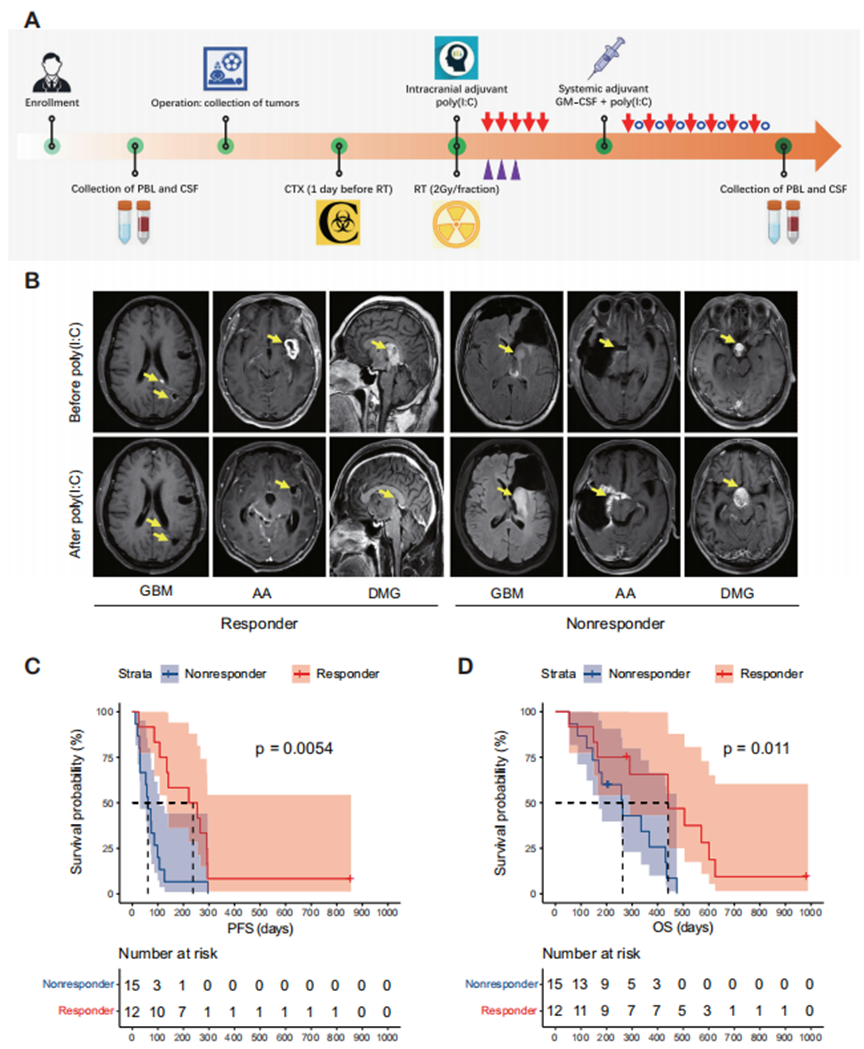
图1 免疫佐剂poly(I:C)治疗为应答者提供了生存获益
2、应答者的CSF和TILs中存在CTLs的优势寡克隆
为了评估poly(I:C)治疗后反应组和无反应组患者TME中细胞毒性T淋巴细胞(CTLs)增殖的潜在差异,作者分析了两组患者在poly(I:C)治疗前后CSF、外周血淋巴细胞(PBLs)和肿瘤浸润淋巴细胞(TILs)的TCR谱模式。发现CSF中可能发生了一些优势克隆的扩增,最终导致CSF中细胞数量增加,而不影响TCR克隆型。
进一步分析各组间CSF和PBLs中所有克隆型TCRs的比例。CSF内TCR多样性的变化显示出有应答组和无应答组之间的显著差异,而这一趋势在PBLs分析中消失(图2A)。在应答者的CSF中,占总克隆空间5%以上的超扩增克隆型特异性富集(图2B)。作者进一步分析了前10个TCR克隆在应答者和无应答者之间的比例,发现扩增最多的克隆型在应答者CSF中占据了显著更大的克隆空间百分比(图2C)。正如预期的那样,部分CTL克隆在CSF和TILs中强劲增殖发生于有应答者,而非无应答者(图2D)。此外,在接受poly(I:C)治疗后,高度丰富的克隆型仅在有应答者的TILs中显著富集,而在无应答者的TILs中未显著富集(图2E),这表明局部肿瘤中的T细胞库发生了重塑。
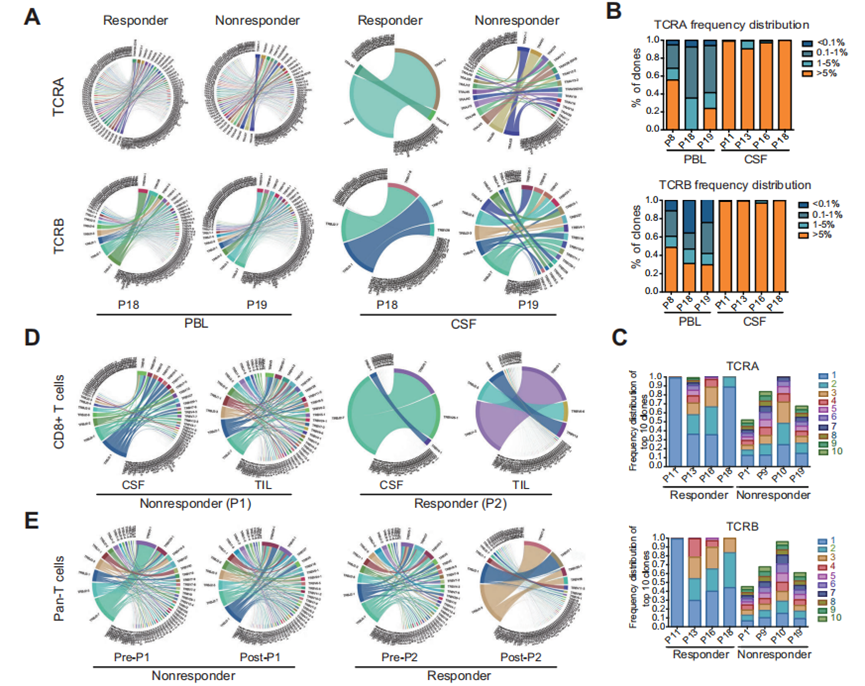
图2 对poly(I:C)应答组和无应答组之间配对CSF和PBL样本的TCR多样性分析
3、无应答者的TME以Treg细胞为主
由于应答者表现出优势的CTL增殖,作者使用scRNA-seq和配对TCR-seq扩展了TILs中CD45+免疫细胞的特征。作者最初通过无监督聚类法在2个样本中识别出10个不同的T细胞簇(图3A)。CD8+和CD4+ T细胞表现为表达naïve标志物(SELL和CCR7)、活化效应标志物(GZMA、GZMH和GZMK)或耗竭标志物(PDCD1和HAVCR2)的亚群。此外,Treg细胞表达CD4和FOXP3(图3B)。接下来的聚类分析表明,无应答者的TCR克隆主要是CD4+ Treg细胞和耗竭的CD4+细胞,而有应答者的TCR克隆主要是记忆性和效应性T细胞(图3C)。作者进一步将免疫细胞分为三个主要亚组(Treg细胞、非Treg CD4+细胞和CD8+细胞),发现Treg细胞在无应答者的肿瘤中占优势,而CD8+细胞在有应答者的肿瘤中富集(图3D)。有趣的是,根据治疗前后样本中TCR比率的变化,结合从缓解后复发肿瘤中获得的scRNA-seq数据,作者发现,在无反应者的治疗后肿瘤中比例增加的克隆最终退化为耗竭和Treg CD4+细胞(图3E)。而缓解组患者治疗后肿瘤中高比例和递减比例的克隆主要为CTLs,且多为复发后的效应性、记忆性和耗竭性CD8+细胞(图3F)。这些结果表明,无应答患者增加的Treg细胞产生了免疫抑制性TME。
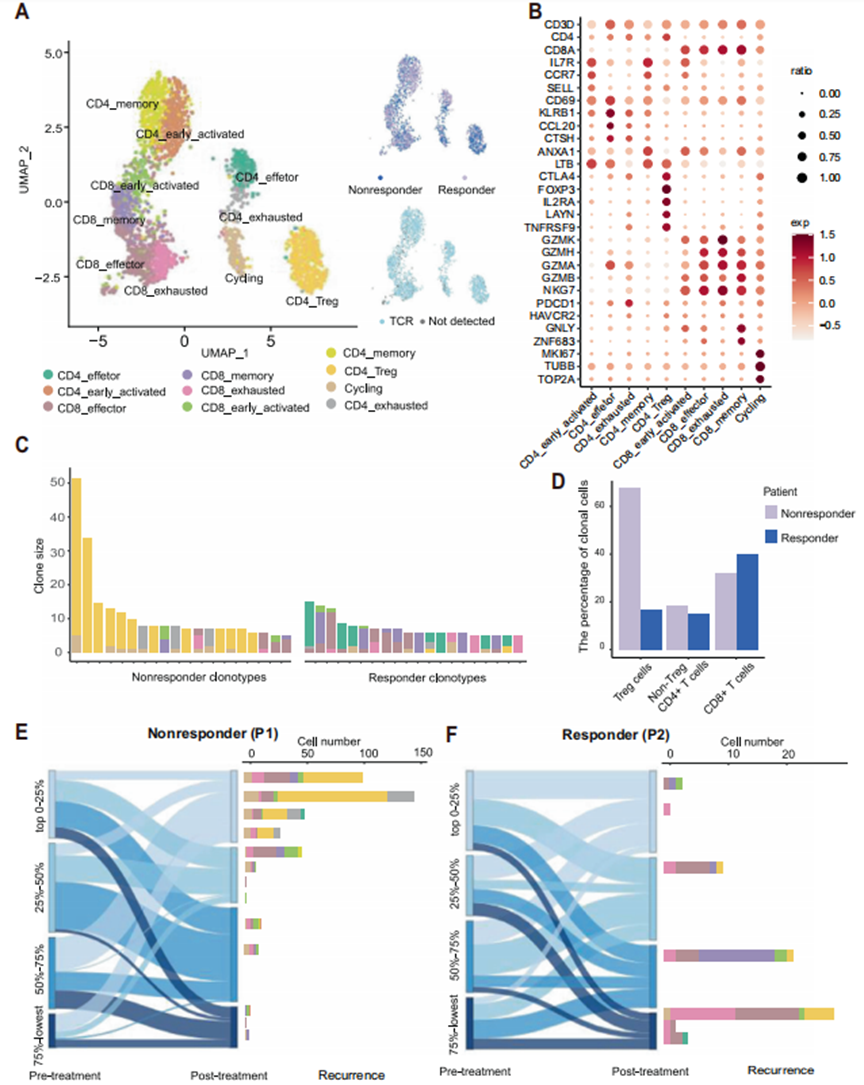
图3 scRNA-seq分析揭示无应答者保留了以Treg细胞为主的肿瘤微环境
4、无应答者可促进过度炎症性TME
为进一步研究产生这种不同治疗应答的原因,并确定对poly(I:C)产生应答的预测因素,作者对应答者和无应答者的6个治疗前样本的转录组进行了测序。对差异表达基因的功能富集分析显示,在无应答者中,许多参与适应性和固有免疫的免疫相关基因模块上调(图4A和B)。此外,无应答者中大多数下调的模块与神经发育功能相关(图4C和D)。
为了更好地了解无应答患者的特征,作者系统分析了癌症基因组图谱(TCGA)数据库中作为对照的5例癌旁正常组织(GBM)样本、2例有应答的复发患者样本的转录组数据和既往测序数据。综合分析表明,治疗前应答组样本的基因表达模式与癌旁组样本相似,而复发应答组样本的特征介于应答组和无应答组之间(图4E-G)。这一发现提示了患者从免疫应答到无应答的转录特征逐渐转化。值得注意的是,与其他患者的样本相比,在无应答者的样本中,免疫相关模块显著上调(图4F)。这些发现提示无反应患者的TME与过度激活和过度炎症相关。
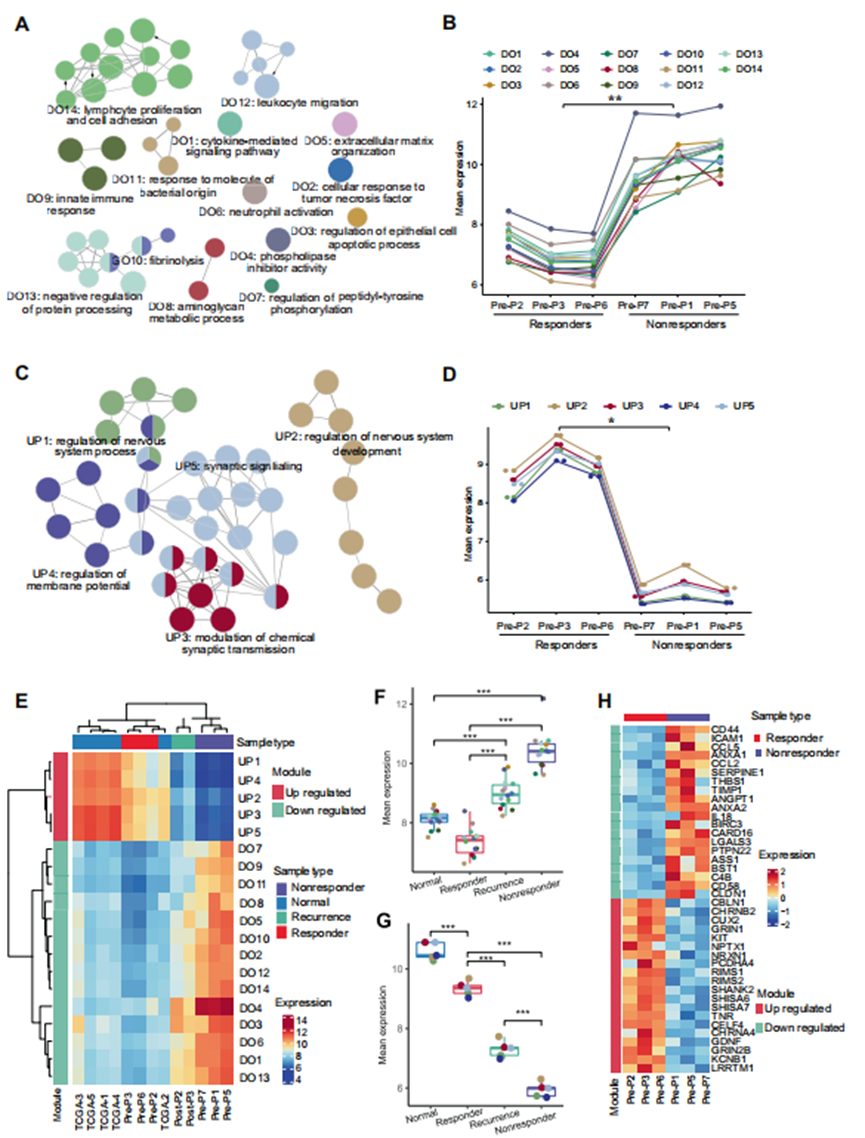
图4 应答者和无应答者之间转录组谱的差异
5、ANXA1是TLR3配体应答的潜在预测因子
通过差异表达分析,作者确定了上调或下调的前20个差异表达基因(图4H)。通过定量PCR验证,作者发现有应答者和无应答者之间的ANXA1水平显著不同(图5A)。因此,作者后续的分析集中在ANXA1上。通过比较ANXA1在4组(癌旁组、无应答组、有应答组和有应答的复发组)中的表达水平,作者发现ANXA1在无应答组中表达最高,其次是在正常组和有应答组中表达较低(图5B)。免疫组化数据还表明,ANXA1在无应答者的肿瘤中高表达,并且其表达在应答组中非常低,但在复发组中升高(图5C)。此外,作者根据TCGA和GTEx数据库添加了数百个胶质瘤肿瘤和对照正常组织之间的样本中ANXA1的表达。分析结果显示,ANXA1在胶质瘤中的表达水平显著高于正常组织。通过回顾性分析接受poly(I:C)治疗的患者中ANXA1蛋白的表达,探讨ANXA1作为TLR3配体治疗应答预测因子的有效性。作者的结果表明,有应答者的ANXA1表达显著低于无应答者。受试者工作特征(ROC)曲线显示,ANXA1预测TLR3配体应答的敏感度、特异度和准确度分别为91.7%、92.9%和92.3%(图5D)。
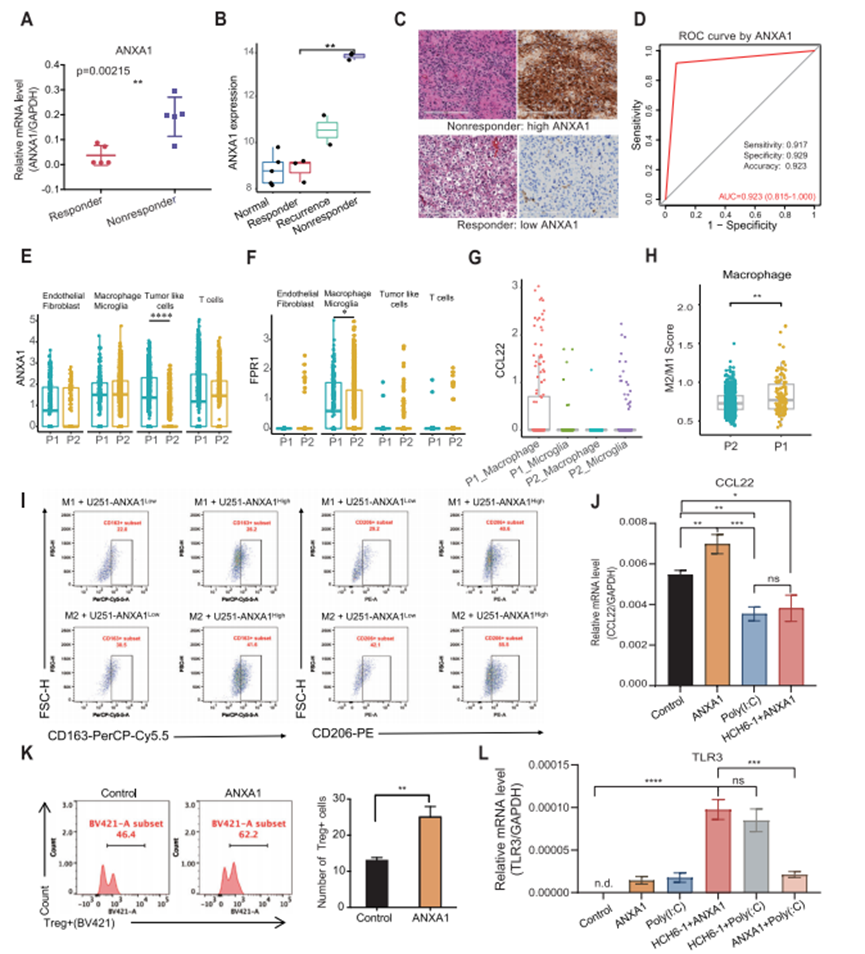
图5 胶质瘤源性ANXA1诱导M2样巨噬细胞募集Treg细胞
6、ANXA1可诱导巨噬细胞M2型极化
虽然ANXA1在细胞中广泛表达,但根据单细胞数据,肿瘤细胞是应答者和无应答者之间不同表达模式的主要来源(图5E)。FPR1作为ANXA1的主要受体,主要表达于无应答的小胶质细胞和巨噬细胞(图5F)。这些结果提示肿瘤中巨噬细胞可能通过分泌一些趋化因子来招募Treg细胞。因此,作者通过单细胞RNA-seq测定了巨噬细胞中CCL22的表达,发现应答样本中的CCL22表达显著高于无应答样本(图5G)。既往研究表明M2型巨噬细胞募集更多的Treg细胞,因此作者评估了M2型相关基因在巨噬细胞中的表达。根据M1(IL6、IL1B、IL12B、CD86、CXCL9、CXCL10、IFNB1、IFNAR1和TNF)和M2(IL10、CCL22、ARG1、MRC1、CD163、MRC1、TGFB1、IRF4、TGM2、CXCL12和CXCR4)标记基因,作者对单细胞RNA-seq中的每个巨噬细胞进行了评分,并证实无应答(P1)样本中的巨噬细胞显示出更强的M2表型(图5H)。
这一与肿瘤-巨噬细胞/小胶质细胞-Treg关系相关的见解促使作者探索ANXA1在调节巨噬细胞极化中的作用。在U251细胞与巨噬细胞共培养体系中,通过检测巨噬细胞表面标志物CD163和CD206的表达来评估其M2型表型。流式细胞术检测结果显示,与U251-ANXA1High胶质瘤细胞共培养组的M2型巨噬细胞数量高于与U251-ANXA1Low胶质瘤细胞共培养组。这些结果共同支持ANXA1在触发巨噬细胞M2表型极化中发挥关键作用的结论(图5I)。此外,与未处理的巨噬细胞相比,重组人类ANXA1处理的巨噬细胞释放更高水平的CCL22,而poly(I:C)显著抑制ANXA1的诱导并进一步降低巨噬细胞中CCL22的表达。加入FPR1抑制剂HCH6-1可抑制ANXA1诱导的CCL22水平升高(图5J)。
为了验证ANXA1/FPR1轴在肿瘤细胞和巨噬细胞之间募集Treg细胞的功能,作者进行了Treg趋化实验,结果表明ANXA1处理的M2巨噬细胞比未处理的M2巨噬细胞募集更多的Treg细胞(图5K)。这些结果表明ANXA1可以显著增强巨噬细胞募集Treg细胞的能力。
此外,poly(I:C)刺激后,M0细胞中TLR3的mRNA表达显著激活,加入FPR1抑制剂HCH6-1后,激活效率无明显影响,但ANXA1与poly(I:C)共存导致TLR3下调(图5L)。这一结果表明ANXA1通过下调其受体TLR3的表达来抑制对poly(I:C)的应答。
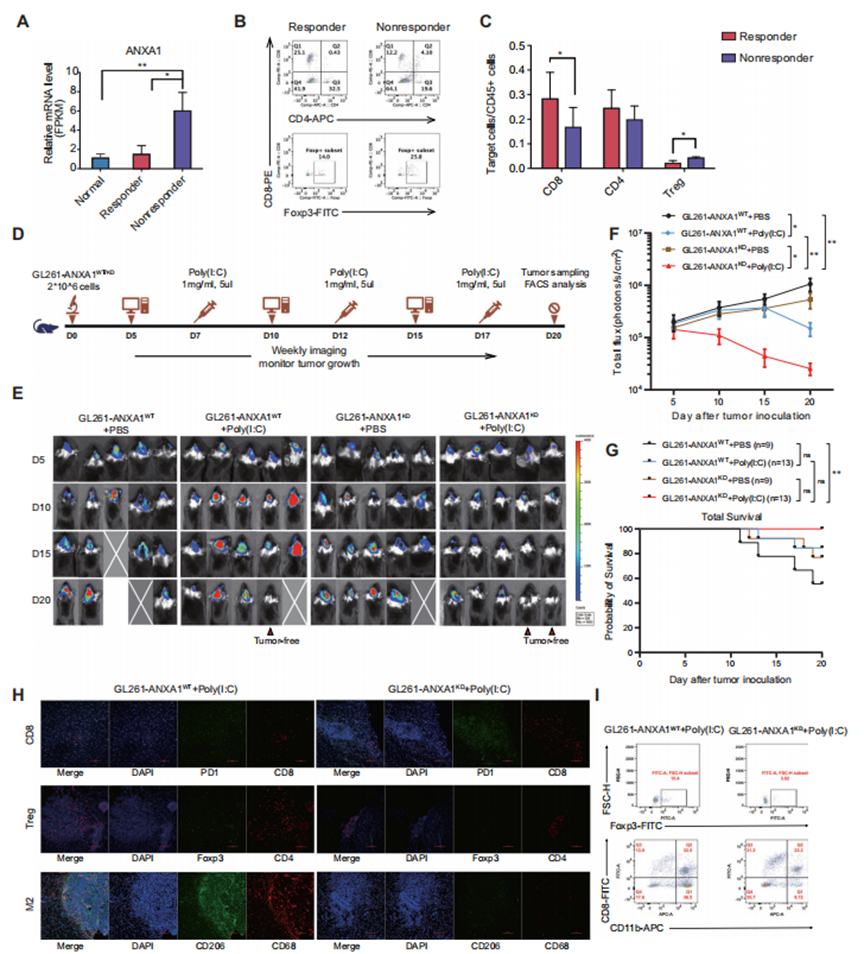
图6 胶质瘤中ANXA1的低表达与原位肿瘤小鼠对TLR3配体的有效反应相关
7、降低ANXA1的表达可提高对TLR3配体的应答
作者使用GL261细胞建立原位肿瘤小鼠模型,研究ANXA1对TLR3配体的直接影响。对小鼠进行Poly(I:C)免疫治疗。作者对肿瘤进行了RNAseq分析,发现poly(I:C)应答小鼠的ANXA1表达水平相对较低,这与正常小鼠脑组织中的ANXA1表达水平相似(图6A)。为了确定该模型小鼠原位肿瘤中的肿瘤浸润T细胞类型,作者分析了来自小鼠样本的细胞,发现与无应答小鼠的肿瘤相比,CD8细胞在有应答小鼠的肿瘤中显著富集。相反,无应答小鼠的Treg细胞水平高于有应答小鼠(图6B和C)。为了进一步验证ANXA1和TLR3配体之间的关联,作者使用GL261-ANXA1WT-luc和GL261-ANXA1KD-luc细胞在小鼠中产生原位肿瘤,并给予poly(I:C)(图6D)。GL261-ANXA1WT-luc细胞较GL261-ANXA1KD-luc细胞诱导更多的实质性肿瘤进展。此外,肿瘤中ANXA1的低表达导致了对poly(I:C)的有效应答,显示了强大的肿瘤控制能力(图6E和F)。此外,作者在所有实验小鼠中进行了生存分析,结果显示,接受poly(I:C)的ANXA1KD小鼠的生存时间显著长于未注射poly(I:C)的ANXA1WT小鼠(P < 0.01)(图6G)。虽然这些小鼠在第20天被杀死,但四组小鼠的生存趋势仍然可以为干预的效果提供有价值的见解。作者分析了小鼠原位肿瘤的TILs,发现在poly(I:C)处理后,GL261-ANXA1KD-luc小鼠比GL261-ANXA1WT-luc小鼠激活了更多的CD8细胞。相反,在GL261-ANXA1WT-luc小鼠的肿瘤中,Treg细胞和M2巨噬细胞的水平高于GL261-ANXA1KD-luc小鼠的肿瘤(图6H)。流式细胞术数据与多色IF染色结果一致(图6I)。因此,作者的数据表明,ANXA1水平较低的肿瘤对TLR3配体有更有效的应答。
结论:
在本研究中,作者证明了胶质瘤来源的ANXA1对体内TLR3配体应答有重要影响,通过ANXA1/FPR1轴使巨噬细胞和小胶质细胞向M2样表型倾斜,促进免疫抑制性TME的发展。作者的发现为ANXA1在胶质瘤生物学中的功能提供了更多的机制见解。首先,作者发现,如在对poly(I:C)有应答的患者中观察到的那样,无应答者在CSF或TILs中均不具有优势寡克隆的特征。其次,作者发现在无反应的TME中,高炎症和免疫抑制的TME伴随着ANXA1的高表达被促进。第三,作者发现ANXA1高表达可以触发巨噬细胞向M2表型极化,增强Treg细胞浸润,降低患者和胶质瘤模型小鼠的生存率。作者的结果揭示了胶质瘤细胞通过ANXA1/FPR1轴调节脑肿瘤环境的机制,并有助于TLR3配体的治疗抵抗。
综上所述,作者提出了以下模型(图7):在无应答胶质瘤中,ANXA1的高表达与巨噬细胞和小胶质细胞中FPR1的高表达相关,后者可以通过趋化释放抗炎细胞因子来招募Treg细胞;因此,以Treg细胞为主的免疫细胞群建立了免疫抑制性TME。与此模型一致,TME抑制了poly(I:C)的免疫激活,临床表现为对poly(I:C)的抵抗。ANXA1被认为是一个可靠的预测对TLR3配体反应的指标,因为它在肿瘤组织样本中有应答和无应答之间的差异表达。从临床角度来看,评估TLR3配体(如poly(I:C))的治疗效用可能是有趣的,同时重点关注通过穿刺活检确定的胶质瘤肿瘤组织中ANXA1表达水平与癌旁组织相似或略低的患者人群。这种方法有助于制定个性化的免疫治疗方案。对于无应答者,FPR1阻滞剂可能克服poly(I:C)耐药,但仍需要临床试验的支持。探索和了解ANXA1在胶质瘤生物学中的分子机制,可拓宽TLR3配体应答者的靶人群,改善胶质瘤患者的预后。
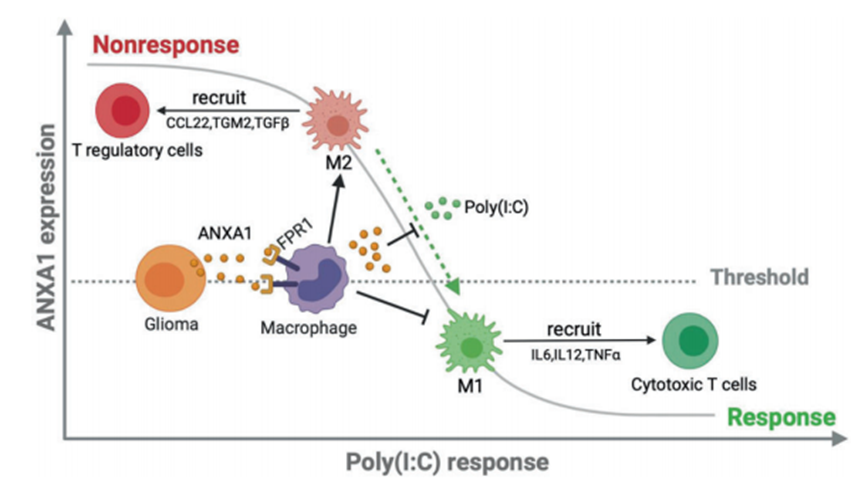
图7 在胶质瘤的TME中,ANXA1/FPR1轴和TLR3配体触发了抗肿瘤免疫应答
实验方法:
制备单细胞悬浮液;CD8+CTLs TCR库的建立与分析;单细胞RNA测序(scRNA-seq)和scRNA-seq数据处理;TCR测序(TCR-seq)数据处理;细胞间相互作用;RNA-seq数据分析及富集分析;组织切片和免疫组化(IHC);免疫荧光(IF);细胞系和培养条件;流式细胞术;趋化性实验;小鼠模型。
参考文献:
Zheng Y, Jiang H, Yang N, Shen S, Huang D, Jia L, Ling J, Xu L, Li M, Yu K, Ren X, Cui Y, Lan X, Lin S, Lin X. Glioma-derived ANXA1 suppresses the immune response to TLR3 ligands by promoting an anti-inflammatory tumor microenvironment. Cell Mol Immunol. 2023 Dec 4. doi: 10.1038/s41423-023-01110-0. Epub ahead of print. PMID: 38049523.






