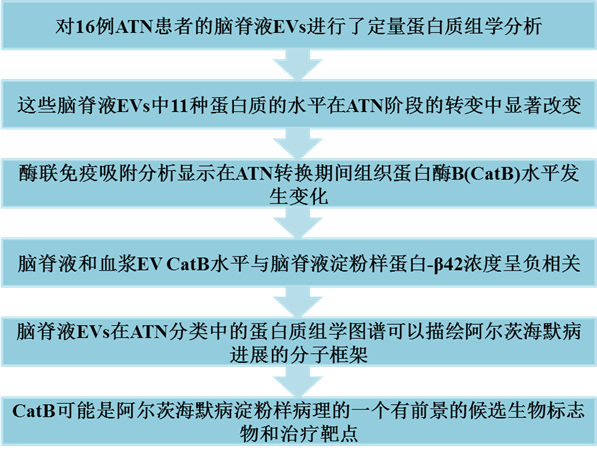
细胞外囊泡蛋白质组揭示组织蛋白酶B与阿尔茨海默病发病机制的联系
阿尔茨海默病(AD)是痴呆最常见的病因,也是全球亟待解决的主要医学问题。该疾病的病理学特征是由淀粉样-β肽(Aβ)在细胞外聚集构成的淀粉样斑块和由磷酸化Tau蛋白(pTau)构成的神经原纤维缠结在细胞内沉积。近年来,有人提出,致病蛋白通过细胞外囊泡(EVs)在神经元之间传播参与了AD进展。外泌体、微囊泡和凋亡囊泡等EVs是含有多种蛋白质、脂质和核酸的分泌性膜囊。EVs可由多种细胞释放,有报道称来自CNS的EVs含有aβ、其分解代谢酶和Tau等分子,这些分子均在AD的发病机制中发挥重要作用。该研究发表在《Brain》,IF:14.5。
技术路线:
主要研究结果:
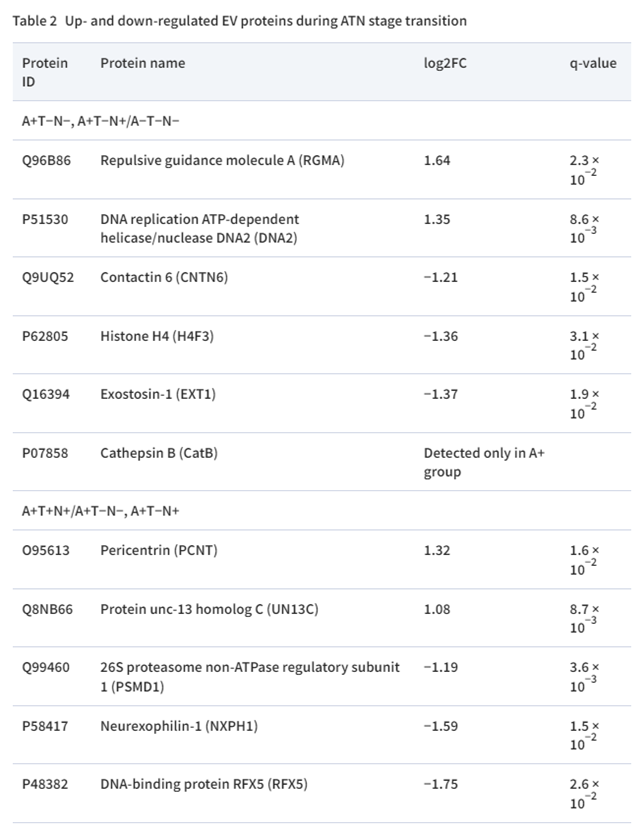
1. ATN分类中脑脊液细胞外囊泡的蛋白质组学分析
工作流程如图1所示。首先,利用受试者工作特征(ROC)曲线分析脑脊液aβ42、pTau和Tau的截断值(cut-off值)(n=60;aβ42的cut-off值为677.9 pg/ml(AUC 0.80,灵敏度87%,特异度70%),pTau的cut-off值为73.0 pg/ml(AUC 0.74,灵敏度97%,特异度57%),tTau的cut-off值为597.7 pg/ml(AUC 0.80,灵敏度78%,特异度70%)。接下来,利用这些cut-off值设计蛋白质组学分析的发现集(表1)。
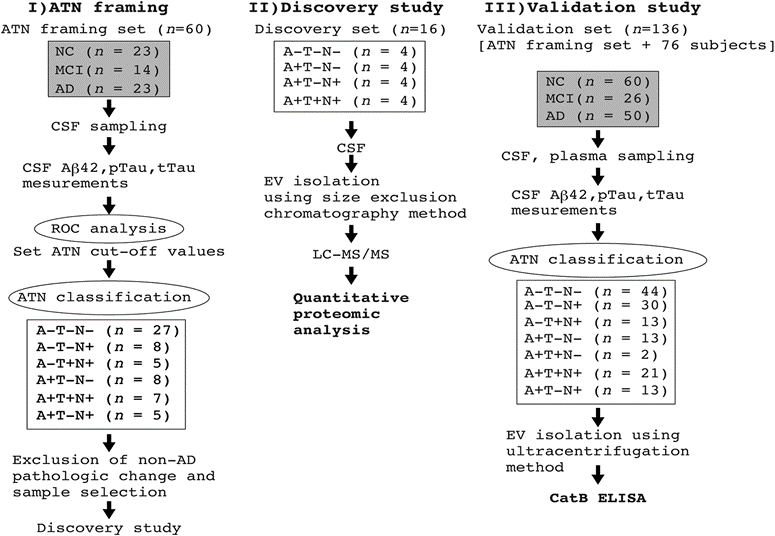
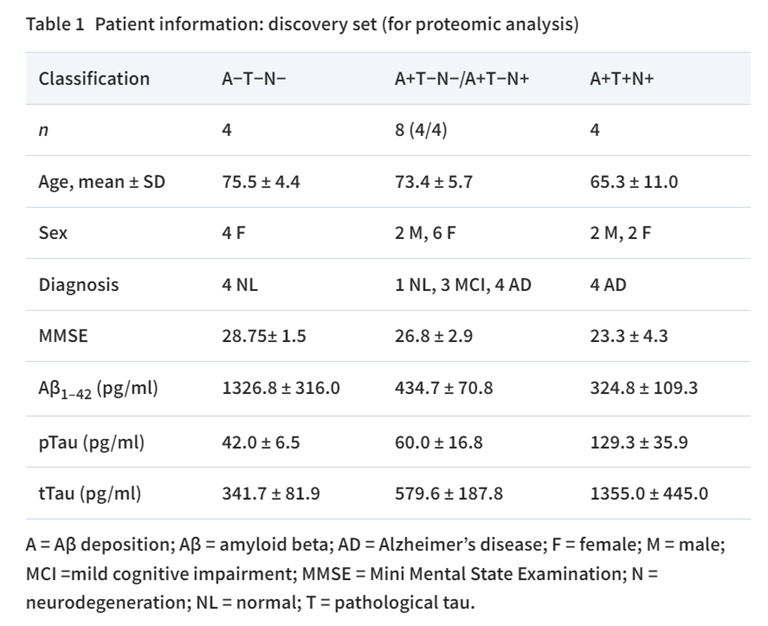
为了鉴定与AD病理进展相关的蛋白质,研究者从16例参与者的脑脊液中分离出EVs,测量其粒径并使用LC-MS/MS进行分析。分离的EV平均粒径约为120nm。从脑脊液EV中共鉴定和定量了1756个蛋白质。鉴定的脑脊液EV蛋白质与Vesiclepedia数据库中top100列表中的EV蛋白质进行了比较,在脑脊液EV蛋白质组学列表中发现了top100列表中的87个蛋白质。通过注释、可视化和整合发现数据库进行GO分析,进一步对脑脊液EV蛋白进行功能评估在生物过程、分子功能和细胞成分中富集的蛋白主要与细胞外结构组成和细胞外结构组织相关。这些结果表明,样品富含EVs。A−T−N−组、A+T-N−/A+T−N+组和A+T+N+组脑脊液EVs分别鉴定出1487、1592和1535个蛋白质。在所有组中检测到约95.2%的蛋白质(1671个蛋白质),A−T−N−、A+T−N−/A+T−N+和A+T+N+分别有1、30和15个蛋白质(图2A)。两组共有的蛋白质数量为:EV标志蛋白Alix、CD9和CD63的丰度水平在三组间无差异,表明蛋白质组学谱的差异很可能不是由于EV数量/组成的差异。
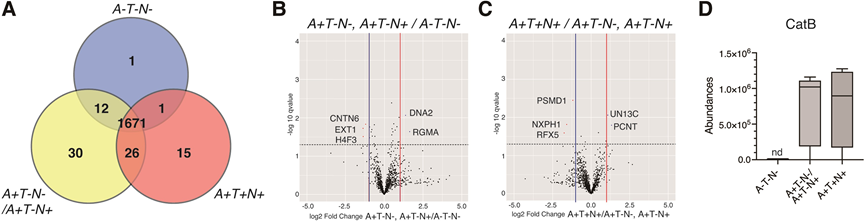
图2 在ATN分类下对发现集中的脑脊液细胞外囊泡(EV)蛋白质进行蛋白质组学分析
2. 淀粉样蛋白发病期间脑脊液和血浆细胞外囊泡中CatB水平升高
CatB是在A−T−N−和A+T−N−/A+T−N+之间发生显著变化的蛋白之一,与AD脑内的老年斑相关,也参与溶酶体蛋白酶介导的淀粉样前体蛋白(APP)向Aβ的加工。因此,研究者选择了CatB,在使用CSF和血浆EVs的更大规模队列中验证蛋白质组学结果。从136份脑脊液样本中分离出EV,分为7个ATN组(表3),采用ELISA法测定其CatB水平(CSF-EV-CatB)。从CSF和血浆中分离出的EV平均粒径约为105 nm。与蛋白质组学分析一致,CSF-EV-CatB水平显著升高(A−,35.9±24.7 pg/ml;A+为95.4±23.9 pg/ml;P<0.0001)与淀粉样蛋白阴性组相比(图3A),并且A+和T+时的水平分别显著高于A-和T-时的水平(图3B)。CatB浓度与脑脊液aβ42浓度呈强负相关(r=−065,P<0.0001),与pTau呈极弱相关(r=0.172,P=0.046),与tTau呈弱相关(r=0.261,P=0.019)(图3C-E)。这些结果表明CSF-EV-CatB与CSF的Aβ状态密切相关。
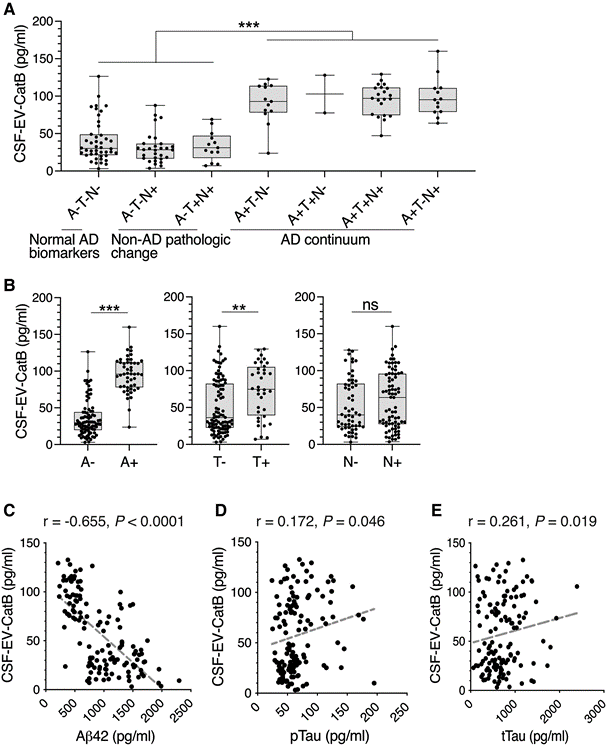
图3 基于ELISA方法验证CatB在脑脊液细胞外囊泡中的表达
EVs外周血中可用于监测病变在CNS。因此,研究者测量总CatB和EV CatB使用由ELISA血浆样本136例(表3),由于等离子体的浓度CatB ATN组之间没有显著差异。与自由等离子CatB plasma-EV-CatB水平显著增加相比,A−T−N−(A−T−N−,143.3±40.4 pg/ml;A+T−N−,177.7±52.6 pg/ml;P=0.042),而在其他AD连续组中没有(图4A)。A+组的水平显著高于A-组,但T+/T−组和N+/N−组之间没有差异(图4B)。血浆-EV-CatB与CSF aβ42浓度呈中度负相关,但与CSF pTau或tau无中度负相关(图4C-F)。这些结果提示血浆EV-CatB与脑脊液Aβ状态相关。
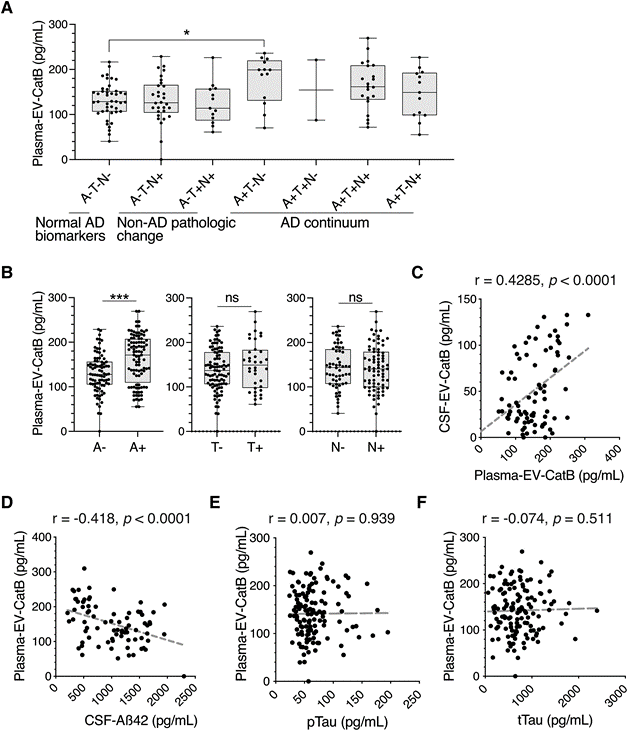
图4 ELISA验证血浆细胞外囊泡中的CatB作为推定的血液生物标志物使用ATN分类
结论:
总之,该研究对ATN分类中的脑脊液EVs进行的全蛋白质组分析发现,淀粉样蛋白阳性组和淀粉样蛋白阴性组之间有6种蛋白质发生了显著变化。此外,对136份样本的ELISA分析证实,随着淀粉样蛋白进展,CSF和血浆中EVs中的CatB水平升高,表明EVs中的CatB可能参与AD淀粉样蛋白的发病机制。除了与淀粉样蛋白病理相关的蛋白,EV蛋白质组分析揭示了一些病理生理功能未知的蛋白,这些蛋白的表达在Tau蛋白病理/神经变性中发生了改变,这可能有助于阐明AD的分子发病机制和开发新的治疗药物。
实验方法:
质谱分析,免疫测定,ELISA,蛋白质组学分析
参考文献:
Yuyama K, Sun H, Fujii R, Hemmi I, Ueda K, Igeta Y. Extracellular vesicle proteome unveils cathepsin B connection to Alzheimer's disease pathogenesis. Brain. 2023 Dec 10:awad361. doi: 10.1093/brain/awad361.






