单细胞新亚群:肿瘤外膜细胞重塑血管基质促进CRC转移
血行播散是结肠直肠癌(CRC)转移的一种普遍途径。然而,作为血管的守门人,肿瘤外膜细胞(TPCs)在血行转移中的作用仍然大部分未知。本文旨在研究TPCs的异质性及其对CRC转移的影响。作者从有或没有肝转移的CRC患者中分离TPCs,并通过单细胞RNA测序(scRNA-seq)进行分析。通过scRNA-seq鉴定了13个TPC亚群。一种新的TCF21高表达的TPC亚群,被称为“基质-外膜细胞”,与CRC患者的肝转移相关。TPCs中的TCF21增加了血管周围ECM的硬度,胶原重排和基底膜降解,建立了一种促使结直肠癌肝转移(CRCLM)的外膜细胞转移微环境。TPCs中的Tcf21耗尽减轻了血管周围ECM的重塑和CRCLM,而TCF21高表达的TPCs与CRC细胞的共注射显著促进了CRCLM。在机制上,整合素α5的丧失抑制了FAK/PI3K/AKT/DNMT1轴,从而损害了TCF21高表达TPCs中的TCF21 DNA高甲基化。本研究揭示了TPCs在血行转移中的先前未知角色,并为CRC转移提供了潜在的诊断标志物和治疗靶点。本文于2023年4月发表在《Gut》IF:24.5期刊上。
技术路线:

主要实验结果:
1、鉴别与CRC转移相关的TPCs的特定亚群
为剖析TPCs的异质性并评估它们对CRC转移的贡献,从有或没有肝转移的CRC患者的原发肿瘤组织中分离了TPCs,并进行了scRNA-seq分析。从50,000个细胞中生成了单细胞转录组,这些细胞在t-SNE空间中对比,以识别出不同的聚类(图1A)。TPCs的基因表达谱被分类为13个不同的聚类(图1B)。图1C显示了前10个聚类特异性基因。在所有亚群中,聚类2中细胞的比例在有(18.5%)和没有(3.4%)肝转移的CRC患者之间显示了最大的差异(图1D),表明这个亚群与CRCLM相关。GO富集分析表明,在来自有肝转移的CRC患者的样本中,上调的基因与ECM相关的几个GO术语有关(图1E),包括MATN2、CHI3L1、COL3A1、COL1A2、CILP、MMP2、MFAP4、FBLN1和FBLN2(图1F)。因此,聚类2中的细胞被定义为基质-外膜细胞。在聚类2中独特富集的基因之一是MATN2,它编码蛋白质matrilin-2(MATN2),被选择为基质-外膜细胞的生物标志物。在源自有肝转移的CRC患者的肿瘤切片中,MATN2+ TPCs的比例高于没有肝转移的患者(图1G)。此外,ROC曲线分析显示,MATN2+ TPCs的最佳截断百分比,以高灵敏度和特异性预测CRCLM,为30%(图1H)。Kaplan-Meier生存分析显示,在MATN2+ TPCs比例较高(>30%)的患者中,总生存(OS)(图1I)和无病生存(DFS)(图1J)较短。这些数据表明,基质-外膜细胞与CRC转移密切相关。
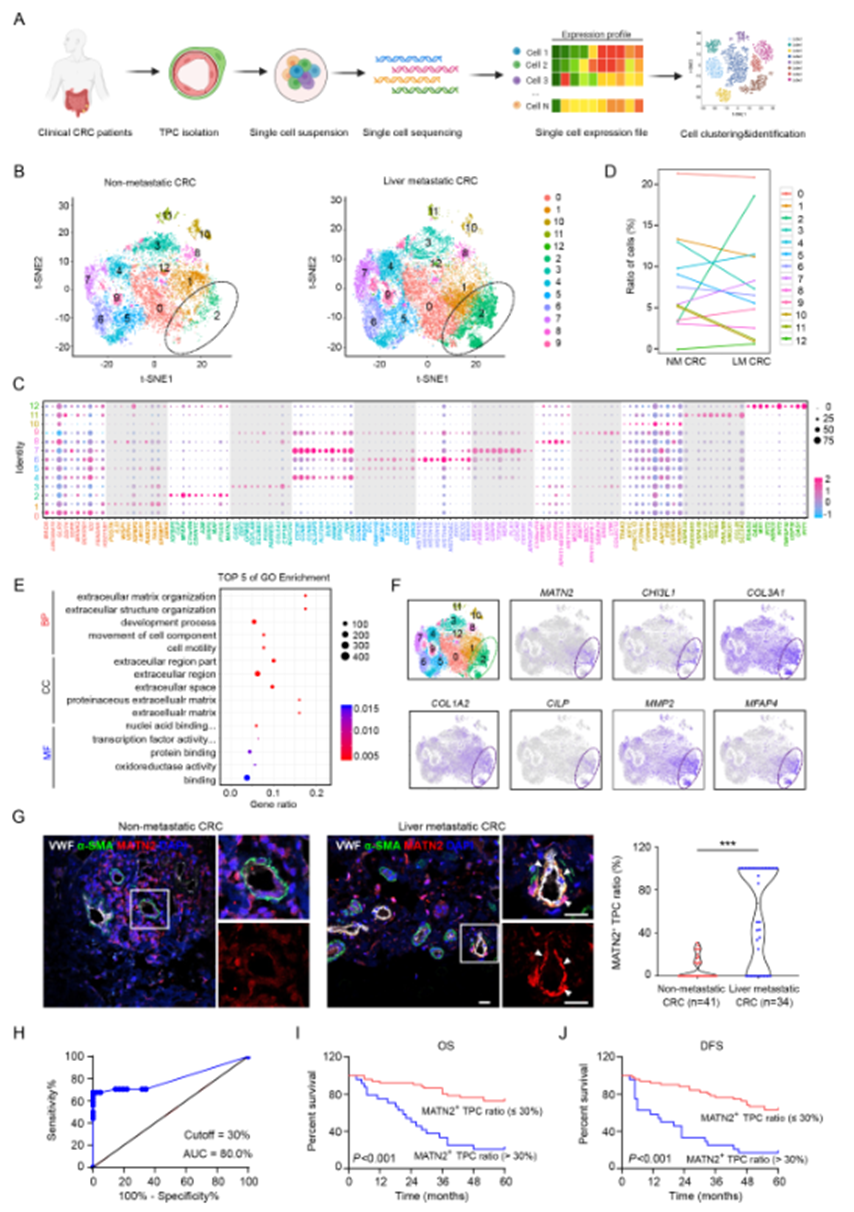
图1 结直肠癌患者TPCs中基质周细胞的转录组学特征
2、TPCs中的TCF21与CRC转移相关
使用单细胞调控网络推断和聚类(SCENIC)流程鉴定了基质-外膜细胞的关键调控因子,该流程将顺式调控序列信息与scRNA-seq数据相连接。SCENIC分析显示,TCF21的调控区活性在基质-外膜细胞中最高(图2A),在所有细胞的t-SNE空间中得到了确认(图2B)。此外,与没有肝转移的CRC患者相比,有肝转移的患者样本中TCF21高表达的TPCs数量显著增加(图2C)。在有肝转移的CRC患者的肿瘤切片中,TCF21+ TPCs的比例也增加了(图2D)。Pearson相关系数分析显示TCF21+ TPCs比例与MATN2+基质-外膜细胞呈正相关(r=0.805,P<0.001;图2E)。ROC曲线分析显示,预测有肝转移的CRC患者中TCF21+ TPCs的最佳百分比为44%(图2F)。Kaplan-Meier生存分析表明,在TCF21+ TPCs比例较高(>44%)的患者中,总生存(OS)(图2G)和无病生存(DFS)(图2H)显著缩短。这些发现表明TPCs中的TCF21可作为CRC转移的预测性生物标志物。
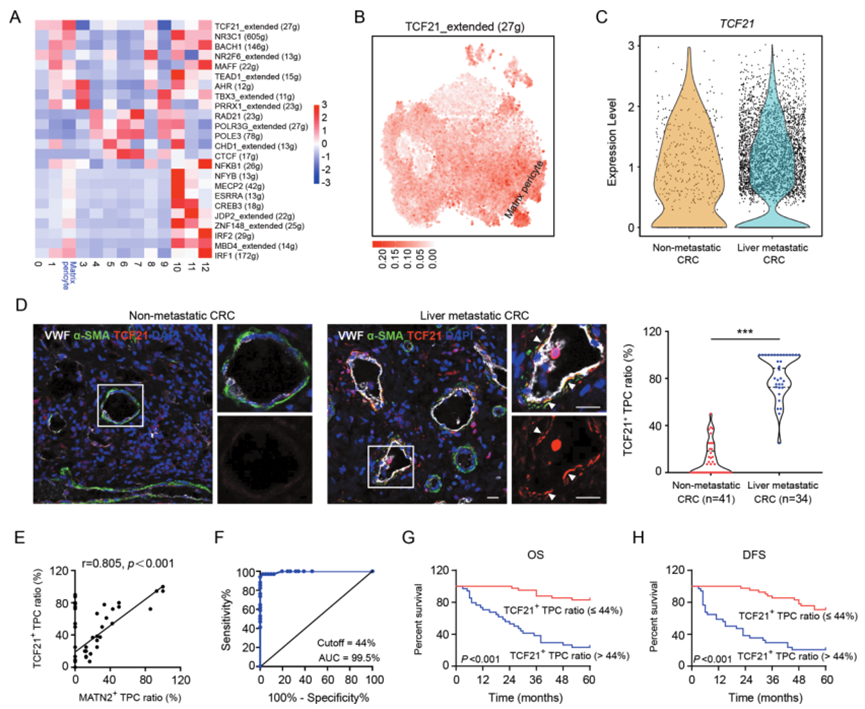
图2 基质周细胞TCF21与结直肠癌肝转移呈正相关
3、TPCs中的TCF21对基质-外膜细胞的表型转变和血管周围ECM的重塑起促进作用
TCF21在TPCs中的上调与CRCLM之间的正相关表明,TCF21可能参与了TPCs的激活,并可能促进基质-外膜细胞的表型转变。基质-外膜细胞中的九个基因,包括IGFBP5、CILP、MFAP4、c11orf96、A2M、SFRP2、MAF、PTGDS和MATN2,在TPCNM TCF21中显著高于TPCNM Vector(图3A)。此外,在TPCNM中过表达TCF21会增加MATN2+基质-外膜细胞的百分比,而在TPCLM中敲除TCF21会减少MATN2+基质-外膜细胞的百分比(图3B)。
使用全转录组RNA-seq和ChIP-seq分析,对TCF21下游基因在TPCs中进行了调查。RNA-seq和ChIP-seq结果的GO富集分析显示,由TCF21调控的基因与“ECM组织”和“ECM”等类别相关(图3C、D),与基质-外膜细胞的表达谱相似。此外,通过比较ChIP-seq分析检测到的TCF21峰值、RNA-seq检测到的TCF21诱导基因和scRNA-seq检测到的基质-外膜细胞基因,确定了139个重叠基因(图3E)。这些重叠基因的GO分析显示它们与“含胶原的ECM”和ECM等类别相关(图3F)。这些结果通过RT-qPCR和ChIP-qPCR进行了确认,TCF21与基质-外膜细胞特异基因的启动子的结合在TCF21过表达的TPCNM中显著上调(图3G、H),Western blotting进一步确认了这些结果(图3I)。这些结果表明TCF21对于基质-外膜细胞的生成至关重要。
ECM重塑对于肿瘤转移至关重要,它以异常的胶原产生和交联为特征,导致组织硬度增加,从而促进肿瘤转移。此外,矩阵金属蛋白酶等蛋白酶对血管基底膜的降解促使肿瘤细胞逃离原发肿瘤部位。作者提出TCF21可能在血管周围ECM重塑和CRC转移中发挥作用。原子力显微镜(AFM)显示,与TPCNM Vector相比,TPCNM TCF21在诱导胶原局部排列、卷曲和片状胶原纤维重新组织成辐射和捆绑结构以及增加粗糙度方面具有更强的能力(图3J)。此外,TPCNM TCF21优于TPCNM Vector在增加胶原的机械性能(图3K)和增加胶原收缩(图3L)方面,从而增强ECM的硬度。为了进一步评估TCF21介导的血管周围ECM重塑对CRC细胞跨越的影响,PKH-67标记的HCT116或DLD-1细胞与TPCNM Vector、TPCNM TCF21、TPCLM siNC或TPCLM siTCF21混合后播种到Matrigel中。TPCNM TCF21比TPCNM Vector更有利于CRC细胞通过Matrigel涂覆的Transwell膜侵入(图3M),而TPCLM siTCF21减少了与TPCLM siNC相比的CRC细胞的侵入。在一个器官样培养系统上进行的实验显示,在由胶原I和Matrigel组成的基质与TPCNM TCF21预混比与TPCNM Vector相比,侵入的HCT116细胞数量显著增加(图3N)。总体而言,这些结果表明在基质-外膜细胞中的TCF21诱导血管周围ECM的重塑,从而促使CRC细胞通过血管周围的基质进行侵入。
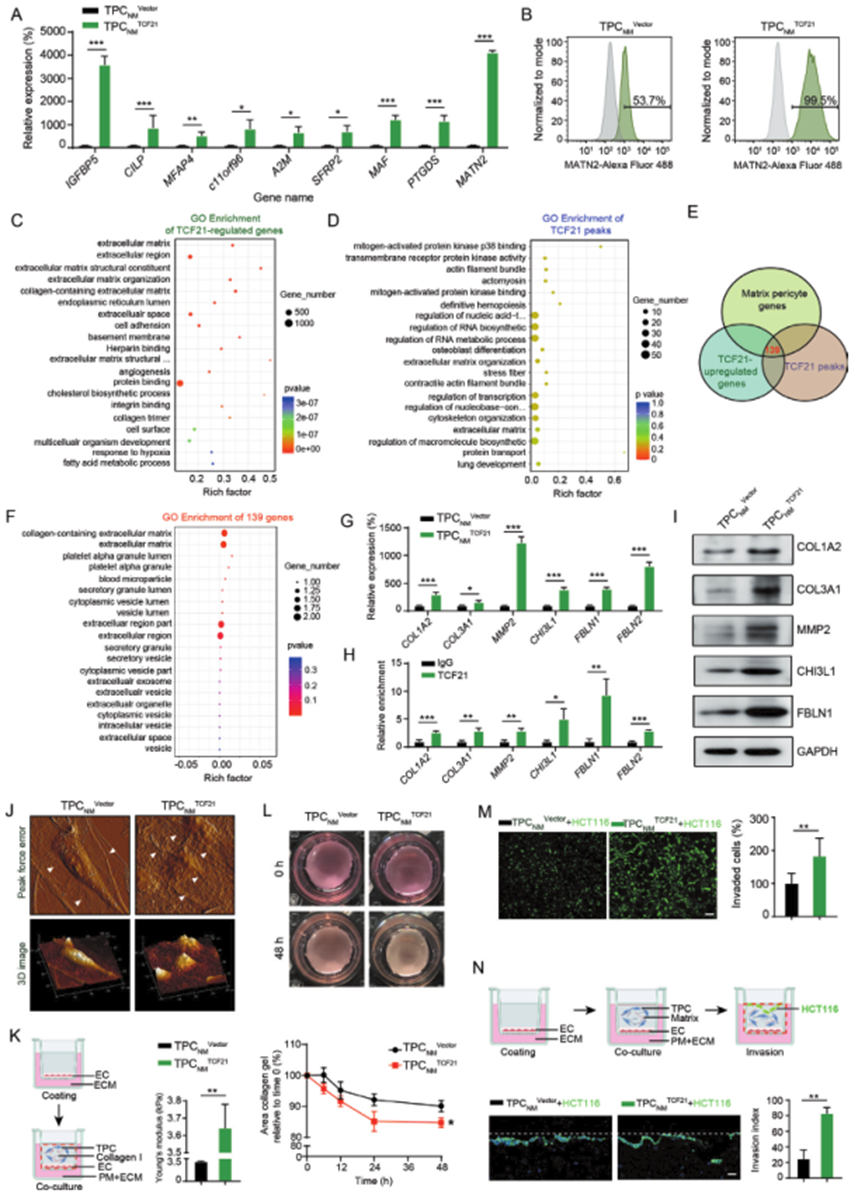
图3 TCF21对于基质周细胞的形成至关重要,并通过ECM重塑促进CRC细胞的侵袭
4、敲除TPCs中的Tcf21抑制CRC转移
为确定TPCs中的TCF21是否对CRC在体内的转移至关重要,作者生成了外膜细胞谱系追踪小鼠(PClin)和诱导剂型Cspg4驱动的外膜细胞特异性Tcf21敲除小鼠(PClin-KO)(图4A)。对PClin和PClin-KO小鼠同时进行了盐酸酮庚酮的给药,结果是对外膜细胞进行了永久标记,并敲除了PClin-KO小鼠中的Tcf21。为检查TPCs中的TCF21对CRC转移的影响,先分别将PClin和PClin-KO小鼠注射荧光素标记的肿瘤细胞(MC38-luc-LM3),然后进行1周的盐酸酮庚酮处理。盐酸酮庚酮处理诱导了TPCs中的Cre活性,这表现为PClin和PClin-KO小鼠中的tdT荧光,以及PClin-KO小鼠中TCF21的丧失。在体内,TPCs特异性敲除Tcf21显著抑制了肝转移的形成(图4B)。与PClin小鼠相比,PClin-KO小鼠中肝转移灶的面积和数量显著减少(图4C)。此外,在PClin-KO小鼠中,EpCAM+CD45− CTCs的数量明显低于PClin小鼠(图4D)。这些数据表明,TPCs中的TCF21促进CRC的转移,独立于肿瘤生长和EMT。
对TCFs在TPCs中对血管结构和功能的影响进一步通过评估外膜细胞覆盖率和肿瘤血管中MATN2+基质-外膜细胞的百分比来进行评估。在MC38-luc-LM3 CRCLM移植小鼠的原发肿瘤组织中,MATN2+基质-外膜细胞的数量在PClin-KO小鼠中低于PClin小鼠(图4E)。此外,PClin小鼠的TPCs中与ECM重塑相关的蛋白,包括MMP2、COL1A2、COL3A1和CHI3L1的表达,明显高于PClin-KO小鼠(图4F)。Masson染色显示PClin-KO小鼠的肿瘤切片中纤维胶原成分的密度显著降低,相比之下,PClin小鼠的肿瘤切片中纤维胶原成分的密度较高(图4G)。透射电子显微镜分析表明,在PClin-KO小鼠的肿瘤切片中,血管周围区域的胶原束较PClin小鼠的薄(图4H)。胶原的沉积是组织硬度和肿瘤细胞的局部侵袭性所必需的,而胶原方向的改变也是肿瘤转移的原因之一。通过二次谐波发生和双光子激发荧光进一步检查了血管周围胶原的结构。PClin-KO小鼠中的血管周围胶原纤维呈不规则排列,呈卷曲和不规则的轮廓,而PClin小鼠中的血管周围胶原呈几乎平行的方向,并紧密地环绕在肿瘤血管周围(图4I)。通过AFM确定了血管周围区域的硬度,并用杨氏模量图案进行分析,结果发现PClin-KO小鼠中的血管周围区域明显较PClin小鼠中软(图4J、K)。由于基底膜在阻止肿瘤细胞内渗方面起着物理屏障作用,基底膜的降解可能削弱其屏障功能并增加血管渗透性。结果显示,PClin-KO小鼠中laminin(血管基底膜中最丰富的成分)的表达显著高于PClin小鼠(图4L),而TPCs中的Tcf21的敲除导致PClin-KO小鼠中血管的渗透性降低,相对于PClin小鼠(图4M)。综上所述,基质-外膜细胞中的TCF21可能是血管周围ECM重塑的关键调节因子,建立了一个促使CRC细胞内渗的PMM。
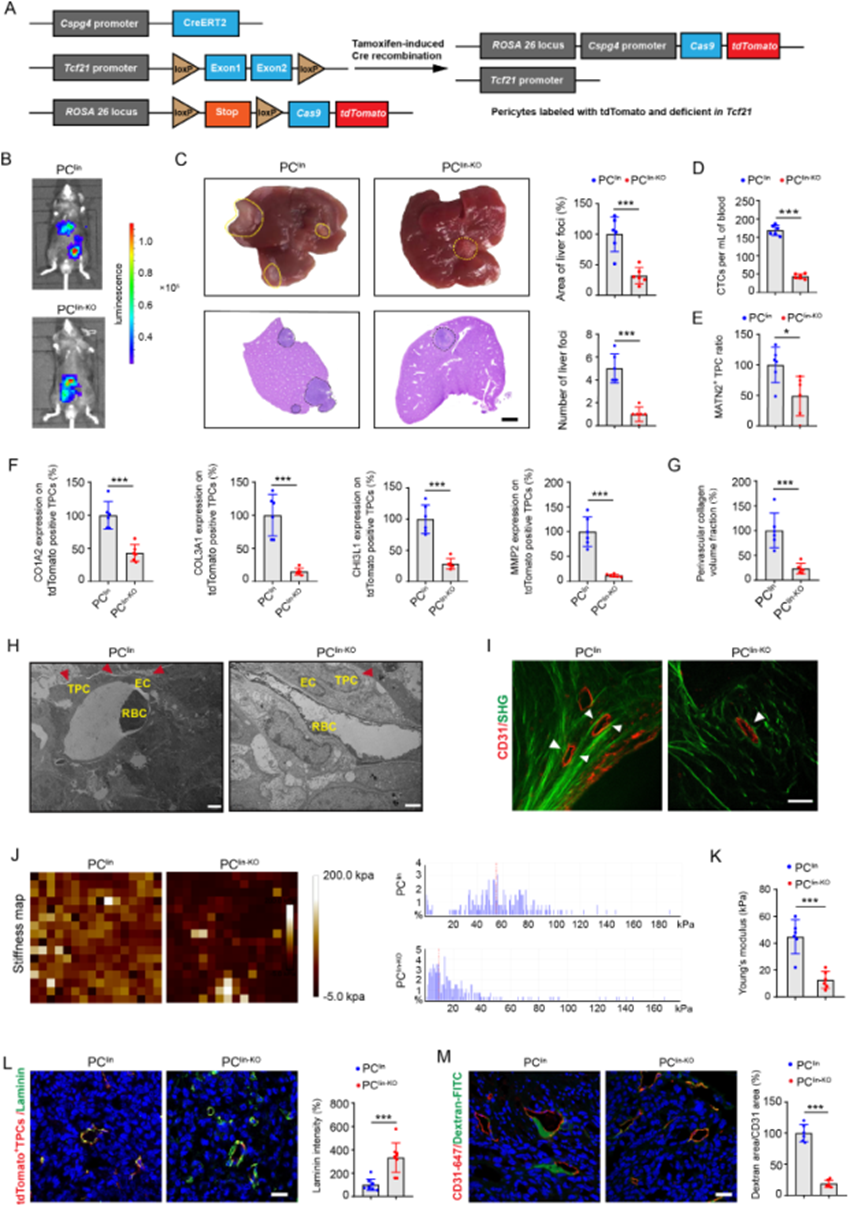
图4 周细胞特异性敲除Tcf21抑制血管周围ECM的重塑和CRC转移
5、缺失整合素α5减弱了TCF21启动子的DNA甲基化,并增加了TPCs中TCF21的表达
整合素是ECM成分的关键受体,起到机械传导作用,促进肿瘤转移。结果显示,在13个TPCs簇中,ITGA2、ITGA5和ITGB1在基质-外膜细胞中显著减少(图5A)。功能实验表明,整合素α5在mRNA和蛋白水平上负调控TCF21(图5B)。此外,整合素α5正调控TCF21 DNA的高甲基化,TPCs中整合素α5的丧失减弱了TPCs中TCF21启动子的DNA高甲基化(图5C)。
据报道DNMT1在肺癌中调节TCF21的DNA高甲基化。结果显示,整合素α5的敲除通过抑制FAK/PI3K/AKT通路减少了TPCNM中DNMT1的表达,而在TPCLM中整合素α5的过表达产生了相反的效果,这可以通过FAK抑制剂Y15逆转(图5D)。此外,Y15或DNMT抑制剂SGI1027都减少了DNMT1的表达,并抑制了TCF21的DNA高甲基化(图5E),随后在TPCLM ITGA5中增加了TCF21的表达(图5D)。这些结果表明,整合素α5的丧失通过抑制TCF21的DNA高甲基化上调了TPCs中的TCF21。
在通过注射HCT116-luc-LM3或DLD1-luc-LM3细胞和过表达或沉默整合素α5的TPCs生成的正位异位移植模型中,研究了TPCs中整合素α5对CRC转移的影响(图5F)。与TPCNM shNC相比,TPCNM shITGA5增加了肿瘤组织血管周围区域的胶原密度(图5G),并显著增加了肝脏转移灶的数量和面积(图5H)。相反,与TPCLM Vector相比,肿瘤细胞与TPCLM ITGA5的共注射显示了相反的效果(图5G、H)。这些数据表明,TPCs中整合素α5的丧失促进了CRC的转移。
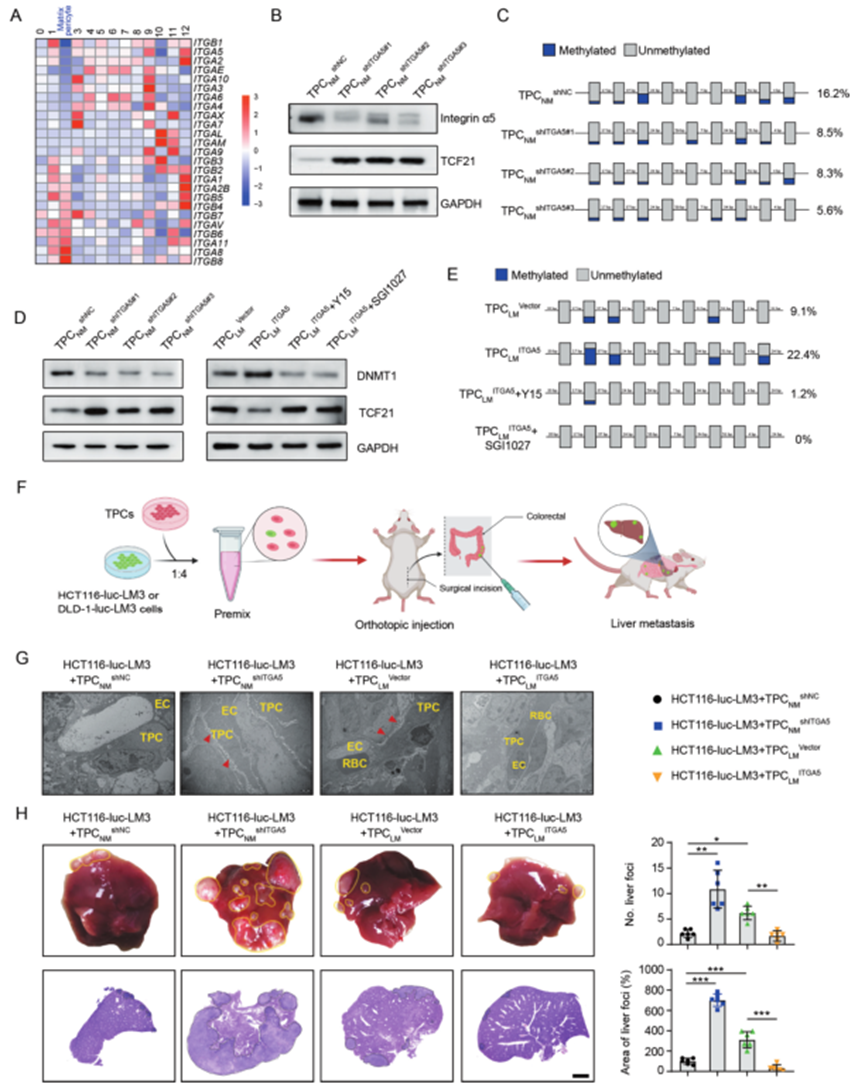
图5 整合素α5缺失可抑制TCF21启动子的高甲基化,上调TCF21在TPC中的表达
6、TCF21高表达的基质-外膜细胞与CRC患者的血管周围ECM重塑和肝转移相关
为确定上述发现是否适用于CRC患者,评估了具有和不具有肝转移的CRC患者的血管周围胶原沉积和排列情况。与没有肝转移的CRC患者相比,有肝转移的CRC患者的血管周围胶原丰度以及血管周围胶原纤维向径向排列的重新定向更为显著(图6A、B)。此外,与没有肝转移的CRC患者相比,有肝转移的CRC患者的血管周围区域的硬度显著增强(图6C、D)。此外,与没有肝转移的CRC患者相比,有肝转移的CRC患者的TPCs中COL1A2、COL3A1和CHI3L1的表达(图6E)以及参与基底膜降解的关键蛋白酶MMP2(图6F)的表达更高。相应地,与没有肝转移的CRC患者相比,有肝转移的CRC患者的TPCs中整合素α5的表达较低(图6G)。Pearson相关分析表明,TPCs中MMP2、COL1A2、COL3A1和CHI3L1的水平呈正相关,而TPCs中整合素α5的水平与TCF21高表达的TPCs比率呈负相关(图6E–G)。这些临床数据表明,整合素α5丧失导致TCF21的上调是血管周围ECM重塑和PMM建立的重要调节因子,从而促进CRC的转移。
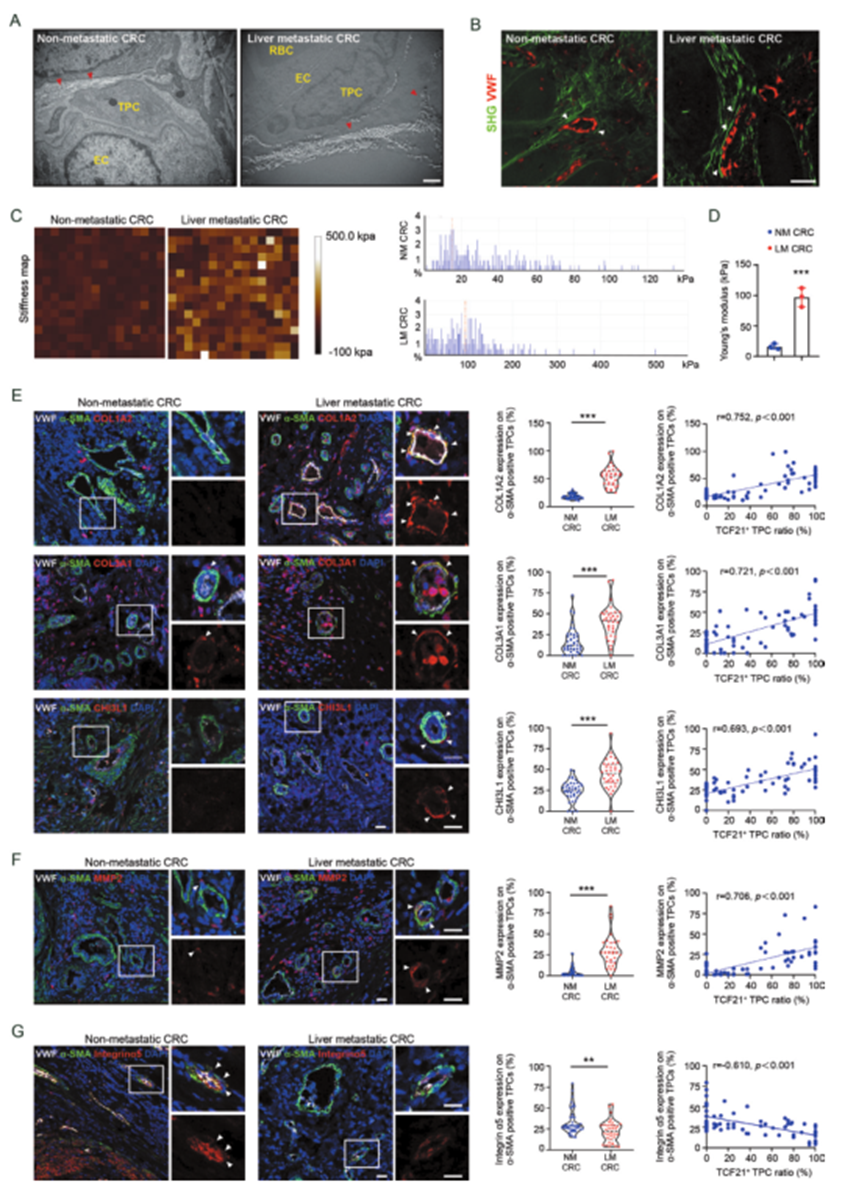
图6 基质周细胞中的TCF21与CRC患者原发性肿瘤血管周围ECM的重塑有关
实验方法:
细胞培养,人体样本的获取,小鼠模型,TPC细胞的分离和培养,scRNA-seq及其生信分析,重组细胞的构建,流式细胞术,细胞追踪,血管通透性实验,循环肿瘤细胞(CTCs)的分离和鉴定,染色质免疫沉淀(ChIP)和ChIP- seq,RT-qPCR,Y15和SGI1027处理,WB,免疫荧光,H&E染色,免疫组织化学和Masson染色,RNA测序,迁移和侵袭实验,胶原凝胶收缩试验,细胞增殖实验,粘附实验,管形成实验,透射电镜分析,二次谐波产生和双光子激发荧光(SHG/TPEF),原子力显微镜(AFM)测量,DNA提取和亚硫酸盐测序,器官型培养系统
参考文献:
Li X, Pan J, Liu T, Yin W, Miao Q, Zhao Z, Gao Y, Zheng W, Li H, Deng R, Huang D, Qiu S, Zhang Y, Qi Q, Deng L, Huang M, Tang PM, Cao Y, Chen M, Ye W, Zhang D. Novel TCF21high pericyte subpopulation promotes colorectal cancer metastasis by remodelling perivascular matrix. Gut. 2023 Apr;72(4):710-721. doi: 10.1136/gutjnl-2022-327913. Epub 2022 Sep 7. PMID: 36805487; PMCID: PMC10086488.






