NSUN2介导SLC7A11 mRNA的m5C修饰赋予子宫内膜癌铁死亡抗性
子宫内膜癌(EC)是世界范围内普遍存在的妇科恶性肿瘤,mRNA的5-甲基胞嘧啶(m5C)修饰是一种重要的表观遗传学修饰,与多种癌症的发展发生有关。然而,m5C修饰在EC中的确切功能仍然难以捉摸。本研究旨在研究主要m5C修饰因子NSUN2在EC中的表达和临床意义。作者的研究结果表明,KDM5A下调触发H3K4me3在启动子区的表观遗传增加,从而导致NSUN2在EC中显著上调。此外,功能获得和丧失实验揭示NSUN2增强了mRNA的 m5C修饰作用,从而促进EC细胞增殖。采用RNA亚硫酸氢盐测序和转录组测序来阐明NSUN2在铁死亡中的作用。随后的体外实验证实,敲低NSUN2显著上调EC细胞中脂质过氧化物和脂质ROS的水平,从而增强EC对铁死亡的易感性。从机制上讲,NSUN2促进SLC7A11 mRNA的m5C修饰,m5C阅读器YBX1通过其内部冷休克结构域(CSD)直接识别并结合SLC7A11 mRNA上的m5C位点,导致SLC7A11 mRNA稳定性增加和SLC7A11水平升高。此外,挽救实验表明,NSUN2对依赖SLC7A11的铁死亡具有抑制作用。总之,靶向NSUN2/SLC7A11轴通过增加体外体内EC细胞的脂质过氧化和铁死亡来抑制肿瘤生长。该研究为NSUN2的作用提供了新的见解,表明NSUN2可能是EC患者的预后生物标志物和治疗靶点。该研究于2023年11月发表在《Redox Biology》,IF 11.4。
技术路线:
主要研究结果:
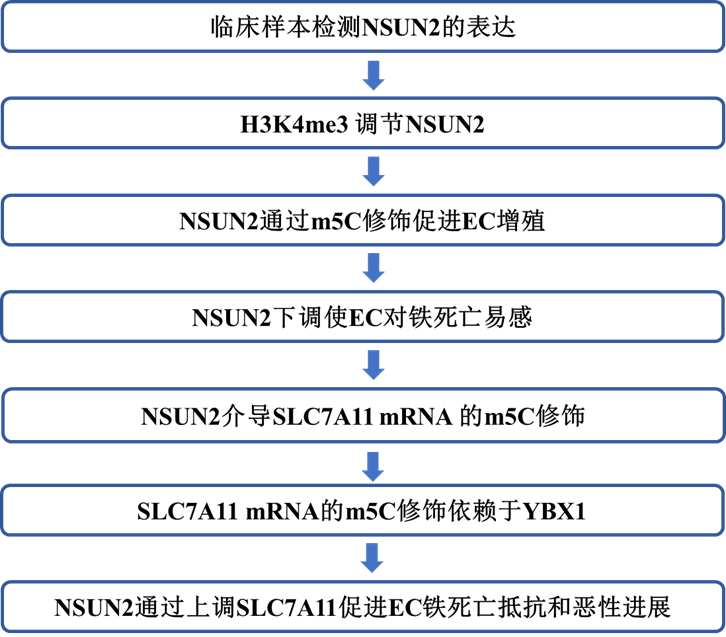
1 EC患者NSUN2表达升高与预后不良相关
为研究m5C修饰在EC进展中的潜在作用,作者初步分析了TCGA-UCEC数据集中关键m5C调控基因的表达。他们发现,催化mRNA m5C的NSUN2显著上调(图1A)。同时还在TCGA数据库中比较了配对EC组织和相邻正常组织中NSUN2的mRNA水平,结果表明NSUN2在EC中高表达(图1B)。此外,根据CPTAC的公开数据,发现EC中NSUN2蛋白表达高于正常子宫内膜组织(图1C)。使用RT-qPCR和蛋白质印迹来评估手术切除标本中NSUN2的mRNA和蛋白质水平,这证实了与正常组织相比,NSUN2在EC组织中过表达(图1D和E)。免疫组织化学显示,NSUN2在EC组织中高度表达,主要位于细胞核中(图1F)。通过分析临床病理因素评估NSUN2的预后意义,发现NSUN2在EC中的表达水平与FIGO分期、组织学分级和病理类型密切相关(图1G–I)。此外,NSUN2高表达的患者显示出更差的预后(图1J)。总之,这些发现表明NSUN2常在EC中上调,使其成为潜在的预后指标。
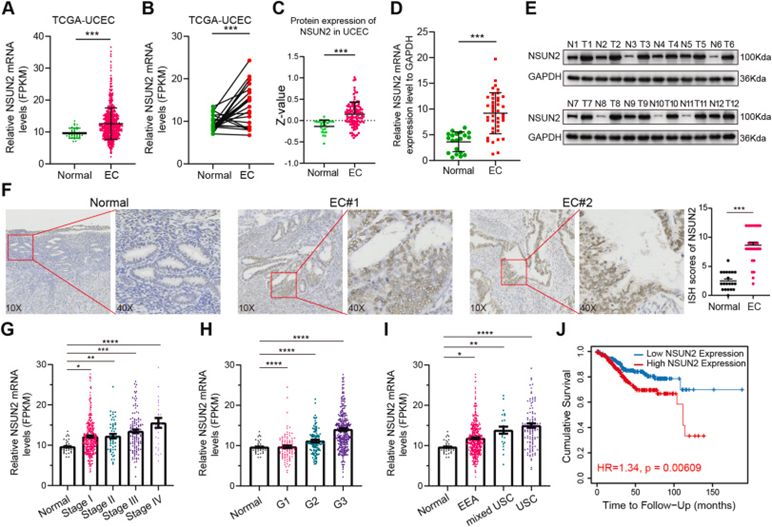
图1:NSUN2过表达预测子宫内膜癌预后不良
2 H3K4me3的表观遗传改变诱导NSUN2上调
组蛋白的翻译后修饰(PTM)在癌细胞基因表达的调节中发挥着重要作用。因此,使用WashU表观基因组浏览器和Cistrome数据浏览器来探索NSUN2是否受表观遗传学机制的调节,该机制发现H3K4me3在NSUN2的启动子区显著富集(图2A)。富含H3K4me3的基因启动子通常与转录激活有关,这表明升高的NSUN2可能受到组蛋白甲基化调节。此外,进行染色质免疫沉淀(ChIP)测定进一步测定EC细胞中的组蛋白甲基化水平,并且ChIP PCR结果表明组蛋白H3赖氨酸4(H3K4)三甲基化(H3K4me3)在NSUN2的启动子区显著富集(图2B)。为更深入地了解潜在机制,作者分析了TCGA-UCEC数据集中H3K4me3的赖氨酸甲基化酶和去甲基化酶的表达。研究结果表明,KDM5A表达减少可能是导致NSUN2启动子区H3K4me3水平升高的主要因素。然后使用siRNA技术敲低EC细胞中内源性KDM5A的表达,发现NSUN2的mRNA水平显著增加(图2C)。此外,蛋白质印迹结果还表明,敲低KDM5A导致NSUN2蛋白水平和H3K4me3水平增加,而过表达KDM5A产生相反的结果(图2D)。一致地,在KDM5A过表达的EC细胞中进行ChIP-PCR,结果表明KDM5A过表达导致NSUN2启动子区中H3K4me3富集显著降低(图2E)。类似地,作者还在Cistrome数据浏览器中的NSUN2启动子区发现KDM5A的富集,并且使用KDM5A抗体的ChIP PCR测定也证实KDM5A在EC中结合NSUN2的启动子(图2F和G)。此外,作者继续在EC细胞系中抑制KDM5A,并进CUT&Tag分析。研究结果表明,降低KDM5A水平可以增加H3K4me3在启动子区的积累(图2H)。此外,IGV图谱显示,在KDM5A敲低后,NSUN2启动子区中H3K4me3富集信号增强(图2I)。综上所述,以上结果进一步揭示了NSUN2的上调是由于KDM5A减少介导的H3K4me3增加而发生的。
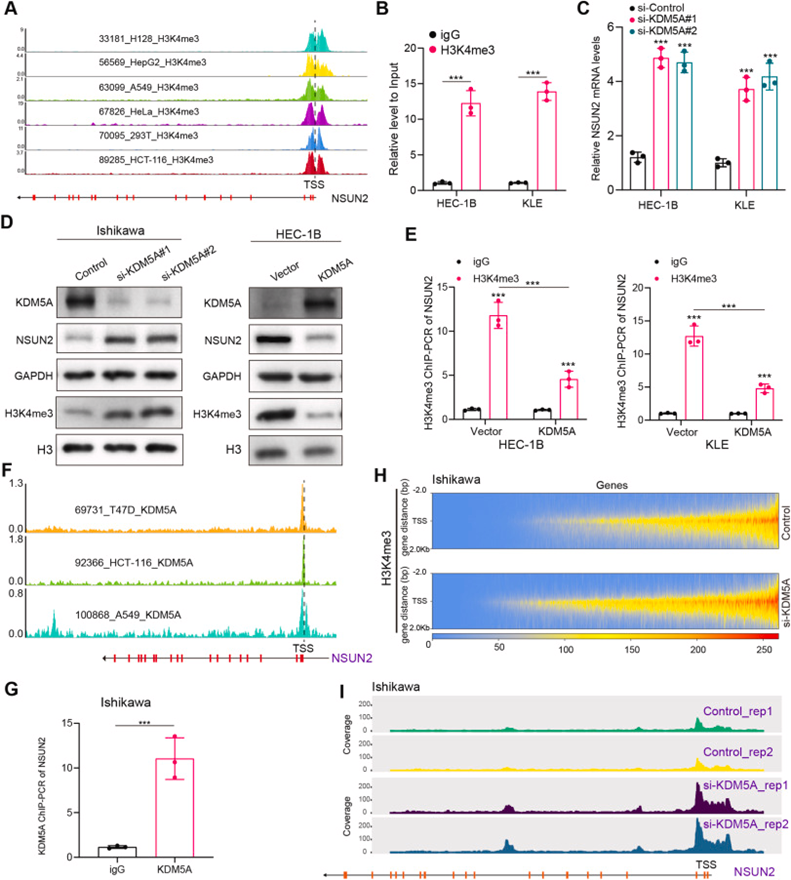
图2:NSUN2上调受H3K4me3表观遗传改变的调节
3 NSUN2在mRNA上沉积m5C并促进EC体外增殖
为进一步证明NSUN2对体内肿瘤进展的调节作用,作者评估了NSUN2在不同EC细胞系和正常子宫内膜(NE)中的mRNA和蛋白表达。与原代正常细胞相比,在癌症细胞系中观察到NSUN2水平增加(图3A和B),并选择HEC-1B、KLE和Ishikawa细胞系进行后续研究。使用shRNA敲低使HEC-1B和KLE细胞中的NSUN2沉默,并使用NSUN2表达载体在Ishikawa细胞中过表达NSUN2。从所示载体转染的三种EC细胞系中纯化mRNA,并用识别m5C的抗体进行点印迹分析,这表明NSUN2敲低导致m5C水平降低,而NSUN2过表达导致m5C mRNA水平增加(图3C)。随后,进行一系列实验来评估NSUN2对EC细胞增殖的影响,包括CCK-8、克隆形成和EDU测定。如图3D–F所示,NSUN2敲低有效抑制了HEC-1B和KLE细胞的增殖,而NSUN2的过表达促进Ishikawa细胞的增殖。
作为主要的mRNA m5C甲基转移酶,已证实NSUN2释放(半胱氨酸271)和催化(半胱氨酸321)位点的突变完全消除了其对mRNA m5C水平的调节作用。因此,作者构建了野生型和双突变体NSUN2过表达质粒,并将其转染到具有稳定敲低NSUN2的EC细胞中。与野生型NSUN2相比,突变体NSUN2未能恢复EC细胞的增殖能力。总之,这些结果表明NSUN2通过m5C修饰促进体外EC增殖。
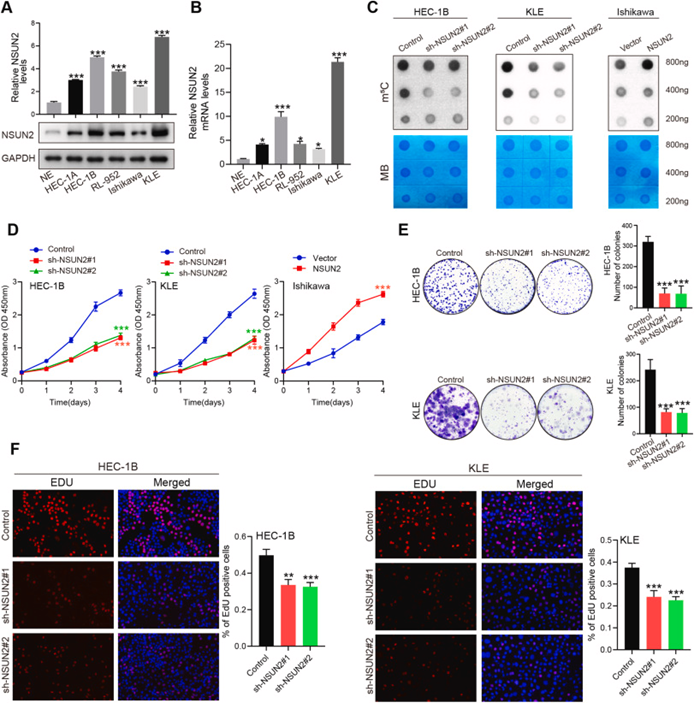
图3:NSUN2参与m5C水平的调节和EC细胞的增殖能力
4 NSUN2刺激EC中m5C的高甲基化
由于NSUN2是一种主要的mRNA甲基转移酶,对来源于对照或sh-NSUN2载体转染的HEC-1B细胞的mRNA进行亚硫酸氢盐测序(BS-seq)(图4A)。如图4B所示,NSUN2敲低导致m5C修饰位点显著减少。在使用WebLogo生成的可能序列背景中,观察到m5C位点下游C[A/C]GGG的频率更高(图4C)。绘制了HEC-1B mRNA上m5C位点的分布密度图,结果表明m5C位点位于编码区(CDS):5′UTR 和 3′UTR(图4D)。不同甲基化区域(DMRs)是样本之间甲基化水平存在显著差异的区域,可能在基因表达调控中发挥重要作用。使用Metylene软件,鉴定了对照组和NSUN2敲低组之间的差异甲基化修饰基因。显著DMR的临界值为|甲基化变化|>0.1和p<0.05(图4E)。在这些不同甲基化的基因中,有更多的基因在NSUN2敲低后甲基化水平降低了一个以上(图4F)。使用KOBAS3.0对不同甲基化的基因进行途径富集分析,并观察到氧化应激反应、铁死亡和铁摄取的显著富集(图4G)。
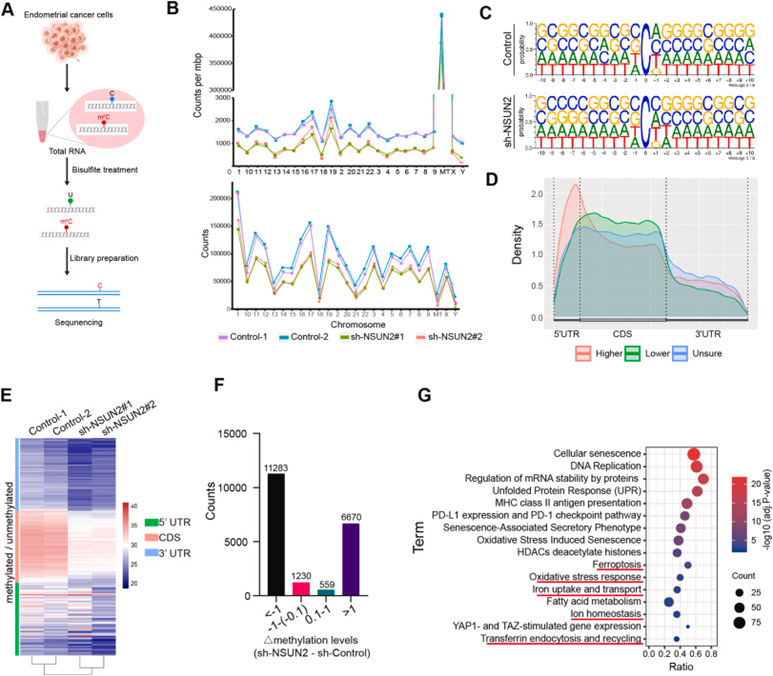
图4:NSUN2介导的m5C修饰mRNA调控的鉴定
5 NSUN2下调使EC对铁死亡易感
考虑到差异甲基化基因在铁死亡通路中富集,作者推测NSUN2可能参与EC铁死亡的调节。铁死亡的特征是由半胱氨酸缺失和大量脂质过氧化诱导的铁依赖性细胞死亡。在之前的研究中,作者发现EC细胞中存在显著的铁死亡抵抗,靶向铁死亡是EC的潜在治疗方法。在功能上,NSUN2敲低以浓度依赖的方式显著促进erastin诱导的细胞死亡(图5A和B)。值得注意的是,Fer-1是铁死亡的抑制剂,在NSUN2敲低的情况下抑制了erastin诱导的HEC-1B和KLE细胞中细胞死亡的增加(图5C和D)。这表明NSUN2参与EC细胞中铁死亡的调节。类似地,用erastin或DMSO处理EC细胞12小时,并进行活细胞或死细胞染色,这表明NSUN2敲低显著增加了erastin诱导的细胞死亡(图5E)。此外,相对的细胞内MDA浓度和脂质ROS水平表明,NSUN2敲低导致脂质过氧化和脂质ROS的程度显著增加(图5F和G)。透射电子显微镜(TEM)分析进一步显示,NSUN2敲低的EC细胞表现出典型的铁死亡形态学特征,包括线粒体萎缩和膜密度升高(图5H)。总之,这些观察结果支持NSUN2下调使EC对铁死亡易感。
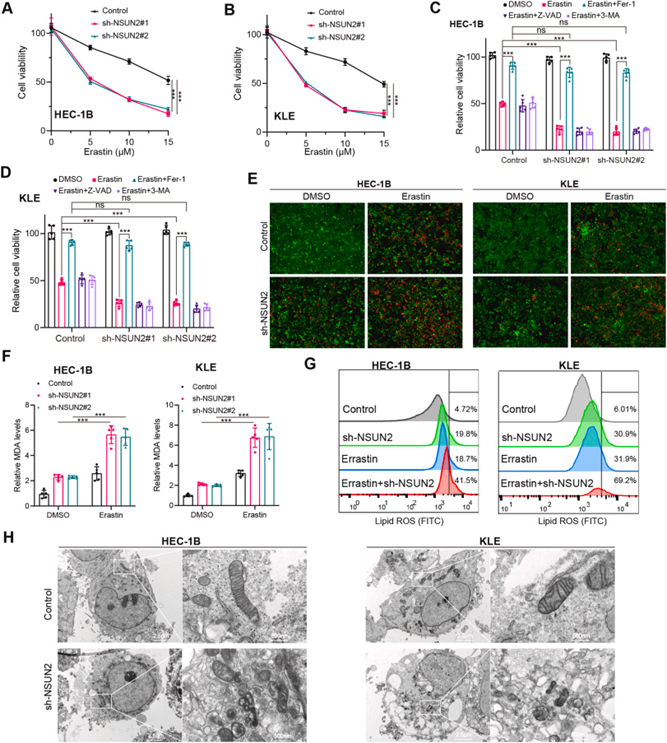
图5:NSUN2敲低促进EC铁死亡
6 NSUN2介导的SLC7A11 mRNA m5C修饰维持其稳定性
为探索NSUN2调节铁死亡的分子机制,作者分析了RNA亚硫酸氢盐和转录组测序数据,并鉴定了一系列RNA甲基化水平改变的铁死亡相关基因(图6A)。SLC7A11是HEC-1B细胞中NSUN2敲低后最显著下调的基因(图6B)。KLE细胞系中SLC7A11 mRNA水平在NSUN2敲低后显示出显著的降低(图6C)。此外,在HEC-1B和KLE细胞中,NSUN2敲低降低了SLC7A11蛋白水平。相反,Ishikawa细胞中NSUN2过表达显著增加SLC7A11蛋白水平(图6D)。为了研究NSUN2对SLC7A11的m5C修饰的潜在调节作用,作者使用野生型或双突变体NSUN2在Ishikawa细胞中进行过表达实验。研究结果表明,与野生型NSUN2相比,突变体NSUN2不能诱导SLC7A11蛋白水平的上调(图6E),表明SLC7A11的表达依赖于NSUN2调节的m5C修饰。为探索NSUN2是否与SLC7A11 mRNA直接相互作用,作者进行了RNA免疫沉淀(RIP)实验,然后进行RT-qPCR,并观察到相较于对照,NSUN2 RIP中SLC7A11 mRNA显著富集(图6F)。类似地,当NSUN2被敲低,SLC7A11 mRNA显示m5C修饰减少。然而,在NSUN2过度表达时,观察到SLC7A11 mRNA相反的趋势(图6G)。鉴于NSUN2敲低导致SLC7A11 mRNA和蛋白质水平降低,推断NSUN2通过促进m5C修饰增强SLC7A11 mRNA的稳定性。因此,用放线菌素D(一种转录抑制剂)处理EC细胞,发现NSUN2敲低后SLC7A11 mRNA的半衰期显著降低(图6H)。
SLC7A11是半胱氨酸和谷氨酸的反向转运蛋白,主要输入半胱氨酸用于谷胱甘肽生物合成和抗氧化防御。此外,SLC7A11的免疫组织化学染色图像显示,SLC7A12在EC中显著过表达(图6I)。此外,在TCGA UCEC数据集中,SLC7A11过表达,并且在mRNA水平上与NSUN2显著正相关(图6J和K)。
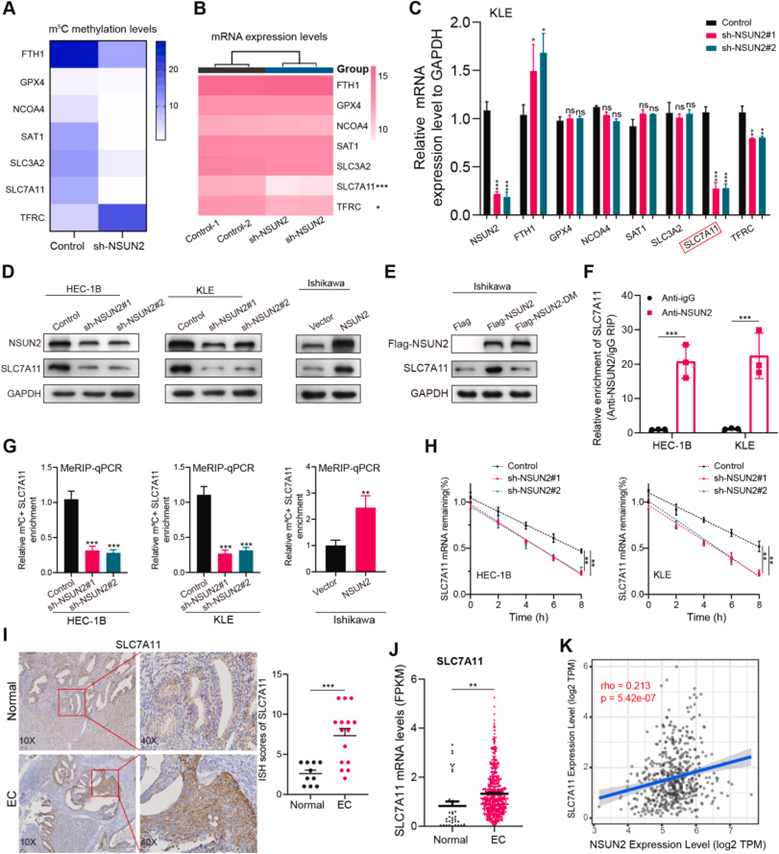
图6:NSUN2调节SLC7A11 mRNA的m5C修饰以提高其mRNA稳定性
7 SLC7A11 mRNA的m5C修饰识别和稳定性维持依赖于YBX1
先前已经表明,m5C读取器蛋白与mRNA上的m5C修饰位点结合,从而增强其稳定性。使用生物素化的SLC7A11或m5C-SLC7A11 RNA探针进行RNA pull-down,然后通过银染和质谱鉴定来检查特异性探针结合蛋白。m5C阅读器YBX1在RNA蛋白复合物中表现出显著富集(图7A和B)。结合蛋白质印迹和RNA pull-down提供了额外的验证,即与未修饰的探针相比,m5C修饰的SLC7A11探针表现出对YBX1的结合亲和力(图7C)。此外,HEC-1B和KLE细胞中YBX1敲低导致SLC7A11 mRNA和蛋白质水平降低(图7D和E)。此外,RNA稳定性测定还表明,YBX1敲低导致SLC7A11 mRNA稳定性降低(图7F)。接下来,作者使用YBX1抗体进行RIP,然后进行RT-qPCR。这意味着内源性YBX1与SLC7A11 mRNA结合(图7G)。YBX1的CSD负责识别和结合mRNA的m5C修饰位点,从而增强mRNA稳定性。为确定YBX1的CSD结构域是否对维持m5C修饰的SLC7A11 mRNA至关重要,构建了含有三个FLAG标记的、全长或CSD结构域缺失的YBX1表达载体,研究结果表明, CSD缺失的YBX1过表达不能上调SLC7A11的蛋白水平(图7H)。同样地,SLC7A11在全长YBX1-RIP中富集,但在CSD结构域缺失的YBX1-RP中不富集(图7I)。基于这些发现,YBX1似乎是一种m5C介体,通过m5C修饰稳定SLC7A11 mRNA。
免疫组化显示,与正常子宫内膜组织相比,YBX1在EC组织中频繁过表达,并且YBX1和SLC7A11的水平在人类EC组织中呈正相关(图7J和K)。在包括EC在内的大多数恶性肿瘤中,全癌水平的TIMER数据库分析揭示了YBX1和SLC7A11表达之间的正相关性。在TCGA UCEC数据集中,YBX1显著过表达,并与不良预后密切相关。CPTAC数据库还证实了子宫内膜癌组织中YBX1蛋白水平上调。
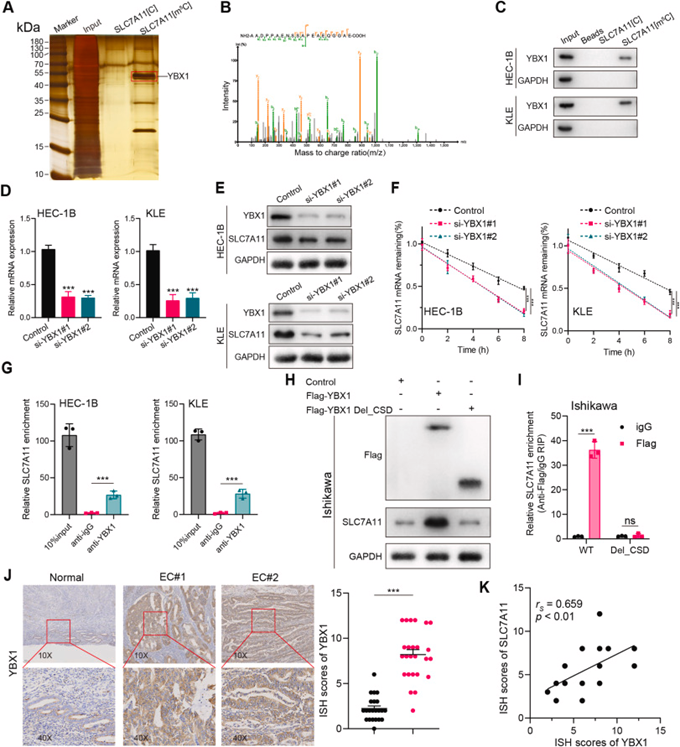 、
、
图7:YBX1识别SLC7A11的m5C修饰并稳定SLC7A11 mRNA
8 NSUN2通过上调SLC7A11促进EC的铁死亡抵抗和恶性进展
作者进行了一系列挽救实验,以阐明NSUN2是否通过介导EC中SLC7A11的m5C修饰来调节铁死亡。值得注意的是,在NSUN2敲低的HEC-1B和KLE细胞中SLC7A12表达恢复导致NSUN2基因敲低引起的SLC7A11下调逆转(图8A)。此外,SLC7A11部分逆转了由NSUN2敲低引起的生长抑制,它还挽救了由NSUN2敲低诱导的细胞活力下降和细胞死亡增加(图8B–D)。此外,SLC7A11有效降低了由NSUN2敲低触发的脂质ROS水平(图8E和F)。总之,作者的数据表明,NSUN2主要通过增强SLC7A11 mRNA的稳定性使EC细胞对铁死亡产生抗性,并进一步表明,靶向NSUN2/SLC7A111轴可能是EC的潜在有效治疗方法。
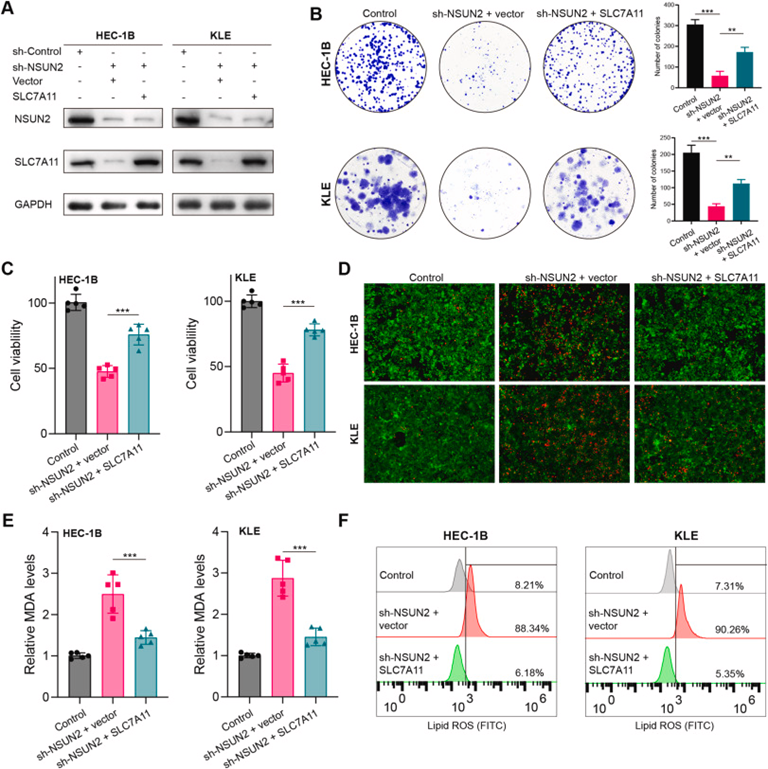
图8:EC中NSUN2通过SLC7A11依赖性机制促进肿瘤进展
9 SLC7A11对于NSUN2介导的EC细胞生长是必需的
为进一步证实NSUN2/SLC7A11轴在EC生长中的作用,使用用特定载体转染的HEC-1B细胞在严重免疫缺陷的雌性BALB/c裸鼠中建立皮下异种移植物肿瘤模型。与体外结果一致,SLC7A11修复显著逆转了NSUN2敲低诱导的异种移植物肿瘤生长抑制(图9A-C)。4-HNE的免疫组化用于评估异种移植物肿瘤中的脂质过氧化物水平。结果显示,由NSUN2敲低诱导的脂质过氧化增加被SLC7A11的表达部分挽救(图第9D段)。
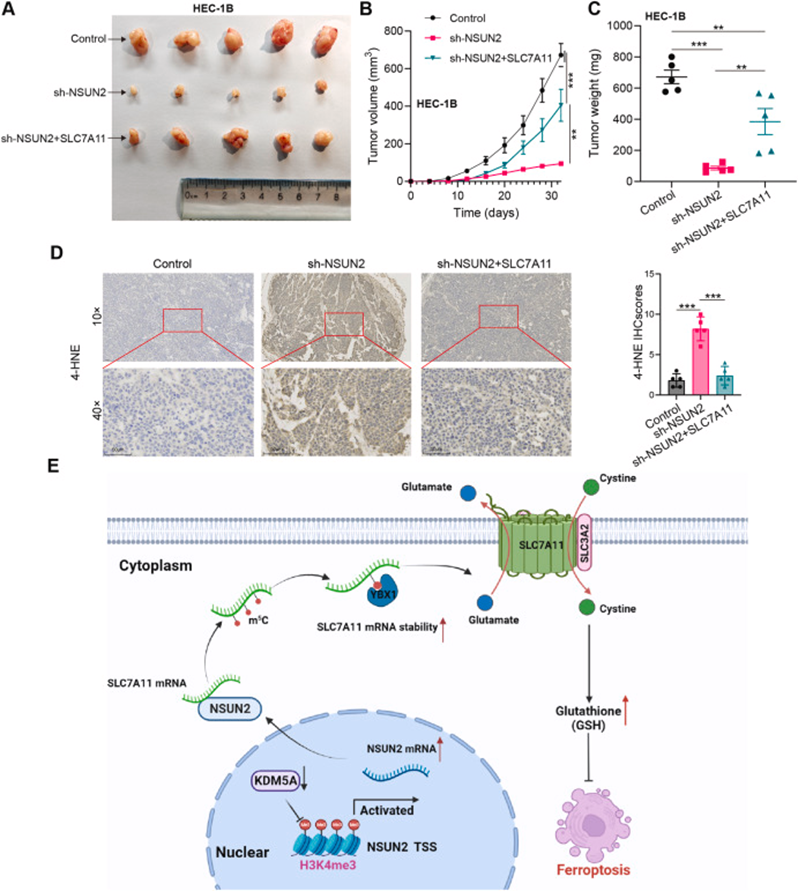
图9:体内NSUN2通过SLC7A11调节EC细胞铁死亡
结论:
本研究的一个重要发现是,EC中KDM5A表达降低导致NSUN2启动子区内H3K4me3甲基化升高,从而导致NSUN2转录激活。此外,NSUN2通过调节SLC7A11的m5C并以YBX1依赖的方式增强其mRNA稳定性,赋予EC细胞对铁死亡的抗性。体外和体内实验证实,靶向NSUN2/YBX1轴通过增强EC细胞中脂质过氧化和铁死亡来抑制肿瘤生长。这些结果为铁死亡调节机制提供了新的见解,并为EC患者的铁死亡治疗提供一种有前景的策略。
实验方法:
细胞培养,载体构建及细胞转染,RNA提取及RT-qPCR,Western blot, ChIP,CUT&Tag,RIP与m5C mRNA免疫沉淀,m5C的斑点印迹分析,RNA亚硫酸氢盐测序,RNA测序,RNA稳定性实验,RNA pull down,银染,质谱(MS)分析,透射电镜,肿瘤异种移植物模型,免疫组化,脂质活性氧(ROS)测量,细胞增殖和活力测定
参考文献:
Chen SJ, Zhang J, Zhou T, Rao SS, Li Q, Xiao LY, Wei ST, Zhang HF. Epigenetically upregulated NSUN2 confers ferroptosis resistance in endometrial cancer via m5C modification of SLC7A11 mRNA. Redox Biol. 2023 Nov 29;69:102975. doi: 10.1016/j.redox.2023.102975. Epub ahead of print. PMID: 38042059.






