藤黄酰胺抗胶质瘤机制:靶向WDR1依赖性的 细胞骨架重塑
胶质瘤是中枢神经系统最常见的原发肿瘤之一,主要起源于胶质组织。根据胶质瘤的病理分级,胶质母细胞瘤(Glioblastoma ,GBM)被归类为最恶性的级别(4级),高发病率和死亡率,预后不良。血脑屏障(Blood‒brain Barrier ,BBB)和胶质瘤干细胞(Glioma Stem Cells,GSCs)的存在是导致化疗治疗胶质瘤疗效有限的关键影响因素。因此,迫切需要探索能够跨越BBB并消除胶质瘤细胞(Glioma Cells,GCs)和GSCs的新化合物。本研究中作者筛选到了一种靶向GSC的小分子化合物,藤黄酰胺(Gambogic Amide ,GA-amide),穿透BBB并在肿瘤区域内显著富集。通过CRISPR、细胞热位移分析(CETSA)、药物亲和反应靶点稳定性(DARTS)、分子对接模拟等实验,确定GA-amide 的直接结合靶点WD重复域1(WD Repeat Domain 1 ,WDR1)。进一步的,作者研究了GA-amide的机制,阐明GA-amide通过与其直接功能靶点结合进而发挥抗胶质瘤作用。
该研究于2023年11月8日发表在《Signal Transduction and Targeted Therapy》,IF:39.3
技术路线
主要研究结果
1. 体外GA-amide特异性抑制GSCs和PDCs
首先,作者为了评估GA-amide在13个细胞系中的选择性,用不同浓度的GA-amide处理细胞后测定IC50。发现GA-amide特异性降低了胶质瘤相关细胞的活力,包括PDCs、GCs和GSCs,在其他癌症干细胞和非肿瘤细胞中GA-amide的IC 50值要更高,表明胶质瘤相关细胞对GA-amide处理更敏感(图1a)。此外,由于自我更新能力反映了GCs的干性特征,因此通过有限稀释法评估GA-amide预处理4小时后干性特征的变化。结果显示,PDCs(T2-4)和GSC2细胞的自我更新均受到抑制(图1b)。为了进一步评估GA-amide对PDCs和GSCs的影响,GA-amide预处理PDCs 4小时后收集细胞进行肿瘤成球实验,结果表明GA-amide停药后PDCs的球形成受到抑制,继发瘤球形成潜力降低(图1c)。收集并解离第二次球体形成实验的活细胞用于第三次肿瘤球形成实验,发现来自 T2-4和 T12-2 的第三次肿瘤球形成仍然受到抑制,表明GA-amide处理在第二次传代后也抑制肿瘤形成(图 1d)。鉴于GBM的高度侵袭性,作者用0.1μM和0.3μM的GA-amide处理PDCs和GSCs以评估细胞侵袭性,结果显示细胞数量显著减少(图1e)此外,用不同浓度的GA-amide处理 PDCs 4小时,收集并评估细胞凋亡,如图 1f 所示,GA-amide处理以剂量依赖性方式诱导 PDC 凋亡。
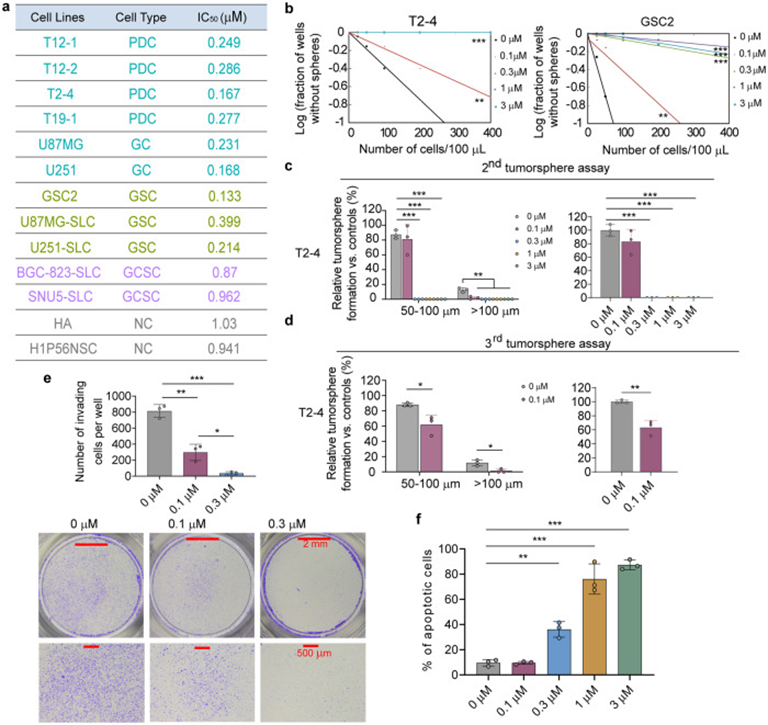
图1:GA-amide的体外抗肿瘤作用
2. GA-amide治疗表现出安全性和BBB通透性,并可特异性靶向肿瘤区域
替莫唑胺(Temozolomide,TMZ)是一种具有BBB渗透性的GBM标准治疗剂。作者建立U87MG-SLC 的颅内异种移植小鼠模型比较 TMZ 和 GA-amide的BBB通透性。在静脉注射GA-amide后仅2分钟浓度就达到了峰值174 ng/g组织,而且肿瘤区域的浓度至少是非肿瘤区域的两倍,这表明GA-amide特异性靶向肿瘤区域(图2a)。大脑的肿瘤区域和非肿瘤区域检测到的TMZ分布无明显差异(图2b)。GA-amide与TrkA在近膜区结合是GA-amide膜渗透所必需的,基于此,作者检查了TrkA在同一小鼠正常脑组织和胶质瘤组织中的表达。结果显示,分子量为140 kDa的糖基化TrkA在小鼠肿瘤组织中高表达,这有助于GA-amide的膜渗透(图2c)。作者还评估了TrkA在正常组织和不同等级的胶质瘤组织中的表达,发现TrkA在胶质瘤组织中表现出高水平的表达,而在正常脑组织中几乎检测不到(图2d)。这可能解释了GA-amide的肿瘤特异性富集,并表明TrkA高表达的患者可能对GA-amide处理更敏感。此外,细胞活力检测显示,GA-amide有效地降低TMZ耐药细胞如PDCs和GSCs的存活率(图2e)。作者建立胶质瘤皮下PDX模型,进一步确定GA-amide与TMZ-GAC的体内抗癌活性。荷瘤小鼠分为四个治疗组:对照组(载体)、GA-amide组、TMZ组和GAC组,观察到GA-amide、TMZ和GAC治疗组的肿瘤体积与对照组相比均有明显减少(图2f和2g)。
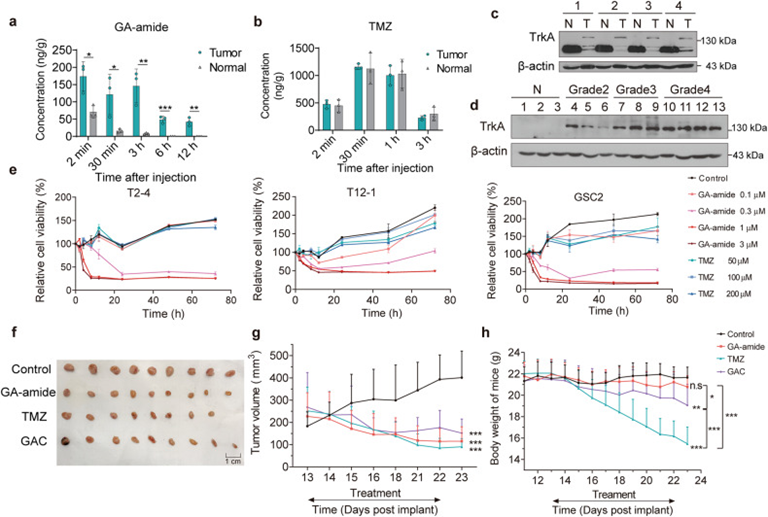
图2: GA-amide与TMZ的BBB通透性和抑癌能力比较
3. GA-amide抑制异种移植模型和转基因小鼠体内胶质瘤的生长
为了进一步阐明GA-amide在体内的作用,作者应用了注射GSC的皮下异种移植模型,其中GA-amide连续11天以2mg/kg的剂量给药,发现GA-amide的给药显著抑制了肿瘤的生长(图3a和3b)。进一步研究GA-amide对颅内异种移植模型的治疗作用,我们连续13天用GA-amide(1mg/kg)治疗携带GSC2的颅内异种移植物的裸鼠,发现GA-amide治疗的裸鼠表现出延长的存活时间(图3c),但实验组和对照组之间的小鼠体重没有显著差异(图3d)。此外,应用转基因小鼠模型作为原发性脑肿瘤模型来模拟原发性胶质瘤的特征,如图3e所示,小鼠大脑注射慢病毒以激活H-RasV12并沉默p53,注射12天后,根据磁共振成像(MRI)结果将小鼠随机分为GA-酰胺治疗组和对照组(图3f和3g)。GA-amide(1 mg/kg)治疗10天后通过MRI评估GA-amide的治疗效果,发现GA-amide治疗的小鼠的肿瘤小于对照小鼠(图3h和3i)。此外,构建颅内原位PDX模型(图3j)进一步评估GA-amide的体内功效,模型构建一周后小鼠随机分成对照和治疗两组进行MRI,发现各组肿瘤体积没有显着差异(图3k和3l)。GA-amide(1 mg/kg,静脉注射)治疗 10 天后进行 MRI 评估疗效,发现GA-amide治疗小鼠的肿瘤体积明显小于对照小鼠(图3m和3n)。
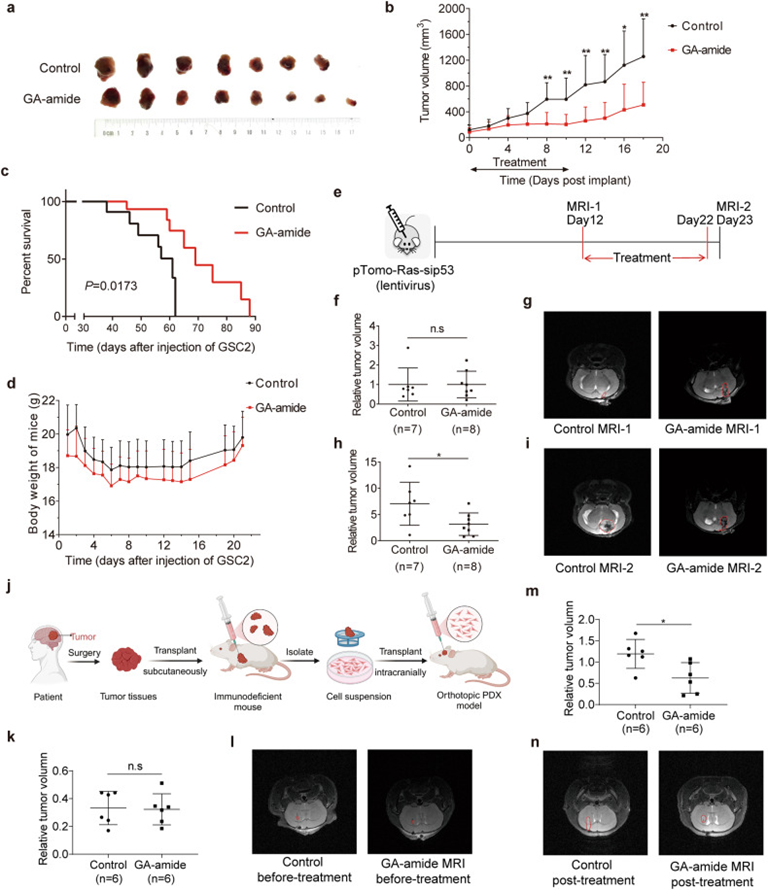
图3: GA-amide对胶质瘤干细胞衍生小鼠模型和转基因小鼠模型的抑制作用
4. CRISPR筛选鉴定PDCs中的GA-amide敏感基因
为了确定GA-amide的可药用靶点,作者使用高度优化的Brunello CRISPR sgRNA文库进行基因组规模的CRISPR筛选。筛选程序的流程图如图4a所示。慢病毒sgRNA文库成功转导的T2-4细胞用高剂量(LD80)GA-amide、低剂量(LD20)的GA-amide和二甲基亚砜(DMSO)处理21天,然后进行深测序和相关分析以发现sgRNA 的分布。图4b表明所有样品中约99.9%的sgRNA序列保留,这确保了CRISPR文库筛选的几乎完整的文库覆盖率。同时,第21天GA-amide处理组的sgRNA分布与DMSO处理组的sgRNA分布明显不同(图4c)。通过分析第21天对照组和高剂量GA-amide处理组的sgRNA,作者确定了1534个作为药物敏感基因的阳性富集基因(图4d);前10个基因如图4e所示。九象限图显示了与必需基因不同的前 5 个正选基因(图4f)。
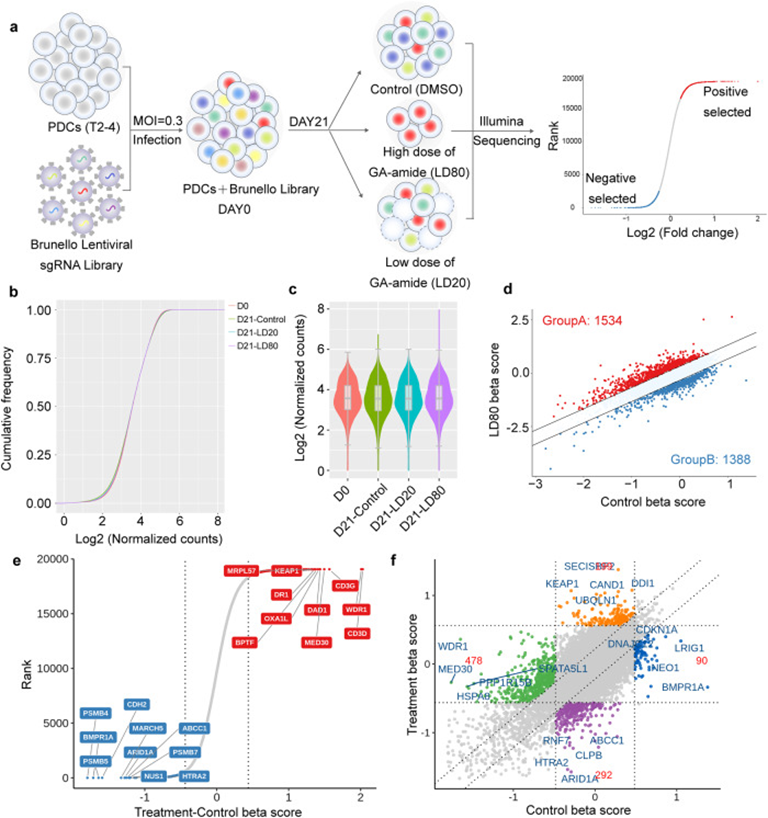
图4: 药物敏感基因的全基因组CRISPR/Cas9筛选
5. WDR1是GA-amide的药物靶点,可恢复PDCs中GA-amide的抑制作用
为了验证与GA-amide相互作用的候选基因中的药物靶点,作者应用了细胞热位移测定(CETSA)。对候选靶点的蛋白质印迹分析表明,在67°C-70°C用DMSO处理的细胞中,对应于WDR1的条带几乎完全消失,而用GA-amide处理的细胞中条带持续存在(图5a)。接下来,作者使用另一种靶点识别技术DARTS进一步研究药物与其靶点的接合。发现随着PDCs中GA-amide浓度的增加,WDR1的稳定性增加,表明GA-amide可以与WDR1结合(图5b)。为了进一步研究WDR1与GA-amide的特定相互作用位点,使用AutoDock进行了分子对接模拟,找到四个预测的结合位点:Lys-65、Asp-153、Arg-196和Gln-288。为了验证这一预测,构建了具有四个结合位点突变的mut-WDR1质粒,发现GA-amide处理细胞保护了wt-WDR1,但没有保护mut-WDR1(图5c)。为了探究哪个位点起关键作用,构建了单残基突变体WDR1质粒,结果表明,R196A-WDR1突变体中,GA-amide的保护减少,而其他残基的突变体仍然表现出GA-amide的保护。随后作者用过表面等离子共振(SPR)来量化GA-amide与WDR1的直接相互作用。纯化了包括四个相互作用位点的含WD2至WD7重复序列的His-WD2-7蛋白,SPR分析结果显示GA-amide和His-WD2-7之间存在强大的结合相互作用,KD为46.7μM(图5d)。在CRISPR/Cas9文库筛选的结果中,所有WDR1靶向的sgRNA都在高剂量GA-amide处理的T2-4细胞中显着富集,这意味着WDR1的丢失导致T2-4细胞对GA-amide处理的耐药性(图5e)。为了验证筛选结果们通过慢病毒转导文库中包含的sgRNA和对照sgRNA建立了WDR1敲除PDCs(图5f)。WDR1敲除细胞GA-amide处理后细胞增殖的抑制作用被减弱(图5g)。此外,体内实验还表明,GA-amide不能抑制注射WDR1缺陷U87MG-SLC细胞的小鼠肿瘤生长(图5h)。0.1μM和0.3μM GA-amide处理WDR1敲除PDCs,发现细胞侵袭的抑制作用几乎消失(图5i和5j)。上述发现揭示了WDR1是藤GA-amide的直接靶点,并且WDR1的缺失导致细胞对藤黄酰胺的抗性。
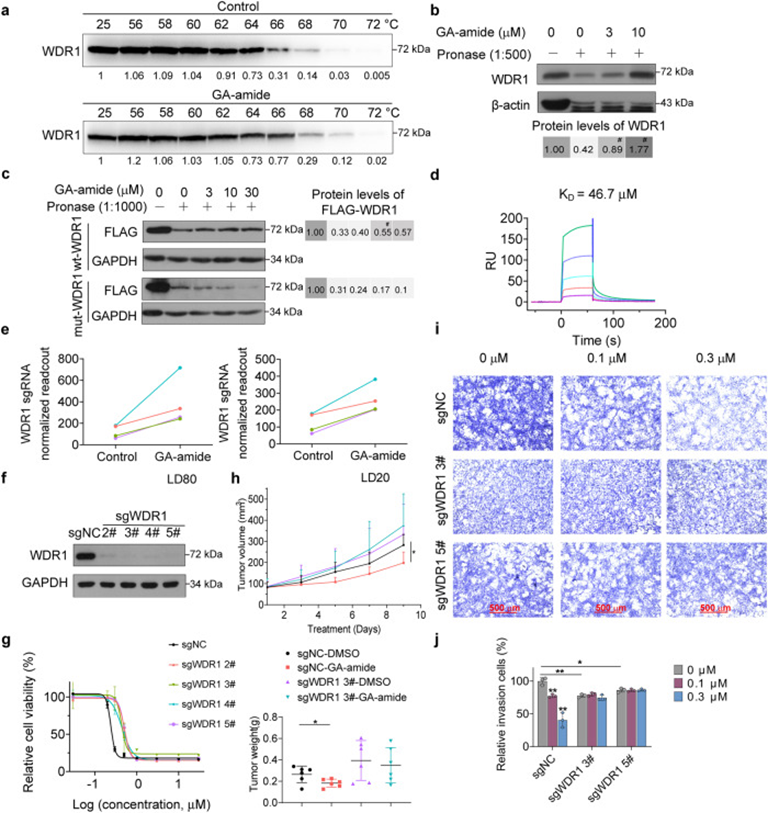
图5:WDR1是GA-amide的直接靶点
6. GA-amide与WDR1互作通过破坏细胞骨架稳态抑制PDC侵袭
为了探讨GA-amide抑制PDCs生长的机制,作者通过RNA测序(RNA-seq)进行了基因表达谱分析。GA-amide处理后,与对照相比,sg-WDR1细胞系恢复了1278个基因的上调和2799个基因的下调,因此这些基因被定义为恢复基因(图6a)。为了了解GA-amide通过WDR1调节的途径,KEGG分析发现TOP 20途径包括调节肌动蛋白细胞骨架和凋亡(图6b)。过表达WDR1的T2-4细胞进行免疫沉淀和质谱(IP-MS)实验,发现在GA-amide处理后,差异结合的蛋白质在肌动蛋白细胞骨架调节、迁移、侵袭和细胞连接等途径中富集(图6c)。与IP-MS分析结果一致,体外IP实验显示WDR1与肌球蛋白重链9(MYH9)、肌动蛋白和Coflin等细胞骨架蛋白之间的相互作用增强(图6d)。WDR1敲除细胞中发现细胞骨架的改变(图6e);GA-amide处理后在sg-NC细胞中观察到F-肌动蛋白水平的降低(图6f),在WDR1敲除细胞中没有观察到。
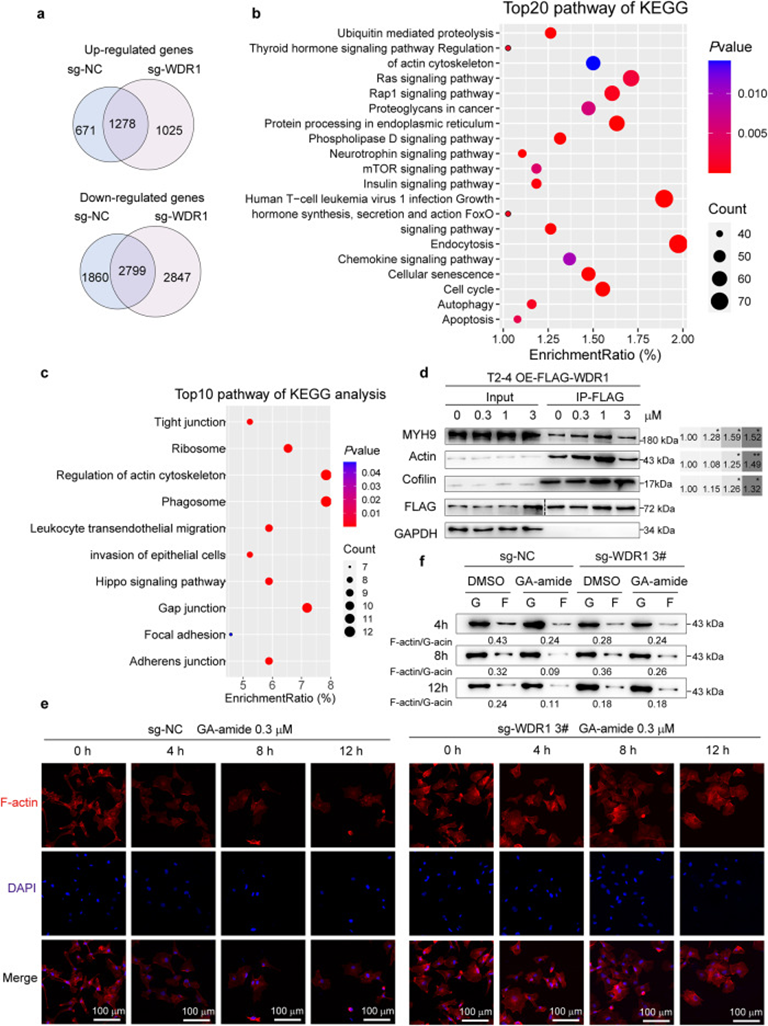
图6: GA-amide和WDR1的互作破坏细胞骨架以抑制细胞侵袭
7. GA-amide通过线粒体凋亡途径诱导GCs凋亡
WDR1敲除T2-4细胞后基因的KEGG富集分析,发现凋亡相关基因正富集(图7a)。为了证实WDR1可能在GA-amide诱导的凋亡中发挥作用的假设,用GA-amide或DMSO处理对照细胞和WDR1敲除PDCs,并测定细胞凋亡的百分比。发现GA-amide处理诱导对照T2-4细胞凋亡,但WDR1被敲除时,GA-amide诱导的凋亡被减弱(图7b)。CRISPR/Cas9筛选结果显示,线粒体家族中富集的药物敏感基因,特别是编码细胞色素C的细胞色素c体细胞(CYCS)和caspase 9(CASP9),在筛选中也正富集(图7c-e)。在GA-amide处理后,凋亡生物标志物PARP和caspase3水平增加,在WDR1敲除细胞中被逆转(图7f)。因此,作者进一步研究了GA-amide诱导凋亡的机制。GA-amide处理后,促凋亡蛋白Bcl-2-修饰因子(BMF) 和肌动蛋白的结合降低,在没有 WDR1 的情况下被逆转(图 7g)。从线粒体和细胞质中提取蛋白质后进行WB,观察到BMF、 BAX在细胞质水平上降低,GA-酰胺处理后在线粒体内的表达增加(图7h)。用相同浓度的GA-amide处理后,WDR1敲除细胞中线粒体细胞色素C释放到细胞质中的作用减弱(图7i)。
总的来说,作者认为GA-amide通过直接与WDR1结合促进细胞骨架的不稳定,导致与肌动蛋白结合的BMF的释放,从而使BMF易位到线粒体,触发BAX通道的开放和细胞色素C的随后释放,最终诱导细胞凋亡。(图7j)。
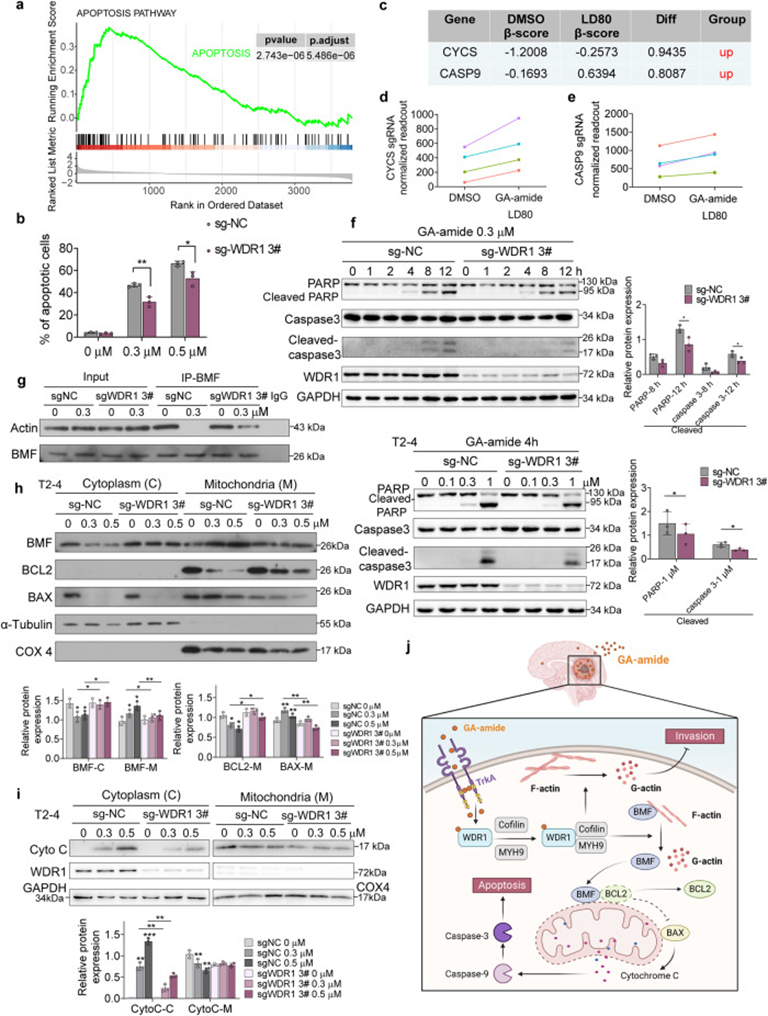
图7: GA-amide通过WDR1介导的线粒体凋亡途径诱导细胞凋亡
结论
本研究已证明GA-amide直接与其可药用靶点WDR1结合,从而抑制GCs侵袭和诱导WDR1介导的凋亡。具体而言,鉴于GA-amide的安全性、保护作用和生发效应,将GA-amide与放疗或化疗结合可能会提高疗效和减轻副作用,表明GA-amide作为胶质瘤治疗剂的临床潜力。值得注意的是,CRISPR/Cas9筛选中的阴性选择基因可能暗示了GA-amide联合治疗的可能方式。总之,本研究说明GA-amide是一种有前途的胶质瘤化疗新选择,并揭示了其抗癌机制。
实验方法
细胞培养,IC50化验,体外肿瘤球形成实验和有限稀释实验,细胞侵袭实验,蛋白质印迹分析,异种移植小鼠模型,血脑屏障通透性测定,全基因组CRISPR筛查,转染与感染,重组蛋白的表达和纯化,细胞凋亡检测,F-肌动蛋白的分离和检测
参考文献
Qu Jiaorong, Qiu Bojun, Zhang Yuxin et al. The tumor-enriched small molecule gambogic amide suppresses glioma by targeting WDR1-dependent cytoskeleton remodeling. [J]. Signal Transduct Target Ther, 2023, 8: 424.






