神经节苷脂GM3通过抑制血管平滑肌细胞铁死亡预防腹主动脉瘤
腹主动脉瘤(AAA)是一种潜在的危及生命的血管疾病,但目前缺乏经批准的药物治疗来防止AAA的进展和破裂。鞘脂代谢紊乱与AAA的发生发展相关,研究发现,神经节苷脂GM3(一种含唾液酸型鞘脂糖)对动脉粥样硬化具有保护作用,是AAA发生的重要危险因素;然而,GM3对AAA发展的潜在贡献尚未得到调查。作者进行了一项代谢组学研究,以评估人类AAA患者血浆中的GM3水平。作者通过Western blotting和免疫荧光染色分析了GM3合成酶(ST3GAL5)在小鼠动脉瘤模型和人类AAA组织中的表达。通过RNA测序、亲和纯化和质谱、蛋白质组学分析、表面等离子体共振分析和功能研究,解析GM3调控铁死亡的分子机制。作者在体内的平滑肌细胞(SMCs)中有条件地删除和过表达St3gal5,以研究其在AAA中的作用。作者发现,人类腹主动脉瘤患者的血浆GM3水平显著降低。腹主动脉血管平滑肌细胞GM3含量和ST3GAL5表达在腹主动脉瘤患者和腹主动脉瘤小鼠模型中降低。RNA测序分析表明,沉默ST3GAL5可诱导人主动脉平滑肌细胞发生铁死亡。作者发现GM3直接与TFR1(转铁蛋白受体1)的胞外结构域相互作用,并破坏其与全转铁蛋白的相互作用。TFR1是细胞摄取铁的关键细胞膜蛋白。SMC特异性St3gal5敲除加重了病变部位的铁沉积,显著促进了小鼠AAA的发展,而GM3补充抑制了脂质过氧化,减少了主动脉平滑肌细胞的铁沉积,显著降低了AAA的发病率。综上所述,GM3失调可促进AAA血管平滑肌细胞铁死亡,GM3可能成为治疗AAA的新靶点。本文于2023年11月发表于《Circulation》,IF:37.8,Q1。
技术路线:
主要实验结果:
1、GM3在人和小鼠腹主动脉瘤中表达下调
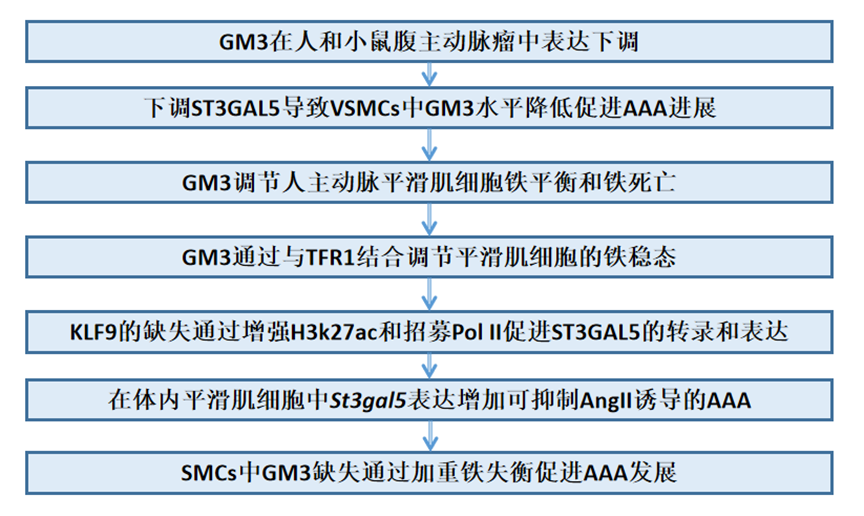
为了探讨AAA患者鞘脂水平的变化,作者采用液相色谱串联质谱(LC-MS/MS)对100名AAA患者和100名对照组的血浆进行了靶向代谢组学分析研究。正交偏最小二乘-判别分析的评分图表明,人AAA的鞘脂谱发生了显著改变(图1A),而投影评分图中的变量重要性确定GM3分子是导致组间差异的前3个变量(图1B)。进一步分析数据(热图和火山图)证实,GM3水平在AAA中显著降低(图1C和1D)。此外,GM3血浆浓度较低与AAA风险增加相关(图1E)。在100例AAA患者中,4种GM3类型(GM3 16:0、GM3 18:0、GM3 20:0和GM3 22:0)的水平显著低于100例对照(图1F)。作者还通过LC-MS/MS分析了GM3在AAA和AngII处理ApoE−/−小鼠模型中的水平。结果表明,AngII治疗小鼠的病变中GM3水平低于盐水治疗对照(图1G)。综上所述,这些数据表明GM3在人和小鼠腹主动脉瘤中表达下调,并且可能在腹主动脉瘤中起重要作用。
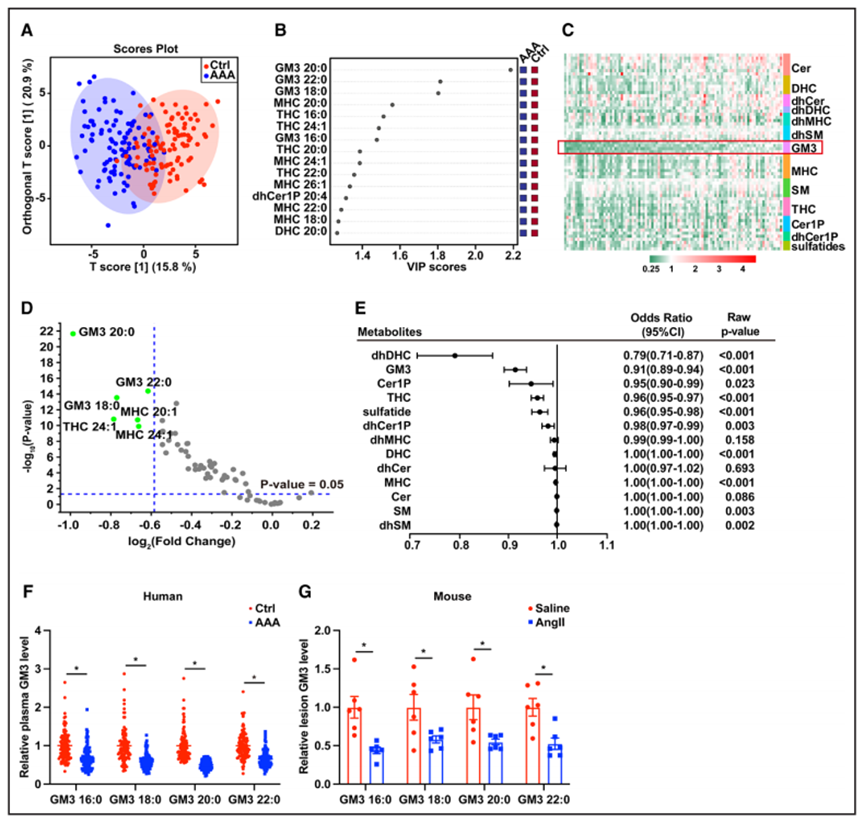
图1 AAA患者和小鼠AAA病变血浆中GM3水平降低
2、下调ST3GAL5导致VSMCs中GM3水平降低促进AAA进展
鉴于VSMC功能障碍是AAA的主要病理特征,作者进一步通过免疫荧光染色比较了AAA患者和小鼠模型腹主动脉VSMCs中GM3的含量。结果显示,腹主动脉瘤患者腹主动脉VSMCs的GM3水平显著降低(7倍),而接受AngII治疗的ApoE - / -小鼠腹主动脉GM3水平显著降低(5倍;图2A-2C)。这些结果证明VSMCs中GM3水平降低与AAA疾病进展密切相关。作者发现GM3降低了AAA发生率(图2D和2E)和弹性蛋白破裂程度(图2F)。这些结果表明,GM3可能对腹主动脉瘤有潜在的治疗作用。接下来,作者想研究可能导致GM3水平变化的酶。ST3GAL5将乳糖神经酰胺转化为GM3,而GM3可被ST8SIA1和B4GALNT1进一步催化,分别形成GM2和GD3(图2G)。作者的数据表明,ST3GAL5在人AAA组织和AngII处理的ApoE - / -小鼠主动脉动脉瘤的蛋白质水平显著下调(图2H和2I)。作者还发现,在AAA患者和小鼠AAA病变的VSMCs中,ST3GAL5水平显著降低(图2J-2L)。这些结果证实了ST3GAL5是GM3的关键酶调节因子,并在AAA进展中发挥重要作用。
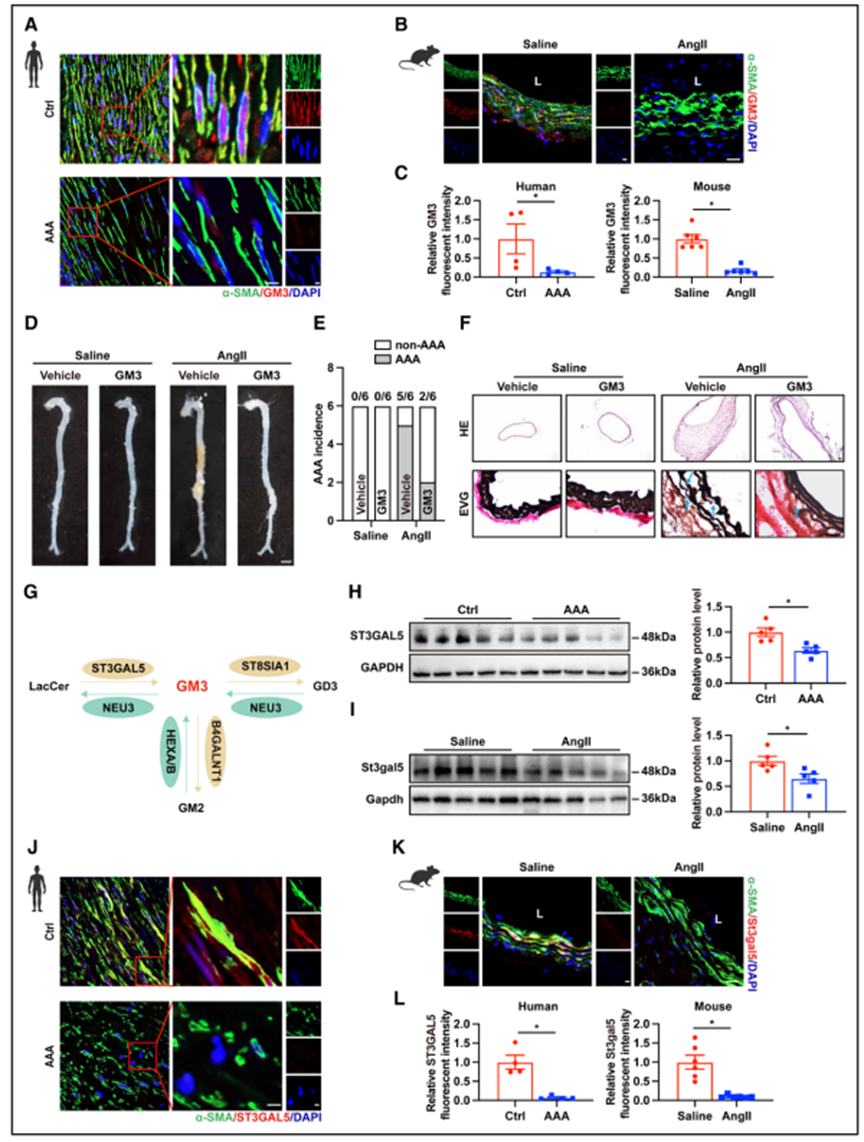
图2 T3GAL5在人和小鼠AAA中下调
3、GM3调节人主动脉平滑肌细胞铁平衡和铁死亡
为了了解GM3如何影响血管平滑肌细胞的细胞过程,作者对转染ST3GAL5 siRNA (siST3GAL5)或对照siRNA (siNC)的人主动脉平滑肌细胞(HASMCs)进行了RNA测序(图3A)。差异表达基因的KEGG通路富集分析突出了细胞衰老、细胞周期、自噬和铁死亡等细胞过程(图3B)。同时,感染siST3GAL5的HASMCs细胞死亡增加。只有铁死亡抑制剂ferrostain-1显著地抑制了ST3GAL5敲低引起的细胞死亡增加,而坏死、凋亡和自噬抑制剂necrostain-1、emricasan或氯喹均无这一作用(图3C),这意味着GM3主要影响HASMC铁死亡。这些结果表明,铁死亡的过程,包括铁超载,SMC谷胱甘肽消耗和脂质过氧化,在AAA的发展过程中发生。
同样,沉默ST3GAL5的HASMCs表现出明显的铁死亡特征。相对于对照细胞的水平,在siST3GAL5转染细胞中,脂质活性氧(ROS)生成、丙二醛生成、细胞内总铁和Fe2+显著增加,而谷胱甘肽水平显著降低(图3D-3I)。接下来,由于研究发现ST3GAL5敲除可诱导HASMCs发生铁死亡,因此作者研究了ST3GAL5过表达在铁死亡诱剂咪唑酮抹去素处理的HASMCs中减轻铁死亡的能力。正如预期的那样,ST3GAL5过表达显著抑制了咪唑酮抹去素诱导的细胞死亡(图3J和3K)。ST3GAL5过表达还部分阻断了咪唑酮抹去素诱导的脂质ROS生成增加、丙二醛生成和铁负荷增加,以及谷胱甘肽水平降低(图3L-3Q)。值得注意的是,在基础条件下,ST3GAL5过表达对HASMCs中的谷胱甘肽和丙二醛水平、脂质ROS生成或死亡没有影响(图3J-3N),但总铁和Fe2+被轻度下调(图3O-3Q)。因此,作者推测GM3缺失可能通过影响平滑肌细胞的铁沉积来诱导铁死亡。总之,这些数据表明,GM3主要通过铁死亡介导的机制影响SMC的死亡。
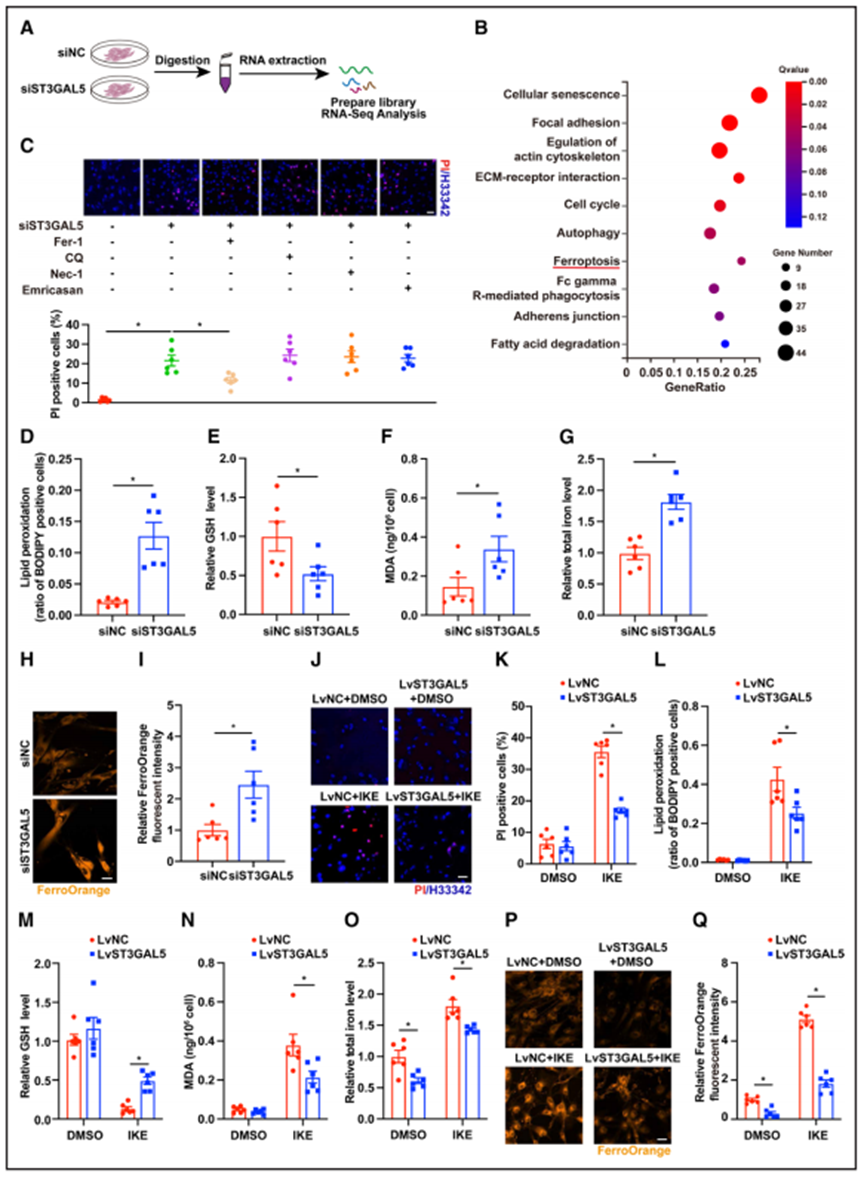
图3 GM3调节HASMCs的铁死亡
4、GM3通过与TFR1结合调节平滑肌细胞的铁稳态
在确定GM3影响平滑肌细胞的铁水平后,作者研究了GM3是否影响细胞外不稳定铁的水平。不稳定铁池被认为是由受细胞铁稳态调节的松散结合的氧化还原活性铁组成的细胞质区室。高水平的不稳定铁已被证明会促进氧化应激。用钙黄绿素- AM(与铁结合后淬灭的荧光探针)通过流式细胞术分析HASMCs中不稳定的铁。敲低ST3GAL5导致的GM3缺失导致不稳定铁池显著增加,而这种作用被GM3的加入所缓解;此外,ST3GAL5过表达显著减少了不稳定铁池(图4A)。接下来,作者探索了GM3影响细胞内铁含量的机制。GM3是一种细胞膜脂质,由位于细胞膜外叶的脂质部分和突出于细胞外间隙的碳水化合物链组成。因此,GM3已被证明与膜受体结合并影响受体信号传导。作者推测GM3与某些膜蛋白的结合可能直接或间接影响细胞内的铁含量。为了确定HASMCs中潜在的结合伴侣,作者使用亲和链霉亲和素T1珠粒将与生物素标记的GM3结合的蛋白拉下来,并进行蛋白质组学分析(图4B和4C)。在筛选出的15个GM3相互作用的候选膜蛋白中(图4D),TFR1可能与GM3对细胞内铁含量的影响有关。质膜上的全转录因子与TFR1结合,然后通过核内体内化,介导了细胞外铁的转运进入细胞。表面等离子体共振分析表明GM3和TFR1胞外结构域之间存在相互作用(图4E)。作者还发现,GM3水平降低(在ST3GAL5敲低的细胞中)显著增强了细胞的铁摄取,而补充GM3后,细胞的铁摄取受到抑制(图4F)。竞争性表面等离子体共振实验证实,GM3抑制了全转录因子和TFR1胞外结构域的结合(图4G)。此外,流式细胞术分析链霉亲和素/FITC与生物素-全转录因子的结合表明,GM3的缺失导致全转录因子和TFR1的结合增加,主要在细胞膜上;添加GM3逆转了这一增加(图4H)。邻近实验显示,在ST3GAL5敲低的细胞中,TFR1和全转录因子进入细胞的转运显著增加(3倍)。将GM3重新引入这些细胞可抑制上述增加(图4I和4J)。与这些发现一致,GM3水平降低促进了TFR1与核内体调节因子RAB5的结合,导致含铁的核内体囊泡形成增加(图4K和图4L)。TFR1敲低恢复了siST3GAL5的作用,包括降低脂质ROS水平,以及增加细胞死亡、总铁和Fe2+水平(图4M-4P)。因此,作者得出结论,GM3通过干扰TFR1和holo- Tf之间的相互作用在铁的转运中发挥重要作用。
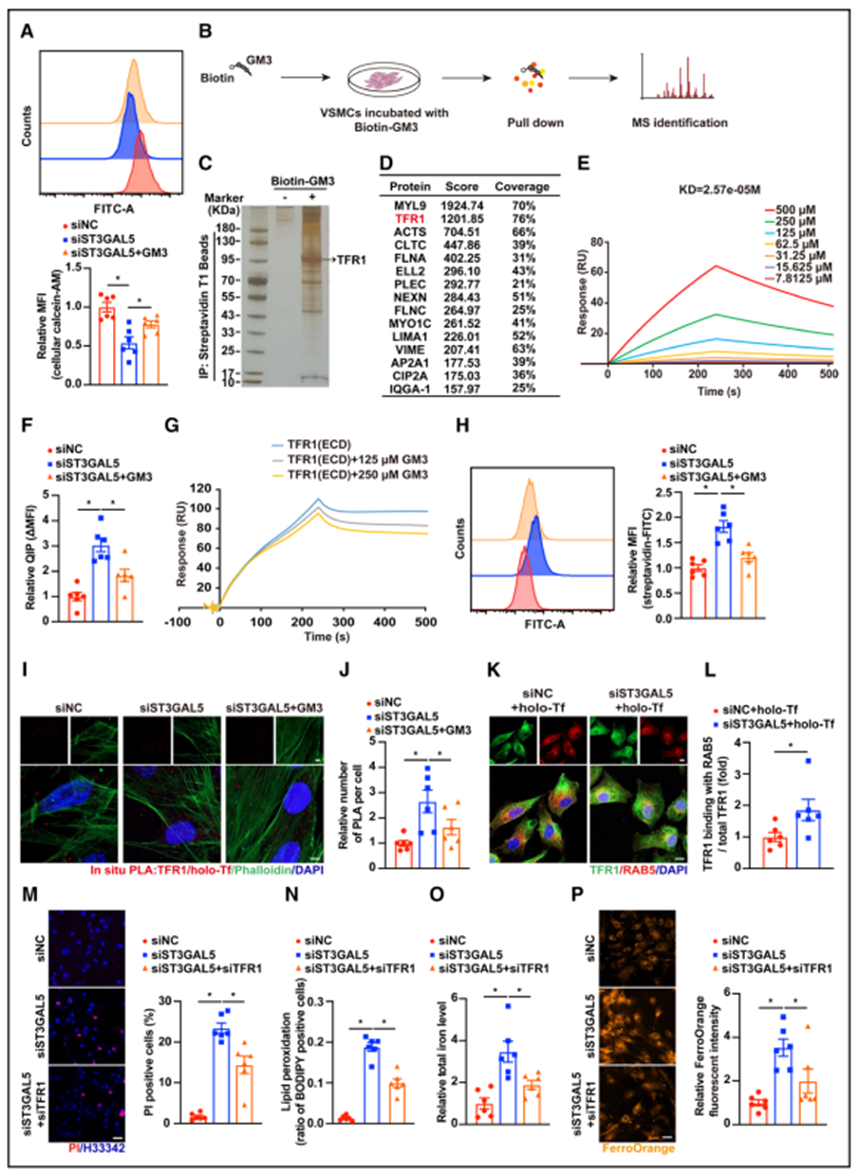
图4 低GM3水平通过增强TFR1和holo-Tf相互作用诱导铁摄取增加
5、KLF9的缺失通过增强H3k27ac和招募Pol II促进ST3GAL5的转录和表达
在阐明了GM3在铁转运中的作用后,作者进一步探索了ST3GAL5改变AAA的潜在机制,如转录因子的调节。H3K27ac (HiChIP)监管相互作用数据库(GEO;https://ncbi.nlm.nih.gov/geo/)揭示了HASMCs中ST3GAL5启动子和远端增强子之间的相互作用(图5A和5B)。Ma等人最近通过H3K27ac HiChIP数据库发现了KLF家族转录因子在AAA中的关键作用。值得注意的是,作者发现KLF家族转录因子KLF5、KLF6、KLF9、KLF10、KLF11和KLF16的推测结合位点位于ST3GAL5启动子/增强子(GeneCards数据库;https://genecards.org/cgi-bin/carddisp.pl?gene=ST3GAL5)。定量聚合酶链反应分析表明,KLF9(一个众所周知的转录抑制因子)的敲低诱导ST3GAL5 mRNA水平显著增加。相反,敲低其他5个KLF家族成员对ST3GAL5的转录没有影响(图5C)。染色体构象捕获聚合酶链反应分析显示,siKLF9增强了ST-3GAL5的启动子和增强子区域之间的相互作用(图5D)。接下来,作者通过CUT&RUN qPCR分析KLF9敲低后ST3GAL5调控区域中KLF9顺式结合位点的变化。结果表明,转染siKLF9后,KLF9与ST3GAL5的启动子和增强子区域的结合显著减弱,同时H3K27ac和Pol II结合显著富集(图5E-5G)。总之,这些数据提示,KLF9通过阻碍H3k27ac修饰和Pol II募集来抑制ST3GAL5的近端启动子和远端增强子之间的相互作用(图5H)。细胞中KLF9敲低也诱导ST3GAL5蛋白水平显著增加(4倍;图5I和5J)。与这些发现一致,作者发现在AngII诱导的小鼠腹主动脉病变(图5K)和人类AAA患者的主动脉平滑肌细胞(图5L和图5M)中,KLF9蛋白水平显著升高。因此,作者的数据表明KLF9抑制ST3GAL5在AAA中的表达。
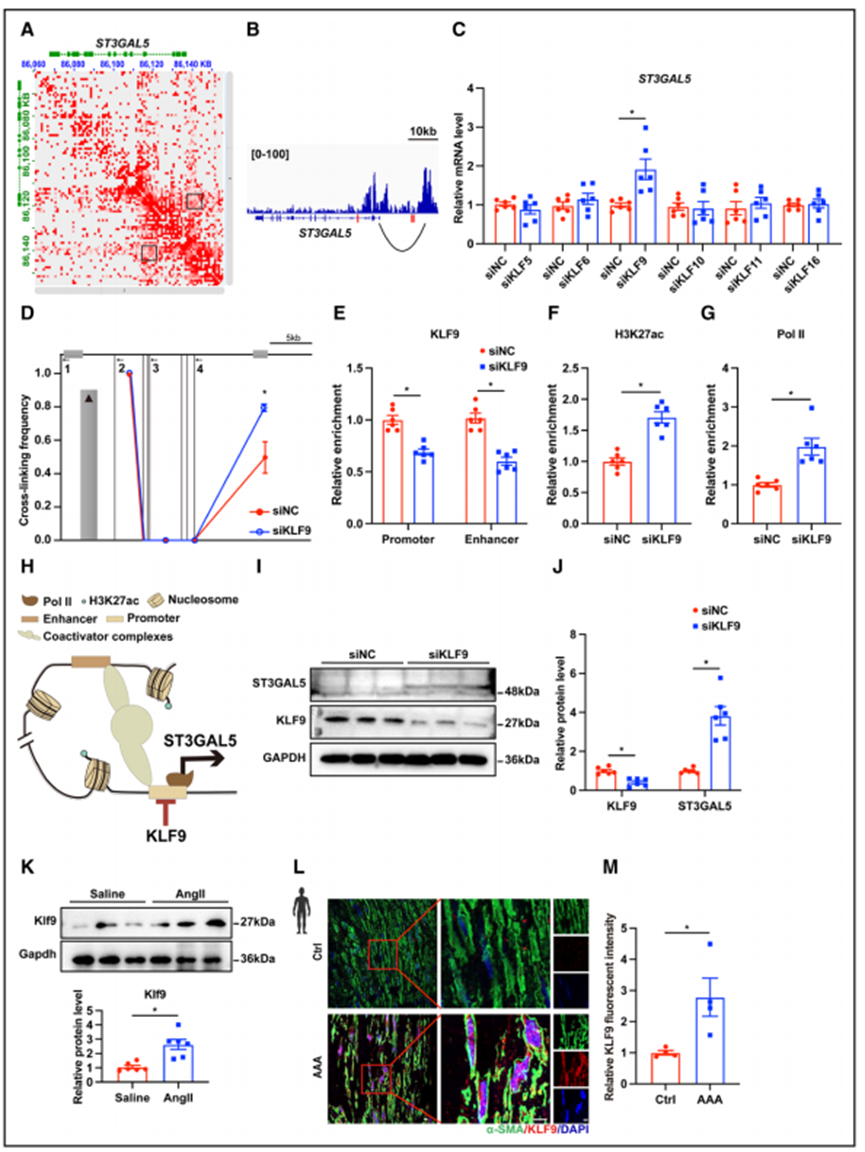
图5 KLF9在AAA中表达上调,KLF9敲低可通过增加增强子-启动子相互作用促进ST3GAL5转录
6、在体内平滑肌细胞中St3gal5表达增加可抑制AngII诱导的AAA
为了探索GM3对体内AAA的治疗潜力,作者使用腺相关病毒St3gal5 (AAV-St3gal5)或腺相关病毒增效绿色荧光蛋白(AAV-EGFP)感染ApoE - / -小鼠的肾上腹主动脉节段30日(通过外膜周给药),之后输入AngII 28日(图6A)。在感染AAV-St3gal5或AAV-EGFP的盐水输入小鼠中,未发生AAA(图6C)。相反,在输入AngII的小鼠中,与AAV-EGFP组相比,AAV-St3gal5组的生存率较高,AAA发生率和最大腹主动脉直径较低(图6B-6E)。病变的组织学分析显示,在接受AngII治疗的AAV-St3gal5组中,Elastica van Gieson染色显示弹性蛋白降解减少(图6F和6G),柏林蓝染色显示铁蓄积显著减少(图6F和6H)。在AngII处理的AAV-St3gal5组中,VSMCs中的Gpx4表达也显著增加,而4-羟基壬烯醛水平显著降低(图6I和图6J)。这些结果表明,GM3通过稳定AAA细胞内铁水平和减少脂质过氧化来保护VSMCs。
血压是腹主动脉瘤发病的重要危险因素。例如,一项研究分析了13年期间的605例腹主动脉瘤患者,结果显示高血压与腹主动脉瘤的发生密切相关。本研究表明VSMCs中St3gal5过表达可能通过减轻铁死亡减轻小鼠AAA的发生和发展,而不是影响血压。
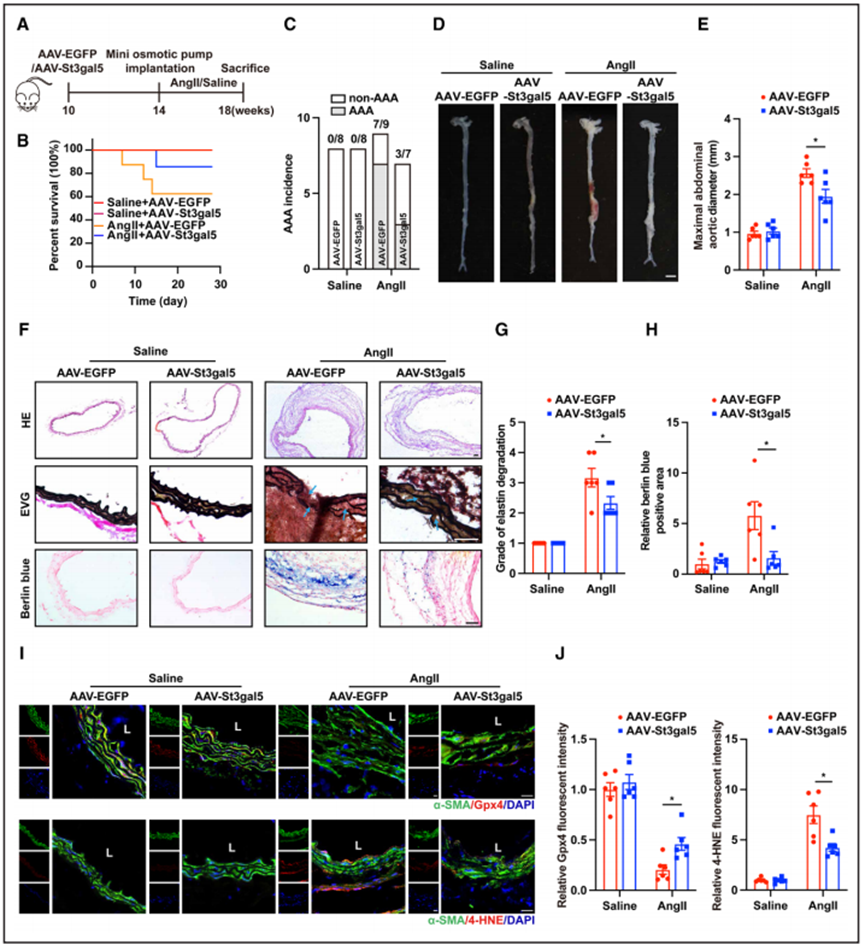
图6 VSMC特异性过表达St3gal5可减弱AngII诱导的小鼠AAA形成
7、SMCs中GM3缺失通过加重铁失衡促进AAA发展
为了进一步探索GM3在AAA平滑肌细胞内铁稳态维持中的作用,作者通过将St3gal5flox/flox ApoE−/−小鼠(St3gal5fl/fl ApoE−/−)与Myh11-CreERT2 ApoE−/−小鼠杂交,产生了平滑肌特异性St3gal5敲除ApoE−/−小鼠(St3gal5SMKO ApoE−/−)。作者使用他莫昔芬诱导产生的St3gal5SMKO ApoE - / -小鼠,然后输入AngII/生理盐水(图7A)。在连续28日输入AngII的St3gal5fl/fl ApoE−/−小鼠中,约60%发生AAA,而在输入AngII的St3gal5SMKO ApoE−/−小鼠中,>80%发生AAA。此外,St3gal5fl/fl ApoE−/−和St3gal5SMKO ApoE−/−血管灌注小鼠分别表现出20%和37.5%的不同死亡率(图7B和7C)。离体分析和超声数据证实,在输入AngII的St3gal5SMKO ApoE - / -小鼠中,最大主动脉直径显著增加(图7D, 7E)。在St3gal5SMKO ApoE−/−小鼠的病变中,弹性蛋白降解水平显著高于St3gal5fl/fl ApoE−/−小鼠的病变(图7F和7G)。此外,与接受AngII治疗的St3gal5fl/fl ApoE−/−小鼠的病变相比,St3gal5SMKO ApoE−/−小鼠的病变中有较多的铁蓄积(图7F和7H),同时伴有VSMCs中4-羟基壬烯醛水平显著升高(图7I和7J)。最后,尽管两个AngII治疗组之间的Gpx4水平无显著差异,但在盐水输入的St3gal5SMKO ApoE - / -组中,Gpx4水平显著降低(图7I和7J)。综上所述,这些体内实验结果支持GM3在调节AAA中VSMC铁死亡的关键作用。
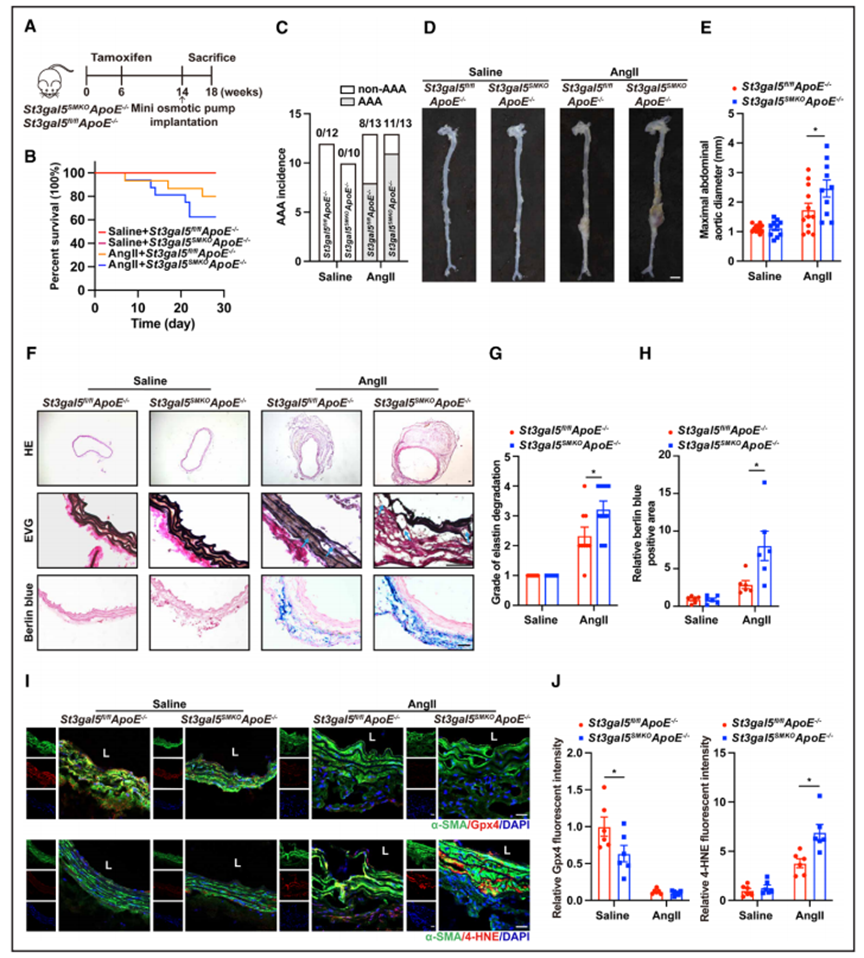
图7 VSMC特异性ST3GAL5缺乏通过促进铁失衡加重AAA形成
结论:
作者已经全面证明了鞘脂代谢在腹主动脉瘤中的破坏,并强调了VSMCs中GM3缺失对该病的促进作用。作者的研究结果揭示了GM3能够与细胞膜上的TFR1结合并抑制铁的摄取,为阐明AAA中SMC铁死亡的机制提供了新的思路。作者的研究还表明,KLF9通过转录抑制ST3GAL5的近端启动子和远端增强子的结合来抑制GM3的合成。综上所述,作者的结果为将GM3作为潜在的AAA治疗策略提供了基础。
实验方法:
小鼠AAA模型及治疗方案;细胞培养;细胞内Fe2+水平检测;PI染色法;ELISA;组织学和免疫组织化学;免疫荧光染色;质粒构建及细胞转染;总RNA分离和实时定量PCR;RNA测序;WB分析;亲和纯化及质朴分析;脂质过氧化、谷胱甘肽和铁含量的测量;脂质提取和脂质组学分析;脂质过氧化MDA实验;全转铁蛋白结合的流式细胞术分析;Calcein-AM染色及流式细胞术分析;表面等离子体共振分析;原位接近结扎试验;Hi-C数据分析;染色体构象捕获(3C)测定;剪切运行qPCR。
参考文献:
Zhang F, Li K, Zhang W, Zhao Z, Chang F, Du J, Zhang X, Bao K, Zhang C, Shi L, Liu Z, Dai X, Chen C, Wang DW, Xian Z, Jiang H, Ai D. Ganglioside GM3 Protects Against Abdominal Aortic Aneurysm by Suppressing Ferroptosis in Vascular Smooth Muscle Cells. Circulation. 2023 Nov 29. doi: 10.1161/CIRCULATIONAHA.123.066110. Epub ahead of print. PMID: 38018467.






