三阴性乳腺癌中的铁死亡异质性揭示了一种创新的免疫治疗联合策略
铁死亡(Ferroptosis)最早由哥伦比亚大学Dr. Brent R.Stockwell在2012年提出,是一种铁依赖性的,区别于细胞凋亡、细胞坏死、细胞自噬的新型的细胞程序性死亡方式。铁死亡的的本质是谷胱甘肽的耗竭,谷胱甘肽过氧化物酶(GPX4)活性下降,脂质氧化物不能通过GPX4催化的谷胱甘肽还原酶反应代谢,之后二价的铁离子氧化脂质产生活性氧,从而促使铁死亡的发生。下图为2023年铁死亡中标项目:
三阴性乳腺癌(Triple-negative breast cancer, TNBC)是一种生物学和临床异质性疾病,约占已诊断乳腺癌的 15%,仍然是最难治疗的乳腺癌亚型。作者之前的工作描述了中国人群中 TNBCs在分子特征、代谢重编程和肿瘤微环境方面的异质性。基于这些发现,作者提出了一个稳健的 TNBC分型系统,包括四种亚型:间充质样(MES)、管腔雄激素受体(LAR)、免疫调节(IM)和基底样和免疫抑制(BLIS)亚型。因为 TNBC是一种富含铁和脂质的肿瘤,诱导铁死亡是一种可探索的治疗策略。重要的是,干预脂质代谢或氧化还原平衡可诱导多种癌症的铁死亡。然而,最近乳腺癌背景下的铁死亡研究主要集中在探索调节铁死亡的新分子和新型纳米颗粒的开发上。鉴于铁死亡是一个逐步的过程,并受多种代谢途径的调控,而 TNBC 中铁死亡的清晰图谱仍不清楚,因此在 TNBC 中利用铁死亡进行精准治疗仍有诸多阻碍。2023年3月发表在《Cell Metabolism》,IF:29。
技术路线:

研究结果:
1.TNBC亚型中铁死亡相关特征的异质性
作者使用了多组学 TNBC数据集(n = 465),该数据集包括360个转录组数据的样本、279个全外显子组测序(WES)结果的样本、401个体细胞拷贝数改变(SCNA)数据的样本和330个代谢组数据的样本(图1A和B),划分出MES、LAR、IM和BLIS四个亚型,以评估铁死亡特征。TNBC 在铁死亡相关代谢产物和代谢途径中具有高度异质表型,LAR亚型中诱导过氧化脂质形成等正调控铁死亡的通路富集评分均较高,主要包括脂肪酸代谢通路、ROS代谢通路,脂肪酸过氧化酶(LOXs)相关通路(图1C和D)。HAMP是铁稳态的负调节因子,在MES亚型中HAMP在mRNA水平分度较低(图1E和F)。此外,通过铁检测试剂盒分析,在TNBC细胞系中验证了MES亚型铁代谢失调(图1G)同时,促进铁死亡的代谢通路也在LAR亚型中显著上调。与其他亚型相比,LAR肿瘤的OxPE和OxPE/PE-PUFA比值较高(图1D和H)。此外,棕榈油酸和油酸促进细胞铁死亡,在LAR肿瘤中表达较高。LAR亚型的脂质过氧化水平升高也在TNBC细胞系中得到验证(图1I)。多组学分析和实验均证实,LAR 亚型是TNBC 中铁死亡活跃性最高的亚型。
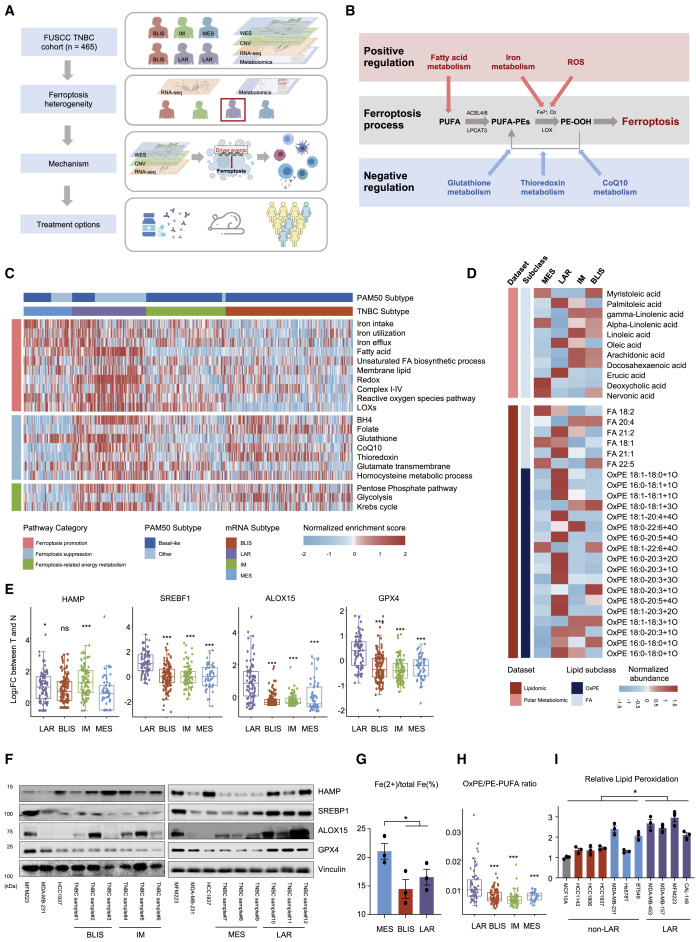
图1. TNBC亚型中铁死亡相关特征的异质性
2.谷胱甘肽代谢对于抑制 LAR 肿瘤的铁死亡至关重要
作者利用代谢组学和转录组学数据探索了LAR肿瘤中抑制铁死亡的最主要途径。在代谢组学方面,GSH代谢被确定为LAR肿瘤中最显著的铁死亡抑制和可靶向的特征(图2A和B)。GSH是癌细胞中主要的小分子抗氧化剂,由半胱氨酸、谷氨酸和甘氨酸组成(图2C)。通过比较GSH循环核心代谢物的丰度,作者发现GSH相关代谢物如甘氨酸和半胱氨酸在LAR肿瘤中显著富集并且在TNBC细胞系中也证实了LAR亚型中GSH与氧化GSH (GSSG)的较高比例(图2D、E、F)。在转录组学中比较 LAR和非 LAR肿瘤之间的铁死亡抑制通路。结果表明,GSH代谢是LAR亚型铁死亡抑制的基本途径(图2G)。在GSH通路的所有代谢基因中,GPX4 将LAR肿瘤与非LAR肿瘤区分开来(图2H和I)。这些数据表明,GPX4 是 GSH代谢抑制LAR肿瘤铁死亡的潜在决定因素。
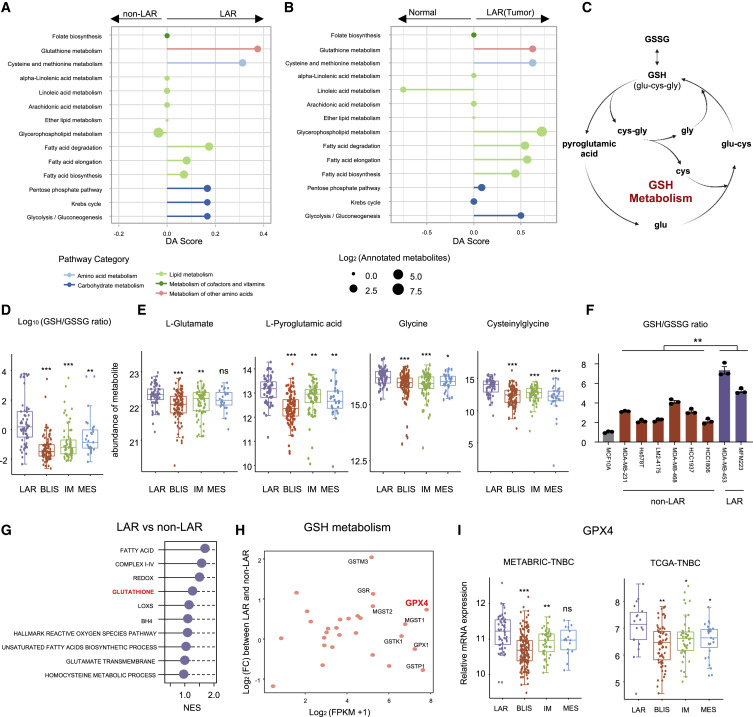
图2. 谷胱甘肽代谢对于抑制 LAR 肿瘤的铁死亡至关重要
3.GPX4对多种铁死亡诱导因子的敏感性突显其在 LAR肿瘤中的重要性
作者组装了包括erastin、PX-12、FIN-56、RSL3 和ML162 在内的一系列铁死亡诱诱剂(图3A和B),以评估每种化合物在LAR、非LAR和非TNBC细胞系中启动铁死亡的效果结果与之前的转录组和代谢组学分析一致(图3C和D),并强调了GPX4 在LAR肿瘤铁死亡稳态中的重要性,并强调了GPX4 是LAR肿瘤的代谢靶点。
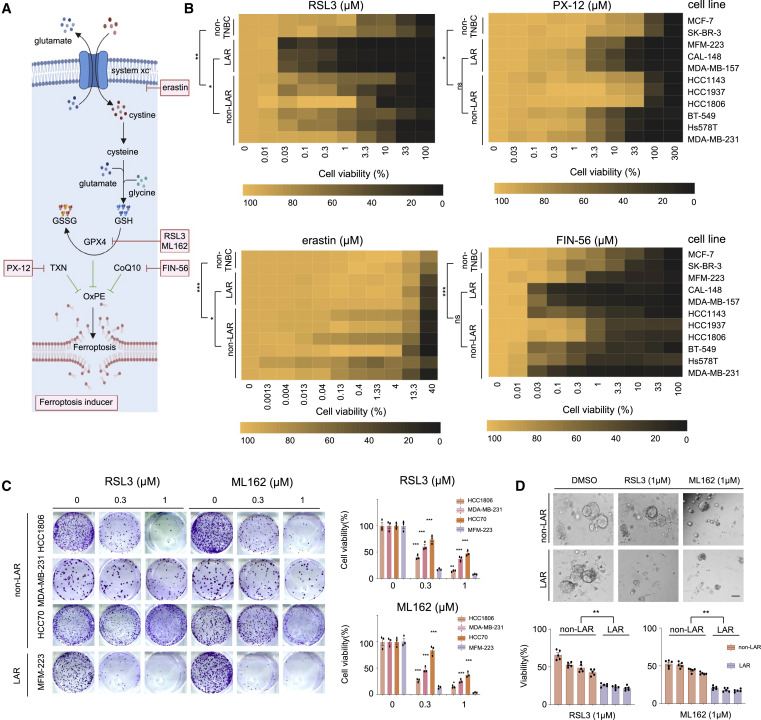
图3. GPX4对多种铁死亡诱导因子的敏感性突显其在 LAR肿瘤中的重要性
4.AR 与 GPX4 启动子结合并驱动其表达,是 LAR肿瘤中 GPX4 表达的关键调节因子
作者进行了整合基因组和转录组分析,并确定LAR特异性改变与GPX4表达之间的相关性(图4A)。在LAR肿瘤中,GSEA证明了标志基因集中的几种途径的激活,如FA代谢、雄激素反应和过氧化物酶体途径(图4B)。基因组分析显示,在LAR肿瘤中,磷脂酰肌醇-4,5-二磷酸3激酶(PI3K)信号通路、受体酪氨酸激酶(RTK)信号通路和丝裂原活化蛋白激酶(MAPK)通路的突变以及缺失9p21.3、9p24.2和18q11.2得到富集(图4C)。Spearman相关分析显示,FA代谢、胆汁酸代谢、雄激素反应、脂肪生成、胆固醇稳态、PI3K信号突变、MAPK信号突变、溶质载体家族1成员1 (SLC1A1)表达与GPX4表达呈正相关(图4E)。
接下来,我们进行了实验来验证这些转录组和基因组改变对GPX4的影响。鉴于胆汁酸代谢、FA代谢、脂肪生成和胆固醇代谢密切与AR信号通路密切相关。测试了bicalutamide(一种AR抑制剂)、tamoxifen(一种雌激素受体调节剂)、apitolisb(一种PI3K抑制剂)、ulixertinib(一种MAPK抑制剂)和RSL3在蛋白水平上对GPX4表达的影响。在所有抑制剂中,只有AR抑制剂比卡鲁胺和GPX4抑制剂RSL3明显降低GPX4蛋白(图4F)。此外,我们证实了AR在HEK293T细胞中的过表达导致GPX4 mRNA和蛋白水平表达降低,MDA-MB-453和MFM223在细胞中,抑制AR表达导致GPX4 mRNA和蛋白水平表达降低(图4G和H)。接下来,我们探讨了AR调控GPX4的机制。首先使用包含GPX4转录起始位点上游五个区域的瞬时转染报告基因构建体进行转录分析Flag-AR共转染后,只有2500至2000-bp区域上调荧光素酶信号(图4I)。对该区域的AR结合位点进行扫描,确定了四个基序(图4J)。这些基序的突变(ABS1/2/3/4-Del和all-ABSs-Del)阻断了AR诱导的转录上调(图4 K)。
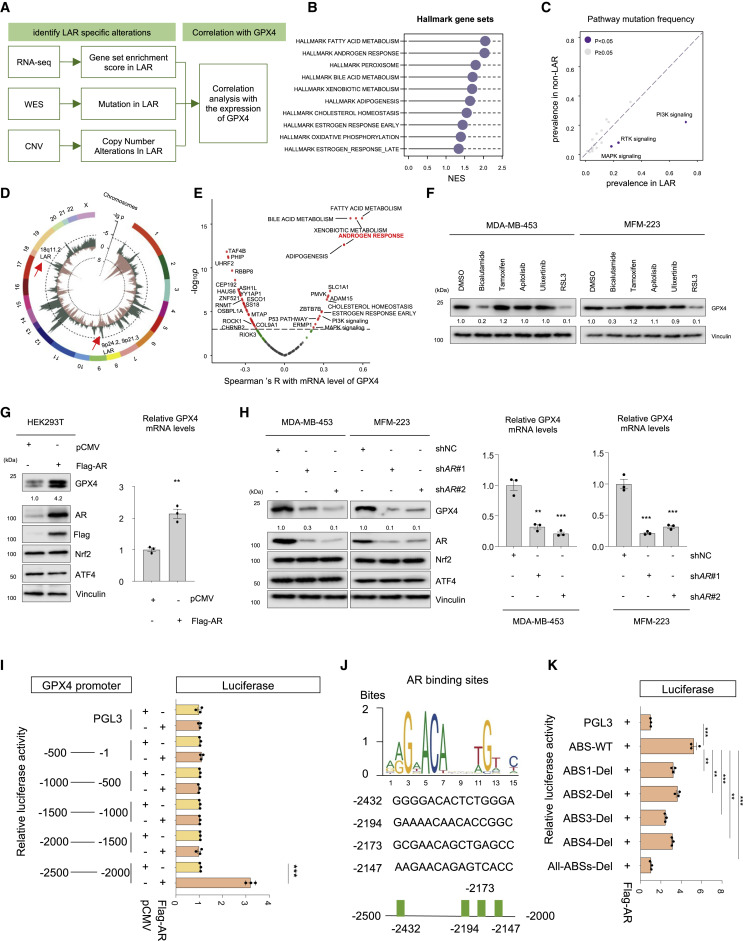
图4. AR 与 GPX4 启动子结合并驱动其表达,是 LAR肿瘤中 GPX4 表达的关键调节因子
5.对于 LAR患者,靶向 GPX4 是比靶向 AR 更好的策略
考虑到GPX4是LAR肿瘤铁死亡的潜在抑制因子,AR驱动GPX4的表达,我们想知道AR抑制剂是否促进铁死亡并作为LAR肿瘤患者的最佳治疗方法。然而,AR抑制剂单药治疗或与PI3K抑制剂和CDK4/6抑制剂联合使用在几项临床试验中显示出次优效果,包括MDV3100-11、TBCRC032和FUTURE试验
这些数据表明,LAR肿瘤中的未知机制使它们在AR抑制后能够逃避铁死亡。接下来,作者确定了AR在LAR肿瘤细胞系铁死亡中的作用。用比卡鲁胺(靶向细胞核中的雄激素相关元件)、达鲁胺(靶向 AR 核易位)、恩杂鲁胺(靶向 AR 核易位)处理 MFM-223和MDA-MB-453细胞后,通过免疫印迹、脂质过氧化测定和 BODIPY 581/591 C11 染色分析了铁死亡。(图5A和5B)所示,GPX4抑制剂而不是AR抑制剂扩大了脂质过氧化水平并促进了铁死亡。我们进一步探讨了AR抑制剂在促进铁死亡方面无效的可能机制。既往研究表明,AR可以通过下调2,4-二烯酰辅酶A还原酶(DECR1)来促进FA代谢,尤其是PUFA的积累,DECR1是一种直接雄激素抑制的基因,我们还验证了 LAR 肿瘤中 DECR1和OxPE 1之间的负相关关系,以及通过在 LAR 细胞系中使用 AR 抑制剂来上调DECR1(图5C和5D)。此外,我们验证了MDA(脂质过氧化的生物标志物)在暴露于GPX4抑制剂而非AR抑制剂后上调(图5C)。这些数据证明了AR在铁死亡中的多重作用。一方面,AR可能促进PUFA生物合成,支持铁死亡。另一方面,AR 可能上调 GPX4 的表达以清除铁死亡过程中的脂质过氧化(图 5E)。因此,GPX4 抑制(而非 AR 抑制)是刺激 LAR 肿瘤患者铁死亡的最佳方法。
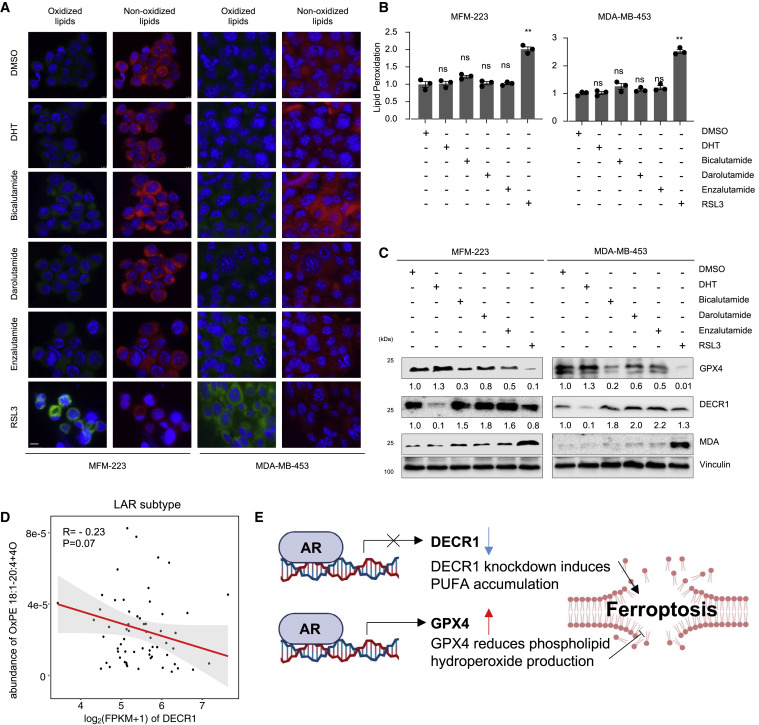
图5. 对于 LAR患者,靶向 GPX4 是比靶向 AR 更好的策略
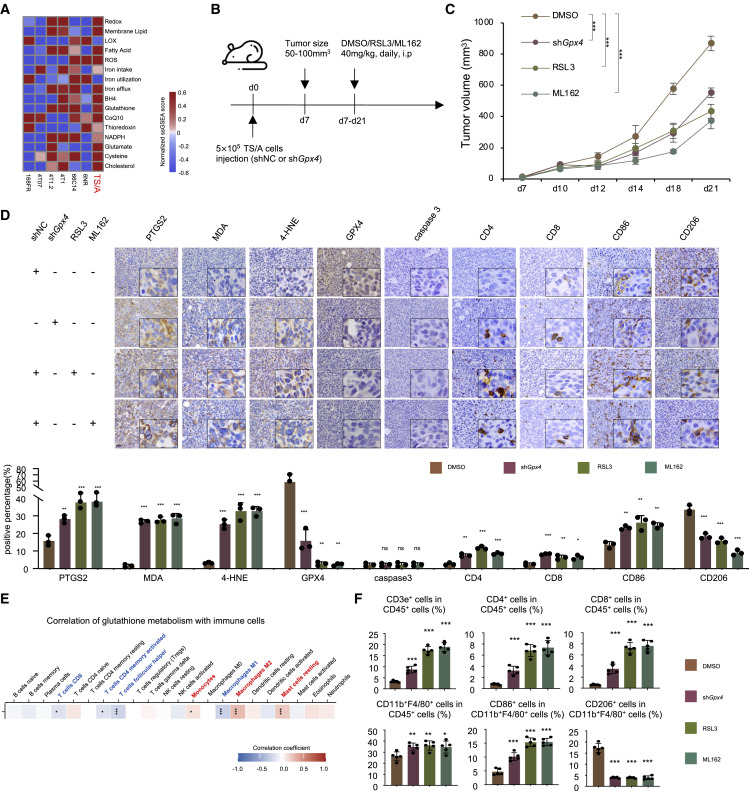
6.GPX4 抑制剂抑制肿瘤生长,并在体内重编程肿瘤微环境
接下来,我们进行了体内实验,以探索基于亚型特异性铁死亡活性的LAR肿瘤患者的治疗策略。首先,在体内评估GPX4抑制剂在表达AR的TNBC肿瘤中的抗癌作用。我们选择了小鼠 LAR 肿瘤细胞系 TS/A,因为该细胞系富含铁死亡相关通路,并在我们最近的研究中被确定为 LAR 亚型( 图6A). 我们在 TS/A 细胞中稳定表达 shGpx4 或 shNC,并通过注射建立原位模型5细胞进入小鼠(图S5A)。注射有shNC细胞系的两组小鼠用两种不同的GPX4抑制剂处理,而其他组用DMSO作为对照处理(图6B)。如图 6C、6D、S5B 和 S5C 所示,敲低 Gpx4 表达或添加 GPX4 抑制剂显着诱导肿瘤铁死亡,但不诱导细胞凋亡。最近的研究表明,铁死亡诱导的纳米颗粒抑制肿瘤生长并增强抗癌免疫力。因此,作者研究了Gpx4 敲低或利用 GPX4 抑制剂对肿瘤微环境的影响。如图 6D 所示,IHC 染色表明 GPX4 抑制有效导致药物诱导的铁死亡生物标志物 PTGS2、MDA 和 4-HNE 升高并募集CD3e细胞、CD4细胞、CD8细胞和CD86细胞,并减少CD206细胞的数量。相关性分析表明,GSH代谢与CD8 T细胞和M1巨噬细胞的比例呈负相关,但与M2巨噬细胞和静息肥大细胞的比例呈正相关(图6E)。CD3e T细胞是抗癌免疫中最重要的效应因子,包含 CD4 T 细胞和 CD8 T 细胞亚群。巨噬细胞是肿瘤微环境中的关键细胞,表现出杀瘤 M1 型和再生 M2 型表型。我们通过流式细胞术分析进一步评估了免疫反应。GPX4的抑制显著增加了CD45细胞中CD3e细胞的比例、CD45 T细胞中CD4细胞的比例、CD45 T细胞中CD8细胞的比例、CD45细胞中CD11b F4/80细胞的比例以及CD45 CD11bF4/80细胞中CD86细胞的比例,同时降低了CD45CD11bF4/80细胞中CD206细胞的比例(图6F)。我们还使用4T1细胞衍生的异种移植模型验证了 GPX4 抑制剂对肿瘤微环境的影响,因为4T1被称为免疫冷肿瘤模型。这些数据表明,抑制LAR肿瘤中GPX4的表达可显著促进铁死亡,减缓肿瘤生长,并触发肿瘤微环境获得炎症表型。
7.GPX4 抑制剂联合 ICB 有效治疗类似 LAR 的肿瘤
为了测试GPX4抑制剂和免疫疗法是否发挥协同作用,我们通过注射5×10来建立TS / A异种移植肿瘤5将TS / A小鼠乳腺癌细胞系放入每只小鼠中,并用GPX4抑制剂或DMSO加阻断PD-1处理小鼠(图7A)。与单药治疗相比,GPX4抑制剂和抗PD-1抗体联合治疗可显著抑制肿瘤生长(图7B)。此外,我们利用流式细胞术分析了治疗后肿瘤的免疫反应。与单药治疗相比,联合治疗不会导致额外的免疫细胞浸润。然而,流式细胞术的结果表明,联合疗法诱导了明显的免疫反应,增加了PRF1CD8 T细胞和GZMBCD8 T细胞的比例(图7C)。
接下来,作者研究了两个队列中LAR亚型对GSH代谢的抑制作用是否与ICB的临床反应相关。在 I-SPY2 队列中,21例 TNBC患者接受了新辅助免疫治疗,并进行了转录组学分析具有较高AR表达的TNBC显示出增强的铁代谢,不饱和FA代谢和GSH代谢活性(图7E)。我们验证了GSH代谢与肿瘤炎症特征、STAT1特征、IFN-γ特征、PD-1表达、PD-L1表达和M1型巨噬细胞比例呈负相关,但与AR高TNBC肿瘤中M2型巨噬细胞比例呈正相关(图7F)。此外,GSH代谢的增加与AR高亚组缺乏病理完全缓解(pCR)有关(图7G)。在TNBC小鼠模型中的另一组抗PD1和抗CTLA-4联合治疗中,我们注意到类似的结果。具有较高AR表达的肿瘤也显示出与LAR肿瘤相似的生物学特征(图7H和7I)。在第一个队列中,GSH代谢与AR高亚组中的免疫相关生物标志物呈负相关(图7J)。通过将 GPX4 表达与单个小鼠细胞系对免疫治疗的反应进行比较,我们发现 ICB 耐药组表达 GPX4 的水平更高(图7K)。总之,我们的研究表明,GPX4抑制剂与ICB的联合治疗在生物学特征上类似于LAR的肿瘤是最佳疗法。
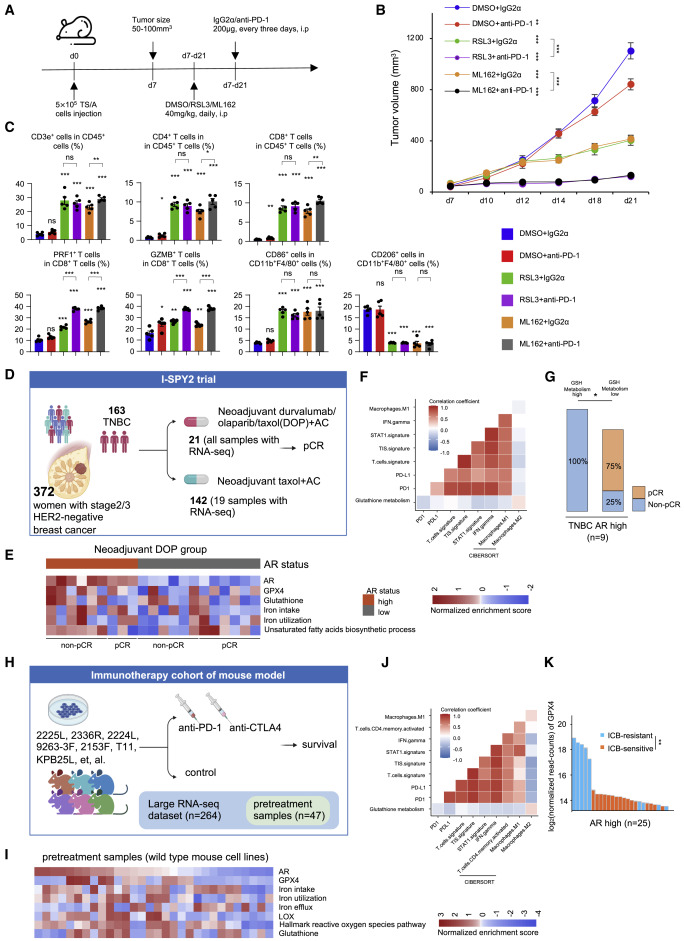
图7.GPX4 抑制剂联合 ICB 有效治疗类似 LAR 的肿瘤
结论:
总之,该研究展示了TNBC的铁死亡的高度异质性,并揭示了难治性LAR肿瘤的一种新型免疫治疗联合策略,将有望给LAR型TNBC患者带来新希望。该研究提出通过多组学融合分析全面揭示铁死亡特征和鉴定关键调控因子的思路,是研究肿瘤铁死亡的新模式,在肿瘤铁死亡研究和TNBC临床治疗领域均具有重要意义。
实验方法:
异种移植模型、类器官培养、基因集富集分析(GSEA)、载体构建、转染、免疫印迹分析、实时荧光定量PCR(qPCR)和ChIP–qPCR、脂质过氧化试验、GSH/GSSG比值测定、铁测定、荧光素酶检测、流式细胞术分析、免疫组化染色和H&E染色。
参考文献:
Yang F, Xiao Y, Ding JH, et al. Ferroptosis heterogeneity in triple-negative breast cancer reveals an innovative immunotherapy combination strategy. Cell Metab. 2023;35(1):84-100.e8.






