SETD2-NR2F1-STAT1信号轴重塑肿瘤免疫微环境、增强免疫治疗疗效的新机制
以免疫检查点抑制剂(Immune Checkpoint Inhibitors,ICIs)为代表的免疫治疗彻底改变了如肾细胞癌、非小细胞肺癌、霍奇金淋巴瘤、乳腺癌等晚期癌症患者的治疗,但临床实践证明只有约20%的患者有效。SETD2突变与免疫检查点抑制剂(ICIs)免疫治疗的疗效有关。SETD2失活的功能重要性以及如何调节免疫治疗反应仍不清楚。为了探讨SETD2在免疫治疗中的作用,通过RNA-seq、ATAC-seq、ChIP-seq、流式细胞术、蛋白质免疫印迹等方法确定SETD2在ICI治疗中的作用,并阐明了对肿瘤免疫的机制影响,揭示了各种难治性癌症的新潜在治疗生物标志物,为SETD2缺失患者的免疫治疗策略提供了理论依据。该研究于2023年12月6日发表在《Journal for ImmunoTherapy of Cancer》,IF:10.9
技术路线
主要研究结果
1. Setd2敲除基因小鼠模型中的肿瘤对ICI免疫治疗敏感
为了测试敲除SETD2是否会使肿瘤对免疫检查点阻断敏感,作者建立了一个同源小鼠肿瘤细胞系:来自Pdx1cre小鼠自发性胰腺癌的KC细胞。使用CRISPR/Cas9基因组编辑技术建立Setd2-KO的KC细胞(图1A)。为了确定Setd2对免疫治疗反应的影响,同等数量的KC-sgSetd2和对照细胞皮下移植到C57BL/6免疫活性小鼠中,然后腹腔注射PD-L1抗体。与载体对照相比,PD-L1治疗显著减少了KC-sgSetd2肿瘤的生长,但对对照组肿瘤大小没有影响(图1B-E)。这些结果表明,Setd2基因敲除可使胰腺癌对PD-L1免疫治疗敏感。为了验证该结论,作者又验证了Setd2(图1F)在第二个小鼠肿瘤细胞系(B16F10,小鼠黑色素瘤)中的作用,发现B16F10细胞中完全抵抗免疫检查点阻断,但对免疫功能正常小鼠中抗PD-L1治疗的有效性有显著影响(图1G-1 I)。相比之下,对照组B16F10肿瘤没有抑制作用(图1I和1J)。因此,敲除Setd2使KC胰腺癌和B16F10黑色素瘤对免疫检查点阻断敏感。
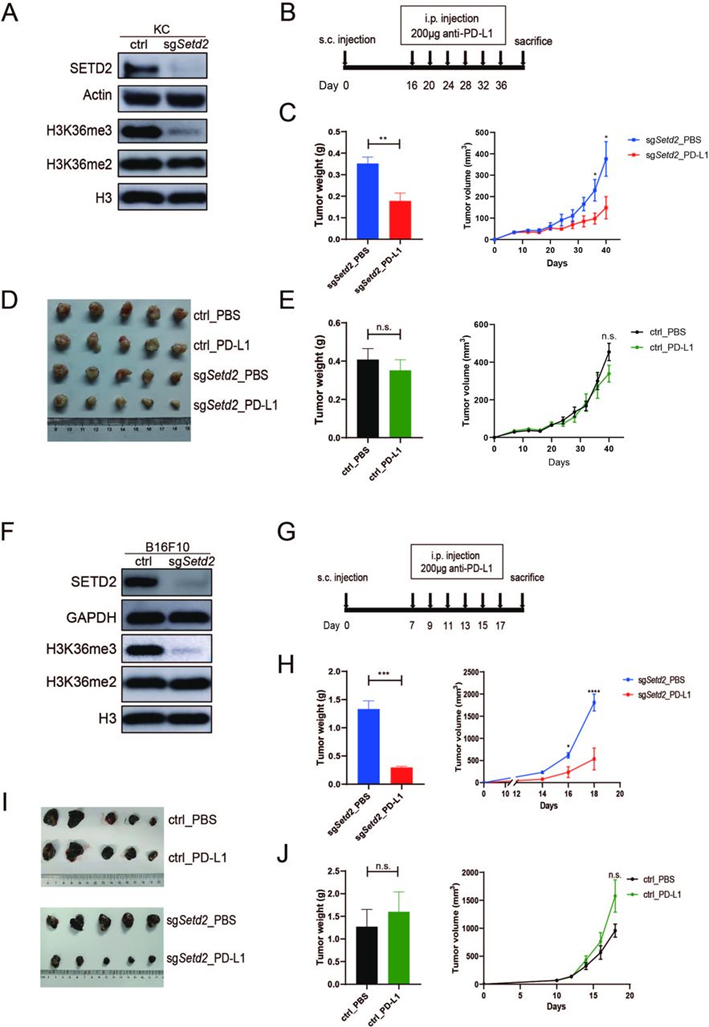
图1:Setd2敲除使小鼠肿瘤对PD-L1免疫治疗敏感
2. SETD2失活通过上调Stat1激活IFNγ通路
为了确定由Setd2调节的全基因表达模式,作者在配对的KC-KO/KC-WT C57BL/6同种异体移植肿瘤体内和KC-sgSetd2/KC对照细胞体外进行RNA-seq。GSEA显示,在KC-KO肿瘤和KC-sgSetd2细胞中,调节免疫反应、细胞因子产生、干扰素-γ(IFNγ)反应、抗原加工和提呈的基因集显著上调(图2A)。IFNγ通路在肿瘤对免疫治疗的反应中起着关键作用。在KC-KO肿瘤和KC-sgSetd2细胞中,IFNγ通路中的关键转录因子STAT1 27显著上调和激活(图2B和2C)。在B16F10-sgSetd2细胞中,通过WB和RT-qPCR进一步证明了SETD2-STAT1调节(图2D和2E)。此外,SETD2失活在体外(图2F和2G)和体内(图2H)上调了IFNγ诱导的趋化因子基因Cxcl9,Cxcl10和Cxcl11。STAT1-IFNγ调节轴被报道通过招募CXCR3+CD8+T细胞和CXCR3+NK细胞来促进抗肿瘤免疫。综上所述,这些结果表明敲除Setd2增加了STAT1的表达和激活,然后激活了IFNγ通路,从而促进免疫相关基因的表达和免疫相关通路的激活。
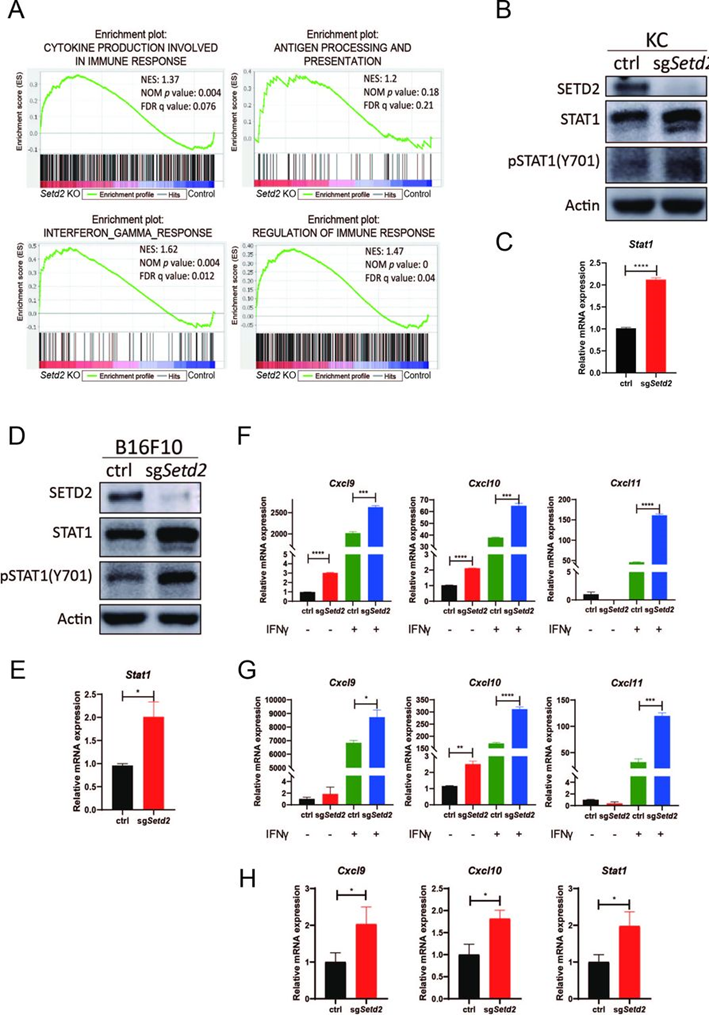
图2:敲除Setd2诱导STAT1表达和激活
3. 敲除SETD2促进PD-L1表达和抗原递呈
众所周知,IFNγ-JAK-STAT1轴是促进PD-L1表达和MHC-I抗原加工和呈递的主要途径。在作者的Setd2缺陷小鼠模型中,除了趋化因子基因之外,还发现PD-L1的表达和抗原递呈增强。在Setd2敲除细胞和同种异体移植肿瘤中,通过RT-qPCR在转录水平证实了Pdl1的上调(图3A和3B)。如图3C和3D所示,细胞膜上的PD-L1蛋白表达增加。据报道,PD-L1的上调导致有效的免疫抑制和肿瘤免疫逃逸,这解释了Setd2缺陷肿瘤发生免疫抑制的潜在原因。RT-qPCR还显示Setd2敲除细胞中MHC-I复合物核心基因H2K1的上调(图3E),细胞表面的H-2Kb /Db蛋白表达水平持续增加(图3F)。体内进一步证实了H2-K1的上调(图3B)。GSEA结果显示敲除Setd2促进MHC-I抗原加工和提呈。此外,细胞中SIINFEKL-H-2Kb水平上调(图3G),体外和体内试验表明敲除Setd2使KC细胞对CD8+OT-1细胞介导的杀伤更敏感(图3H)。
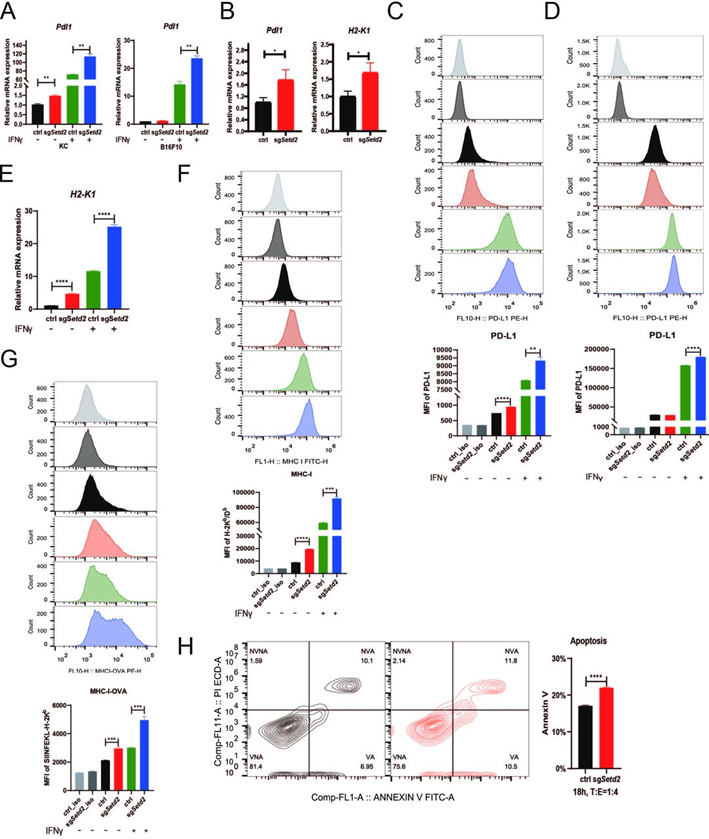
图3: 敲除Setd2促进IFNγ-STAT1诱导的PD-L1表达和MHC-I抗原递呈
4.失活SETD2通过下调Nr2f1促进Stat1表达
SETD2的大部分功能由H3K36me3介导,进行ChIP-seq绘制H3K36me3在KC-WT和KC-KO中的分布,观察失活SETD2通过H3K36me3缺失诱导染色质可及性和转录输出的改变。通过ATAT-seq评估敲除Setd2后对Stat1表达的染色质可及性的影响。ChIP-seq和ATAC-seq显示H3K36me3沉积和Stat1染色质可及性没有显著差异,表明Stat1可能表达间接受Setd2调控。转录水平上Stat1的减少使作者确定了敲除Setd2可能调节增加Stat1转录的潜在转录因子的表达。Nr2f1是差异表达基因中最显著的下调转录因子,且敲除Setd2的细胞中ChIP-seq的H3K36me3富集和ATAC-seq的染色质可及性的下降(图4A和4B)。为了通过实验研究Stat1转录是否由NR2F1调节,将Nr2f1慢病毒转导到Setd2敲除和对照细胞中(图4C),并通过RT-qPCR和WB(图4D)证实Stat1表达的降低,且一系列IFNγ诱导的基因下调(图4E)。此外,为了评估NR2F1是否直接与Stat1启动子结合,作者构建了Flag-Nr2f1慢病毒载体,并确定了其抑制STAT1表达和激活的能力。通过ChIP-qPCR检测证实了直接结合(图4F)。此外,GFP报告基因检测显示NR2F1显著抑制了Stat1启动子驱动的GFP表达(图4G和4H)。这些结果表明了敲除Setd2是通过降低Nr2f1基因体上的H3K36me3沉积和减少Nr2f1启动子区域近端的染色质可及性,从而进一步增加了STAT1的表达和激活。
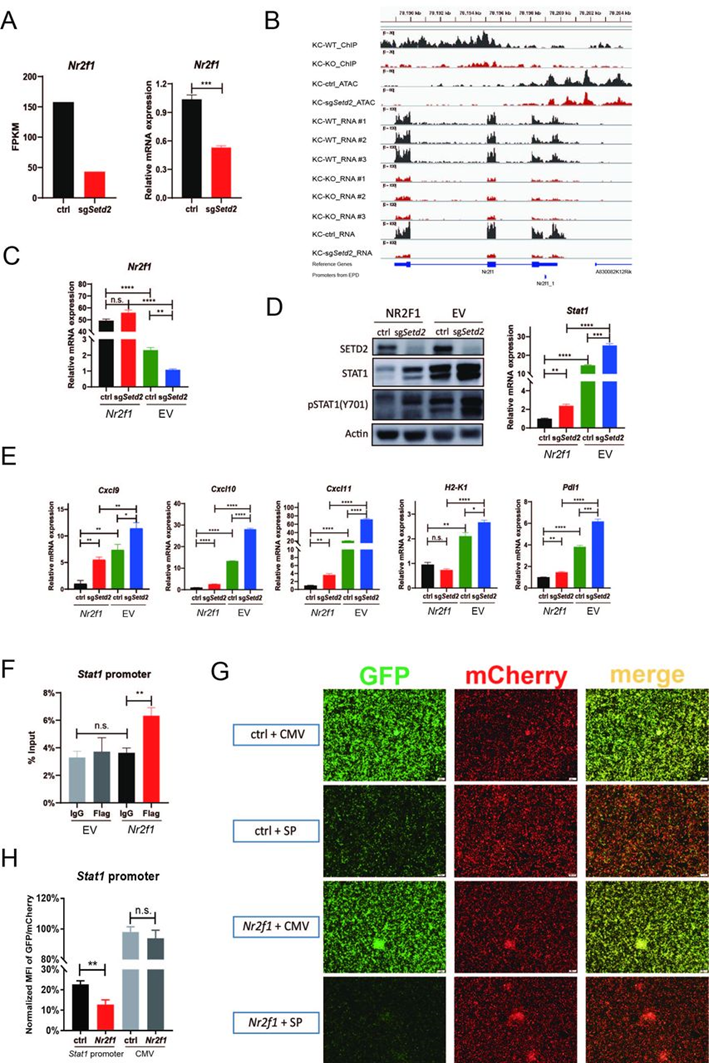
图4: Setd2失活通过下调Nr2f1表达诱导STAT1表达和激活
5. SETD2失活重编程肿瘤免疫微环境
为了系统地阐明SETD2-NR2F1-STAT1轴对肿瘤免疫微环境的调节,作者建立了Setd2-敲除(KC-KO)和Setd2-野生型(KC-WT)细胞系,并在C57BL/6同种异体移植肿瘤中进行RNA-seq。通过单样本基因集富集(ssGSEA)和ESTIMATE分析,KC-KO肿瘤的免疫细胞浸润显著高于KC-WT肿瘤(图5A)。许多免疫相关基因,包括免疫抑制基因Cd274、Ctla4、Lag3和Ido1,在KO肿瘤中上调。此外,一些免疫刺激基因和趋化因子如Ccl5和Cxcl10基因的表达,在KO肿瘤中也上调(图5B)。PBS治疗的C57BL/6免疫活性小鼠分离的敲除Setd2和对照中分选CD45+免疫细胞的单细胞RNA-seq(scRNA-seq)分析显示,浸润T细胞、中性粒细胞、NK细胞和树突状细胞的比例显著增加,而与对照相比,Setd2缺陷肿瘤中浸润巨噬细胞的比例显著降低(图5C和5D)。鉴于肿瘤相关巨噬细胞(TAMs)的双重功能,作者们将巨噬细胞重新聚集到M1样和M2样巨噬细胞中,发现这两种类型的巨噬细胞比例都有所下降,而在Setd2缺陷肿瘤中,M2样巨噬细胞急剧减少(图5E和5F)。鉴于T细胞在抗肿瘤免疫中的关键作用,作者又根据其功能和标记基因注释了T细胞亚群(图5G)。在Setd2敲除的同种异体移植物中,初始和效应T细胞亚群(包括初始CD4+T细胞、调节性CD4+T细胞(Treg)、CD4+辅助T细胞、初始CD8+T细胞和效应CD8+T细胞)的浸润显著增强,主要表现为效应CD8+T细胞和Treg的增加(图5H)。这些结果表明Setd2下降是通过减少M2巨噬细胞浸润和增加效应T细胞浸润来加剧肿瘤微环。为了进一步探索CD8+T细胞在PD-L1治疗中的作用,评估了CD8+T细胞的状态。结果表明,在PD-L1免疫治疗的KC-sgSetd2肿瘤中,细胞毒性CD8+T细胞的比例显著增加(图5I和5J),PD-L1免疫治疗调节CD8+T细胞的分化,使其在Setd2表达和Setd2敲除肿瘤中从耗尽状态转为细胞毒性状态。流式细胞术分析进一步证实, PD-L1治疗显著增加了Setd2敲除的皮下同种异体移植体中CD3+T细胞、CD4+T细胞和CD8+T细胞的浸润(图5K和5L)。综上可知,一方面,Setd2缺乏促趋化因子的产生,通过增加T细胞的浸润来刺激免疫微环境,增强抗原递呈,激活CD8+T细胞介导的杀伤。另一方面,STAT1的激活促进免疫抑制检查点分子如PD-L1的表达,与抗肿瘤免疫相竞争。所有这些机制都有助于ICI免疫治疗。
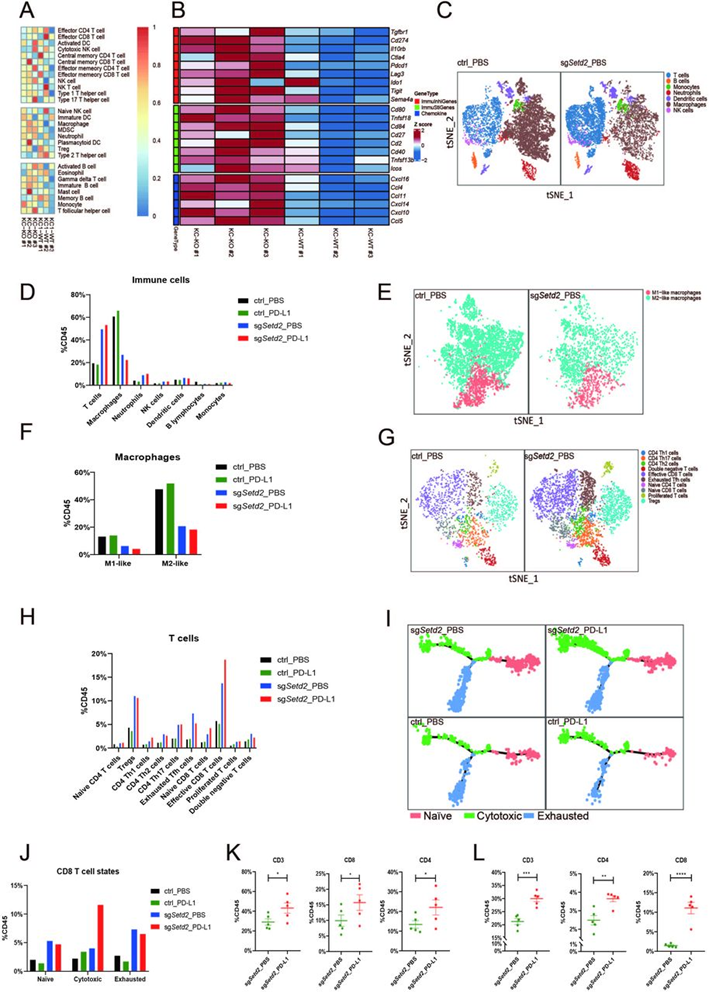
图5:肿瘤内免疫浸润的Bulk RNA-seq和scRNA-seq
6. 人类癌症中的SETD2-NR2F1-STAT1轴
为了证实小鼠肿瘤中SETD2失活抑制STAT1表达且以NR2F1依赖性方式激活的发现,作者在人胰腺导管腺癌细胞系YAPC中用单个SETD2 sgRNA敲除SETD2(图6A)。在mRNA和蛋白水平上证实STAT1表达升高,在YAPC-sgSETD2细胞中也证实了STAT1激活介导CXCL10和PDL1的上调(图6A和6B)。接下来,作者进行了GSEA分析,以获得SETD2敲除和对照YAPC细胞转录组差异的全局视图。SETD2敲除的YAPC细胞中富集了几种途径,类似于KC-sgSetd2细胞中的基因特征(图6C),免疫相关基因的表达也像KC-KO细胞一样增加(图6D)。对胰腺癌队列公共数据集的分析显示,SETD2和STAT1表达、NR2F1和STAT1表达以及SETD2和PDL1表达之间存在负相关(图6E和6F)。根据SETD2和NR2F1的表达水平进一步完善了队列。非配对比较显示,在SETD2高表达的肿瘤中STAT1和PDL1的表达较低(图6G),在NR2F1低表达的肿瘤中STAT1的表达显著增加(图6G),这与小鼠肿瘤中的发现一致。接下来,基于SETD2表达水平的人类胰腺癌队列中差异表达基因的GSEA也显示了与SETD2敲除的YAPC细胞中鉴定的相同的富集基因特征。最后,用经过验证的SETD2和NR2F1抗体对75例胰腺导管腺癌患者组成的人体组织芯片进行免疫组化,并证明SETD2和NR2F1表达显著正相关(图6H和6I)。接下来,根据TCGA数据集,SETD2在透明肾细胞癌中以高患病率(16%)发生突变,这些突变中的大多数是失活突变,并导致完整蛋白质表达的丧失。通过TCGA和RECA-欧盟(ICGC)队列中ccRCC肿瘤的基因组分析显示,NR2F1和STAT1、SETD2的表达与免疫抑制基因CTLA-4、IDO1、HAVCR2和LAG3呈负相关(图6J),SETD2和NR2F1的表达呈正相关(图6K)。SETD2高表达肿瘤中NR2F1的mRNA水平显著高于SETD2低表达和SETD2失活肿瘤(图6L)。总体而言,这些结果表明SETD2-NR2F1-STAT1调节的机制在人类癌细胞系和患者样本中高度保守,突出了SETD2失活在ICI免疫治疗人类癌症疗效中的作用。
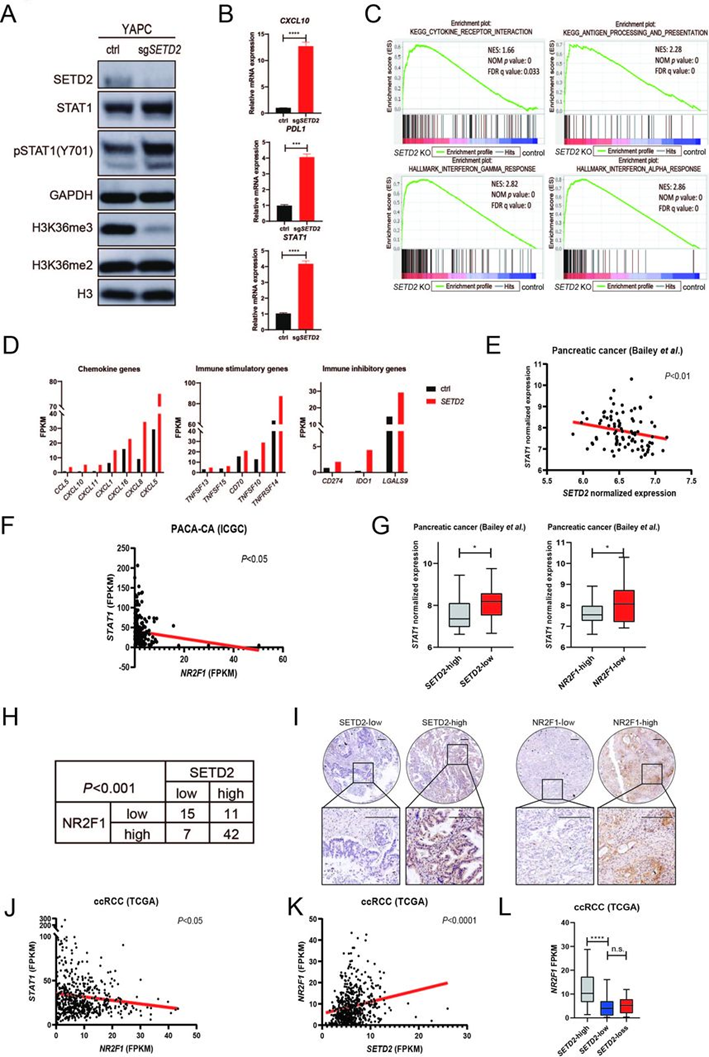
图6: 人类肾透明细胞癌和胰腺癌中的SETD2-NR2F1-STAT1轴
7. 携带SETD2突变的癌症患者可从ICI免疫治疗中获益
检索并分析了1662例接受ICI免疫治疗的晚期癌症患者的基因组和临床结局数据。在476个癌症基因中,127个基因与免疫治疗的有益效果相关。排名靠前的基有已知的ICI治疗预测生物标志物,包括TP53、PAK7、TET1、PTPRD/PTPRT和STK11。SETD2在476个基因中排名前三。SETD2失活突变的患者免疫治疗的效果更好(图7A和7B)。这一结果在额外的黑色素瘤(图7C,D)和非小细胞肺癌队列中得到了外部验证。
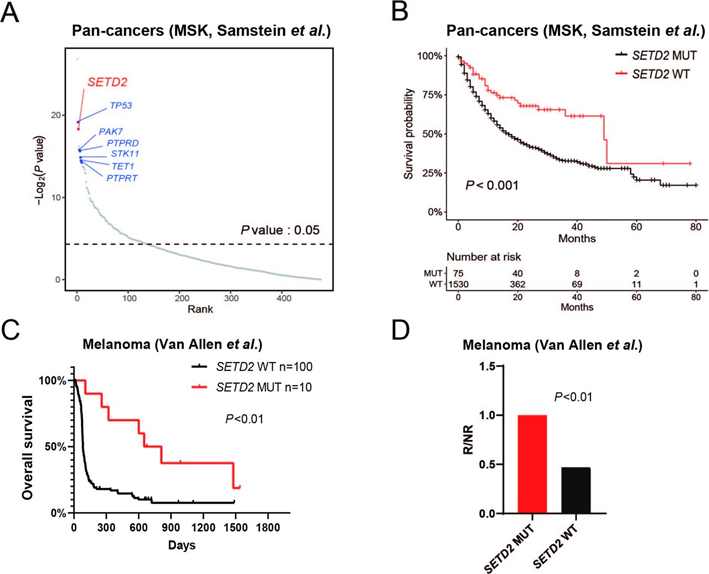
图7: SETD2突变的患癌患者的ICI免疫治疗疗效更好
结论
总体而言,作者从细胞系、基因小鼠模型和患者标本中获得的数据揭示了SETD2失活通过NR2F1-STAT1信号通路增强肿瘤免疫原性和激活肿瘤免疫微环境的重要意义。这项工作不仅为SETD2肿瘤抑制生物学提供了见解,还提供了SETD2突变癌症可以从ICI免疫治疗中受益的证据,突出了SETD2突变体在指导免疫治疗中的预测价值。
实验方法
蛋白质印迹分析,细胞培养,小鼠实验,基因集富集分析(GSEA),流式细胞术,ChIP-seq,ATAC-seq,RNA-seq,ChIP-qPCR,批量RNA-seq和单细胞RNA-seq分析,轨迹分析,免疫组织化学染色
参考文献
Zheng Xufen, Luo Yuxiang, Xiong Yangjie et al. Tumor cell-intrinsic SETD2 inactivation sensitizes cancer cells to immune checkpoint blockade through the NR2F1-STAT1 pathway. [J]. J Immunother Cancer, 2023, 11: undefined.






