胰腺癌致癌因子—BHLHE40上调SREBF1抑制癌细胞铁死亡
胰腺癌(PCa)是最致命的人类恶性肿瘤之一。间质组织向PCa肿瘤微环境浸润的增强限制了恶性上皮细胞中关键肿瘤特异性转录因子和表观基因组异常的鉴定。对胰腺癌类器官的整合转录组和表观遗传多组学分析表明,碱性螺旋-环-螺旋转录因子40(BHLHE40)在肿瘤样本中显著上调。BHLHE40不仅作为经典转录因子调节固醇调节元件结合因子1(SREBF1)的转录,而且连接SREBF1的增强子和启动子区域。BHLHE40-SREBF1-硬脂酰辅酶A去饱和酶轴保护PCa细胞免受铁死亡,导致脂质过氧化的积累减少。此外,SREBF1抑制剂fatostatin显著抑制BHLHE40高表达的PCa肿瘤的生长。该研究于2023年12月发表在《Advanced Science》,IF:15.1。
技术路线:
主要研究结果:
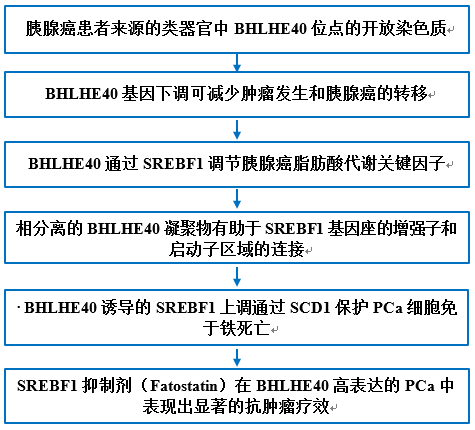
1. 胰腺癌患者来源的类器官中BHLHE40位点的开放染色质
使用ATAC-seq和CUT&Tag H3K27ac修饰谱分析两对肿瘤(PTO1和PTO2)和癌旁(PNO1和PNO2)组织类器官(图1A)。通过评估TCGA中PAAD数据集的mRNA-seq中差异表达转录因子组的基因的交集,以及PCa类器官中增强的结合位点的H3K27ac CUT&Tag分析和上调的可及性增强区域的ATAC-seq分析确定了一个转录因子(BHLHE40),用于进一步研究(图1A)。与PNOs相比,在PCa类器官中,H3K27ac富集于BHLHE40的启动子区域(图1B)。EP300沉默或抑制(使用C646作为抑制剂)持续降低PANC-1和BxPC-3细胞系中BHLHE40的H3K27ac表达水平(图1C)。因此得出结论,EP300介导的H3K27ac修饰参与BHLHE40的上调。由于BHLHE40在肝细胞中的诱导被mTOR信号的抑制剂雷帕霉素所阻止,随后研究了mTOR信号对BHLHE40的影响BHLHE40的表达。BHLHE40表达越高的临床样本或PCa细胞雷帕霉素IC50值越低,表明这些样本更容易受到雷帕霉素的影响(图1D)。雷帕霉素降低PANC-1和BxPC-3细胞中BHLHE40的表达水平(图1E)。先前的研究表明mTOR激活EP300诱导脂肪生成为证实mTOR-EP300对BHLHE40表达的调控作用,作者进一步证明雷帕霉素处理显著降低PANC-1和BxPC3细胞中EP300的活化(图1F)。PCa临床样本的IHC染色结果显示,BHLHE40在肿瘤样本中的表达水平高于癌旁组织(图1G,H)。在GEO(GSE16515)和TCGA-PAAD数据集中观察到RNA水平的类似结果(图1I)。在PCa患者中,较高的BHLHE40表达与总生存期降低显著相关(图1J)。综上所述,启动子区染色质可及性的增加和mTOR通路活性的增强导致BHLHE40在PCa中表达的升高,而BHLHE40在PCa中呈不良预后。
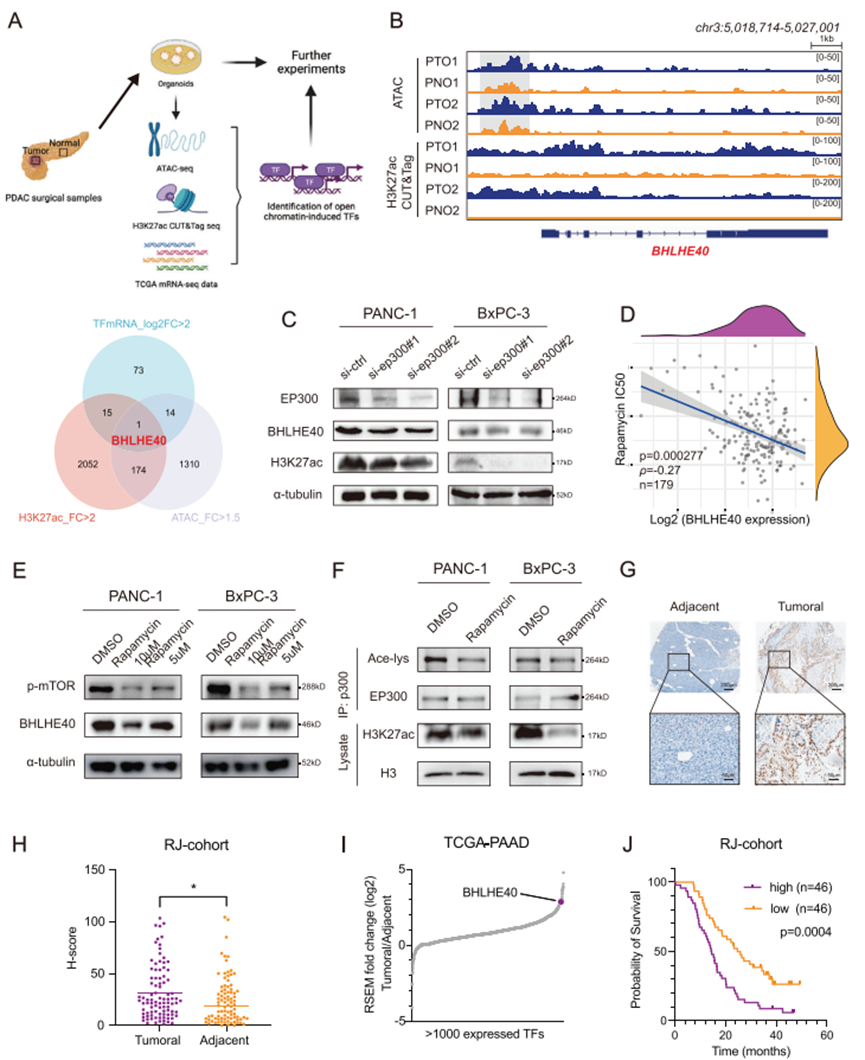
图1. 胰腺导管腺癌中BHLHE40及其上游调控因子的鉴定
2. BHLHE40基因下调可减少肿瘤发生和胰腺癌的转移
在两个高表达的细胞系(PANC-1和BxPC-3)中沉默BHLHE40,并在MIA PaCa-2细胞中过表达BHLHE40。利用蛋白质印迹法(western blot)评估BHLHE40的敲低和过表达(图2A)。BHLHE40敲低降低细胞增殖(图2B)和迁移(图2C)。皮下移植瘤实验表明,BHLHE40沉默细胞诱导的肿瘤显著小于对照诱导的肿瘤(图2D-E)。免疫组织化学染色显示,BHLHE40敲低组中Ki-67丰度降低(图2F)。此外,PET/CT发光信号显示,BHLHE40沉默部分抑制PCa细胞在肝脏中的转移能力(图2G,H)。BHLHE40过表达增强了PCa细胞的体外和体内致瘤性(图2I-K)。同样,在两个已建立的PCa类器官(PTO1和PTO2)中,BHLHE40敲低降低细胞增殖(图2L-N)。因此,这些数据表明BHLHE40具有很强的致癌功能。
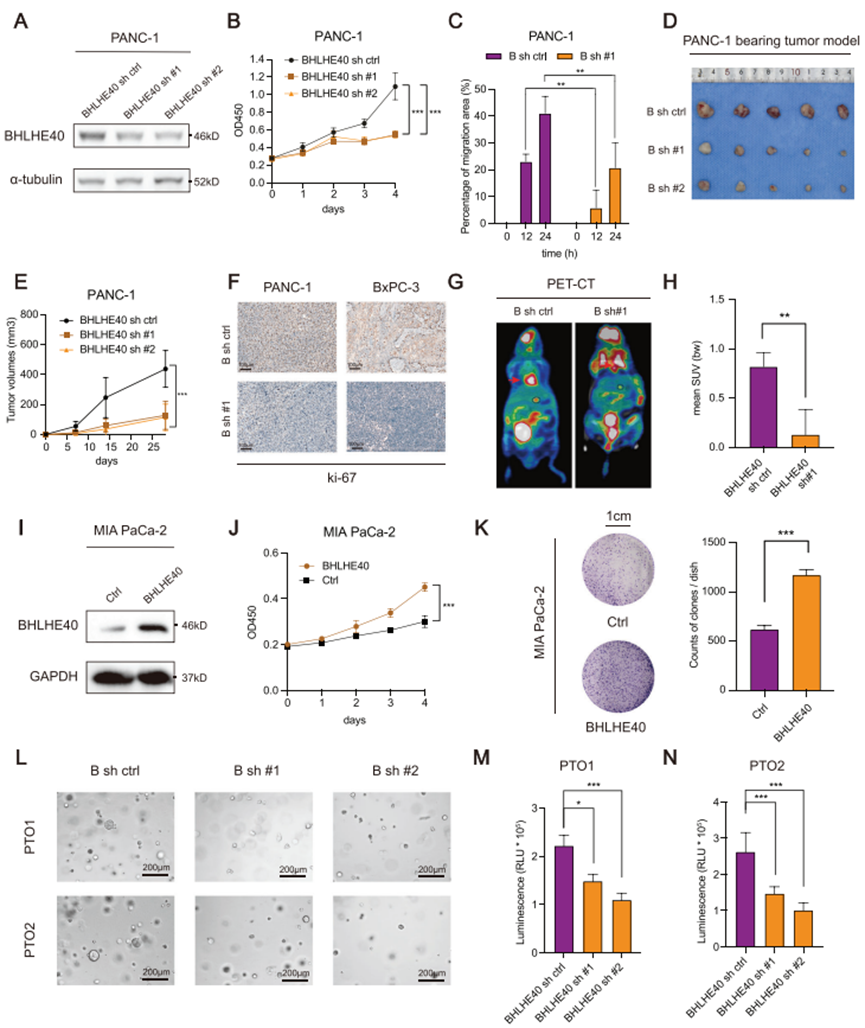
图2. BHLHE40在体内外均可促进胰腺癌的增殖和肝转移
3. BHLHE40通过SREBF1调节胰腺癌脂肪酸代谢关键因子
对BHLHE40沉默的PCa细胞系进行转录组分析(图3A)。DEGs富集在脂肪酸代谢的生物过程中(图3B)。BHLHE40的ChIP-seq表明,BHLHE40主要与启动子和基因间区结合,提示其可能在靶基因的转录调控中发挥多重作用(图3C)。共筛选出187个基因作为RNA-seq和BHLHE40 ChIP-seq数据集的交集组。其中,SREBF1引起兴趣(图3A),因为它调节参与脂肪酸合成的关键因子,并且在几种癌症类型中过表达BHLHE40。ChIP-seq(图3D)和荧光素酶报告基因检测(图3E)的结果表明,BHLHE40与SREBF1的启动子区域结合。此外,对H3K4me3进行了ChIP-qPCR,以确认SREBF1启动子的激活(图3F)。
与其他癌症类型相似,PCa表现出SREBF1的上调(图3G)。较高的SREBF1表达与总生存期降低相关(图3H)。正如预期的那样,沉默BHLHE40降低PCa细胞和类器官中SREBF1及其下游靶点的表达(图3I-J)。免疫荧光(IF)检测表明,在来自PTO1细胞的恶性导管细胞中,BHLHE40与SREBF1共定位(图3K)。综上所述,BHLHE40调控SREBF1的转录,而SREBF1是PCa中脂肪酸代谢的关键因子。
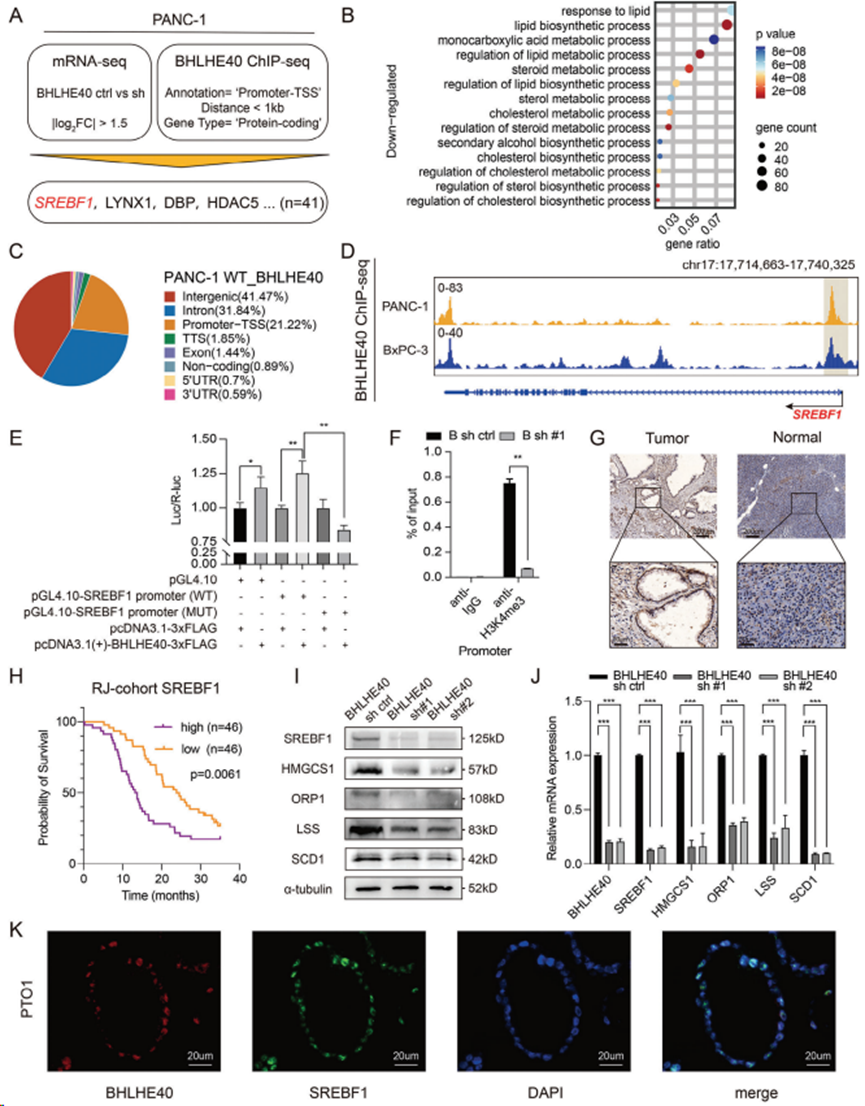
图3. BHLHE40过表达通过改变胰腺癌细胞的致癌转录组促进肿瘤的发生
4. 相分离的BHLHE40凝聚物有助于SREBF1基因座的增强子和启动子区域的连接
在鳞状细胞癌细胞中,SREBF1基因座的侧翼有增强子或超级增强子对PANC-1细胞Hi-C测序数据的分析显示,SREBF1启动子和潜在增强子区域之间存在一个染色体内环;然而,这一环在永生化的正常胰腺上皮细胞系(HPNE)中并不明显(图4A)。沉默BHLHE40降低染色质的开放程度,特别是在BHLHE40结合的SREBF1的启动子和增强子区域(图4A)。在PANC-1细胞中,通过3C检测证实SREBF1增强子和启动子区域之间存在染色体内环。值得注意的是,该环在BHLHE40沉默后未检测到(图4B),提示其由BHLHE40介导。此外,BHLHE40沉默降低基因组水平的H3K27ac修饰,尤其是SREBF1基因座上游的H3K27ac修饰,从而进一步证实BHLHE40对SREBF1转录的调控(图4C)。然而,根据超级增强子排序(Rank order of super - enhancer, ROSE)算法预测,SREBF1位点上游假定的增强子的17 kb片段被移除(图4C),因此SREBF1蛋白水平降低,但BHLHE40过表达不能完全恢复(图4D)。
免疫共沉淀(Co-IP)证实BHLHE40与BRD4、MED1和Pol II的相互作用(图4E)。ChIP-qPCR还表明,这些共激活因子以bhlhe40依赖的方式与SREBF1的启动子和增强子区结合(图4F)。BHLHE40连接启动子和增强子区域,在SREBF1基因座上游形成一个染色体内环。
自然紊乱区域(PONDRs)评分预测因子显示BHLHE40含有大IDR(177 ~ 319个氨基酸的片段)(图5A)。纯化重组mEGFP、mEGFP-BHLHE40(全长,FL)、mEGFP-BHLHE40 (177-319aa)和删除177-319aa的mEGFP-BHLHE40[称为BHLHE40 (Δ177-319aa)]蛋白。mEGFP-BHLHE40 (177-319aa)以浓度依赖性方式形成球形液滴(图5B)。mEGFP-BHLHE40或mEGFP-BHLHE40 (177-319aa)形成的液滴逐渐融合,形成更大更亮的液滴(图5C)。使用2D培养的PTO1和PTO2细胞,可以观察到BHLHE40在细胞核内的点状分布(图5D)。通过测定光漂白后的荧光回收率(FRAP)来测定mEGFP-BHLHE40形成的类液态凝聚物的动态重组和快速交换动力学。光漂白后,mEGFP-BHLHE40点状体在数秒内恢复荧光(图5E-G)。3C检测结果显示,全长BHLHE40可以促进染色体内环的形成,而BHLHE40 (Δ177- 319aa)则不能(图4B)。这些结果表明相分离的BHLHE40凝集物促进SREBF1位点增强子和启动子区域的连接,从而促进SREBF1的转录。
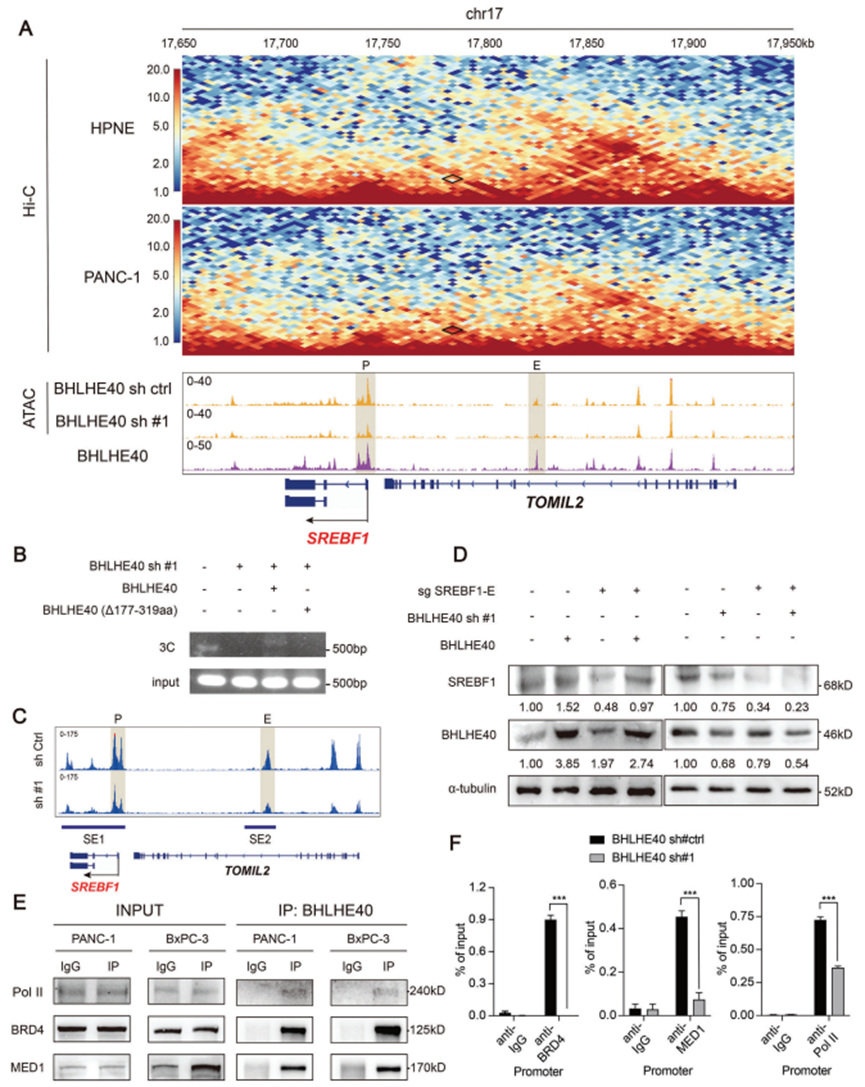
图4. BHLHE40促进SREBF1基因座上游增强子和启动子区域的连接
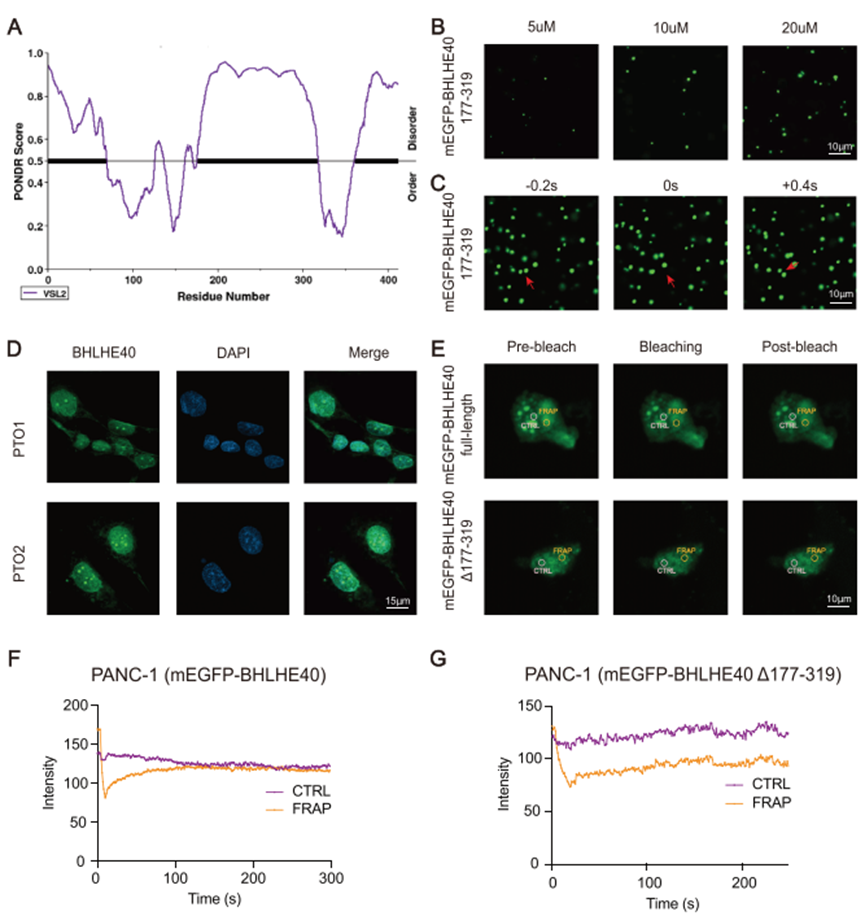
图5. BHLHE40在体内外均可形成相分离凝聚体
5. BHLHE40诱导的SREBF1上调通过SCD1保护PCa细胞免于铁死亡
由于BHLHE40和SREBF1导致PCa中脂肪酸代谢的失调(图3B,C),因此研究BHLHE40通过SREBF1在过氧化作用中的作用。使用BODIPY 581/591 C11探针检测氧化脂质的流式细胞术表明,BHLHE40敲低增加脂质过氧化作用(图6A)。在BHLHE40敲低的细胞中,MDA水平也增强(图6B,C)。此外,BHLHE40或SREBF1敲低的细胞表现出线粒体萎缩和脂滴增加,这类似于RAS-选择性致死蛋白-3(RSL3)诱导的铁依赖性氧化性细胞死亡(图6D-F)。铁死亡抑制剂ferrostatin-1(fer)至少部分消除增强的脂质过氧化作用(图6A-C),并恢复BHLHE40敲低导致的细胞活力下降(图6G,H)。此外,SREBF1沉默促进PCa细胞中的铁死亡(图6I-K)。
为研究BHLHE40抑制铁死亡是否需要SREBF1,在BHLHE40敲低的PCa细胞中过表达SREBF1(图6L)。SREBF1过表达缓解BHLHE40敲低引起的脂质过氧化(图6M,N)。在PCa临床样本中BHLHE40的表达水平与SREBF1和SCD1的表达水平相关(图6O,P)。因此,BHLHE40主要通过上调SREBF1的表达来保护PCa细胞免于铁死亡。
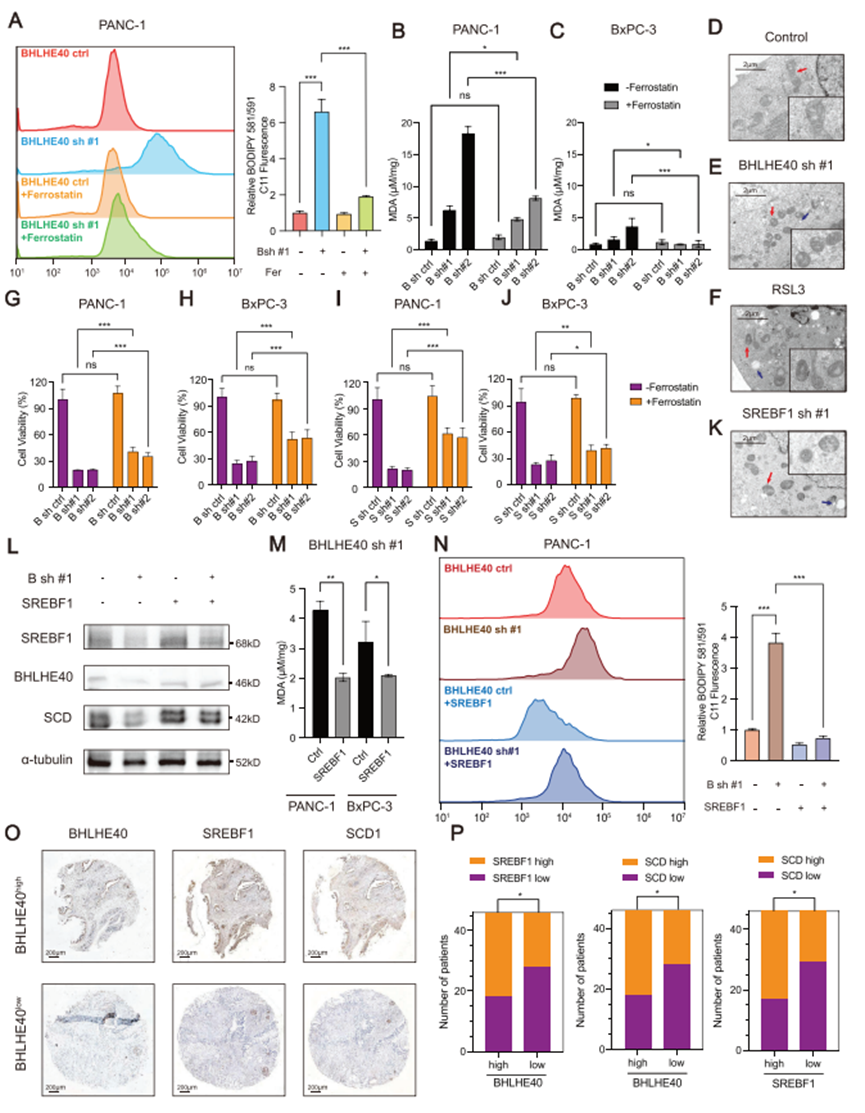
图6. 体内BHLHE40缺失可通过SREBF1促进胰腺癌的铁死亡
6. SREBF1抑制剂(Fatostatin)在BHLHE40高表达的PCa中表现出显著的抗肿瘤疗效
虽然SREBF1抑制剂fatostatin有抑制肿瘤生长和活性的报道,但对PCa细胞的作用尚未明确。fastostatin处理后PANC-1细胞活力明显降低,且呈剂量依赖性;然而,fastostatin处理后MIA PaCa-2细胞的活力没有观察到明显的差异,这可能是由于BHLHE40在MIA PaCa-2细胞中的低表达(图7A)。在患者来源的类器官(图7B、C)和KPC小鼠细胞系的体内胰腺原位模型(图7D-H)中观察到类似结果。此外,IHC染色显示,与BHLHE40表达水平较低的细胞诱导的原位肿瘤相比,BHLHE40表达水平较高的KPC小鼠细胞诱导的原位肿瘤的Ki-67表达水平显著降低(图7I)。因此,这些数据表明,SREBF1抑制剂对PCa具有显著的抗肿瘤作用,这依赖于BHLHE40的表达水平。
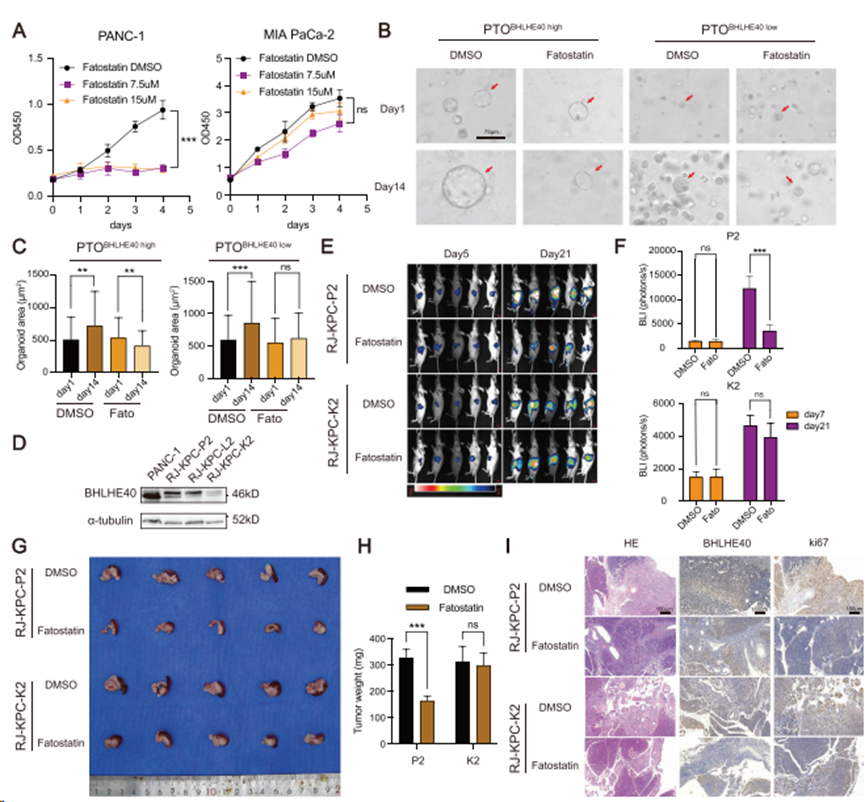
图7. SREBF1的特异性抑制剂fatostatin在PCa中发挥抗肿瘤作用
结论
综上所述,本研究发现染色质开放诱导的BHLHE40表达在肿瘤中显著上调。BHLHE40上调SREBP的详细机制为PI3K-AKT-mTORC-SREBP信号轴提供了新的见解。此外,本研究首次揭示了BHLHE40-SREBF1-SCD1-铁死亡轴在PCa进展中的作用,这可能为以脂肪酸合成和去饱和为靶点的PCa治疗策略的开发提供线索。
实验方法
从胰腺癌手术样本中生成类器官,细胞培养和转染,细胞迁移检测,RNA提取及mRNA-Seq文库制备,雷帕霉素IC50评分与BHLHE40基因表达的Spearman相关性分析,使用GEPIA分析来自TCGA和基因型-组织表达(GTEx)的数据,ChIP-seq,CUT&Tag库生成和测序,核分离和ATAC-Seq文库制备,Hi-C分析和染色体构象捕获实验(3C),差异可达区域的识别,免疫沉淀和免疫印迹,RNA分离及实时荧光定量PCR,克隆形成实验,细胞增殖和活力测定,蛋白质纯化和体外相分离观察,FRAP实验,类器官细胞活力测定,C11-BIDOPY染色,双荧光素酶报告基因检测,MDA测定,透射电镜(TEM)成像,动物研究(皮下和原位模型),细胞凋亡检测,KPC小鼠衍生细胞系的构建
参考文献
Cao Y, Wang X, Liu Y, Liu P, Qin J, Zhu Y, Zhai S, Jiang Y, Liu Y, Han L, Luo J, Zhang R, Shi M, Wang L, Tang X, Xue M, Liu J, Wang W, Wen C, Deng X, Peng C, Chen H, Cheng D, Jiang L, Shen B. BHLHE40 Inhibits Ferroptosis in Pancreatic Cancer Cells via Upregulating SREBF1. Adv Sci (Weinh). 2023 Dec 8:e2306298. doi: 10.1002/advs.202306298. Epub ahead of print. PMID: 38064101.






