T淋巴细胞诱导癌细胞分泌半乳凝素-9,与其他免疫检查点蛋白合作,促进免疫抑制
半乳糖凝集素-9是凝集素蛋白家族的一员,对人体免疫反应起着至关重要的调节作用,特别是因为它具有抑制T淋巴细胞和自然杀伤细胞抗癌活性的能力。最近的证据表明,半乳糖凝集素-9在广泛的人类恶性肿瘤中高表达,包括最具侵袭性的肿瘤,如高级别胶质母细胞瘤和胰腺导管腺癌,以及常见的恶性肿瘤,如乳腺癌、肺癌和结直肠癌。然而,实体肿瘤细胞要么分泌极少量的半凝集素-9,要么在大多数情况下根本不分泌它。作者的目的是阐明T细胞是否可以诱导来自实体恶性肿瘤的人类癌细胞分泌半乳糖凝集素-9,以及与细胞表面蛋白相比,这种可溶性形式是否表现出更高的全身免疫抑制活性。作者的结果强调了半乳糖凝集素-9在抗癌免疫逃避中的关键作用。因此,半乳糖凝集素-9和控制其产生的调控途径应被视为大量癌症免疫治疗的关键靶点。该文发布于2023年1月《Journal of ImmunoTherapy of Cancer》,IF=10.9。
技术路线:
主要研究结果:
1、T淋巴细胞激活源自实体恶性肿瘤的人癌细胞的半乳糖凝集素-9分泌
作者研究了T细胞是否能诱导来自实体恶性肿瘤的人癌细胞分泌半乳糖凝集素-9。作者研究了那些自身不分泌半乳糖凝集素-9的细胞和那些分泌少量这种蛋白质的细胞。此外,作者还测试了非恶性快速增殖的人类细胞,包括HaCaT角质形成细胞和原代人类胚胎细胞。所有被测试的细胞都清晰地表达了可检测到的且通常含量很高的半凝集素-9。肿瘤细胞模型选用MCF-7乳腺癌细胞、WT3ab Wilms肿瘤细胞、G401肾横纹肌样肿瘤细胞和LN-18高级别胶质母细胞瘤细胞。所有细胞与Jurkat T细胞按1:1的比例共培养16小时。然后分离Jurkat T细胞,用新鲜培养基洗涤2-3次,然后用各自的细胞特异性培养基孵育共培养的细胞。细胞培养4小时,分别于2、3、4小时检测半凝集素-9的分泌。分离后,Jurkat T细胞分泌的半凝集素-9几乎无法检测到。人类癌细胞分泌高水平的半乳糖凝集素-9,HaCaT角质形成细胞分泌较少,人类胎儿细胞产生几乎无法检测到的蛋白质(图1A)。作者早期的研究证实了半乳糖凝集素-9在MCF-7、WT3ab、HaCaT和原代人胚胎细胞中的表达。然后作者研究了不同类型的T细胞是否能诱导半乳糖凝集素-9的分泌。为了进行比较,作者将MCF-7人乳腺癌细胞与Jurkat T细胞(cd4阳性)、TALL-104细胞毒性(cd8阳性)淋巴细胞以及原代人cd3阳性T细胞共培养。所有共培养按1:1的比例进行16小时,然后按上述方法处理。分离后,所研究的T细胞均未分泌半乳糖凝集素-9 (Jurkat T细胞除外,其分泌量几乎无法检测到(<100 pg/mL))。然而,在所有三种情况下,MCF-7细胞都分泌大量的半凝集素-9(图1B)。如上所述,在所研究的贴壁细胞中,在没有T淋巴细胞的情况下,只有LN-18能够在静止状态下分泌可检测到(但含量很低)的半凝集素-9(图1C)。然后作者研究了CD4或CD8蛋白是否参与T细胞诱导的半凝集素-9分泌。作者将原代人T细胞与MCF-7细胞在CD4或CD8中和抗体存在或不存在的情况下共培养16小时。然后,如上所述,分离T细胞,然后在条件培养基中测量培养的MCF-7细胞在2、3和4小时后释放的半凝集素-9水平。在MCF-7和原代人T细胞共培养16小时的培养基中也测量了半乳糖凝集素-9。细胞上Western分析证实了抗CD4和抗CD8与原代T细胞的结合。作者发现这两种抗体都不能显著减少t细胞诱导的MCF-7细胞中半乳糖凝集素-9的分泌,这表明CD4和CD8不太可能参与这一过程。然而,由于作者看到抗CD8抗体引起的效果略有降低,作者将高活性的LN-18胶质母细胞瘤细胞与Jurkat T(仅表达CD4而不表达CD8蛋白)细胞共培养16小时,如上所述。然后分离Jurkat T细胞,LN-18细胞培养4小时,2小时、3小时和4小时后在条件培养基中测量半凝集素-9水平。在LN-18和Jurkat T细胞共培养16小时的培养基中也测量了半乳糖凝集素-9。作者证实抗cd4在Jurkat T细胞上高表达,而使用细胞上的Western分析几乎检测不到抗cd8。此外,作者用流式细胞术测量了共培养后Jurkat T细胞中的CD4和CD8,发现它们CD4阳性,而CD8水平几乎无法检测到。CD4和CD8中和抗体对T细胞诱导的LN-18细胞半凝集素-9分泌无影响。在抗cd8抗体存在的情况下,观察到半乳糖凝集素-9分泌非常轻微(不显著)的减少,与MCF-7细胞相似。然而,由于Jurkat T细胞中缺乏CD8表达,这不太可能是特异性的。重要的是,FACS分析证实共培养后LN18细胞中没有任何CD4的痕迹。MCF-7细胞只表达一种半乳糖凝集素-9结合受体- Tim-3,16 16 WT3ab细胞只表达T细胞活化抑制因子(VISTA)蛋白和微量的Tim-3,16而LN-18细胞同时表达Tim-3和VISTA。作者评估了半乳糖凝集素-9是否在复合物中与其受体片段一起释放,这些片段可以作为该蛋白的载体/转运者。作者免疫沉淀半乳糖凝集素-9,在不煮沸样品的情况下使用Western blot分析检测。当MCF-7细胞与Jurkat T细胞共培养时,这导致半乳糖凝集素-9以Tim-3片段复合物的形式分泌(图2A)。然而,在WT3ab细胞中,它以与VISTA片段复合物的形式分泌(图2B)。与Tim-3不同,VISTA在SDS-PAGE电泳中与半乳糖凝集素-9分离,证实了作者之前报道的Tim-3与VISTA相比对半乳糖凝集素-9具有更高亲和力的发现。这两种受体都存在于LN-18中,其中Tim-3是半乳糖凝集素-9的载体(图2C),这与作者之前对同样表达Tim-3和VISTA受体的原代人胚胎细胞的发现一致,作者希望评估MCF-7和细胞毒性TALL-104细胞之间的相互作用,以发现MCF-7衍生的半凝集素-9是否能够调理细胞毒性T细胞。MCF-7和TALL-104细胞按1:1的比例共培养,然后按上述方法分离。裂解TALL-104细胞,从静止的TALL-104裂解物中装载约50-60µg/孔的细胞总蛋白,用于Western blot检测半乳糖凝集素-9(这些细胞表达低量的半乳糖凝集素-9和Tim-3)。然后,作者在与T细胞共培养后裂解的TALL-104细胞中加载较少的蛋白(约15µg/孔)。结果,在与MCF-7细胞共培养的TALL104细胞的裂解物中,作者观察到抗tim -3和抗半乳糖凝集素-9抗体均可检测到约52 kDa的条带(图3A)。这与MCF-7细胞分泌的半乳糖凝集素-9相对应(图3B),在半乳糖凝集素-9免疫沉淀后的培养基中检测到。重要的是,该复合物对TALL-104细胞表面受体的亲和力低于对运输它的Tim-3的亲和力。作者可以排除这不是TALL104细胞产生的内部复合物,因为已知该内部复合物在Tim-3脱落前的分子量约为70 kDa。另外,作者发现TALL-104与MCF-7细胞共培养后,半凝集素-9 mRNA水平显著下调。VISTA mRNA水平也有相同的观察结果,而Tim-3 mRNA水平显著上调(详见图3C)。在MCF-7细胞中,Tim-3和半乳糖凝集素-9 mRNA水平均显著上调(图3D)。同时,TALL-104细胞相对不能将颗粒酶B传递到MCF-7细胞中(图3E, F),这与作者之前的观察结果一致。
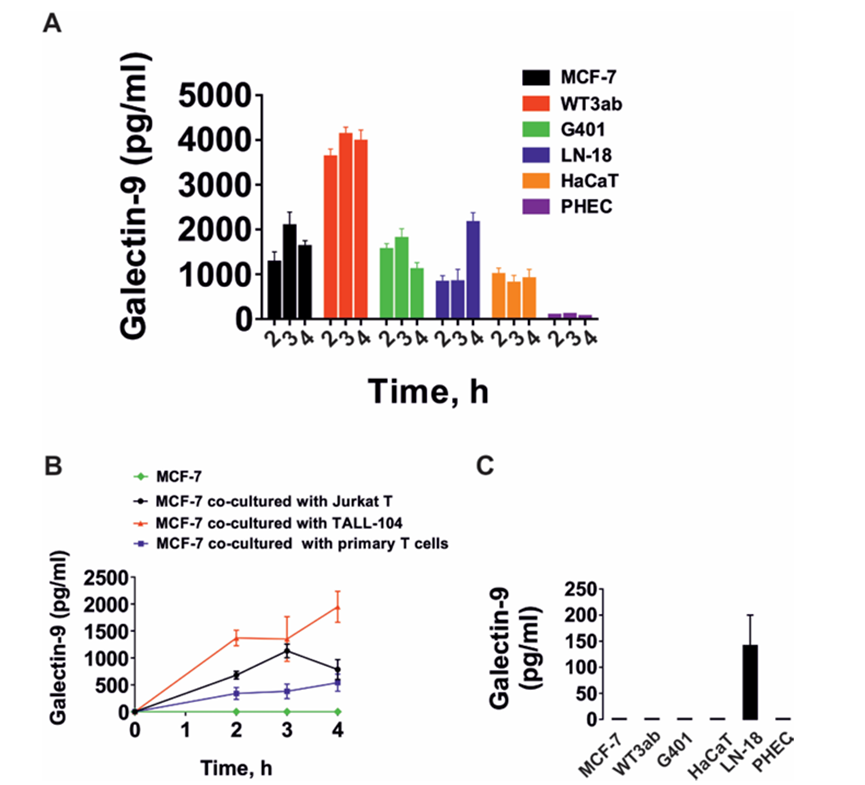
图1、T细胞诱导来自实体恶性肿瘤和角质形成细胞的人癌细胞分泌半凝集素-9
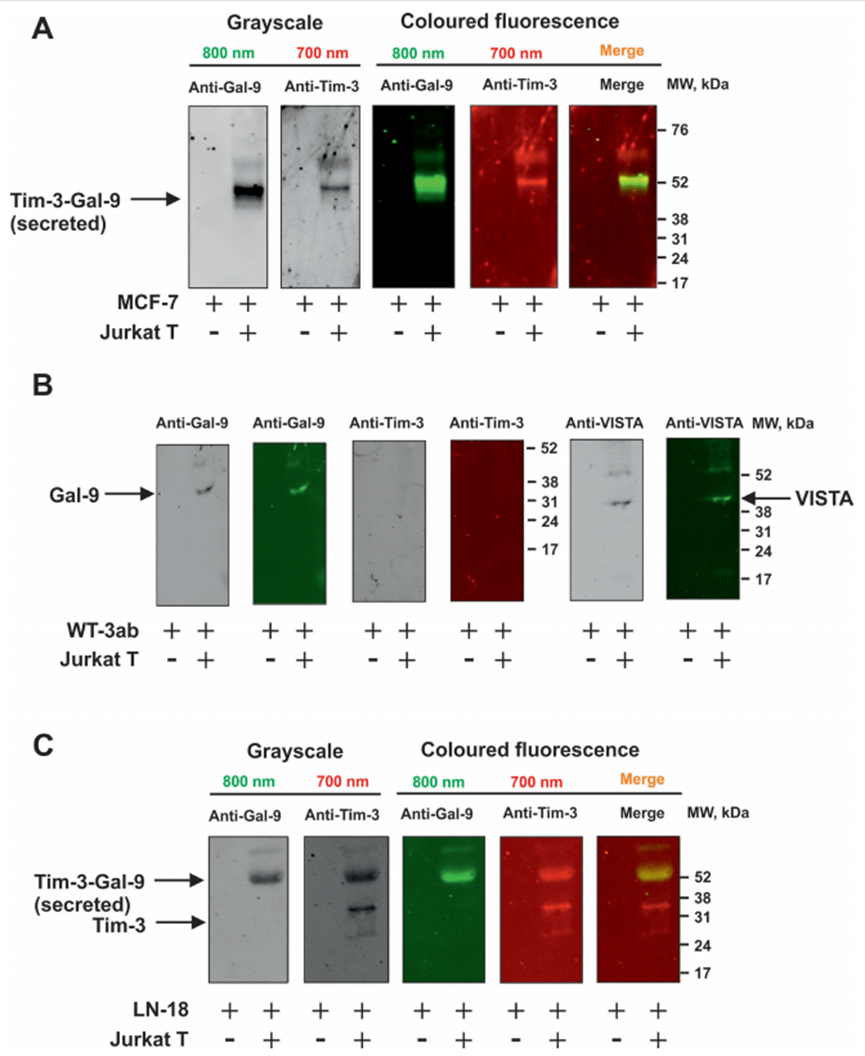
图2、Tim-3或VISTA在分泌过程中干扰半乳糖凝集素-9
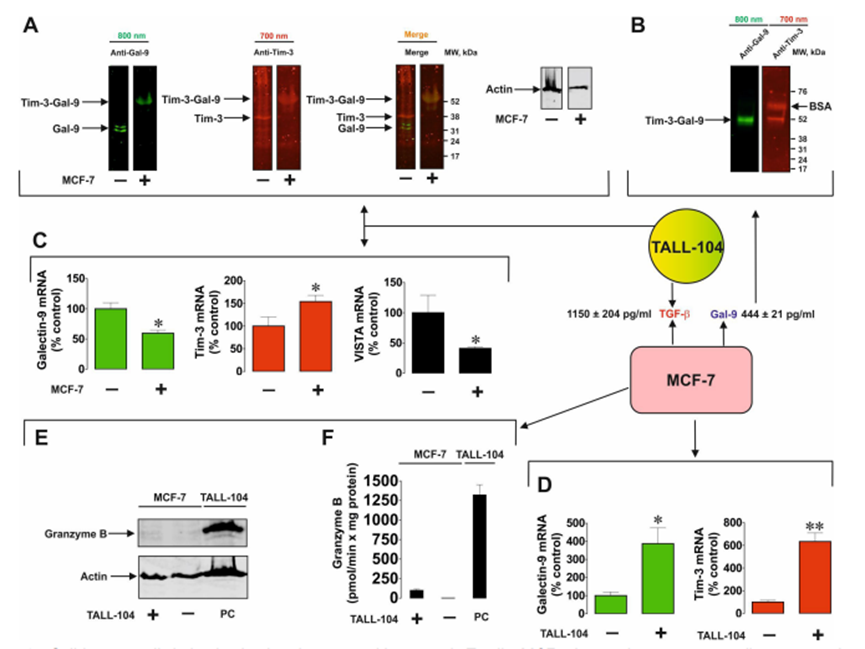
图3、实体肿瘤细胞来源的半乳糖凝集素-9与细胞毒性T细胞相互作用。MCF-7人乳腺癌细胞与TALL-104按1:1的比例共培养16小时
2、来源于实体恶性肿瘤的人癌细胞在T细胞诱导下有两种半乳糖凝集素-9分泌机制
作者考虑了来自实体恶性肿瘤的人类癌细胞T细胞诱导半乳糖凝集素-9分泌的两种不同机制的可能性。作者将MCF-7和Jurkat T细胞按1:1的比例共培养16小时,然后如上所述分离它们,随后将MCF-7细胞在新鲜培养基中培养4小时,在2、3和4小时时测量半凝集素-9的分泌。细胞在不同抑制剂存在或不存在的情况下共培养。其中包括U73122 (PLC抑制剂)、Gö6983 (PKC抑制剂)、液泡素-1(溶酶体胞吐抑制剂)、AZD2014 (mTOR抑制剂)、EDTA(基质金属蛋白酶抑制剂)和含有溶酶体蛋白酶和基质金属蛋白酶阻滞剂的蛋白酶抑制剂混合物(PIC)(图4A)。作者发现Gö6983、液泡素-1、EDTA和PIC下调分泌(图4B)。AZD2014上调了这种分泌,这表明它是自噬依赖性溶酶体分泌(液泡素-1的抑制作用证实了这一点),而不像AML细胞中半乳糖凝集素-9的分泌是自噬依赖性的。这些结果表明半乳糖凝集素-9的分泌有两种机制。第一个是该蛋白易位到细胞表面,然后通过基质金属蛋白酶(如AML细胞)从细胞表面脱落。另一种是自噬体的形成,随后是溶酶体胞吐作用,其中半乳糖凝集素-9也脱落。这一结论是基于PIC阻断溶酶体蛋白酶和基质金属蛋白酶后半乳糖凝集素-9的分泌减少。参与该过程的PKC最有可能是钙依赖性和二酰基甘油(DAG)非依赖性的(PLC对分泌过程没有影响)。作者通过将MCF-7与Jurkat T细胞以1:1的比例共培养2小时,然后使用Fluo4活性染料检测细胞内钙水平,检查MCF-7细胞内钙水平是否上调,方法见材料和方法部分。作者发现,与静止的MCF-7细胞相比,与Jurkat T细胞共培养的MCF-7细胞的细胞内钙水平显著上调。这表明环境支持激活Ca2+依赖性PKC异构体,该异构体与该酶的DAG/Ca2+依赖性异构体Gö6983一起被抑制。
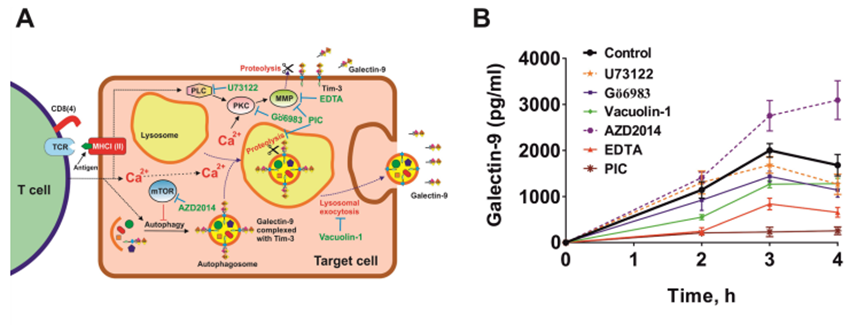
图4、T细胞诱导MCF-7人乳腺癌细胞分泌半乳糖凝集素-9可通过两种机制发生。
3、半凝集素-9可以协同VISTA抑制T淋巴细胞的抗癌活性
然后作者研究了半乳糖凝集素-9的免疫抑制活性,以及它如何与其他免疫检查点合作以实现T细胞失活。首先,作者将MCF-7人乳腺癌细胞与Jurkat T细胞(具有T辅助活性的CD4阳性细胞)以1:1的比例共培养16小时,无论是否存在9S2-1半乳糖凝集素-9中和(阻断)抗体或同型对照抗体。在孵育完成后,作者在细胞培养基和Jurkat T细胞裂解物中测量了IL-2。作者还分析了Jurkat T细胞裂解物中磷脂酰肌醇3-激酶(PI-3K)的活性(PI-3K活性及其途径有助于辅助性T细胞中IL-2的表达,并表明TCR信号的激活)。重要的是,静止的Jurkat T细胞分泌的IL-2几乎无法检测到,而MCF-7则不分泌任何IL-2。作者发现,Jurkat T细胞在与MCF-7细胞相互作用过程中产生的分泌(但不是细胞相关IL-2的水平)以及IL-2的总量(分泌+在裂解物中检测到的细胞相关水平)在半乳糖凝集素-9中和抗体而不是同型对照抗体的存在下显着降低(图5A)。对PI-3K也观察到同样的效果。这意味着半乳糖凝集素-9支持PI3K在Jurkat T细胞中的激活,并通过它们增强IL-2的产生。然后,作者将Jurkat T细胞与LN-18(与MCF-7细胞不同,LN-18也表达VISTA)以1:1的比例共培养16小时。作者发现,在LN-18的存在下,Jurkat T细胞并不比静止的Jurkat T细胞分泌更多的IL-2。然而,转化生长因子-β 1型(TGF-β)和半乳糖凝集素-9的分泌水平高度上调(图5B)。与作者之前的研究结果一致,作者发现TGF-β在mRNA和蛋白水平上上调了LN-18细胞中半乳糖凝集素-9和VISTA的表达。然后,作者将LN-18细胞与原代人cd -3阳性T细胞共培养,并评估IL-2、颗粒酶B、TGF-β和半乳糖凝集素-9在培养基中的释放。作者发现颗粒酶B和IL-2的释放水平没有增加,但TGF-β的产生和半乳糖凝集素-9的分泌均显著上调(图5C)。重要的是,当LN-18细胞与Jurkat T细胞或原代人T淋巴细胞共培养时,细胞表面的VISTA水平显著上调。ELISA未检测到LN-18分泌的VISTA。为了评估VISTA对半乳糖凝集素-9在T细胞中触发的事件的贡献,作者在缺乏或存在半乳糖凝集素-9或vistan中和抗体的情况下共培养LN-18和Jurkat T细胞。作者发现,当半乳糖凝集素-9被中和时,IL-2的分泌(与MCF-7细胞存在时不同)没有改变,但当VISTA被中和时,IL-2的分泌会上调(图6A)。在Jurkat T细胞裂解液中也观察到同样的效果。这意味着VISTA有助于抑制T辅助活性。为了确认PI-3K在IL-2产生中的作用,作者在共培养中加入了30µM LY294002 (PI-3K抑制剂),发现PI-3K的活性和IL-2的释放都减弱了(图6A)。重要的是,经FACS分析证实,Tim-3存在于与Jurkat T细胞共培养的LN-18细胞表面,并且与半乳糖凝集素-9的表达水平几乎相同。为了排除Tim-3参与观察到的效应,作者按照上述方法在存在或不存在Tim-3中和抗体(4BS)的情况下共培养细胞。Tim-3中和对PI-3K活性和IL-2释放均无影响(图6A)。下一步是用异种移植模型在体内证实观察到的效果。首先,为了验证LN-18细胞是否能够抑制小鼠T细胞活性,作者在不存在半乳糖凝集素-9或VISTA中和抗体的情况下,以1:1的比例与小鼠T细胞共培养16小时。作者发现共培养导致细胞培养基中释放的颗粒酶B具有大量活性(图6B)。当半乳糖凝集素-9中和时,这种活性进一步高度上调,当VISTA中和时,这种活性也显著上调(图6B)。当半乳糖凝集素-9或VISTA被中和时,LN-18细胞的活力分别降低(图6B)。小鼠IL-2分泌只有在VISTA被中和时才会上调,这与LN-18与Jurkat T细胞共培养时的观察结果一致(图6A)。小鼠T细胞裂解物中的人半乳糖凝集素-9(总细胞相关半乳糖凝集素-9)通过ELISA(与小鼠半乳糖凝集素-9无交叉反应)进行测量,如材料和方法部分所述。作者发现,当半乳糖凝集素-9被中和时,它在T细胞中几乎不存在,而当VISTA被中和时,它在小鼠T细胞中的水平显著下调(图6B)。VISTA中和的这种效果也可能是半乳糖凝集素-9无法在小鼠T细胞上结合VISTA的结果。
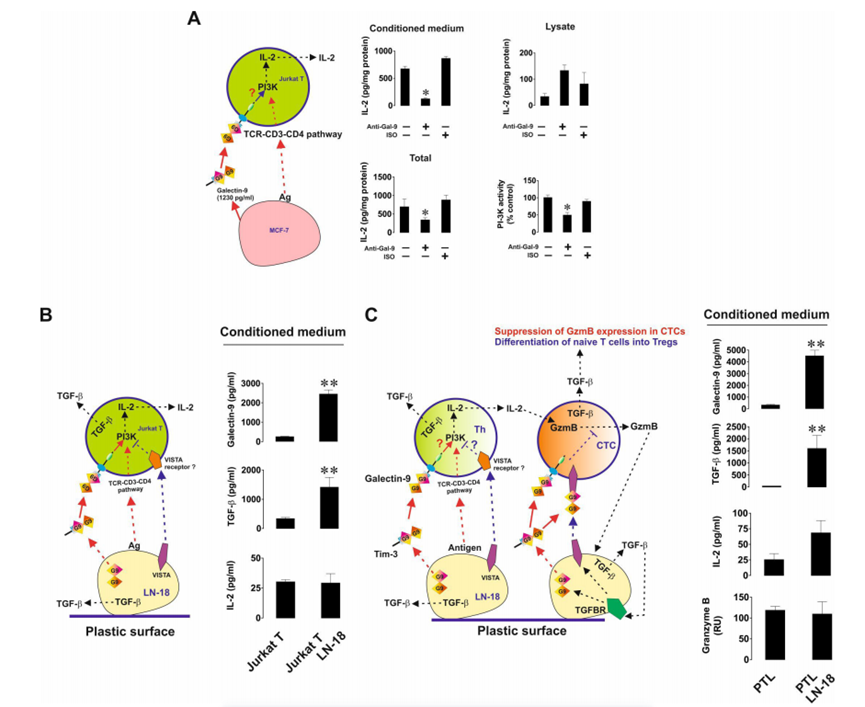
图5、来源于实体恶性肿瘤的人癌细胞产生的半乳糖凝集素-9触发辅助性T细胞的PI-3K激活和il - 2产生。表达半乳糖凝集素-9和VISTA的人类癌细胞抑制辅助性和细胞毒性T细胞活性
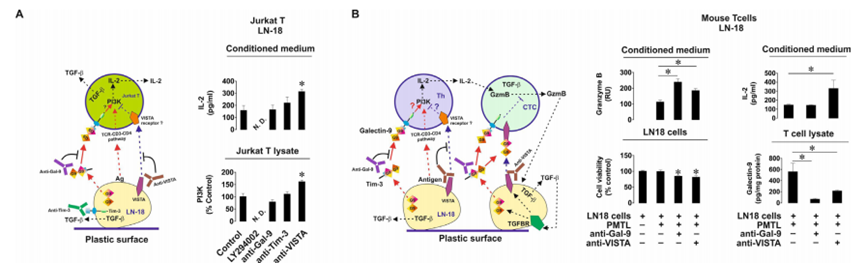
图6、VISTA与半凝集素-9协同抑制辅助性T细胞和细胞毒性T细胞的活性
4、来源于实体恶性肿瘤的人癌细胞能够分泌半乳糖凝集素-9,在体内抑制细胞毒性T细胞的活性
为了在体内证实作者的发现,作者使用了C57 BL16小鼠。以5只小鼠作为对照组,其余5只小鼠分别皮下注射2×106 LN-18细胞(具有高度致瘤性),5小时后分析其血液(由于这些小鼠具有免疫活性,并且植入人LN-18具有高度活性,因此在LN-18细胞被小鼠免疫抑制之前,用5小时的时间观察其最大的免疫逃避反应)。首先,作者分离了LN-18细胞注射区域,并将其置于细胞裂解缓冲液(50 mM Tris pH 7.5, 150 mM NaCl, 5 mM EDTA和0.5% NP-40)中进行软均质,以溶解分泌到微环境中的蛋白质,并获得其中存在的裂解的造血细胞。作者发现获得的匀浆含有高水平的人半乳糖凝集素-9(图7A),但不含任何人VISTA。在对照组中检测不到这两种蛋白。对照组和ln -18注射组。注射微环境(皮下区域,LN-18细胞被注射)含有T细胞,因为在匀浆中可以清楚地检测到CD3蛋白(图7A)。注射ln -18的小鼠血浆中含有明显可检测到的人半乳糖凝集素-9(对照组未检测到)。这些小鼠的T细胞裂解物也显示出高水平的人半乳糖凝集素-9,这在对照动物的T淋巴细胞中检测不到(图7B)。此外,血浆TGF-β水平高度上调(图7B)。作者还评估了人半乳糖凝集素-9是否影响小鼠T淋巴细胞的抗癌细胞毒活性。为此,将小鼠T细胞与100 nM PMA预处理的等量K562细胞以1:1的比例与从对照和注射ln -18的小鼠中分离的小鼠原代T细胞共培养24小时。细胞共孵育24小时,测定K562细胞活力。作者发现,与未与小鼠T淋巴细胞共培养的细胞和与注射了LN-18细胞的小鼠的T细胞共培养的细胞相比,K562细胞与对照组小鼠T细胞共培养的细胞的活力显著降低(图7C)。因此,可以得出结论,人半乳糖凝集素-9下调小鼠T淋巴细胞的细胞毒活性。
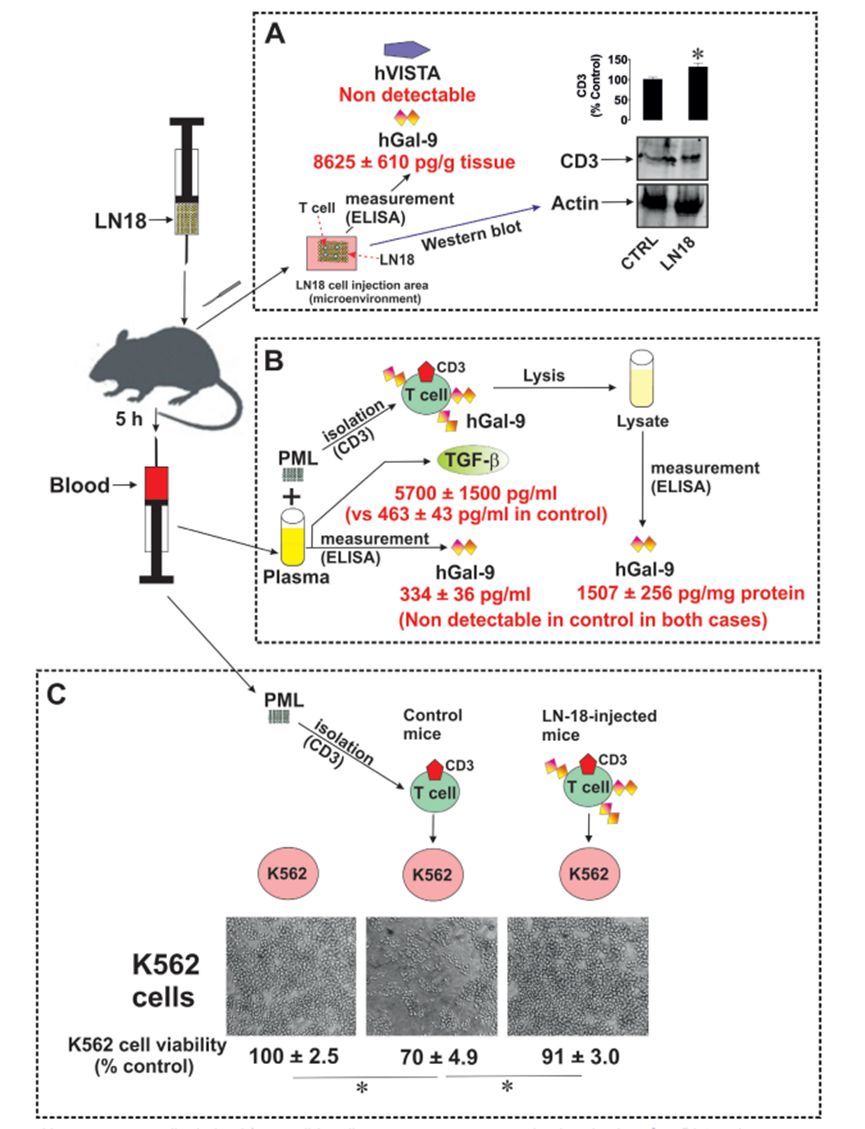
图7、来源于实体恶性肿瘤的人癌细胞在体内分泌半乳糖凝集素-9。C57 BL16小鼠皮下注射致瘤性LN-18细胞(每只小鼠2 × 106个细胞)。然后在注射的微环境中测量CD3蛋白、人半乳糖凝集素-9和VISTA
结论
综上所述,作者的研究结果首次表明,来自实体恶性肿瘤的人类癌细胞在与T细胞相互作用时能够高度分泌半乳糖凝集素-9。半乳糖凝集素-9是通过转运到细胞表面后的蛋白水解脱落以及与自噬和蛋白水解脱落相关的溶酶体分泌而分泌的。当非恶性细胞(如角质形成细胞)暴露于T细胞时,这一策略也适用,从而解释了在银屑病发展过程中,角质形成细胞如何抑制T细胞,从而抑制攻击角质形成细胞的T细胞,随后是角质形成细胞的增殖。当暴露于T细胞时,胎儿细胞不会分泌半乳糖凝集素-9,这表明胚胎细胞的目的只是抑制攻击胚胎的T细胞,而不是抑制T细胞免疫本身。VISTA还通过抑制辅助性T细胞产生IL-2来增强半乳糖凝集素-9的免疫抑制作用,并可能进一步阻止细胞毒性T细胞的功能。这包括对PI-3K等信号通路的负面影响,影响BCL-XL抗凋亡蛋白的活性,以及如先前报道的通过改变其膜电位。因此,半乳糖凝集素-9本身及其产生相关的表达系统(如TGF-β/Smad3信号通路)可以被认为是多种癌症免疫治疗的特异性和高效靶点。
实验方法
WB、ELISA、qPCR、细胞内钙含量测定、On-cell Western、细胞活力测定
参考文献
Schlichtner S, Yasinska IM, Lall GS, Berger SM, Ruggiero S, Cholewa D, Aliu N, Gibbs BF, Fasler-Kan E, Sumbayev VV. T lymphocytes induce human cancer cells derived from solid malignant tumors to secrete galectin-9 which facilitates immunosuppression in cooperation with other immune checkpoint proteins. J Immunother Cancer. 2023 Jan;11(1):e005714. doi: 10.1136/jitc-2022-005714. PMID: 36599470; PMCID: PMC9815087.






