急性缺血诱导空间和转录上不同的小胶质细胞亚群
缺血性卒中后,缺血核心和梗死灶周围区的损伤影响患者预后。微胶质细胞立即对缺血性打击做出反应,引发免疫炎症,在卒中后的细胞损伤中发挥着重要作用。然而,微胶质细胞的多样性和涉及的机制仍然不清楚。我们首先对三个时间点的大鼠大脑进行了scRNA-seq和空间转录组学(ST),以确定与卒中相关的微胶质细胞亚簇及其空间分布。此外,通过RNAscope和免疫荧光技术在大鼠中验证了微胶质细胞亚群特异性标记基因的表达和不同微胶质细胞亚群的定位。进行基因集变异分析(GSVA)以揭示微胶质细胞亚群的功能特征。此外,使用调查通路分析(IPA)来探索微胶质细胞亚群的上游调控因子,通过免疫荧光、RT-qPCR、shRNA介导的基因敲除和定向代谢组学进行确认。最后,在特定微胶质细胞亚群操纵后,评估大鼠MCAO模型中的梗死灶大小、神经功能缺陷和神经元凋亡。我们在MCAO大鼠大脑中发现了与卒中相关的微胶质细胞亚群。我们还确定了这些微胶质细胞亚群的新标记基因,并根据它们的空间分布将这些细胞定义为缺血性核心相关(ICAM)和梗死灶相关(IPAM)的微胶质细胞。ICAM由损伤相关分子模式诱导,可能由糖酵解提供动力,并表现出增加的促炎细胞因子和趋化因子产生。BACH1是驱动ICAM生成的关键转录因子。相反,梗死灶中富含的糖皮质激素可能触发IPAM的形成,这些细胞可能由柠檬酸循环和氧化磷酸化提供动力,并以中等的促炎反应、抗炎代谢特征和髓鞘营养特性为特征。ICAM可能引起过度神经炎症,加剧脑损伤,而IPAM可能表现出神经保护特性,对于梗死灶中细胞的稳态和存活可能至关重要。我们的研究结果为以特定微胶质细胞亚群为靶点的治疗策略提供了生物学基础,成为缺血性卒中的潜在治疗策略。该研究于2023年12月发表在《Genome medicine》,IF:12.3。
技术路线:
结果:
1、细胞类型的鉴定
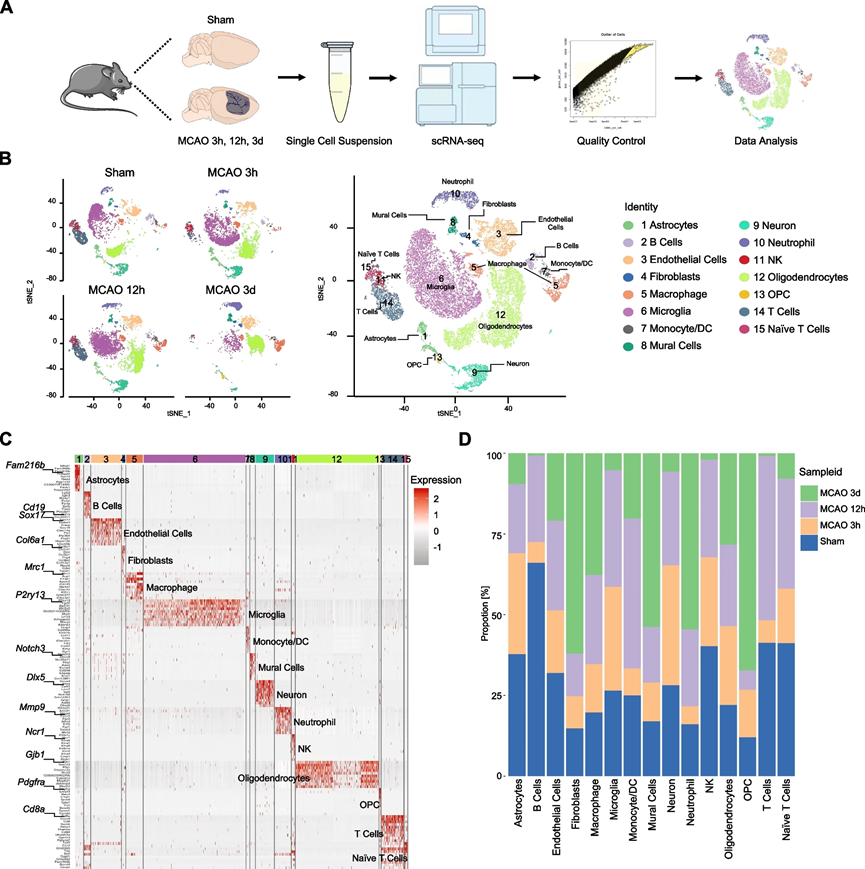
为了全面表征缺血性卒中后缺血半球主要细胞类型的变化,我们在经历短暂性大鼠中脑动脉阻塞(MCAO)的大鼠的脑样本中,采用scRNA-seq技术,在再灌注后的不同时间点(3小时、12小时和72小时)以及模拟大鼠上进行了细胞分离(图1A)。3小时和12小时的时间点代表了缺血性卒中的亚急性阶段,而72小时的时间点被选为进行急性阶段变化的转录分析。总共评估了39,333个细胞,每个细胞平均含有1672-8800个独特的分子标识符(UMIs),经过严格的CellRanger质量控制。在四个组中,每个细胞的平均基因数为901-2636。
接下来,我们进行了无监督聚类,并根据经典基因标记表达进行了细胞类型的注释。如t-分布随机邻居嵌入(t-SNE)图中所示,鉴定了15种不同的细胞类型,包括B细胞、内皮细胞、壁细胞、自然杀伤细胞(NK细胞)、单核/树突细胞(DC细胞)、成熟型寡能神经胶质细胞(OPC)、T细胞、星形胶质细胞、成纤维细胞、巨噬细胞、微胶质细胞、神经元、中性粒细胞、寡能神经胶质细胞和原始T细胞(图1B)。值得注意的是,微胶质细胞、寡能神经胶质细胞和内皮细胞占细胞总数的大多数。我们确定了每种细胞类型的所有标记基因,并在热图中显示了前10个标记基因(图1C)。
与先前的发现一致,缺血性打击后浸润的巨噬细胞和中性粒细胞数量逐渐增加,表明血脑屏障功能失调。此外,OPC的数量在手术后72小时显著增加,表明中风后OPC的增殖,这与先前的研究结果一致。我们还观察到在缺血后星形胶质细胞数量逐渐减少,而在72小时时微胶质细胞显著减少,这可能归因于急性缺血性损伤(图1D)。总体而言,这些数据提供了对缺血半球细胞组成的基本描述。
2、缺血诱导两种类型的小胶质细胞亚簇
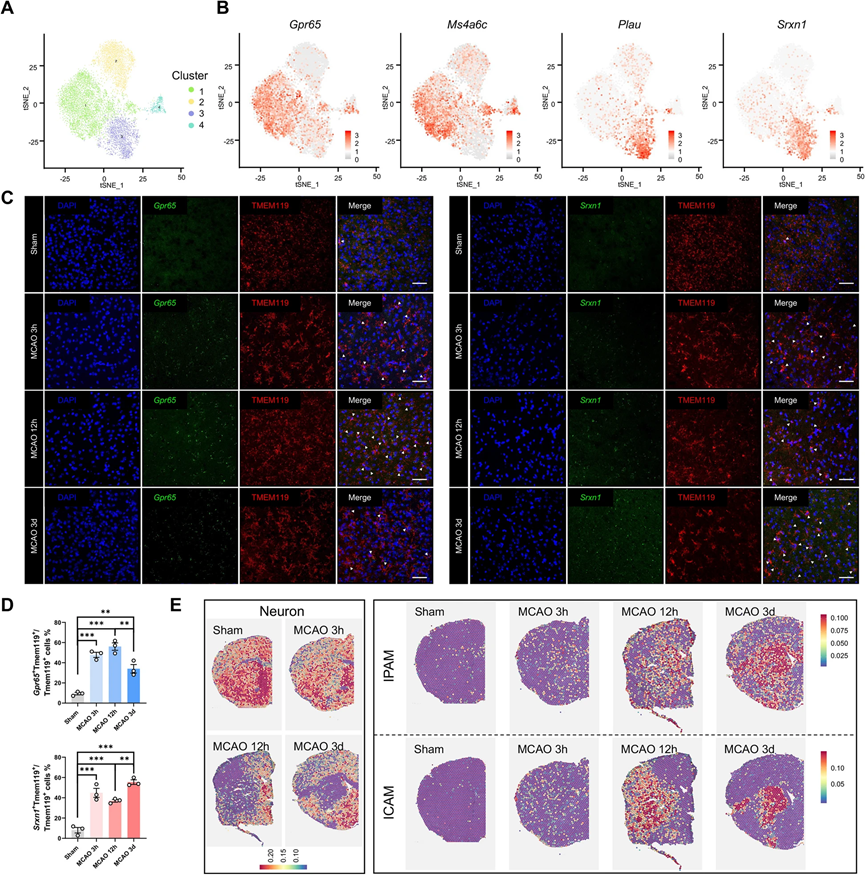
考虑到微胶质细胞在大脑中的重要性和微胶质细胞转录组的高质量,我们将焦点放在了单细胞水平的微胶质细胞上。我们在不同时间点确定了微胶质细胞的差异表达基因(DEGs)。与先前的研究结果一致,微胶质细胞DEGs的KEGG分析表明,在缺血性卒中的急性阶段,微胶质细胞的吞噬和炎症能力增强,代谢发生改变。此外,微胶质细胞被分为四个亚群进行进一步的分析(图2A)。根据亚群比例图,模拟组中94%的微胶质细胞属于亚群2。此外,微胶质细胞的稳态基因(Tmem119、P2ry12、P2ry13、Csf1r、Cx3cr1、Hexb)在亚群2中高度表达,表明亚群2可能由稳态微胶质细胞组成。亚群4(465个细胞)包括相对较少数量的微胶质细胞,在模拟和MCAO大鼠之间变化不大;因此,亚群4的表型和功能特征未进一步研究。亚群1和亚群3占据了MCAO组中微胶质细胞的大多数。这些发现将亚群1和亚群3定位为缺血性卒中急性阶段的关键角色,并提出了它们如何协调缺血性攻击适应的问题。
进行差异基因表达分析以识别亚群特异性标记基因。大多数高表达的基因也是亚群特异性的,表明微胶质细胞亚群具有独特的基因表达模式(图2B)。亚群1表达了先前未报道的标记基因(例如,Pik3ip1、Cd300lf、Gpr65、Ms4a6c、Cep152、Ddit4、Zbtb16、Abhd15、Bmf和Arhgap24)。在亚群3中,Lgals3、Plau、Srxn1、Ankrd33b、Gas2l3、Nes、Edn1、Fam129b、Vat1和Fmn1的表达上调。前10个亚群特异性标记基因可可靠地识别微胶质细胞亚群1和亚群3。此外,疾病相关微胶质细胞(DAM)曾被确定为与阿尔茨海默病(AD)相关的一种独特的微胶质细胞亚型。我们检查了我们数据集中已确定的DAM标记基因的表达水平。在四个亚群中,一些基因(例如Tyrobp、Trem2、Apoe、Timp2和B2m)的表达保持不变。在亚群3中,一些基因的表达上调,例如Lgal3、Fth1、Cstb、Csf1、Cd63、Cd9、Ccl3和Lilrb4a,而与稳态微胶质细胞(亚群2)相比,亚群1中这些基因的表达保持不变,表明亚群3可能表现出DAM样的特征。
为了确定亚群1和亚群3是否具有时间特性,我们使用RNAscope(ACD,Newark,CA,USA)进行了RNA-蛋白共染色,使用亚群1特异性标记基因Gpr65和亚群3特异性标记基因Srxn1标记不同的微胶质细胞群体(图2C)。在再灌注后,亚群1和亚群3均作为对缺血性打击的迅速反应者(图2D)。为了确认亚群1和亚群3是否也存在于其他关于缺血性卒中的单细胞RNA测序研究数据中,我们重新分析了几个现有的缺血性卒中后微胶质细胞的数据集(GSE174574,GSE197731,GSE227651)。与我们的结果一致,亚群1和亚群3在它们的t-SNE微胶质细胞图中可以清晰地区分出来。
为了确定亚群1和亚群3是否与梗死核心存在任何空间关系,我们使用了空间转录组学(ST)来研究模拟和MCAO大鼠的脑切片。尽管ST几乎无法达到单细胞分辨率,但仍然可以通过计算与scRNA-seq数据相关的亚群特异性标记基因的平均表达来获得脑切片中不同细胞亚群的大致位置。为了定义缺血性核心,我们还查询了在脑切片上每个点的下调表明神经元丧失的神经元基因。引人注目的是,亚群3标记基因占据了缺血性核心,而亚群1标记基因则环绕着缺血病灶在缺血后12小时(图2E)。因此,我们将亚群1定义为缺血性梗死后的微胶质细胞(IPAM),将亚群3定义为缺血性梗死核心相关的微胶质细胞(ICAM)。
为了验证这些发现,我们在免疫荧光实验中使用ICAM特异性的LGALS3作为ICAM标记,而选择PIK3IP1作为IPAM标记。在12小时和72小时时,ICAM标记在缺血性核心中显著富集。IPAM标记在12小时时在缺血性梗死灶周围的位置也得到了确认。此外,ICAM特异性标记(Lgals3)和IPAM特异性标记(Pik3ip1、Gpr65和Ms4a6c)也在ST中可视化显示。我们还根据图2E将脑切片分为两个区域(缺血性核心和梗死周围区)。在缺血性核心中上调的基因被定义为缺血性核心基因(ICGs),而在梗死周围上调的基因被称为缺血性梗死周围基因(IPGs)。与ICGs重叠的ICAM标记更多,与IPGs重叠的IPAM标记也更多,进一步验证了ICAM和IPAM的空间分布。因此,我们的数据揭示了两个在缺血性卒中应答中涉及的在空间上和转录上具有不同特性的微胶质细胞亚群。
3、ICAM 和 IPAM 表现出截然不同的特征
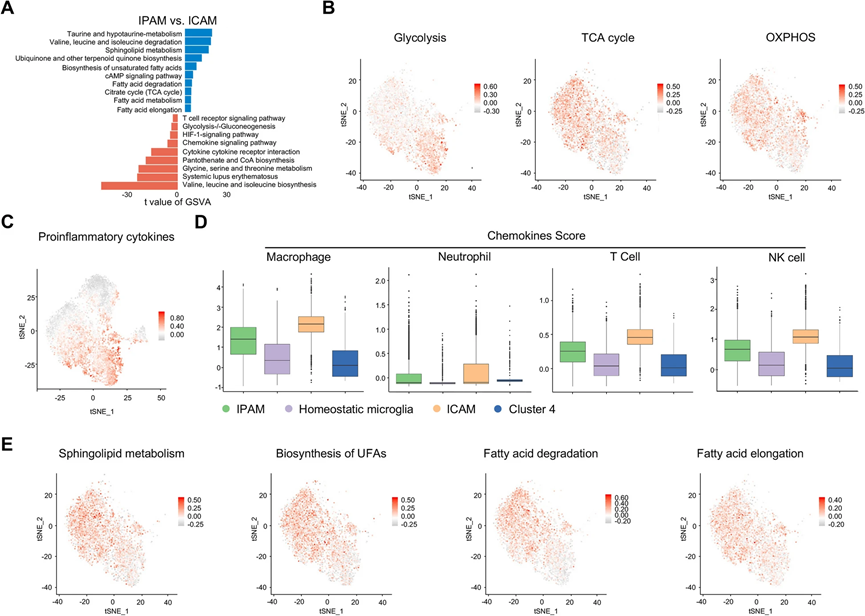
对于功能实验,我们对IPAM和ICAM进行了基因集变异分析(GSVA)(图3A)。我们发现ICAM可能在代谢上更依赖于糖酵解,而IPAM可能依赖于三羧酸循环(TCA)和氧化磷酸化(OXPHOS),通过使用Seurat中的AddModuleScore 计算与感兴趣的代谢途径相关的基因的表达来证实(图3A、B)。一致地,“氧化磷酸化”和“柠檬酸循环”在IPG中也富集,如KEGG分析所示。ICAM中“断裂”的TCA循环也可能导致中间产物水平的增加,如ICAM中增强的泛酮酸和辅酶A生物合成所示。此外,在IPAM中观察到AMPK和cAMP信号通路的上调,表明IPAM使用了完全不同的能源来源(图3A)。此外,微胶质细胞的代谢重编程依赖于HIF-1α通路,ICAM中HIF-1α通路也高度表达(图3A)。
我们进一步发现相对于其他亚群,ICAM中存在一些促炎和炎症响应基因(Il1a、Il1b、Il6、Il18、Tnf、Hmox1、Ptgs2)的表达上调(图3C)。此外,巨噬细胞和中性粒细胞在MCAO后12小时开始浸润大脑,并在72小时时聚集在梗死核心,这表明这些外周免疫细胞在空间上与ICAM存在重叠。由于微胶质细胞是缺血性卒中中各种趋化因子的主要来源,我们检查了ICAM和IPAM中驱动不同外周免疫细胞招募的一系列趋化因子的表达。因此,ICAM中富集了不同外周免疫细胞中相关趋化因子基因集的表达(图3D)。具体而言,与IPAM相比,ICAM中Ccl2、Ccl3、Ccl4、Ccl5、Cxcl2和Cxcl16的表达水平更高。此外,KEGG分析一致表明,促炎信号通路(“TNF信号通路”、“IL-17信号通路”、“MAPK信号通路”)在ICG中显著富集。这些发现表明由ICAM介导的过度促炎和趋化反应,提示ICAM可能在缺血性卒中急性阶段加速组织损伤,具有不利影响。
此外,与ICAM相比,GSVA分析显示,IPAM中与氨基酸、脂质和碳水化合物相关的几个代谢途径显著富集(图3A)。支链氨基酸(BCAAs)如缬氨酸、亮氨酸和异亮氨酸的水平在ICAM中升高,而在IPAM中BCAAs降解被增强(图3E)。此外,IPAM中其他氨基酸的代谢,如牛磺酸,也富集(图3A)。根据GSVA数据,脂质代谢在IPAM中也很活跃,包括鞘脂代谢、主要胆酸生物合成、不饱和脂肪酸生物合成、脂肪酸降解和延长,通过AddModuleScore确认(图3A,3E)。此外,IPAM中富集的代谢途径(“BCAAs降解”、“不饱和脂肪酸生物合成”、“脂肪酸降解”、“脂肪酸延长”、“鞘脂代谢”)在ST中也显示了一个梗死周围的分布。
由于脂质代谢产物是髓鞘的重要组成部分,IPAM可能通过供应脂质组分来补偿寡突细胞。此外,我们使用CellPhoneDB 分析了IPAM-寡突细胞相互作用中的配体-受体相互作用。已经确定了几对配体-受体对,其中GRN-SORT1是其中最显著的一对。为了测试GRN是否具有寡突细胞营养的潜力,我们用重组小鼠GRN(rmGRN)处理寡突细胞,发现rmGRN显著促进了MAG的表达。
总的来说,这些独特的特征至少在一定程度上塑造了微胶质细胞的应答,并为理解微胶质细胞亚群在对缺血刺激的响应中不同的激活状态提供了新的视角。
4、M1/M2 二分法无法对缺血后的小胶质细胞亚簇进行分类
在历史上,基于体外刺激,微胶质细胞曾经简单地被分类为促炎性的“M1”和抗炎性的“M2”。然而,根据我们的数据,M1极化评分的增加总是伴随着不同时间点上升的M2极化评分(图4A)。我们想知道我们的无监督聚类是否与这种表型分类相对应。为了测试这个假设,我们分别在IPAM和ICAM上执行了M1/M2极化评分。然而,ICAM的M1和M2极化评分都高于IPAM(图4B-D)。此外,IPAM和ICAM在缺血损伤后的不同时间点上展现出相同的M1/M2极化改变趋势(图4E-F)。
接下来,我们还进行了伪时轨迹分析,并观察到在缺血后出现了明显的分歧轨迹。为了阐明这两个分支是否与M1-和M2-表型微胶质细胞一致,我们检查了不同轨迹中M1/M2标记基因的表达。在这两个分支之间,M1/M2标记基因的表达仍然没有显著差异(图4G)。基于许多关于M1/2微胶质细胞的已发表的体内研究,我们注意到研究人员使用Iba-1,这不仅在微胶质细胞中表达,而且在巨噬细胞中也表达,作为微胶质标记。他们还使用CD86和CD16(由Fcgr4编码)标记“M1”微胶质细胞,使用Arg1和CD206(由Mrc1编码)标记“M2”微胶质细胞。然而,根据我们的scRNA-seq数据,“M1”微胶质细胞标记物(Cd86和Fcgr4)在微胶质细胞和巨噬细胞中均有表达,而“M2”微胶质细胞标记物(Arg1和Mrc1)主要在巨噬细胞中表达,表明渗透的巨噬细胞可能被错误地认定为经典定义的“M2”微胶质细胞(图4H)。因此,M1/M2的二分法可能无法识别不同的微胶质细胞亚群,并描绘它们在缺血后的功能。
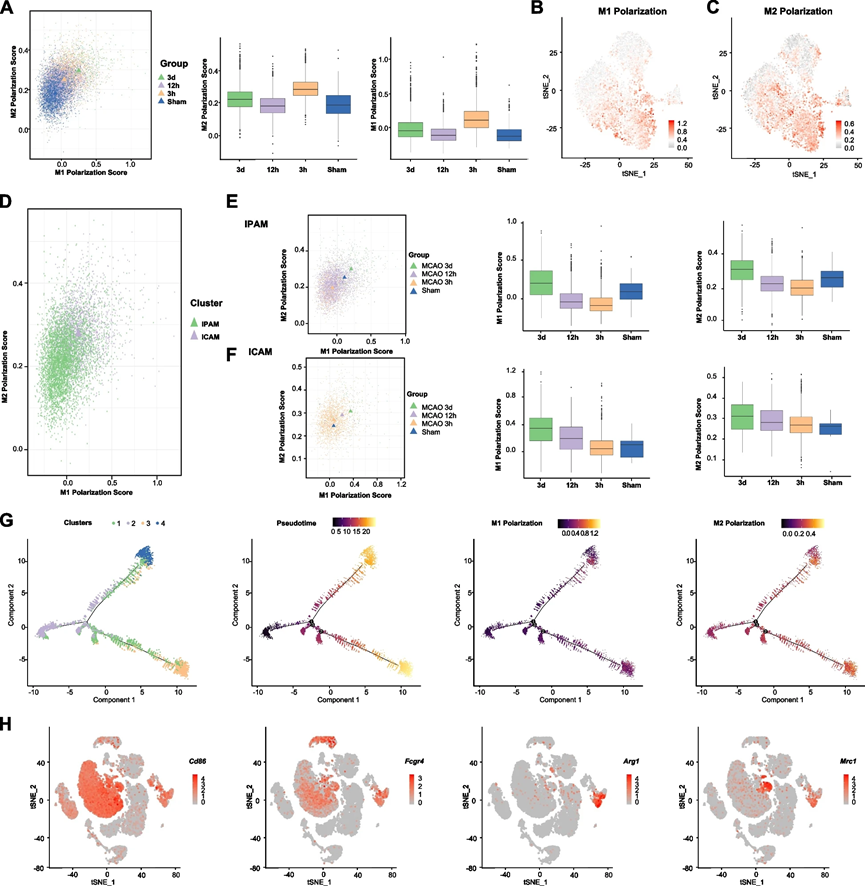
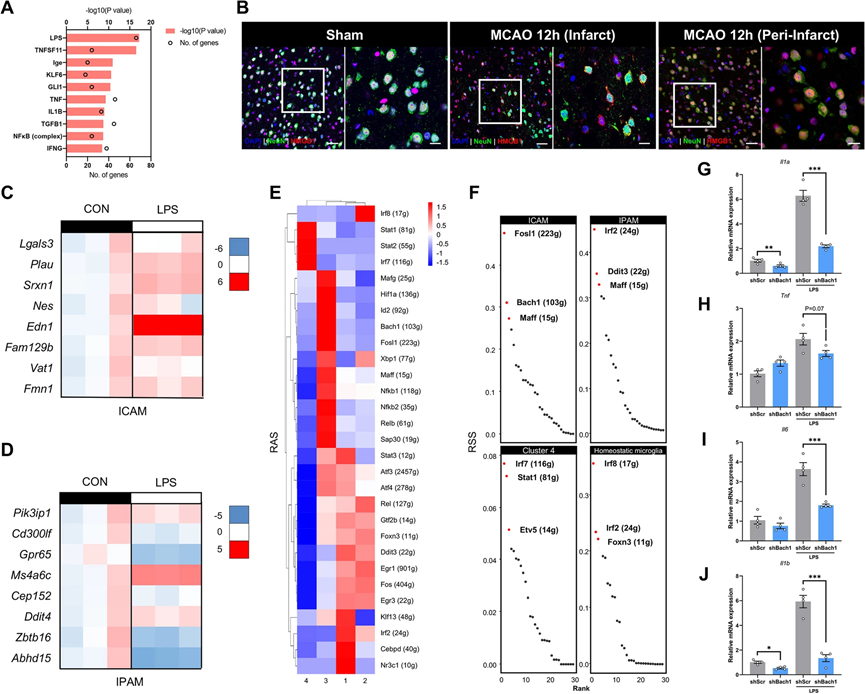
5、关键 DAMP 和调节子驱动 ICAM 生成
我们假设区域微环境信号可能驱动微胶质细胞代谢和功能的转变,使其朝着ICAM和IPAM方向发展。通过使用Ingenuity System Pathway Analysis(IPA)软件(QIAGEN),我们发现脂多糖(LPS)是推动ICAM生成的最重要的潜在因素之一(图5A)。由于LPS是TLR4激活的经典配体,我们调查了在脑缺血后释放的TLR4内源性配体HMGB1的空间分布。在MCAO后的12小时内,在梗死核内受损神经元内明显出现HMGB1的胞质转位,这表明HMGB1,作为一种被广泛认识的损伤相关分子模式(DAMP),在梗死核释放并可能驱动ICAM的形成(图5B)。我们发现在LPS刺激后,大多数ICAM特异性标记基因在初级微胶质细胞中显著上调,而IPAM标志基因的表达变化较小(图5C,D)。为了调查垂死神经元释放的DAMP是否诱导ICAM的生成,我们还通过多次冻融小鼠神经细胞系HT-22制备了神经源性的DAMP,如先前描述的 。结果表明,处理HT-22源DAMP的初级微胶质细胞显著上调了ICAM标记基因,而IPAM标记没有显著差异。
除了细胞外的微环境信号外,我们还研究了哪些细胞内调控因子驱动ICAM的生成。使用单细胞调控网络推断和聚类(SCENIC)分析 来阐明缺血性卒中后微胶质细胞亚群形成的关键分子机制。通过全面考虑调控子活性评分(RAS)和调控子特异性评分(RSS),我们确定FOSL1和BACH1是最强大的ICAM特异性转录因子(TFs)之一(图5E,F)。研究表明,在ST中,Fosl1在急性缺血后在缺血区域上调和富集。此外,BACH1下游靶基因的富集分析(使用Metascape)发现它们与炎症显著相关(例如,“细胞迁移的正调控”,“MAPK级联的正调控”,“TNF-α NF-κB信号通路”,“细胞因子产生的调控”,“MyD88无依赖TLR4级联”,“IL-17信号通路”,“对氧化应激的应答”和“模式识别受体信号通路”),这与ICAM的促炎作用一致。为了验证BACH1对ICAM的调控能力,我们转染了携带靶向Bach1的短发夹RNA(shRNA)的慢病毒的BV2细胞。Bach1-knockdown在LPS刺激后下调了ICAM特异性标记基因(Edn1,Plau)的表达水平,表明BACH1有潜力将稳态微胶质细胞转化为ICAM。此外,LPS刺激后,经典的促炎因子,包括Tnf,Il1a,Il6和Il1b,在Bach1-knockdown细胞中也下调了(图5G-J)。
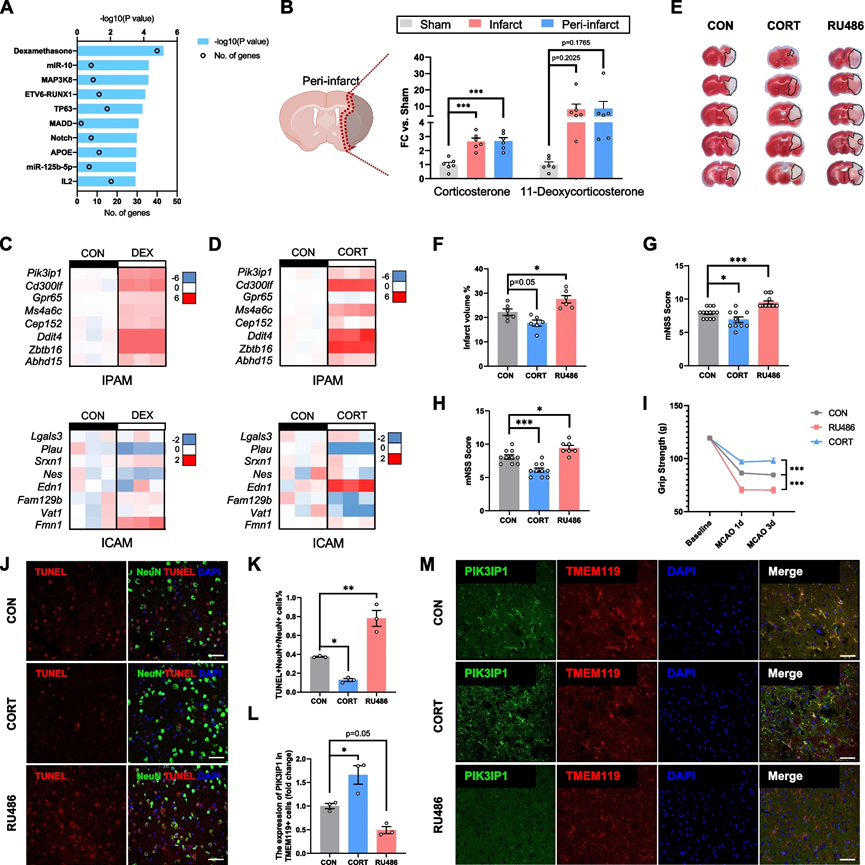
6、糖皮质激素触发 IPAM 形成
为了识别IPAM的关键上游调控因子,使用了前200个IPAM标记基因进行IPA。令人惊讶的是,地塞米松(DEX)是诱导IPAM最强大的刺激因素(图6A)。为了探索中风后糖皮质激素浓度的变化,我们进一步利用高通量靶向代谢组学来筛选在缺血后显示变化的类固醇。根据定量数据,皮质酮和11-去氧皮质酮的水平在MCAO后在缺血核心和梗死周围区域均显著增加(图6B)。为了验证,我们使用DEX刺激初级微胶质细胞,强烈诱导了IPAM的生成,并显著增强了IPAM特异性标记基因的表达(图6C)。此外,小鼠主要的肾上腺皮质类固醇皮质酮也显著上调了初级微胶质细胞中IPAM特异性标记基因的表达,表明糖皮质激素具有推动IPAM生成的强大能力(图6D)。
为了在小鼠中验证这些发现,对MCAO小鼠进行了皮质酮或糖皮质激素受体拮抗剂(RU486)的处理。令人惊讶的是,接受皮质酮处理的MCAO小鼠显示出相对较轻的神经功能缺陷(图6E-I)和减少的神经元凋亡(图6J,K)。然而,在小鼠中RU486的投与导致更严重的神经功能缺陷(图6E-I)和加剧的神经元死亡(图6J,K)。
为了在不同实验组中研究IPAM的变化,我们采用了免疫染色并测量了微胶质细胞中PIK3IP1的表达。与对照组相比,PIK3IP1的平均荧光强度在皮质酮处理组中显著更高,而在RU486处理组中相对较低(图6L,M)。因此,这些体外和体内的发现验证了糖皮质激素在推动IPAM生成以及在缺血性卒中的急性阶段中IPAM的神经保护性质中的决定性作用。
实验方法:
慢病毒转导、梗塞体积测量、神经行为测试、t-SNE 降维、scRNA-seq、GSVA、伪时间分析、轨迹推断、SCENIC、TUNEL染色、空间转录组测序、实时定量 PCR、Western blot、RNAscope、靶向代谢组学。
参考文献:
Li, H., Liu, P., Zhang, B. et al. Acute ischemia induces spatially and transcriptionally distinct microglial subclusters. Genome Med 15, 109 (2023).






