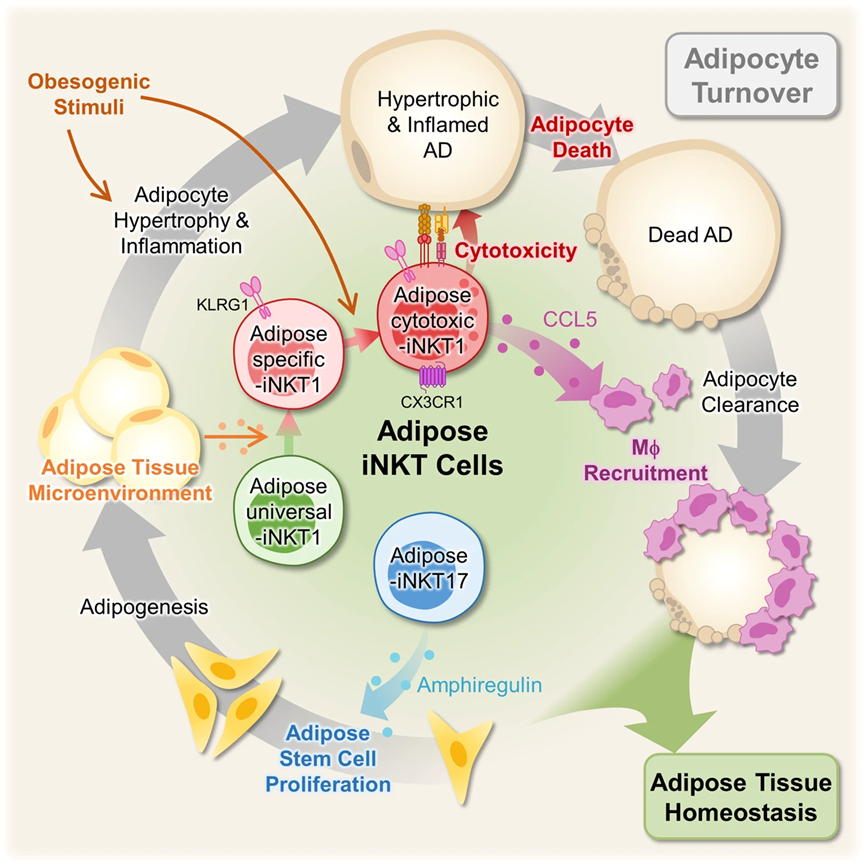
独特的脂肪组织不变自然杀伤 T 细胞亚群控制小鼠脂肪细胞更新
脂肪组织不可变自然杀伤T细胞(iNKT细胞)是肥胖动物脂肪组织稳态的关键细胞类型。然而,脂肪iNKT细胞的异质性及其在脂肪细胞周转中的功能尚未彻底了解。在本研究中,我们利用单细胞RNA测序技术在瘦和肥胖小鼠中调查了脂肪iNKT细胞的转录异质性及其层次结构。我们报告了脂肪iNKT细胞的不同亚群通过调节脂肪组织的稳态影响脂肪细胞的死亡和出生。我们确定了KLRG1+ iNKT细胞作为脂肪组织中独特的iNKT细胞亚群。通过移植实验,我们发现KLRG1+ iNKT细胞在脂肪组织微环境中有选择地生成,并在肥胖小鼠中分化为CX3CR1+细胞毒性亚群。此外,CX3CR1+ iNKT细胞特异性地杀死肥大和炎症性的脂肪细胞,并通过CCL5招募巨噬细胞。此外,脂肪iNKT17细胞具有分泌AREG的潜力,而AREG参与刺激脂肪干细胞增殖。总体而言,我们的数据表明每个脂肪iNKT细胞亚群通过与脂肪细胞、脂肪干细胞和巨噬细胞的相互作用,在控制脂肪细胞周转方面发挥关键作用。
该研究于2023年12月发表在《Nature communications》,IF:16.6。
机制图:
技术路线: 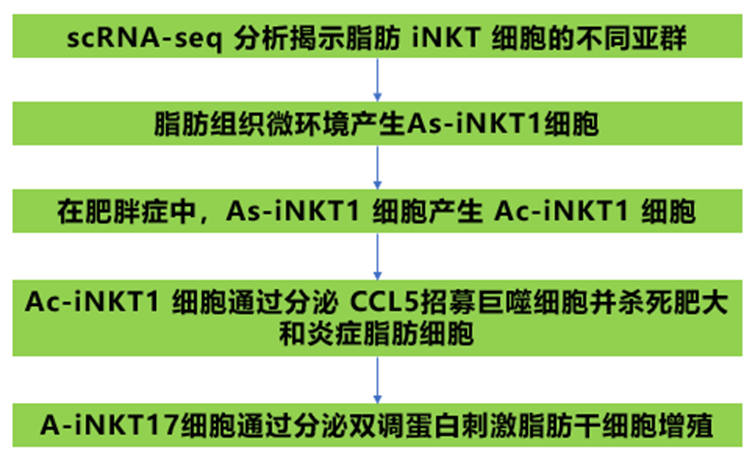 结果:
结果:
1、scRNA-seq 分析揭示脂肪 iNKT 细胞的不同亚群
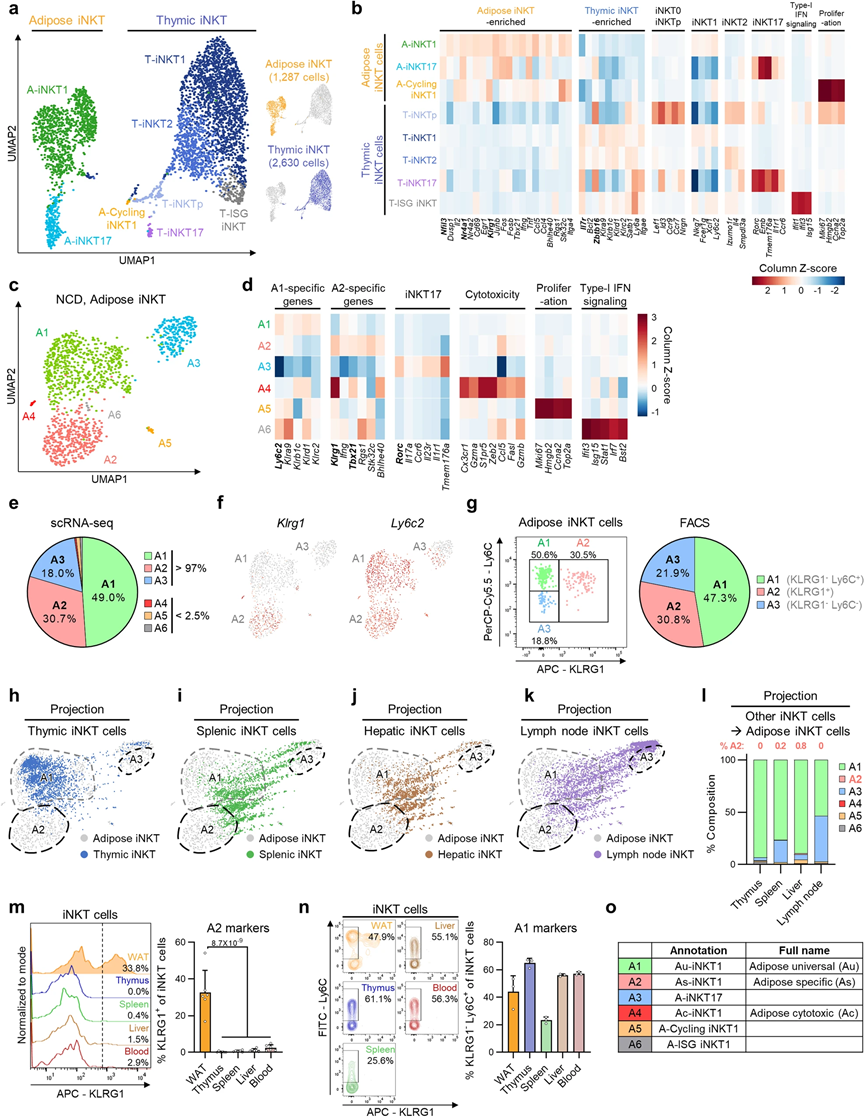
虽然与其他器官的iNKT细胞相比,脂肪iNKT细胞似乎具有组织特异性的特征,但目前很大程度上不清楚脂肪iNKT细胞的组织特异性特征是否有助于它们在脂肪细胞周转中的功能。为了解决这个问题,我们对从附睾WAT中分选出的iNKT细胞进行了单细胞RNA测序,并将其与从胸腺分选出的iNKT细胞进行了比较,在胸腺中,iNKT细胞发育。如图1a、b所示,脂肪iNKT细胞和胸腺iNKT细胞分别形成了不同的簇,表明它们在组织特异性基因表达方面存在明显的分子特征:在WAT中为Nfil3(也称为E4BP4)、Klrg1和Nr4a1,而在胸腺中为Zbtb16(也称为PLZF)和Il7r。这些组织特异性基因表达谱与先前报道的比较脾和脂肪iNKT细胞的研究结果相似,暗示脂肪iNKT细胞中可能存在独特的转录组谱。
在考察异质性方面,我们选择了脂肪iNKT细胞并进行了重新聚类(图1c)。在六个脂肪iNKT细胞亚群(A1–A6)中,大多数是表达Tbx21的iNKT1细胞(A1、A2和A4–A6)或表达Rorc的iNKT17细胞(A3)(图1d)。除了A4和A6之外的大多数脂肪iNKT细胞亚群在转录上与先前报道的亚群相似。由于三个较小的亚群(A4–A6)仅占总脂肪iNKT细胞的2.5%以下(图1e),我们主要关注进一步分析的三个主要亚群(A1–A3)。我们选择KLRG1和Ly6C作为表面抗原,以区分这三个亚群(图1f)。 KLRG1– Ly6C+、KLRG1+ 和 KLRG1– Ly6C– 的脂肪iNKT细胞分别与A1、A2和A3亚群相匹配。使用这些表面抗原区分脂肪iNKT细胞成功地反映了亚型比例和关键转录因子的表达(图1g)。
尽管胸腺和脂肪iNKT细胞具有明显的转录组谱,但它们组织特异性适应的起源目前很大程度上是未知的。为了表征脂肪iNKT细胞亚群的共有和组织特异性特征,我们进行了投影分析,使用了胸腺、脾、肝和淋巴结iNKT细胞。其他器官的iNKT细胞主要投影在A1亚群上,而不是A2亚群或A3亚群的下部分(图1h–l)。这些数据暗示A2亚群和A3亚群的子集可能具有脂肪特异性特征,而A1亚群显示出跨器官的共有基因表达谱。此外,脂肪iNKT细胞的组织特异性基因在A2亚群中高度表达(图1b、d),表明A2亚群可能决定了脂肪iNKT细胞的组织特异性特征。
为了验证A2是否确实是一个脂肪特异性亚群,对各种携带iNKT细胞的器官进行了测试,以确定它们是否表达A2亚群特异性的表面标记KLRG1。在其他器官中几乎未检测到KLRG1+ iNKT细胞,而来自WAT的iNKT细胞约有30%是KLRG1+的(图1m)。为了测试这一模式是否与性别或品系有关,我们检查了雌性C57BL/6和雄性BALB/c小鼠。由于它们表现出与雄性C57BL/6小鼠相似的模式,我们将A2亚群命名为‘脂肪特异性(As)-iNKT1’。此外,人类腹膜脂肪组织中也存在KLRG1+ iNKT细胞,表明人类可能含有类似的iNKT亚群。另一方面,由于其他器官中富含KLRG1– Ly6C+ iNKT细胞(图1n),我们将A1亚群命名为‘脂肪通用(Au)-iNKT1’。A3–A6亚群分别命名为‘A-iNKT17’、‘脂肪细胞毒性(Ac)-iNKT1’、‘A-循环iNKT1’和‘A-干扰素诱导基因(ISG)-iNKT1’(图1o),根据它们的特征基因表达谱(图1d)。综合这些数据,表明脂肪组织选择性的KLRG1+ As-iNKT1细胞可能介导脂肪iNKT细胞的独特特征。
2、脂肪组织微环境产生As-iNKT1细胞
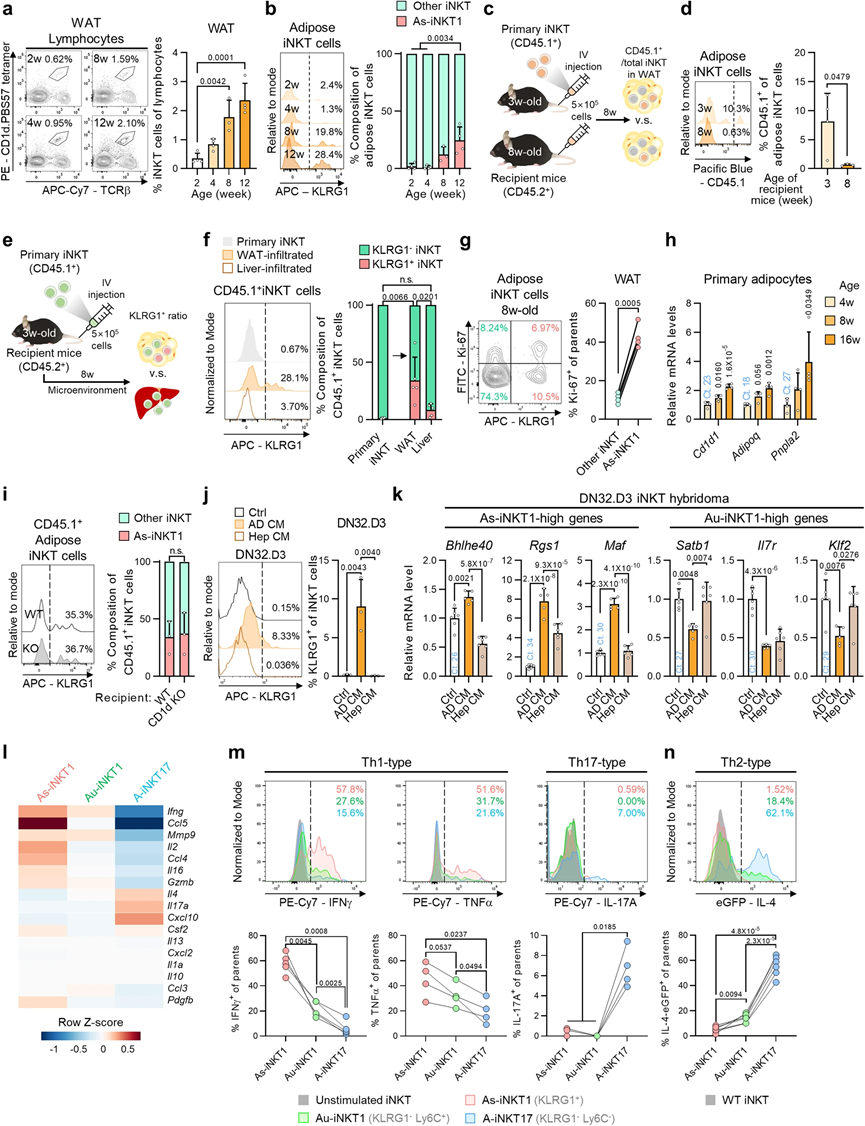
外周iNKT细胞在胸腺开始成熟,通过循环迁移到外周组织,并在外周器官中保持长期存在。与先前的报告一致,我们观察到iNKT细胞在WAT中的数量随年龄增加而增加(图2a)。为了探究KLRG1+ As-iNKT1细胞在WAT中丰富的潜在机制,我们仔细研究了As-iNKT1细胞何时能够出现在脂肪组织中。在4周之前,在WAT中只发现了极少数As-iNKT1细胞,而在8周后它们的比例增加(图2b)。为了检查4周后As-iNKT1细胞的生成情况,我们通过使用不同年龄的受体小鼠进行移植实验,测试了iNKT细胞在发育过程中何时渗入脂肪组织(图2c)。如图2d所示,3周龄时注射的CD45.1+ iNKT细胞占总脂肪iNKT细胞的约8%,当它们在8周龄时注射时,这个比例大大减少。更重要的是,这些数据表明,大多数脂肪iNKT细胞在小鼠满3周之前的早期阶段就会渗入脂肪组织。因此,我们推测4周后As-iNKT1细胞的增加可能是由iNKT细胞所在的脂肪组织微环境介导的。为了测试这一点,我们从脾iNKT细胞建立的原代iNKT细胞被注射,然后根据浸润的器官检查KLRG1的表达程度(图2e)。KLRG1+ iNKT细胞的比例在WAT中显著更高,表明脂肪组织特异的微环境可能有助于KLRG1– iNKT细胞向KLRG1+ iNKT细胞的过渡(图2f)。此外,注射的Au-iNKT1细胞的一个小亚群在三周后转化为KLRG1+ As-iNKT1细胞。在WAT中,As-iNKT1细胞比其他iNKT细胞更具增殖能力,这可能促进它们在青春期后的增加(图2g)。
接下来,我们鉴定了参与As-iNKT1细胞生成的脂肪组织特异性因子。为了找出4周后上调的脂肪组织特异性微环境因子,我们检测了来自4、8和16周龄小鼠的脂肪细胞的mRNA表达谱。随着年龄的增长,脂肪细胞上调了与微环境相关的基因,如Cd1d1、Adipoq和Pnpla2,分别对应于脂质抗原呈递分子、脂联素和脂解基因(图2h)。为了检查As-iNKT1细胞生成是否可能通过CD1d负载的脂质抗原(s)的慢性激活介导,我们将CD45.1+ iNKT细胞注射到年轻的WT小鼠或CD1d KO同胞中。如图2i所示,在转移的iNKT细胞中,As-iNKT1细胞的比例在两个基因型之间没有差异。然后,我们测试了脂肪细胞分泌的因子是否会影响As-iNKT1的生成。有趣的是,脂肪细胞培养基(AD CM)上调了As-iNKT1细胞的几个标记基因,如Klrg1、Bhlhe40和Rgs1,同时下调了Au-iNKT1标记基因(图2j、k)。这些模式在肝细胞培养基(Hep CM)处理组中不如在AD CM处理组中显著(图2j、k)。因此,这些数据表明,脂肪细胞分泌的因子可能在脂肪组织微环境中介导As-iNKT1细胞的生成。
在脂肪组织中,iNKT细胞活跃地分泌促炎和抗炎细胞因子来调节脂肪组织免疫。为了研究主要iNKT细胞亚群(包括As-iNKT1、Au-iNKT1和A-iNKT17细胞)的免疫调节特性,我们检查了它们的细胞因子分泌模式。这些亚群通过激活后的KLRG1和Ly6C的表达模式进行区分。在三个主要亚群中,As-iNKT1细胞在激活后显示出最高水平的IFNγ和TNFα产生(图2l–n)。A-iNKT17细胞产生高水平的IL-17A和IL-4,而Au-iNKT1细胞显示出中等水平的Th1和Th2型细胞因子产生(图2l–n)。因此,脂肪iNKT细胞的炎症调节特性似乎部分取决于各种代谢刺激下每个脂肪iNKT细胞亚群的相对比例,如1周高脂饮食喂养。
3、在肥胖症中,As-iNKT1 细胞产生 Ac-iNKT1 细胞
在肥胖症中,脂肪iNKT细胞通过清除有害的脂肪细胞,在维持脂肪组织稳态方面发挥了保护作用。尽管如此,脂肪iNKT细胞如何在肥胖症中获得或增强促进脂肪细胞清除的作用仍然不明确。为了研究肥胖引起的脂肪iNKT细胞的变化,我们对NCD、1周或8周高脂饮食喂养的同龄小鼠的脂肪iNKT细胞进行了scRNA-seq和TCR库分析(图3a)。即使在高脂饮食条件下,脂肪iNKT细胞仍然被分为与NCD条件相同的六个亚群(A1–A6),并且具有相似的标记基因表达(图3b)。然而,在高脂饮食的影响下,iNKT细胞亚群的比例及其基因表达模式发生了改变。As-iNKT1、Ac-iNKT1和A-Cycling iNKT1细胞的比例在8周高脂饮食后增加,而Au-iNKT1细胞的比例相对减少,A-iNKT17和A-ISG iNKT1细胞的比例则没有改变(图3c)。A-Cycling iNKT1和A-ISG iNKT1细胞是少数亚群,占总脂肪iNKT细胞的不到5%(图3c)。因此,我们决定在进一步的分析中排除A-Cycling iNKT1和A-ISG iNKT1细胞,主要集中在四个亚群上:Au-iNKT1(A1)、As-iNKT1(A2)、A-iNKT17(A3)和Ac-iNKT1细胞(A4)。为了将表达Klrg1的Ac-iNKT1细胞与As-iNKT1细胞区分开来,选择CX3CR1作为Ac-iNKT1细胞的表面抗原。流式细胞分析证实了在8周高脂饮食后As-iNKT1和Ac-iNKT1细胞的增加,而Au-iNKT1细胞的减少(图3d)。
为了了解肥胖如何调节As-iNKT1细胞的基因表达谱,分析了NCD和8周高脂饮食条件下的差异表达基因(DEGs)。大多数脂肪iNKT细胞亚群表现出与激活相关的表型,例如Nr4a1的上调(图3e)。在8周高脂饮食后,As-iNKT1细胞上调了与增殖相关的基因(Hmgb2和Plk3),与Ifng表达相关的特征基因(Bhlhe40),以及特定的TCR Vβ链基因(Trbv13-1、Vβ8.3)(图3e)。另一方面,As-iNKT1细胞中的一些NK受体基因,如Cd160和Klrk1,被下调(图3e)。这些数据表明,在肥胖症中,As-iNKT1细胞可能变得更具增殖能力,并且特定的As-iNKT1细胞可能选择了特定的Vβ。其他脂肪iNKT细胞亚群在高脂饮食后也发生了变化。Au-iNKT1细胞上调了NK受体,如Klrd1和Klrc2,同时下调了Ifng。A-iNKT17细胞上调了Zbtb16和Rora,同时下调了一些与免疫相关蛋白(GIMAP)家族基因和MHC I分子有关的基因。
众所周知,免疫细胞在病理刺激下可以分化为亚群。为了测试在肥胖症中As-iNKT1细胞是否能够分化为其他亚群,我们对三个iNKT1细胞亚群进行了伪时间分析:Au-iNKT1、As-iNKT1和Ac-iNKT1细胞。如图3f所示,As-iNKT1细胞似乎是由Au-iNKT1细胞衍生出来的,并且可以分化为Ac-iNKT1细胞。克隆型重叠分析进一步验证了Ac-iNKT1细胞与As-iNKT1细胞有相同的起源(图3g,h)。此外,A-Cycling iNKT1细胞是As-iNKT1和Ac-iNKT1细胞的增殖亚群,这可能解释了它们在肥胖症中数量的增加(图3g)。为了调查Au-iNKT1、As-iNKT1和Ac-iNKT1细胞在体内的层次关系,Au-iNKT1和As-iNKT1细胞分别注入了HFD喂养的iNKT细胞缺失的Jα18 KO小鼠的左右脂肪垫中(图3i)。有趣的是,Au-iNKT1细胞分化为As-iNKT1和Ac-iNKT1细胞,而As-iNKT1细胞只分化为Ac-iNKT1细胞(图3j–l)。此外,As-iNKT1细胞的分化伴随着Ac-iNKT1细胞的CDR3β多样性减少(图3m),表明某些As-iNKT1细胞通过克隆扩张可能分化为Ac-iNKT1细胞。综合这些数据,提出As-iNKT1细胞在暴露于肥胖刺激时可能会分化为Ac-iNKT1细胞。
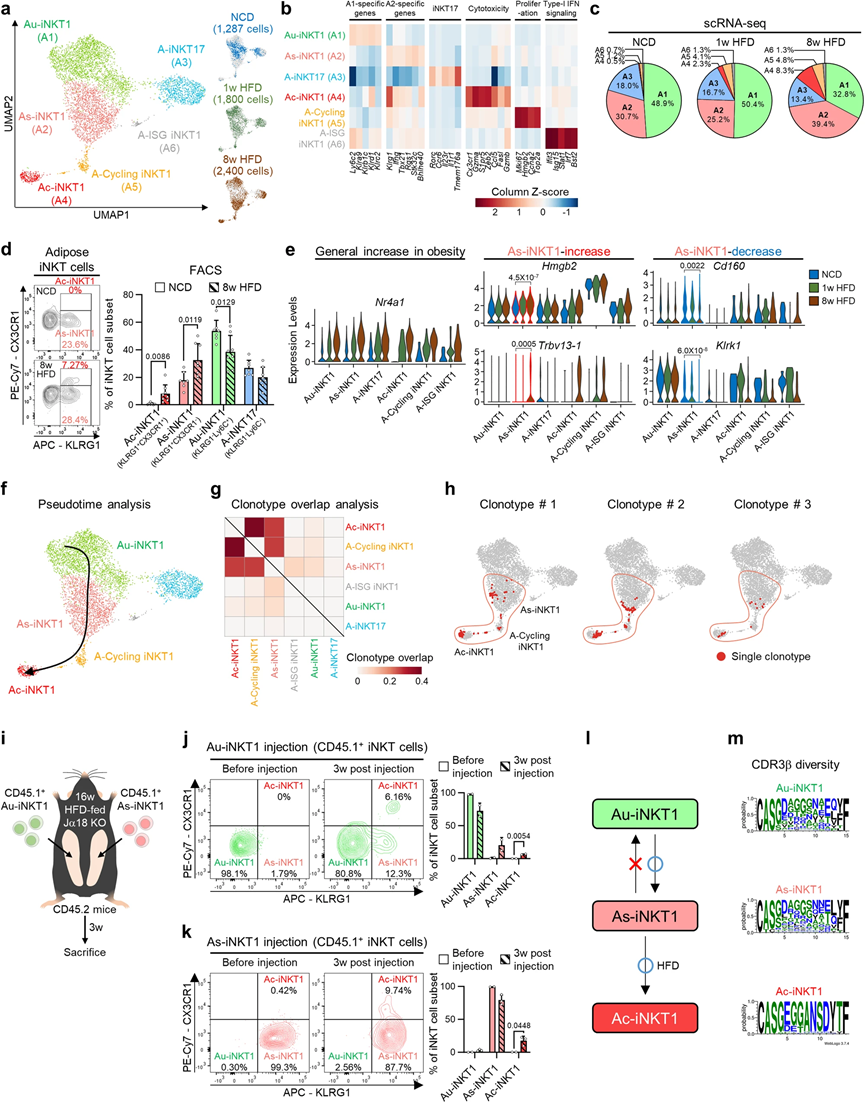
4、Ac-iNKT1 细胞通过分泌 CCL5 杀死肥大和炎症脂肪细胞并招募巨噬细胞
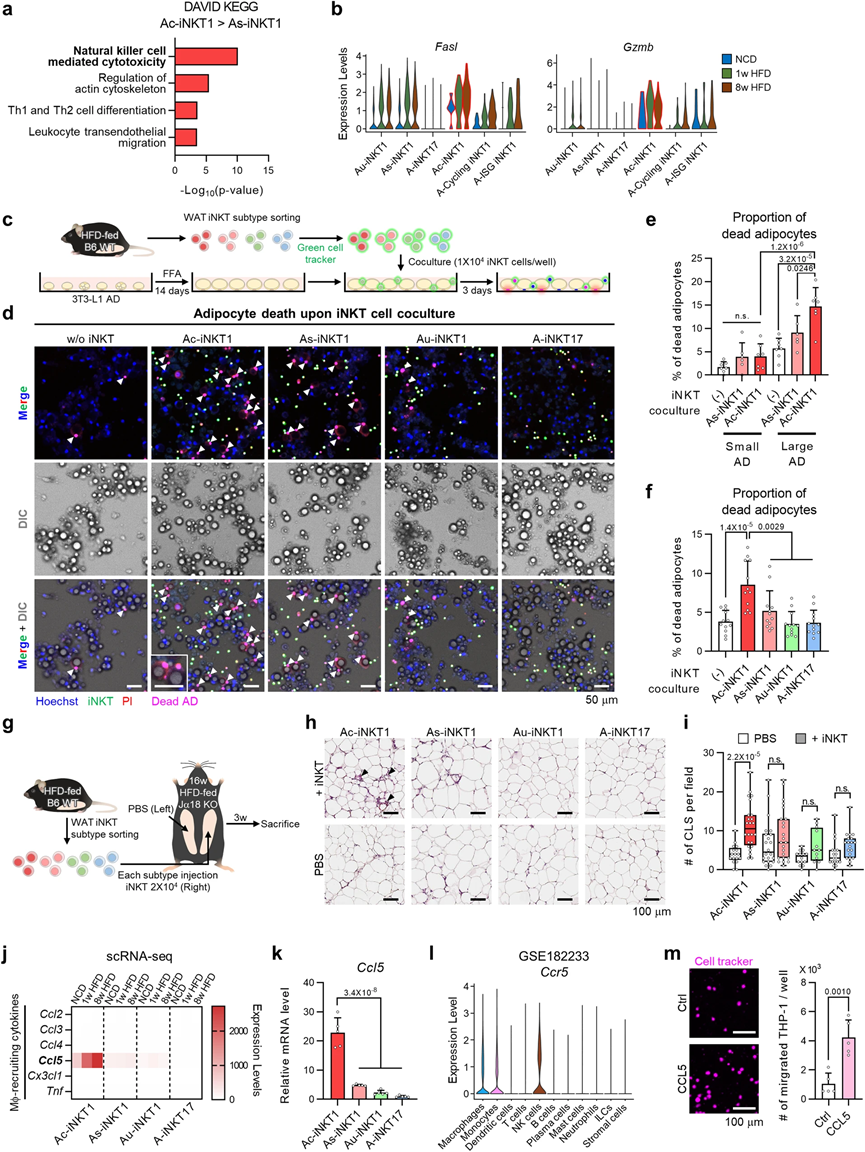
最近,我们已经表明,脂肪iNKT细胞在高脂饮食条件下上调FasL,清除肥大和炎症性的脂肪细胞。肥胖症中Ac-iNKT1细胞数量增加和细胞毒基因表达的结果(图3d,4a,b)促使我们检查Ac-iNKT1细胞是否是能够清除肥大和发炎的脂肪细胞的主要iNKT细胞亚群。为了解决脂肪iNKT细胞数量较少的技术问题,我们采用了使用α半乳糖二酰胺(α-GC)进行脂肪iNKT细胞的体内扩增,这是一种对iNKT细胞具有强大脂质抗原活性的物质。每个脂肪iNKT细胞亚群的基因表达谱和细胞因子产生在体内扩增后基本上没有改变。首先,我们检查了脂肪iNKT细胞亚群与脂肪细胞尺寸和死亡之间的关系。使用棕榈酸(PA)或油酸(OA)过载的3T3-L1脂肪细胞(ADs),这被认为是具有促炎特性或具有无炎特性的肥大细胞,与每个iNKT细胞亚群进行共培养(图4c)。有趣的是,Ac-iNKT1细胞选择性地杀死大型ADs,而小型ADs不太容易被iNKT细胞清除(图4d,e)。接下来,为了测试Ac-iNKT1细胞的细胞毒活性是否取决于ADs的炎症特性,PA处理和OA处理的ADs,它们在炎症特性上有所不同,被与每个iNKT细胞亚群共培养。如图4f所示,AciNKT1细胞对PA处理的3T3L1 ADs(肥大和促炎的ADs)表现出最强的细胞毒性,而对OA处理的3T3-L1 ADs(肥大但不具有炎症的ADs)则没有显示出显著的细胞毒性。此外,CD1d中和明显减少了Ac-iNKT1细胞引起的PA处理的AD死亡。这些数据表明,Ac-iNKT1细胞可能通过TCR/CD1d依赖的方式选择性地清除具有肥大和促炎特性的脂肪细胞。为了在体内详细研究Ac-iNKT1细胞的细胞毒性,我们将相同数量的脂肪iNKT细胞亚群注射到HFD喂养的iNKT细胞缺失的Jα18 KO小鼠的右脂肪垫中(图4g)。在Ac-iNKT1细胞注射的脂肪垫中检测到更多的冠状状结构(CLSs),这是死亡脂肪细胞的标志物(图4h,i)。此外,Ac-iNKT1细胞显示出与终末分化的CD8+效应T细胞(TE)相似的基因表达谱,表明Ac-iNKT1细胞在肥胖症中将发挥关键作用,杀死肥大和发炎的脂肪细胞。
在死去的脂肪细胞周围,巨噬细胞被招募来吞噬它们并形成CLS。为了测试Ac-iNKT1细胞是否能够在清除死亡脂肪细胞后介导巨噬细胞的招募,检查了与巨噬细胞招募有关的细胞因子。如图4j,k所示,Ccl5是在巨噬细胞招募细胞因子中最高表达的,且仅在Ac-iNKT1细胞中表达。Ccr5是Ccl5的受体,仅在巨噬细胞、单核细胞和NK细胞中表达(图4l),这表明CCL5可能通过招募巨噬细胞来清理死亡的脂肪细胞。一致性地,我们观察到CCL5能够介导THP1单核细胞的招募(图4m)。综合这些数据,清楚地表明Ac-iNKT1细胞可能通过CCL5选择性地清除肥大和发炎的脂肪细胞,并通过招募巨噬细胞来清理死亡的脂肪细胞。
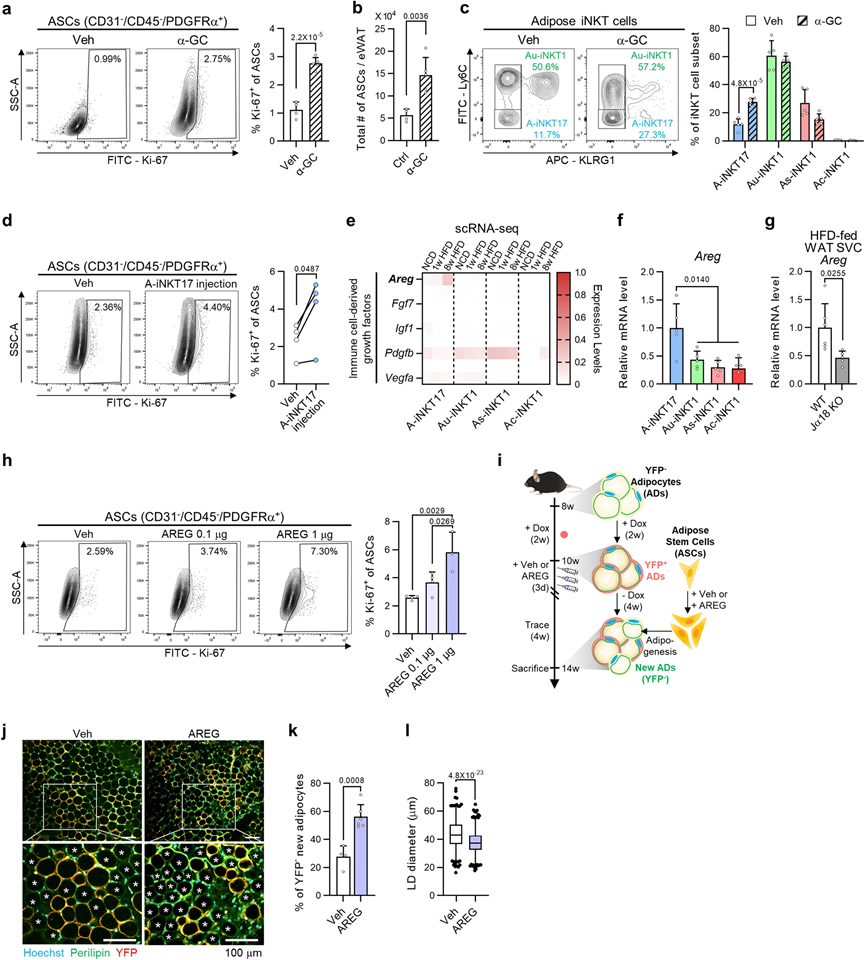
5、A-iNKT17细胞通过分泌双调蛋白刺激脂肪干细胞增殖
目前尚不清楚脂肪iNKT细胞激活后ASC增殖是否归因于死亡脂肪细胞释放的因子,还是脂肪iNKT细胞与ASC直接相互作用的结果。为了验证这一假设,我们向瘦小鼠注射α-GC。α-GC增加了脂肪组织中增殖ASC的比例,而没有刺激脂肪细胞的凋亡(图5a)。在Jα18 KO小鼠中,α-GC诱导的ASC增殖被iNKT细胞耗竭所废除。此外,α-GC进一步增加了WAT中ASC的总数(图5b)。这些数据表明,脂肪iNKT细胞在激活后可能直接刺激ASC增殖。
为了了解哪些脂肪iNKT细胞亚群将参与ASC增殖,我们采用了体内方法。由于α-GC注射显著增加了A-iNKT17细胞的比例(图5c),我们试图验证A-iNKT17细胞在ASC增殖中的作用。当将A-iNKT17细胞注射到HFD饲养的Jα18 KO小鼠的脂肪垫中时,注射A-iNKT17细胞增加了增殖ASC的比例,而其他脂肪iNKT细胞亚群的比例未发生改变(图5d)。然后,为了确定A-iNKT17细胞中的哪种因子可能刺激ASC增殖,我们检查了脂肪iNKT细胞亚群的基因表达谱。已经有报道表明免疫细胞通过生长因子或细胞因子与上皮或间质细胞进行活跃的交流,促进组织再生。有趣的是,在先前报道的免疫细胞衍生的生长因子中,在肥胖小鼠中A-iNKT17细胞中独特地表达了刺激肌肉修复期间卫星细胞分化的amphiregulin(Areg),其表达水平逐渐增加(图5e)。此外,Areg的mRNA水平在A-iNKT17细胞中似乎丰富,并在HFD饲养的iNKT细胞耗竭小鼠中下调(图5f,g)。为了检验AREG是否能够刺激ASC增殖,我们向瘦小鼠注射AREG。如图5h所示,AREG以剂量依赖的方式增强了增殖ASC的比例。同时,通过抑制amphiregulin受体表皮生长因子受体(EGFR),抑制了αGC诱导的ASC增殖。接下来,为了调查AREG驱动的ASC增殖是否确实会导致脂肪细胞生成,我们采用了脂肪细胞谱系追踪小鼠(adiponectinrtTA; TRE-Cre; rosa26-loxpstop-loxp-YFP)。通过青霉素的注射,现有的脂肪细胞被YFP标记,而载体或AREG注射后新形成的脂肪细胞则未被YFP标记(图5i)。AREG注射增加了perilipin阳性且YFP阴性的新脂肪细胞的比例(图5j,k),暗示AREG驱动的ASC增殖将提高脂肪生成的潜力。此外,AREG注射的WAT似乎显示出较小的脂肪细胞大小(图5l),这在激活的脂肪生成的脂肪组织中观察到。鉴于相较于胸腺、脾和肝,WAT中iNKT17细胞的比例较高,似乎A-iNKT17-AREG轴在调节ASC增殖中发挥了重要作用。综合而言,这些数据表明A-iNKT17细胞衍生的AREG可能是刺激ASC增殖和脂肪生成的关键介质之一,参与了脂肪组织的稳态。
实验方法:
scRNA-seq、TCR分析、脂肪组织分离、FACS、共培养、免疫组织化学、THP-1单核细胞迁移测定、RT-qPCR。
参考文献:
Han, S.M., Park, E.S., Park, J. et al. Unique adipose tissue invariant natural killer T cell subpopulations control adipocyte turnover in mice. Nat Commun 14, 8512 (2023).






