SRSF2作为mRNA上m5C的读取器发挥了意想不到的作用
一种常见的mRNA修饰是5-甲基胞嘧啶(m5C),其在基因转录加工和癌症中的作用尚不清楚。在本研究中,作者确定了富含丝氨酸/精氨酸的剪接因子2 (SRSF2)是m5C的读者,而受损的SRSF2与m5C的结合是白血病发生的潜在因素。在结构上,作者鉴定了参与m5C识别的残基,以及流行的白血病相关突变SRSF2P95H的影响。作者发现SRSF2结合和m5C在转录本内共定位。此外,敲低m5C的作者NSUN2会降低mRNA m5C,减少SRSF2的结合,并改变RNA的剪接。作者还表明,SRSF2P95H突变损害了该蛋白读取m5C标记mRNA的能力,显著降低了其与白血病细胞中关键白血病相关转录本的结合。在白血病患者中,NSUN2低表达导致mRNA m5C低甲基化,联合SRSF2P95H预测不良预后。总之,作者强调了表观转录组学和一个关键的肿瘤发生驱动因素之间尚未认识到的机制联系。本文于2023年7月发表于《Molecular Cell》,IF:14.5。
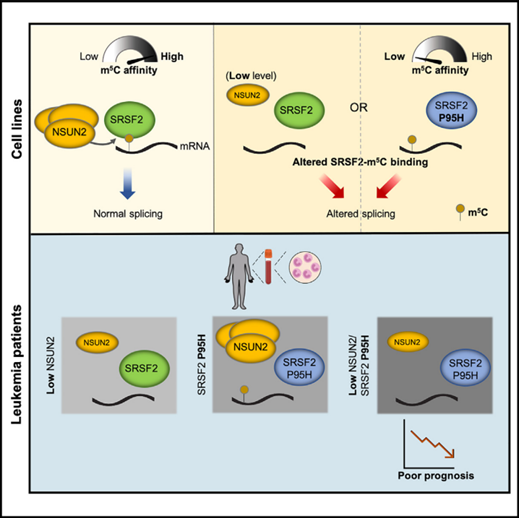
摘要图
技术路线:

主要研究结果:
1. SRSF2优先结合m5C修饰的RNA
鉴定m5C结合蛋白是更好地理解m5C对RNA的生物学影响的重要一步。为了找到m5C结合蛋白,作者进行了RNA下拉分析,然后进行了质谱分析。作者发现只有一种蛋白对生物素化的m5CRNA寡核苷酸表现出显著的结合偏好: SRSF2(图1A)。然而,尽管SRSF2与m5CRNA寡核苷酸的结合明显增加,但其他SR蛋白没有明显变化(图1)。这证实了实验的可靠性和在C(m5C)GG背景下SRSF2对m5C的特异性。此外,与对照相比,m5C对内源性和过表达的SRSF2的下拉混合物的富集程度更高(图1C)。与此一致,重组SRSF2在无细胞环境中对m5C探针表现出强烈的偏好,表明直接结合(图1D)。
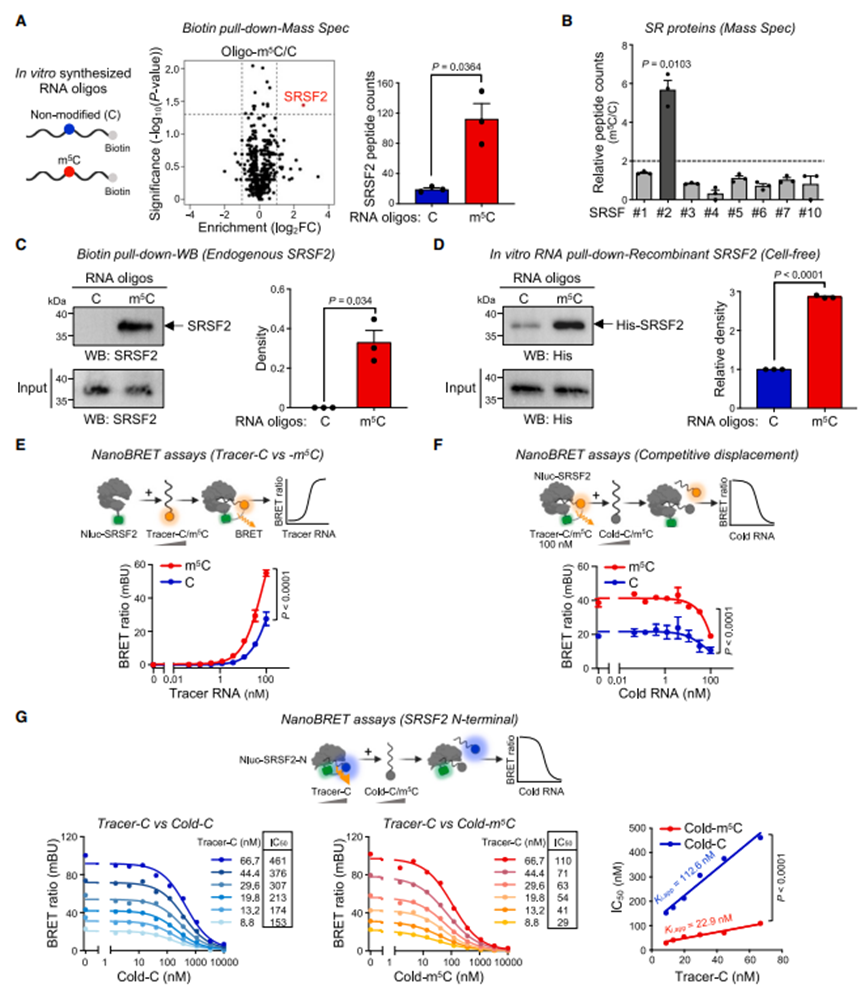
图1 SRSF2优先与m5C修饰的RNAs结合
为了在活细胞上证实上述SRSF2-m5C相互作用并定量监测这种相互作用,作者进行了基于纳米荧光素的生物发光共振能量转移(NanoBRET)实验。首先,作者测试了m5C标记和未标记的RNA示踪探针(称为示踪- m5C和示踪-C)对NanoBRET的适用性。在所有浓度下,示踪剂m5C都比示踪剂C产生更强的BRET信号(图1E)。然后,作者使用冷(未标记)RNA进行竞争性结合,发现冷RNA以浓度依赖的方式减弱BRET信号,这表明BRET信号是由示踪剂与纳米荧光素酶(NLUC)融合的SRSF2特异性可逆相互作用产生的(图1F)。用冷RNA取代示踪RNA,可以确定SRSF2与不同RNA序列结合的相对亲和力利用SRSF2-N进行的竞争实验表明,cold-m5C对示踪剂C的竞争能力显著高于cold-C(图1G)。综上所述,这些结果支持SRSF2在体外和活细胞中优先结合携带m5C的RNA的观点。
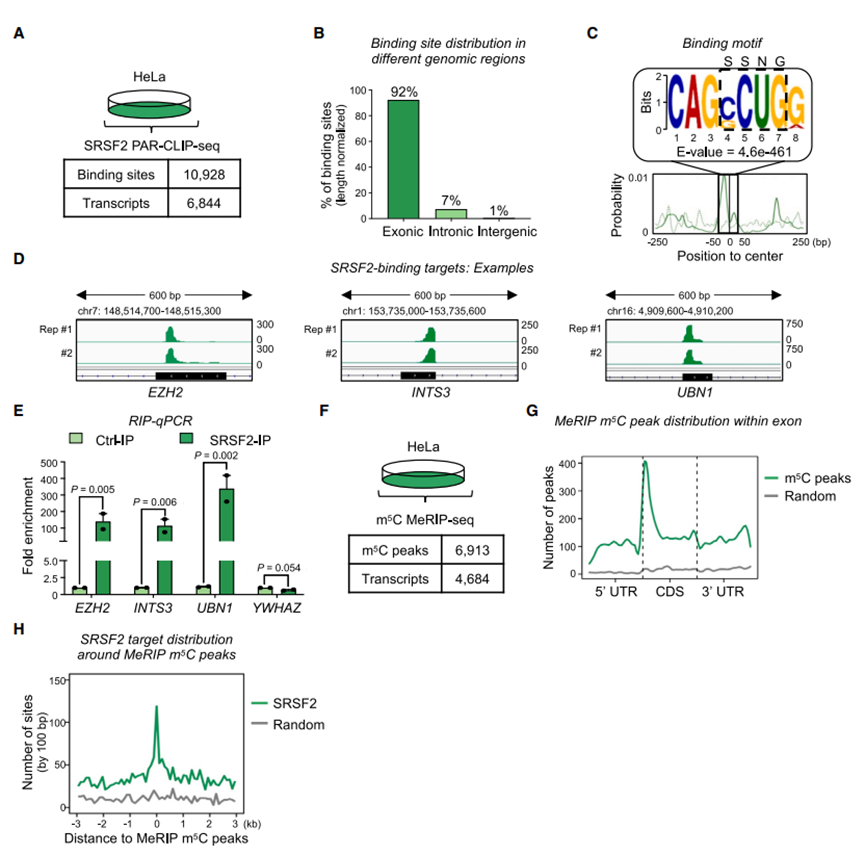
图2 转录组SRSF2结合谱,mRNA m5C图谱,以及SRSF2结合和m5C的共存
2. 转录组SRSF2结合谱
在6844个转录本中共鉴定出10928个SRSF2结合位点(图2A)。SRSF2主要富集于外显子区域(图2B),这与已知的蛋白质优先结合一致。随后的基序分析显示,在峰中心存在CAG(C/G)CUGR基序(图2C)和其他含有SSNG的基序,包含SSNG序列的典型SRSF2结合位点如图2D所示,并通过RNA免疫沉淀- qPCR (RIP-qPCR)进行验证(图2E)。总的来说,作者发现SRSF2主要结合外显子的CDS区域,优先结合胞嘧-鸟嘌呤(CG)丰富的SSNG基序。
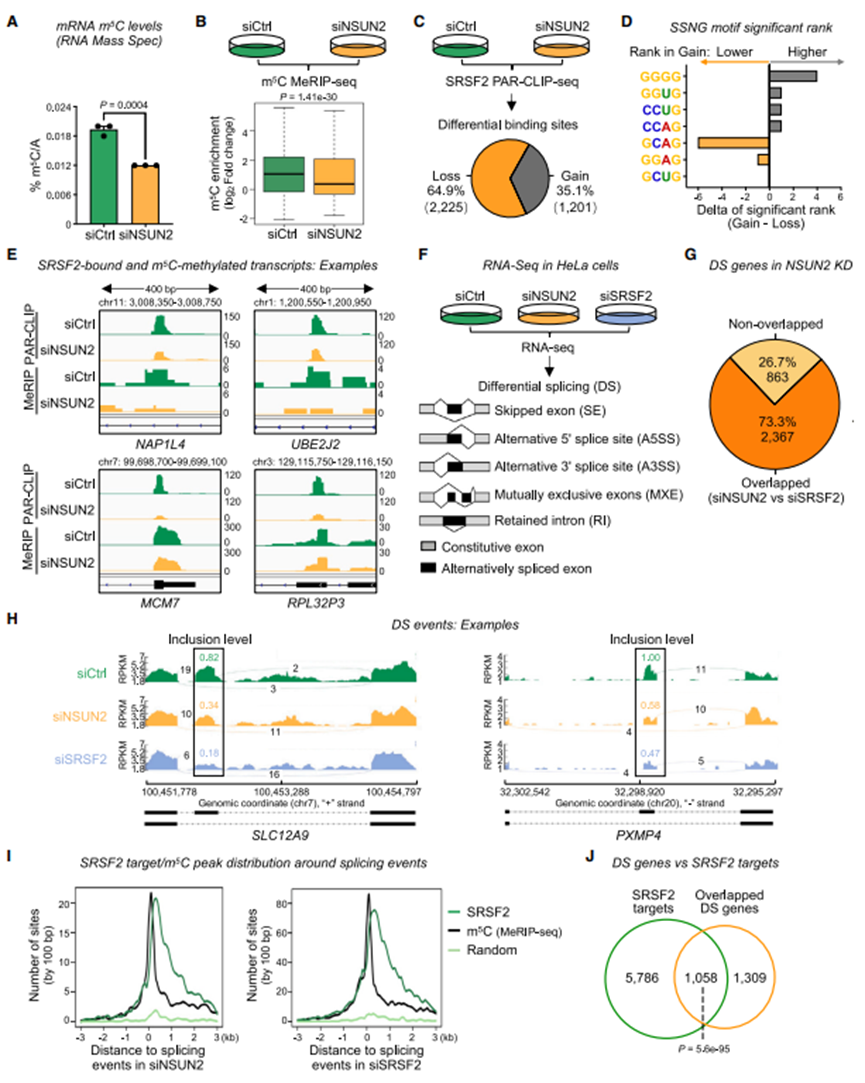
图3 NSUN2的缺失降低了m5C水平,改变了SRSF2的mRNA结合亲和力,并导致与SRSF2缺失相似的RNA剪接变化
3. 在转录组中,SRSF2结合携带m5C的mRNA
然后,作者评估了转录组范围内的m5C景观。在4,684个转录本中共鉴定出6,913个m5C峰(图2F)。在mRNA中,最丰富的m5C峰出现在CDSs中,聚集在翻译起始位点的下游区域(图2G)。有趣的是,通过整合内部SRSF2 PAR-CLIP-seq和RNA m5C MeRIP-seq数据,作者发现SRSF2结合位点非常频繁地出现在m5C峰中心(图2H)。总之,这些结果提供了SRSF2直接结合转录组中m5C标记序列子集的证据。
4. NSUN2缺失会降低m5C水平并改变SRSF2的RNA结合亲和力
由于SRSF2优先结合m5C修饰的RNA,作者接下来想知道减少m5C标记如何影响转录组范围内的SRSF2结合。为了研究这一点,作者首先通过m5C质谱和m5C MeRIP-seq验证了NSUN2敲低(KD) HeLa细胞中mRNA m5C水平显著降低(图3A、3B)。然后,作者在对照和NSUN2 KD细胞上进行SRSF2 PAR-CLIP,然后进行RNA生物素标记试验或高通量测序NSUN2 KD与对照组的差异结合分析显示,共有3,426个SRSF2差异结合位点,其中约65%显示NSUN2 KD后的结合丧失,35%显示结合增强(图3C)。因此,这并不支持SRSF2结合的增加是由于NSUN2低时其他m5C调节因子表达的代偿性改变的假设。接下来,作者想知道当m5C水平较低时,SRSF2与SSNG基序的结合如何改变。虽然观察到相同基序的富集,但作者发现含C基序(GCAG)在增益位点的排名低于损失位点,而不含C基序(GGGG)的排名更高(图3)。这一发现表明,当NSUN2减少时,SRSF2向不含C的结合位点重定向。
图3E显示了失去SRSF2结合和在NSUN2 KD上显示较低m5C水平的位点的代表性覆盖轨迹。含有siNSUN2缺失位点的转录本在细胞生物学类别(如RNA剪接)和肿瘤发生相关类别(如“AML”)中富集。这表明在NSUN2缺失的细胞中观察到的SRSF2结合谱的改变不影响翻译。
5. NSUN2和SRSF2的缺失同样会改变RNA剪接,剪接事件附近的m5C位点和SRSF2结合位点富集
考虑到SRSF2在RNA剪接中的众所周知的功能,以及在显示siNSUN2相关的结合缺失的SRSF2结合靶标中,RNA剪接类别被过度代表,作者假设NSUN2通过在RNA中添加m5C标记,影响SRSF2驱动的选择性剪接。如果是这样的话,NSUN2缺失应该会导致类似于SRSF2缺失所导致的剪接模式改变。为了验证这一假设,作者进行了RNA测序(RNA-seq)并分析了RNA剪接(图3F)同样,在NSUN2 KD中鉴定的73.3%的DS基因也在SRSF2 KD细胞中鉴定出来(图3G),典型的剪接事件如图3H所示。总的来说,这些数据表明NSUN2缺失对选择性剪接的影响类似于SRSF2缺失。
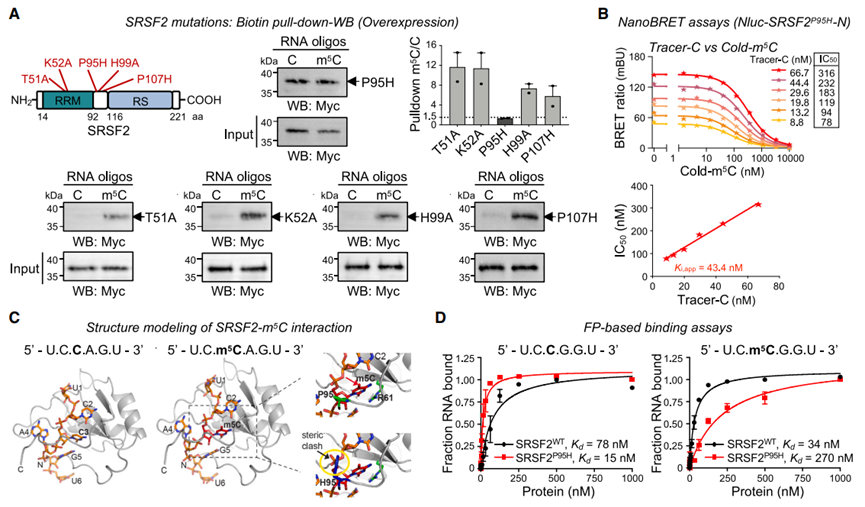
图4 SRSF2P95H突变降低了SRSF2的m5C结合亲和力
鉴于这一观察结果,作者接下来研究了m5C修饰和SRSF2结合是否可能发生在NSUN2-和SRSF2相关的剪接事件中。作者使用内部m5C MeRIP-seq数据和公开的RNA-BisSeq数据进行分析,一致显示SRSF2结合位点和m5C位点与剪接事件非常接近(图3I)。这有力地支持了作者的发现,即SRSF2作为m5C结合蛋白,并提示m5C、SRSF2和RNA剪接之间存在关联。
作者进一步将共发生的差异剪接基因(2367个基因)与SRSF2结合靶点重叠。1058个SRSF2结合靶点的一个重要子集也被差异拼接(图3J)。这些观察结果,以及作者关于SRSF2结合m5C标记的发现,表明SRSF2通过其读取器功能参与了NSUN2介导的m5C的选择性剪接作用。
6. 流行疾病相关的P95H突变降低了SRSF2对RNA m5C的结合亲和力
白血病中经常报道各种体细胞SRSF2突变,这些突变对发病机制至关重要。发现SRSF2结合含有m5C的RNA促使作者研究这些疾病相关突变是否改变了SRSF2与m5C的优先结合。为了回答这个问题,作者测试了SRSF2 N端区域的几个突变:T51A、K52A、P95H、H99A和P107H.28有趣的是,作者发现与P95H变体相比,其他SRSF2突变形式评估保持对m5C的偏好(图4A)。
利用NanoBRET,作者发现与SRSF2WT相比(Ki,app = 22.9 nM;图1G), SRSF2P95H (Ki,app = 43.4 nM;图4B)显示了较高的Ki,app值,即对甲基化RNA的亲和力较低。这些结果一致表明,P95H突变降低了SRSF2与RNA m5C结合的亲和力。
7. m5C与WT或突变体SRSF2相互作用的结构建模,并通过平衡结合亲和测量验证
先前的核磁共振结构揭示了SRSF2 N端结构域和RNA相互作用的模式(PDB: 2LEB)单链己核苷酸RNA (5 ' -U1C2C3A4G5U6-3 ')适合于由SRSF2的中心β片和铰链区域(Lys91-His99)发出的带正电的芳香氨基酸形成的凹槽(图4C,左)。在C3碱基的沃森克里克边缘和Arg61侧链之间的两个直接氢键赋予了第二胞嘧啶(C3)的碱基特异性29有趣的是,C3碱的另一面通过与Pro95的范德瓦尔斯(vdW)接触而稳定。作者在这个位置(C3)建模了m5C(图4C,中间)。有趣的是,m5C的甲基部分似乎通过额外的vdW与Arg94和Pro95的蛋白主链原子从一侧接触,以及与RNA的第一胞嘧啶(C2)的核糖部分从另一侧接触而稳定下来(图4C,右上)。模型组氨酸的侧链始终与RNA的磷酸主链发生空间冲突(图4C,右下)。此外,作者对其他SRSF2突变体的相互作用进行了建模(图S4B)。Arg95 (R95)在AML/CMML患者中的突变频率低于H95也可能与m5C发生立体冲突。Ala95 (A95)是AML/CMML患者中的一种罕见突变,可能危害较小,并且似乎不会与m5C碱基或RNA主干发生冲突。总之,这些数据强调了Pro95在SRSF2-m5C相互作用中的关键作用。最后,基于荧光偏振(FP)的实验分析证实了野生型(WT) SRSF2 RRM与含有m5C的RNA结合更紧密,而P95H突变体更倾向于未甲基化的RNA序列(图4D)。
因此,作者的结构研究和FP分析表明,SRSF2特异性识别m5C修饰RNA的分子机制,从而可能解释WT SRSF2如何更紧密地与含有m5C的RNA结合,而白血病相关的Pro95突变体,如P95H突变体,更倾向于未甲基化的RNA序列。
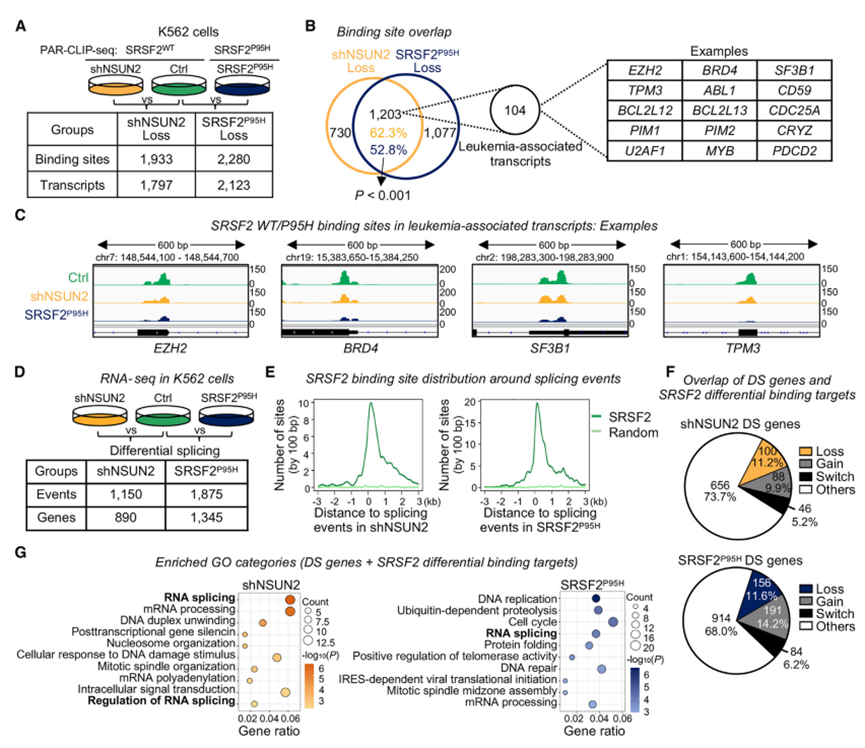
图5 mRNA m5C调控转录物在白血病中的参与
8. SRSF2在NSUN2 KD和P95H突变白血病细胞中的RNA结合谱
然后,作者在白血病细胞模型中探索了P95H突变和RNA低甲基化如何影响SRSF2与mRNA的结合。关注显示SRSF2差异结合的位点,作者发现在对照细胞中鉴定的共有1933个SRSF2结合位点在shNSUN2细胞中丢失,在SRSF2P95H突变细胞中丢失了2280个结合位点(图5A)。接下来,作者比较了以下位点子集的分布:shNSUN2 -缺失或获得位点(NSUN2缺失或获得)和p95h -缺失或获得位点(SRSF2P95H细胞中的缺失或获得)。
当作者比较这两种情况下显示结合缺失的位点时,作者观察到1203个结合位点重叠,对应于62.3%的shNSUN2缺失位点(图5B)。这一结果表明,NSUN2缺失和SRSF2P95H突变可能类似地影响SRSF2与某些靶标的结合。引人注目的是,已知重叠区有104个结合位点编码白血病相关基因,例如ZESTE同源物增强子2 (EZH2)、溴结构域蛋白4 (BRD4)、剪接因子3B亚基1 (SF3B1)和原肌球蛋白3 (TPM3)(图5B和5C)。NSUN2 KD和SRSF2P95H突变都改变了SRSF2与mRNA的结合,特别是与白血病相关靶点的结合,这一事实强调了m5C识别在白血病发生中的潜在参与。
9. NSUN2缺失导致与SRSF2突变相当的全局RNA剪接改变
作者首先研究了在NSUN2缺失或SRSF2P95H突变细胞中观察到的SRSF2结合谱的改变是否与翻译有关。研究表明,SRSF2P95H突变体改变了与癌症发展有关的大量基因的RNA剪接谱。因此,作者对NSUN2 KD和SRSF2P95H K562细胞进行了RNA测序,分析RNA剪接模式(图5D),这表明NSUN2缺失和SRSF2突变介导的rna剪接改变共同影响许多下游生物功能。
接下来,作者研究了SRSF2结合位点与其他剪接事件位点的距离。与HeLa细胞的研究结果一致(图3I),作者发现在对照细胞中发现的SRSF2结合位点,而不是随机选择的位点,优先位于NSUN2缺失或SRSF2P95H突变细胞中发现的剪接事件周围(图5E)。此外,作者发现大约26%-32%的差异剪接基因是SRSF2结合靶点,在NSUN2缺失或SRSF2突变时发生改变(图5F)。有趣的是,这些差异剪接的SRSF2结合靶点在RNA剪接类别中显著丰富(图5G)。这些结果表明,NSUN2缺失和SRSF2突变通过影响其他RNA剪接因子的结合和剪接,导致SRSF2直接结合靶点和间接靶点的选择性剪接。
10. NSUN2高、低水平CMML患者单核细胞中RNA m5C的分布
为了在单碱基分辨率下分析白血病患者转录组范围内的m5C甲基化,作者分离了8名CMML患者的外周血单核细胞,并对核糖缺失的RNA进行了RNA-BisSeq检测(图6A)。作者发现NSUN2-low患者的m5C位点数量明显低于NSUN2-high患者(图6B)。然后检查mRNA中m5C位点的分布概况,发现与m5C相关程度最高的区域是CDS,特别是翻译起始位点的下游区域(图6C)。这些模式与作者对HeLa细胞的m5C MeRIP-seq数据以及先前对小鼠组织和正常和肿瘤来源的人类组织的报道一致值得注意的是,与NSUN2高的患者相比,NSUN2低的患者在mRNA外显子区域(尤其是CDSs)出现m5C位点的频率更低(图6C)。
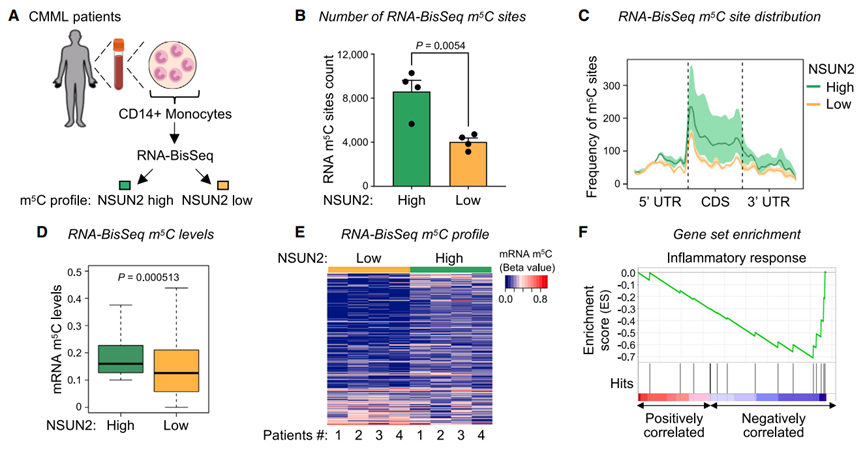
图6 NSUN2高或低水平CMML患者单核细胞中RNA m5C的转录组全分布
鉴于上述观察结果,NSUN2 -低患者的m5C位点计数较低,作者进一步比较了m5C标记mRNA转录物的甲基化水平。作者观察到NSUN2低患者的m5C水平显著降低(图6D)。与此一致的是,热图显示大多数m5C修饰的转录本在NSUN2 -低患者中低甲基化(图6E)。这些结果表明,低NSUN2水平导致CMML患者单核细胞中低m5C水平。基因集富集分析(Gene set enrichment analysis, GSEA)显示炎症反应途径明显被过度代表,并且与NSUN2-高患者相比,NSUN2-低患者的m5C差异呈强负相关(图6F)。值得注意的是,CMML单核细胞的转录特征已被报道为高度炎症,有助于恶性扩张,并反映白血病特异性和年龄相关的改变
11. 在SRSF2P95H突变的AML患者中,NSUN2而非NSUN6的低表达与预后不良显著相关
接下来,作者探索了NSUN2在大量白血病患者中的表达水平,发现NSUN2在CMML和AML患者中的表达显著下调(图7A)。NSUN2在患者中的整体低表达促使作者研究NSUN2的临床作用。
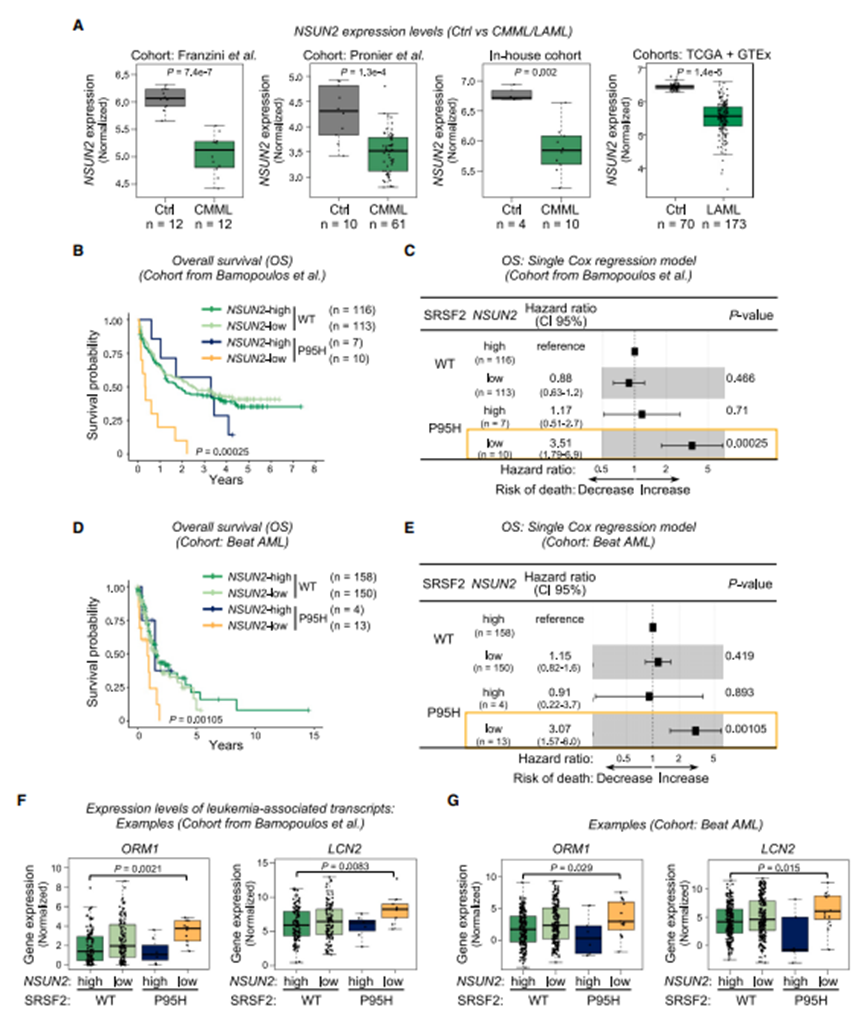
图7 在SRSF2P95H突变的AML患者中,NSUN2低表达与预后不良相关
为了探索m5C相关基因在白血病中的临床相关性,作者首先对246名AML患者(标记为“Bamopoulos等人”)组成的公共数据集进行了生存分析如先前报道,SRSF2P95H患者的总生存期(OS)比非P95H突变(称为“WT”)患者短。然后,作者研究了m5C撰写者NSUN2的丰度与患者预后之间的关系。NSUN2高、低WT患者的OS无显著差异。然而,引人注目的是,NSUN2 -低SRSF2P95H组的预后明显较差,1年生存率仅为20%(图7B)。与此一致的是,单Cox比例风险回归分析显示,对于NSUN2低的SRSF2P95H突变患者,平均死亡风险比NSUN2高的患者高出约251%(图7C)。这些发现通过另一个队列(Beat AML队列,36包含451个样本)的分析得到验证(图7D, 7E)。接下来,作者评估了两个AML队列中四组患者中关键白血病相关基因的表达。在SRSF2P95H突变的NSUN2-低患者中,重要的是, ORM1和LCN2,37,38个已知与白血病发生和进展相关的癌基因的表达显著升高(图7F和7G)。
综上所述,这些结果表明,在SRSF2P95H突变患者中,低表达NSUN2而非NSUN6与预后不良和部分癌基因低表达具有可重复性相关。这表明NSUN2作为SRSF2P95H突变AML患者预后标志物的潜在作用,并突出了NSUN2、SRSF2P95H和肿瘤发生之间未被认识的联系。
总之,作者发现了一个以前未被识别的mRNA上m5C的读者:SRSF2蛋白,它以参与剪接而为人所知,其残基95 (P95H)突变与血液系统恶性肿瘤密切相关。此外,作者还发现了以前未知的NSUN2/m5C与SRSF2介导的RNA剪接之间的关联。引人注目的是,在白血病患者中,NSUN2低表达,这与低m5C甲基化水平相关。低NSUN2与SRSF2突变同时发生预示预后不良。虽然从突变到疾病的途径仍有待完全阐明,但作者的研究表明,SRSF2 m5C读取器功能的损伤可能有助于白血病的进展。总的来说,作者的数据确定了RNA修饰和一个重要的突变依赖因子之间未被识别的机制串扰。
实验方法:
RNA干扰和转染表达质粒,定点突变组氨酸标记,蛋白纯化,m5C印迹质谱分析,逆转录酶定量PCR,RNA免疫沉淀,PAR-CLIP,MeRIP-seq,RNA- bis-seq。
参考文献:
Ma HL, Bizet M, Soares Da Costa C, Murisier F, de Bony EJ, Wang MK, Yoshimi A, Lin KT, Riching KM, Wang X, Beckman JI, Arya S, Droin N, Calonne E, Hassabi B, Zhang QY, Li A, Putmans P, Malbec L, Hubert C, Lan J, Mies F, Yang Y, Solary E, Daniels DL, Gupta YK, Deplus R, Abdel-Wahab O, Yang YG, Fuks F. SRSF2 plays an unexpected role as reader of m5C on mRNA, linking epitranscriptomics to cancer. Mol Cell. 2023 Dec 7;83(23):4239-4254.e10. doi: 10.1016/j.molcel.2023.11.003. PMID: 38065062.






