scRNA-seq和scATAC-seq整合分析发高分——揭示iNKT细胞发育轨迹
与传统的αβT细胞不同,固有自然杀伤T细胞(iNKT细胞)在胸腺中完成其终末分化为功能性的iNKT1/2/17细胞。然而,指导iNKT亚群分化的潜在分子程序仍然不清楚。在这里,作者利用单细胞RNA测序(scRNA-seq)和单细胞转座可及染色质测序(scATAC-seq)对四个胸腺iNKT发育阶段的超过17,000个iNKT细胞的转录组和超过39,000个iNKT细胞的染色质可及状态进行了分析,以定义它们的发育轨迹。研究发现了iNKT前体和不同iNKT亚群的新特征,并表明iNKT2和iNKT17细胞系的发育可能在第0阶段(ST0)早期就通过两个不同的程序发生了,而iNKT1的发育可能发生在ST0之后。iNKT1和iNKT2细胞都表现出广泛的表型和功能多样性,而iNKT17细胞相对均一。此外,发现一个新的转录因子Cbfβ在iNKT前体中高表达,其表达轨迹与其他已知的iNKT细胞发育转录因子Zbtb16和Egr2相似,并且可以指导iNKT细胞命运并推动它们的效应器表型分化。通过条件性敲除Cbfβ,阻断了早期iNKT细胞的发育,并导致iNKT1/2/17细胞分化严重受损。总的来说,本研究揭示了不同的iNKT发育程序以及它们的细胞多样性,并确定了一个新的转录因子Cbfβ作为早期iNKT细胞发育的关键调节因子。本文于2023年6月发表在《Cell Discovery》IF: 33.5期刊上。
技术路线

主要实验结果:
1、通过scRNA-seq和scATAC-seq对胸腺iNKT细胞在连续发育阶段进行聚类
为揭示iNKT细胞的发育景观,采用荧光激活细胞分选(FACS)技术从连续发育阶段中收集胸腺iNKT细胞,以进行scRNA-seq和scATAC-seq实验(图1a,b)。鉴于在C57BL/6小鼠中胸腺ST0(CD24+) iNKT细胞的稀缺性,利用Vα14-Jα18转基因小鼠(也称为rec-Vα14Tg)进行ST0 iNKT细胞分析,其TCR基因座与内源性TCR基因座非常相似,但具有丰富的ST0 iNKT细胞。如预期的,发现在rec-Vα14Tg和C57BL/6小鼠的ST0 iNKT细胞中,scATAC-seq谱的相似性很高。因此,进一步使用rec-Vα14Tg小鼠进行ST0 iNKT细胞的scRNA-seq分析,并使用C57BL/6小鼠进行ST1(CD24−CD44loNK1.1−)、ST2(CD24−CD44hiNK1.1−)和ST3(CD24−CD44hiNK1.1+) iNKT细胞的分析(图1a–c)。
经过质量控制过滤和排除细胞异常值后,共保留了17,944个高质量的单一胸腺iNKT细胞,总共表达了13,578个基因,用于随后的scRNA-seq分析。在聚合的iNKT细胞(ST0–ST3)中鉴定16个簇,每个簇的细胞数量从255个到2817个不等(图1d,e)。每个簇中最显著差异表达的基因(DEGs)显示在热图中(图1f)和小提琴图中(图1g)。在这些簇中,有四个簇(C2,C4,C9和C14)来自ST0,八个簇来自ST1(C3,C5,C6,C7,C10,C11,C15和C16),九个簇来自ST2(C1,C3,C5,C6,C7,C10,C11,C13和C15),以及四个簇来自ST3(C1,C5,C8和C12)(图1d)。ST0 iNKT细胞明显与其他iNKT阶段分离,而来自ST1和ST2 iNKT细胞的簇有适度的重叠,而来自ST3 iNKT细胞的簇与来自ST2 iNKT细胞的簇紧密相邻(图1d)。此外,相关性分析表明,同一阶段内的不同簇呈相对相似的转录组模式。
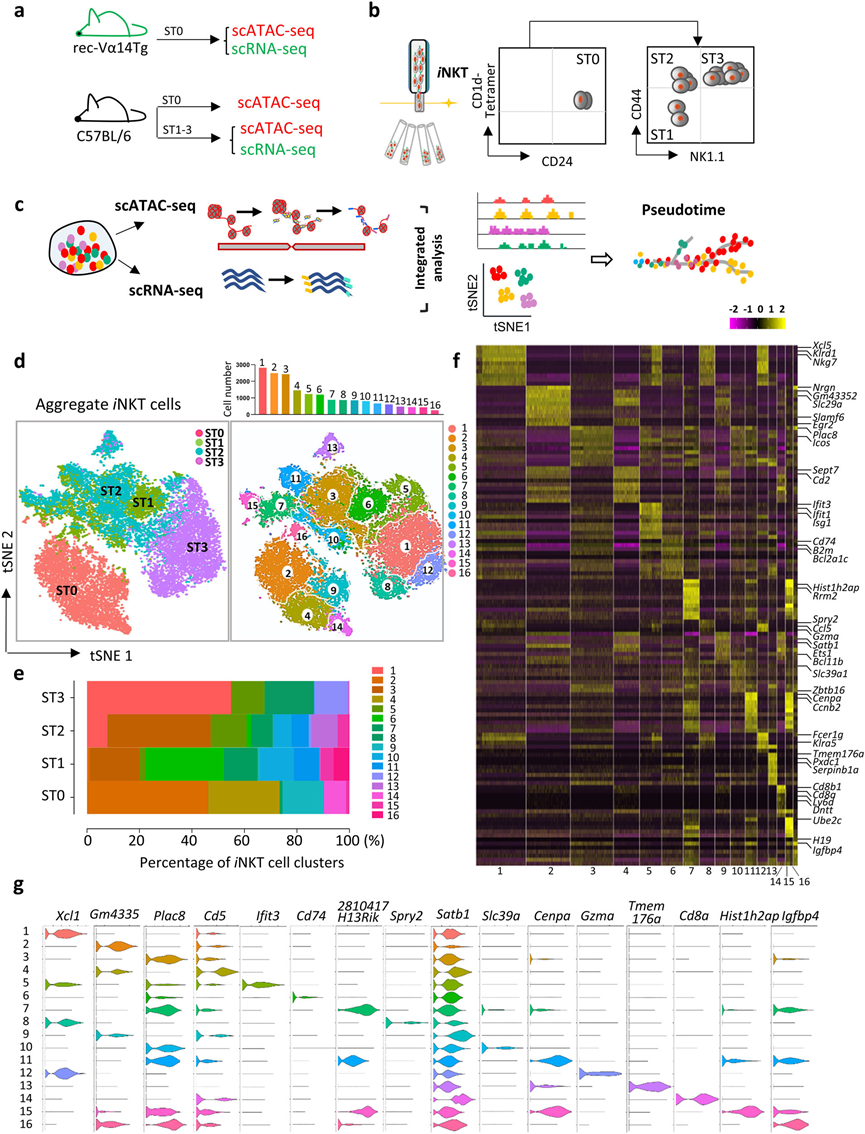
图1 小鼠胸腺iNKT细胞的多样性
细胞分化伴随着由顺式调控元件控制的基因的表达,这些元件必须处于开放状态才能正常发挥功能。因此,对与scRNA-seq分析中相同发育阶段的胸腺iNKT细胞进行了scATAC-seq分析,并绘制了单个iNKT细胞的染色质可及性景观。在与scRNA-seq数据整合后,这十六个iNKT细胞簇很容易识别(图2a)。由于scRNA-seq允许根据转录组推测当前细胞状态,作者根据其特征转录组和细胞因子转录表达,将每个簇(C1–C16)分配到已发表的iNKT1、iNKT2和iNKT17功能亚群中。结果发现来自ST1和ST2的C3、C6、C7、C10、C11、C15和C16簇被分类为iNKT2亚群;来自ST3主要的C1、C5、C8和C12簇被分类为iNKT1(图2b);而来自ST2的独特iNKT C13被分配到iNKT17(图2b)。ST0簇(C2、C4、C9和C14)在任何iNKT亚群中都不突出,因为它们没有表现出强烈的效应特征(图2b)。总体而言,通过整合转录组和表观遗传学特征,绘制了胸腺iNKT细胞的动态转录组和染色质景观,揭示了iNKT1和iNKT2细胞的异质性以及iNKT17细胞的相对同质性。
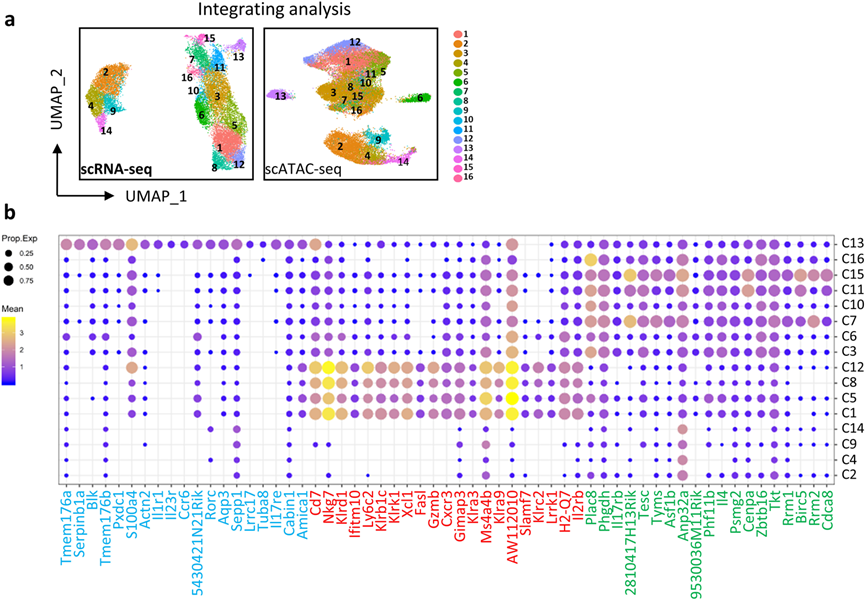
图2 不同的iNKT簇被分配到功能子集中
2、ST0中的两个发育轨迹
胸腺中iNKT细胞的发育依赖于位于胸腺皮质的大约1000个ST0 iNKT前体细胞(iNKTp)。在这里,作者鉴定了ST0中的四个簇(C2、C4、C9和C14)(图1d和3a),并突出显示了每个簇的特定特征(图3b)。根据CD4和CD8的表达,这些ST0簇可以分为三组:C14是CD4+CD8+(DP)iNKTp;C9是CD4+CD8−(CD4SP)iNKTp,富含T淋巴细胞存活调节因子,包括Id2和Il7r;C2和C4是CD4−CD8−(DN)iNKTp,其中C4高度表达Cd5和Cd6,而C2 iNKTp丰富表达Egr2和Slamf6,它们分别通过调节PLZF表达和TCR信号强度,对iNKT细胞的发育至关重要(图3b–d)。尽管先前的研究声称iNKT细胞要么是CD4−CD8−(DN),要么是CD4+CD8−(CD4SP),但在ST0中确实发现了一个小的CD4+CD8+(DP)iNKTp簇(C14)(图3c–e)。
将ST0 iNKTp组织成一个伪时间轨迹。鉴别了两个潜在的发育分支,即C14-C2-C4分支(称为DP-DN分支)和C14-C9分支(DP-CD4SP分支)(图3f)。这两个分支最终在表达趋化因子受体Ccr7增加的发育末端相遇(图3g),Ccr7在ST0 iNKTp从胸腺皮质迁移到髓质中是必需的。通过流式细胞仪在蛋白质水平上进一步确认了DP、DN和CD4SP iNKTp中Ccr7的表达模式(图3h)。因此, DP iNKTp下调CD8或同时下调CD4和CD8的表达,以启动在胸腺皮质中的DP-CD4SP或DP-DN发育程序,最终迁移到胸腺髓质。
3、ST0中功性能iNKT亚型谱系
接下来,想知道ST0中这两个发育程序如何对iNKT亚型谱系产生影响。尽管PLZF被注释为关键的iNKT2标志,但它对整体iNKT细胞的发育也至关重要,包括iNKT1和iNKT17细胞。因此,首先评估了Zbtb16(编码PLZF)在ST0 iNKTp中的表达模式和染色质可及性。发现在DP iNKTp(C14)中,Zbtb16的+40 kb区域和TSS是不可及的,但在CD4SP(C9)和DN(C2和C4) iNKTp中是可及的,其中C2的开放性水平远高于C4,这与Zbtb16的表达模式非常相似(图3i,j)。伪时间轨迹和流式细胞仪进一步表明,Zbtb16在DN和CD4SP iNKTp中富集(图3j,k)。鉴于iNKT2分化需要比iNKT1和iNKT17更强的TCR信号,因此CD4SP中的PLZF高表达iNKTp(C9)更有可能进入iNKT2细胞谱系。
RORγt是调控iNKT17分化的关键转录因子,但也高度表达于未被信号刺激的DP胸腺细胞,并促进iNKT细胞选择。与Zbtb16不同,在+4 kb区域的Rorc(编码RORγt)在DP(C14)和DN(C2和C4)iNKTp中是可及的,但在CD4SP(C9)簇中不可及,而+13 kb到Rorc只在DP iNKTp(C14)中可及。Rorc的表达模式与每个簇中的染色质可及性状态一致(图3l)。Rorc在DP iNKTp中显著高表达,并在DN分支(C4和C2)中逐渐下调,但在CD4SP(C4)中几乎不可检测(图3m),这在流式细胞仪中得到了进一步验证(图3n)。总体而言,基于伪时间的发育轨迹分析揭示了ST0可能存在两个潜在的发育程序,在这两个程序中,iNKT细胞可能启动对iNKT2和iNKT17细胞的发育,这早在ST0发生,而iNKT1细胞可能在ST0后启动。然而,这一假设仍在进一步调查中。
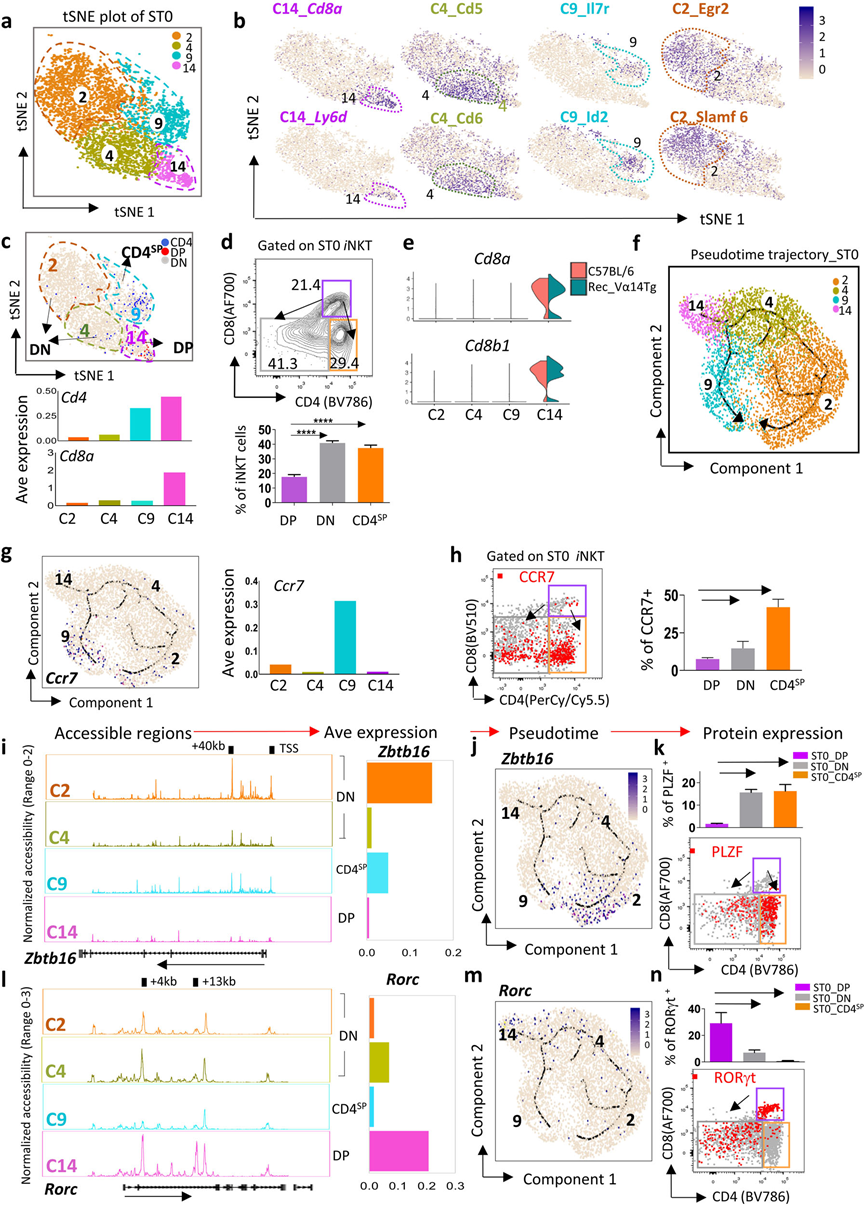
图3 ST0时期iNKT细胞的细胞多样性
4、iNKT2细胞的细胞多样性
为了解ST0后iNKT子集的发展,将聚集的胸腺iNKT细胞(ST0 - 3)映射到伪时间轨迹中(图4a)。iNKT2细胞展示了广泛的多样性,包括C3、C6、C7、C10、C11、C15和C16簇(图2b和4a, b)。首先评估了整合的iNKT细胞簇(C1–C16)中Zbtb16染色质的可及性。在Zbtb16位点的181 kb内,发现iNKT2、iNKT1和iNKT17簇中高度可访问的区域,但在ST0簇(C2、C4、C9和C14)中区域较弱。Zbtb16的表达与其染色质可及性密切匹配(图4c)。iNKT2簇和ST0中的C2和C9显示了GATA3结合活性的高活性,GATA3对iNKT2分化至关重要(图4d)。正如预期的那样,对于iNKT2细胞的大多数标志基因,它们在中间阶段逐渐增加,然后在终端分化期间下调。然而,一些基因,包括Btg1、Cebpb和Osgin1,仅在iNKT发育末端附近出现,这可能与iNKT2细胞的终末事件相关(图4e)。
先前的研究表明,ST1和ST2中的iNKT细胞经历高度的增殖。细胞周期通路富集分析表明,iNKT2簇(C7、C11和C15)表现出高度增殖的特征,这些特征可能处于S期(C7)或G2/M期(C11和C15)(图4f)。Ingenuity Pathway Analysis(IPA)表明,簇C3、C6、C10和C16在功能上存在差异。C16是从ST0到ST1的iNKT细胞的短暂阶段,这些细胞迅速上调了与糖酵解和氧化磷酸化都相关的基因的表达(图4g),表明它们对能量的需求增加。C6在ST1中终止,这些细胞富集了与TCR信号、共刺激信号、细胞骨架、TNFR以及细胞死亡和衰竭通路相关的基因(图4g)。总体而言,iNKT2展现出极大的细胞多样性。
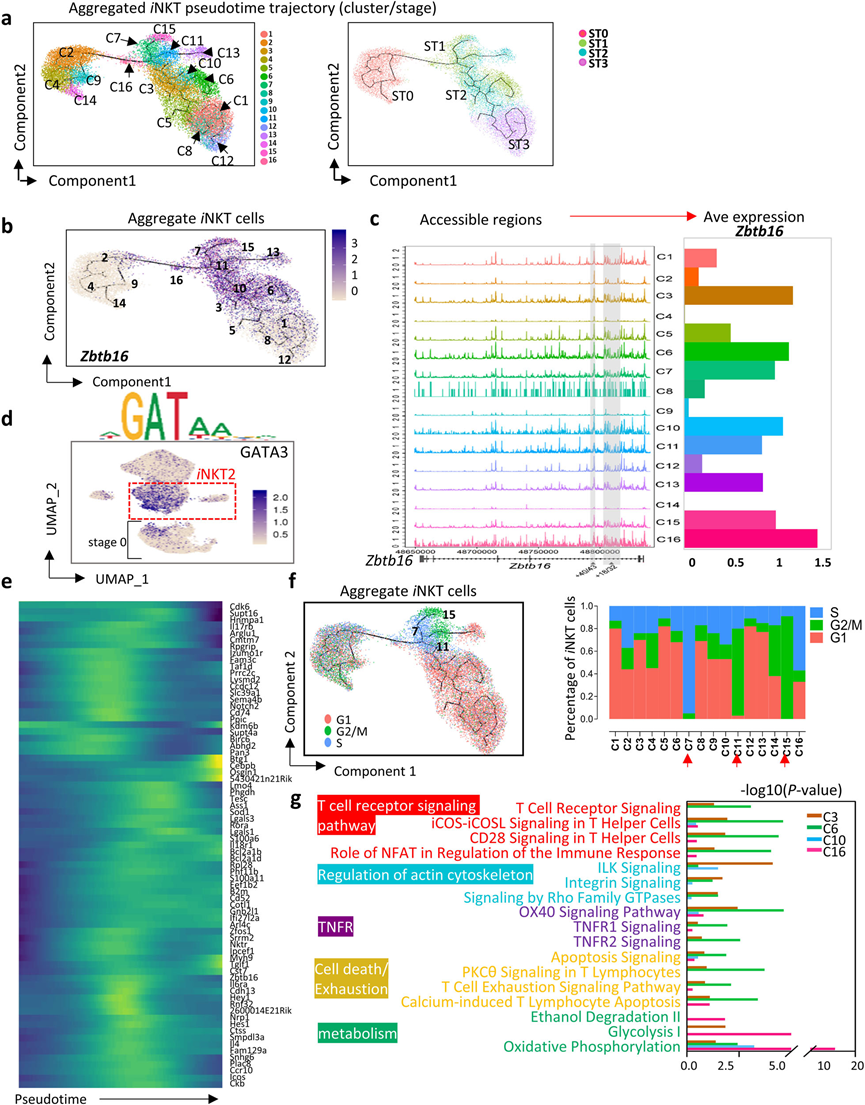
图4 iNKT2细胞的细胞多样性
5、iNKT1细胞的异质性
iNKT1细胞分化受转录因子Tbx21的调控,分为四个簇(C1、C5、C8和C12)(图2b和5a)。在Tbx21位点的17.2 kb内,启动子区域–3 kb和–4 kb在C1、C5和C12中高度可访问,但在C8中较不可访问(图5b)。这些相同的区域在ST1和ST2中的高增殖C7、C11和C15 iNKT2簇中也是可访问的。重要的是,Tbx21结合位点的活性也发生在这些簇中,而在ST0簇中则不是如此(图5c)。流式细胞仪分析进一步证实,ST1和ST2中的PLZFhiiNKT2细胞中有一小部分表达T-bet,并且通过Ki-67测量具有相当的增殖能力(图5d)。因此,iNKT1的前体可能隐藏在这些所谓的高增殖PLZFhiT-bethi iNKT2细胞中。
伪时间轨迹分析发现一个新的标志基因,Slamf7,在iNKT1细胞簇中富集(图5e)。流式细胞仪进一步证实了这一点,基于PLZFloT-bethi iNKT1细胞中SLAM7和NK1.1表达之间的强相关性(图5f)。与其他iNKT1细胞簇相比,NK细胞相关的标志基因Slamf4进一步区分了末端的C12。SLAMF4+ iNKT细胞(C12)主要是DN,逐渐从PLZFloT-bethi iNKT1细胞中分化出来(图5g–i)。SLAMF4+ iNKT1细胞主要分泌IFN-γ,IL-4较少,类似于“经典iNKT1细胞”,而大多数SLAMF4− iNKT1细胞在刺激后分泌IL-4和IFN-γ(图5j)。C5细胞富集了参与干扰素信号通路的Ifit1和Ifit3(图5k)。总体而言,iNKT1细胞从ST1开始,起初表现为目前定义的“iNKT2细胞”,逐渐完成分化并最终转化为末端的SLAMF4+ iNKT1细胞,即经典的分泌IFN-γ的iNKT1细胞。
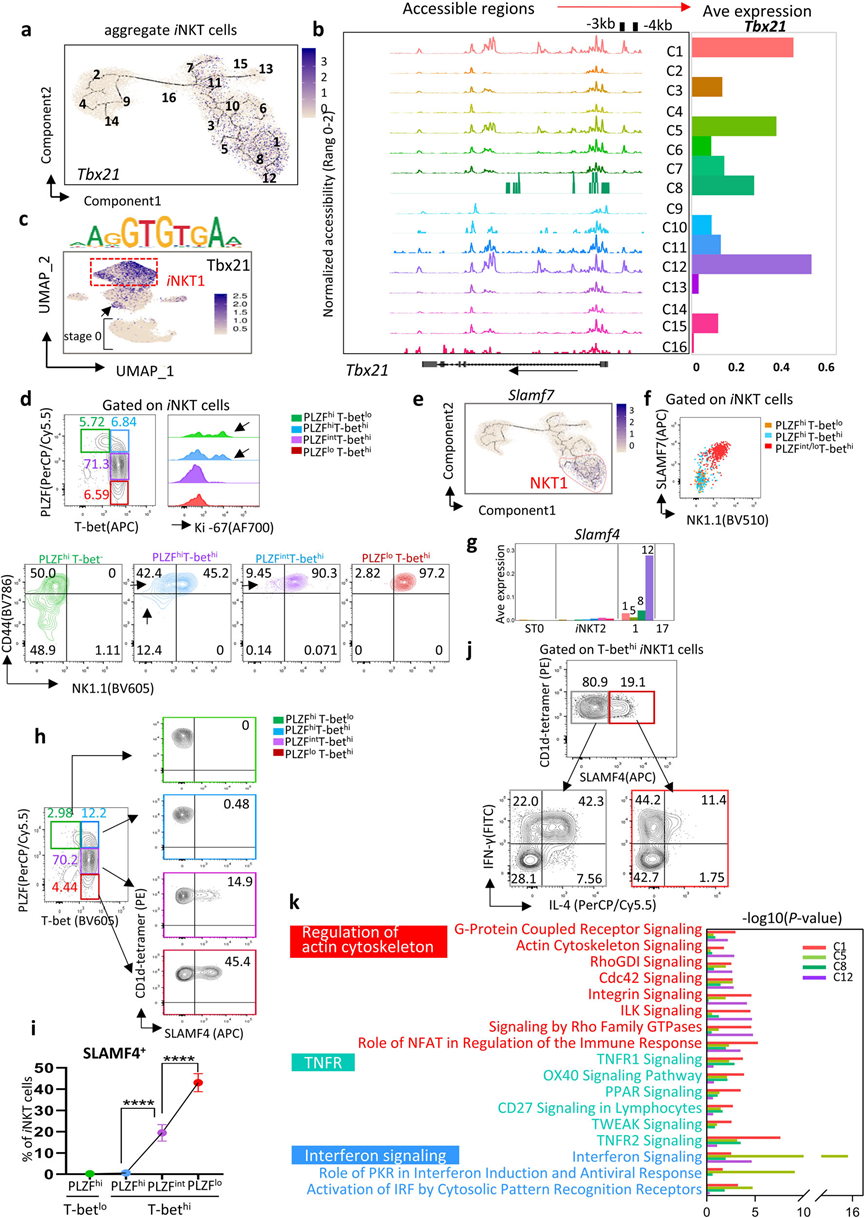
图5 iNKT1细胞具有广泛的细胞异质性
6、iNKT17细胞表现出有限的多样性
C13被指定为iNKT17细胞,它在图2b和6a中与其他簇明显分开。观察到Rorc的+4 kb和+14 kb区域在ST0簇(C2、C4和C14)和成熟的iNKT17簇(C13)中是可访问的(图6b),并且RORC的结合位点在iNKT17簇以及ST0 iNKTp中也被激活(图6c)。这些数据表明,iNKT细胞可能在ST0开始其iNKT17分化,并在C13完成其分化。在mRNA水平上,Rorc在ST0的C14中高度表达,与Rorc的染色质可及性一致,但在C4和C2中逐渐下调,并在C13中重新上调,表明其他转录因子可能靶向开放的Rocr位点,并在iNKT17分化过程中调控Rorc的表达。
为追踪iNKT17细胞的发育轨迹,进一步在一个有序的iNKT细胞轨迹中检查了iNKT17标志基因,并发现少数iNKT17标志基因,包括Rorc,在早期iNKTp中最初表达,然后在它们达到成熟的iNKT17之前。然而,大多数与iNKT17相关的标志基因在iNKTp中几乎不表达(图6d)。进一步发现一个新的标志基因, Aqp3,在胸腺iNKT17(PLZFintRORγt+)细胞中特异表达(图6e,f)。总体而言,iNKT细胞可能在ST0启动iNKT17分化,而这些iNKT17细胞表现出有限的多样性。
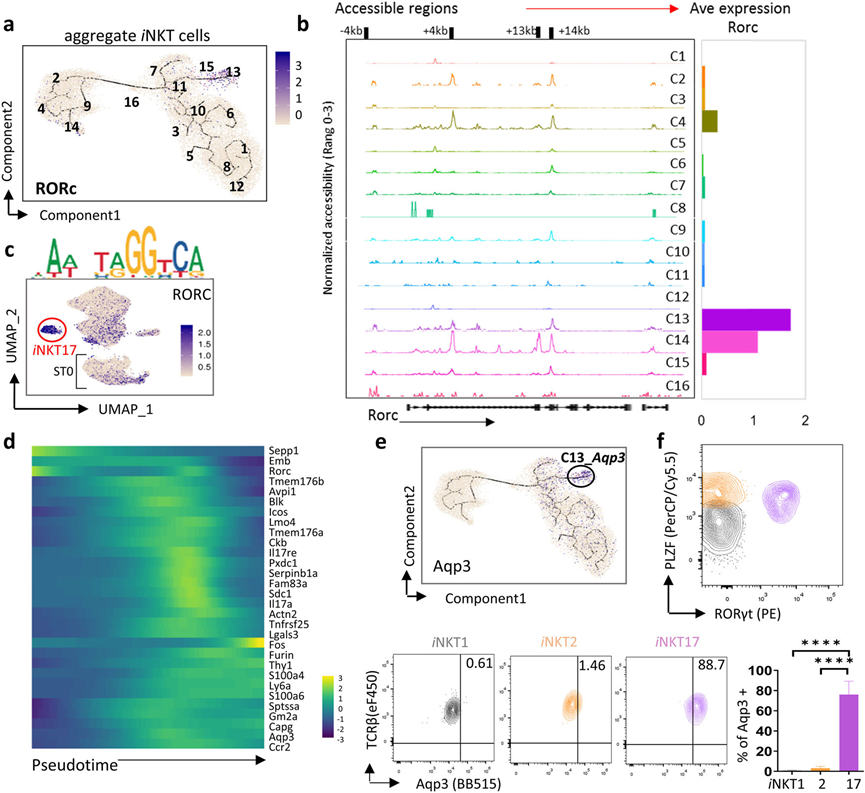
图6 iNKT17细胞表现出有限的异质性
7、Cbfβ调控iNKT细胞的早期分化
先前的研究指出,Egr2和Slamf6通过调节Zbtb16的表达和TCR在ST0中控制早期iNKT细胞的发育。在这里,作者发现了一个新的共转录因子,Cbfβ,它与Egr2和Slamf6表现出相似的表达模式,并在iNKT细胞的ST0阶段表现出很高的富集,特别是在DP-DN分支C2中(图7a, b)。
Cbfβ编码的CBFB是一个非DNA结合的调节亚基,通过异构增强RUNX(RUNX1、RUNX2和RUNX3)的特异性DNA结合能力,从而调节它们目标基因的转录。为确定Cbfβ是否调节iNKT发育,检查了胸腺特异性Cbfβ敲除小鼠(CD4CreCbfβ f/f,Cbfβ KO)中的iNKT细胞发育,其中Cbfβ1和Cbfβ2均被敲除。Cbfβ敲除导致胸腺iNKT细胞的频率和绝对数量显著减少(图7c)。进一步更全面的分析揭示了Cbfβ KO小鼠中ST2和ST3 iNKT细胞的选择性和显著减少。Cbfβ KO小鼠中ST0和ST1 iNKT细胞的频率显著增加,但在Cbfβ KO和WT对照组之间,绝对数量是可比的(图7d)。有趣的是,在Cbfβ KO小鼠的ST0 iNKT细胞中,DP iNKTp增加(图7e),表明Cbfβ的敲除部分阻断了DP iNKTp向CD4SP或DN谱系的转化。作者推测Cbfβ可能影响DP阶段的iNKT细胞选择。
ST1 iNKT细胞经历迅速的增殖,并包含具有高Zbtb16编码PLZF表达的iNKT亚群的前体。在这里,观察到在Cbfβ KO iNKT细胞中,ST1时的PLZF表达显著下调(图7f)。在一个增殖标记Ki-67上也观察到了类似的现象(图7g)。这些数据表明,Cbfβ缺乏的iNKT细胞进入了相对静止状态,无法在ST1正常上调PLZF表达。此外,在ST1中残留的PLZF+ iNKT细胞未能共同表达T-bet以启动iNKT1分化,也未能共同表达RORγt以启动iNKT17分化(图7h,i)。总体而言,研究表明,Cbfβ在控制ST0时的早期iNKT细胞发育、ST1/2时的iNKT细胞分化以及ST3时的最终成熟中起到关键调节作用(图7j)。
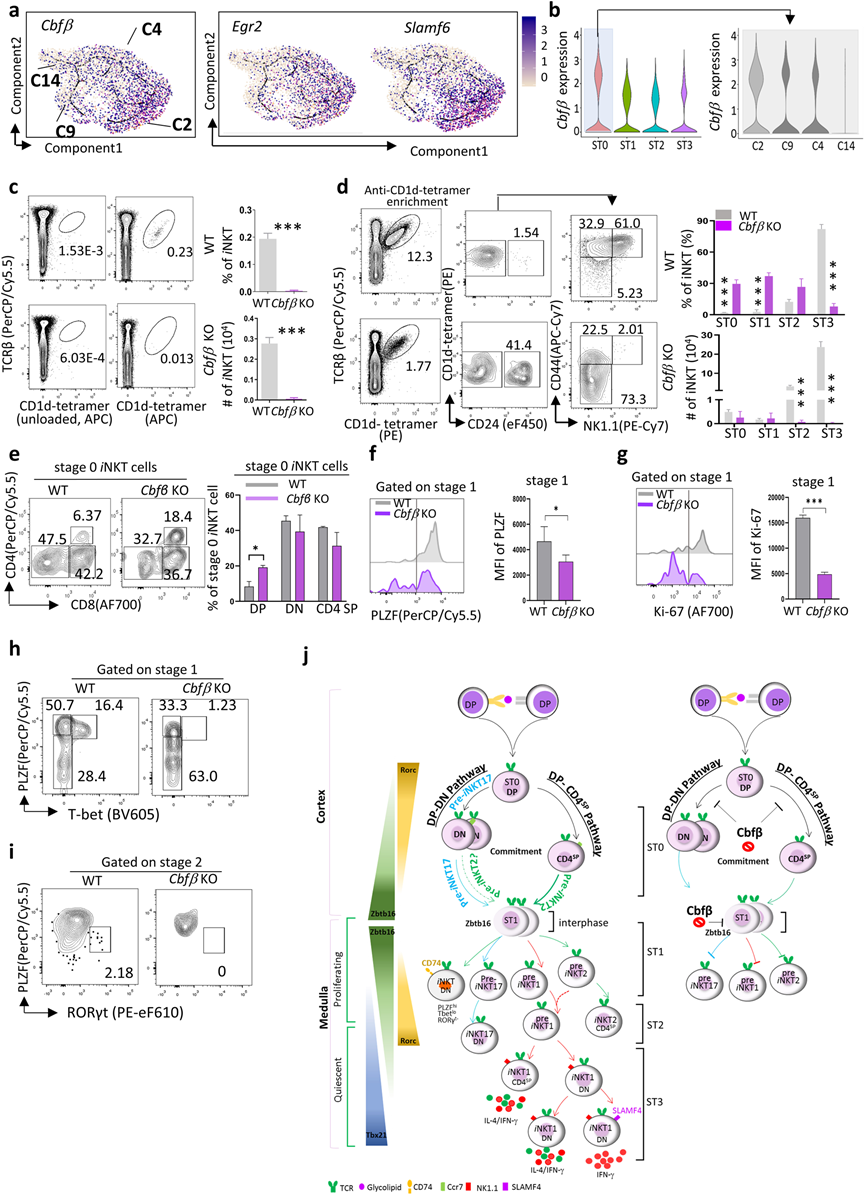
图7 Cbfβ调控iNKT细胞早期细胞谱系
实验方法:
构建条件性敲除小鼠,流式细胞术,骨髓嵌合体移植实验,小鼠iNKT细胞富集和分选,qRT-PCR,WB,scRNA-seq,iNKT scRNA-seq数据集与参考文献的比较分析,scATAC-seq,scRNA-seq和scATAC-Seq的整合分析
参考文献:
Wang J, Adrianto I, Subedi K, Liu T, Wu X, Yi Q, Loveless I, Yin C, Datta I, Sant'Angelo DB, Kronenberg M, Zhou L, Mi QS. Integrative scATAC-seq and scRNA-seq analyses map thymic iNKT cell development and identify Cbfβ for its commitment. Cell Discov. 2023 Jun 20;9(1):61. doi: 10.1038/s41421-023-00547-x. PMID: 37336875; PMCID: PMC10279728.






