ZDHHC5对下丘脑小胶质细胞PKCδ的棕榈酰化作用是脂肪肝治疗靶点
下丘脑通过神经内分泌信号在控制脂质代谢方面发挥重要作用。然而,目前在下丘脑中还没有能够有效改善人类脂质代谢的药物靶点。在这项研究中,作者发现抗疟药物蒿甲醚(ART)通过特异性抑制高脂饮食诱导小鼠下丘脑中的小胶质细胞活化,显著改善脂质代谢。从机制上讲,ART保护小胶质细胞周围的促甲状腺激素释放激素(TRH)神经元免受炎症损伤,并促进TRH释放到外周循环中。因此,TRH刺激甲状腺激素(TH)的合成,从而显著改善肝脏脂质紊乱。随后,作者使用生物素标记的ART化学探针来鉴定小胶质细胞中的直接细胞靶点为蛋白激酶Cδ(PKCδ)。重要的是,ART直接靶向PKCδ,通过阻断锌指DHHC型棕榈酰转移酶5(ZDHHC5)的结合来抑制其棕榈酰化修饰,从而抑制下游神经炎症信号传导。在体内,下丘脑小胶质细胞特异性PKCδ敲低显著损害了小鼠ART依赖性神经内分泌调节和脂质代谢改善。此外,人脑组织中的单细胞转录组学分析显示,小胶质细胞中PKCδ的水平与高脂血症患者呈正相关,从而突出了临床转化价值。总之,这些数据表明,下丘脑中小胶质细胞PKCδ的棕榈酰化通过下丘脑-肝脏通讯调节外周脂质代谢,并为脂肪肝疾病提供了一个有前景的治疗靶点。该研究于2024年1月发表在《Theranostics》,IF 12.4。
技术路线:

主要研究结果:
1 药物再定位确定抗疟药物ART是一种降脂剂
药物重新定位是开发代谢性疾病新疗法的一种很有前途的策略,从而改善传统药物的开发。HFD喂养的小鼠被用作研究脂质代谢的实验模型,特别关注脂质代谢紊乱。为了探讨抗疟药物ART是否能减轻HFD诱导的脂质代谢紊乱,C57BL/6J小鼠接受对照饮食或HFD治疗5周(图1A)。如图1B-1D所示,HFD治疗显著提高了血清总胆固醇(TC)、总甘油酯(TG)和非高密度脂蛋白胆固醇(non-HDL-C)水平,而ART以剂量依赖性方式抑制了这些水平。此外,油红O染色显示,HFD处理促进肝中脂滴的积聚,ART显著逆转这一现象(图1E)。H&E染色还显示ART改善了脂质代谢紊乱相关的脂肪变性(图1F)。此外,定量实时聚合酶链式反应(RT-PCR)分析显示,在接受ART治疗的受试者的肝脏中,脂质代谢相关基因,即肉碱棕榈酰转移酶1A(Cpt1a)和过氧化物酶体增殖物激活受体α(Ppara)的表达显著增加。此外,脂质合成基因的表达,硬脂酰辅酶A去饱和酶1(Scd1),通过HFD治疗上调的在口服ART后被观察到下调(图1G)。在脂质代谢相关蛋白的情况下观察到类似的模式。ART的给药显著增加了CPT1A和PPARA蛋白的表达,同时抑制了SCD1蛋白的表达。同时,我们发现ART明显降低了血清谷丙转氨酶(ALT)和谷氨酰胺草乙酸转氨酶(AST)水平,并使肝脏超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-PX)活性和丙二醛(MDA)水平正常化,证实明显的保肝作用(图1H-1I)。为了验证ART对脂质代谢紊乱的作用,作者使用另一种Balb/c小鼠来测试之前的观察结果。在这里,作者发现ART对脂质代谢表现出类似的改善作用,包括血脂水平、肝脏脂质积聚、脂质代谢相关基因表达、蛋白质表达和氧化应激。总之,这些结果表明ART是一种有效的降脂剂,可以改善肝脏脂质代谢紊乱。
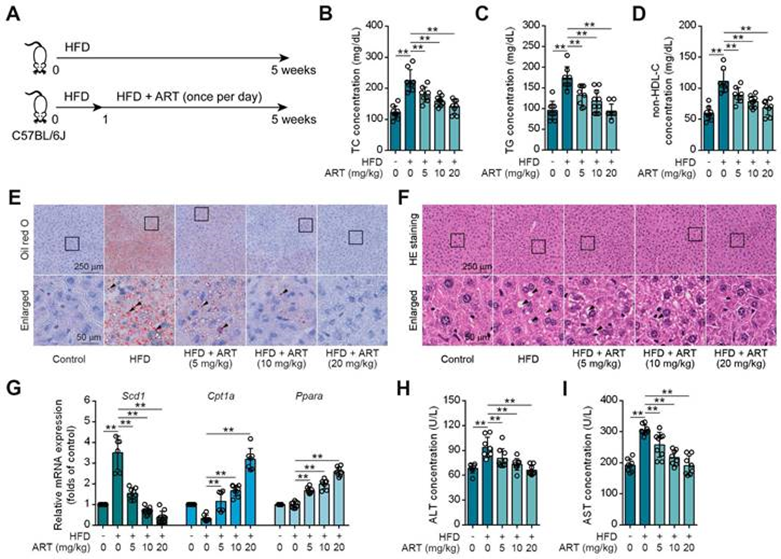
图1:ART抑制HFD喂养的C57BL/6J小鼠肝脏脂质代谢紊乱
2 ART通过激活神经内分泌系统改善肝脏脂质紊乱
为研究ART如何调节脂质代谢,作者建立了棕榈酸(PA)或油酸(OA)诱导的人肝细胞(LO2)模型。尼罗红染色显示,PA或OA处理明显促进LO2细胞中的脂质积累,但ART并不能阻止这些变化。类似的观察结果表明,ART没有阻断PA或OA诱导的人HepG2细胞中的脂质积聚。此外,ART对PA诱导的LO2细胞中Cpt1a和Ppara基因表达没有显著影响。为进一步深入了解ART对肝脏脂质代谢的影响,作者使用原代肝细胞进行实验。研究结果显示,当接受PA或OA治疗时,ART不会增强Cpt1a和Ppara基因或蛋白质的表达。因此,这些结果表明ART剂量不能直接调节肝脏脂质代谢。
先前的研究表明,小肠上皮细胞的摄取和吸收与脂质代谢紊乱的发展有关。为阐明ART是否影响小肠上皮细胞的摄取,作者进行了Caco-2转运实验。他们发现硬脂酸(SA)、PA、OA和胆固醇(CHO)从心尖(AP)转运到基底外侧(BL),不受ART的影响。这些结果表明ART剂量不干扰肠道吸收。此外,ART对体重和食物摄入量没有明显影响。
接下来,作者寻找ART介导的降脂作用的其他潜在机制。据报道,神经内分泌系统在调节能量代谢中起着至关重要的作用,因此作者假设ART通过调节激素分泌改善脂质代谢。首先,作者检测了脂质代谢相关激素的释放,包括肾上腺素、胰岛素和胰高血糖素。在这里,ART并没有显著调节这些激素的水平。此外,研究结果显示,在接受ART治疗后,喂食HFD小鼠PVN区域的TRH水平显著增加(图2A)。此外,作者的研究还表明,ART治疗导致血清TSH、游离总甲状腺素(FT4)和游离总三碘甲状腺原氨酸(FT3)水平显著上调。这些观察结果表明,ART可以通过调节神经内分泌系统来改善HFD诱导的脂质代谢紊乱(图2B-2D)。特别地,在LO2细胞上进行了使用l-THY作为合成甲状腺激素的概念验证实验。发现l-THY显著抑制PA或OA诱导的脂质积聚。类似地,l-THY减少了PA或OA诱导的HepG2细胞中的异常脂质积聚,表明TH在控制肝脏脂质代谢中的重要作用。
为进一步证实ART介导的TH释放和脂质代谢的相关性,作者接下来使用噻唑(THI,一种甲状腺功能抑制剂)治疗HFD喂养的小鼠(图2E)。如图2F-2H所示,THI显著逆转了ART调节的TC、TG和非HDL-C的下降。此外,THI阻断了ART介导的对肝脏脂质积聚的抑制(图2I-2J)。同时,作者发现THI明显消融ART降低了Scd1,而ART增加了Cpt1a、Ppara mRNA水平。
由于甲状腺激素受体(THRs)是能量消耗和肝脏脂质代谢的重要调节因子,作者试图探讨ART诱导的TH释放是否通过TH/THRs途径改善肝脏脂质代谢。在这项研究中,开发了一种肝特异性腺相关病毒-5-小分子短病毒蛋白-RNA-TH受体β(Ash-Thrb),可特异性靶向并降低THRβ蛋白的表达。作为Thrb敲低的结果,THRβ蛋白表达被成功降低(图2K)。数据表明,Thrb敲低逆转了注射Ash-Thrb的C57BL/6J小鼠中ART-介导的TC、TG和非HDL-C的下调(图2L-2N)。此外,作者的研究结果表明,在Thrb敲低模型中,ART治疗对肝脏脂质积聚没有表现出显著的抑制作用(图2O-2P)。这一观察结果表明,TH/THRs信号通路在ART调节肝脏脂质紊乱中起着至关重要的作用。此外,作者还利用HepG2细胞研究了TH介导的脂质代谢的潜在信号机制。作者发现,在HepG2细胞中,l-THY通过阻断核受体辅压因子1(NcoR1)和组蛋白脱乙酰酶3(HDAC3)之间的相互作用,显著降低PA诱导的乙酰组蛋白H3(K9)和乙酰组蛋白H4(K16),HDAC3先前被报道为肝脏脂质代谢的基本生物途径。此外,Thrb敲低抑制了HepG2细胞中l-THY改善的Cpt1a和Ppara mRNA水平,表明TH通过THR依赖性的乙酰组蛋白下调来调节脂质代谢。总之,这些数据表明,ART可能通过TH/THR级联调节肝脏脂质代谢(图2Q)。
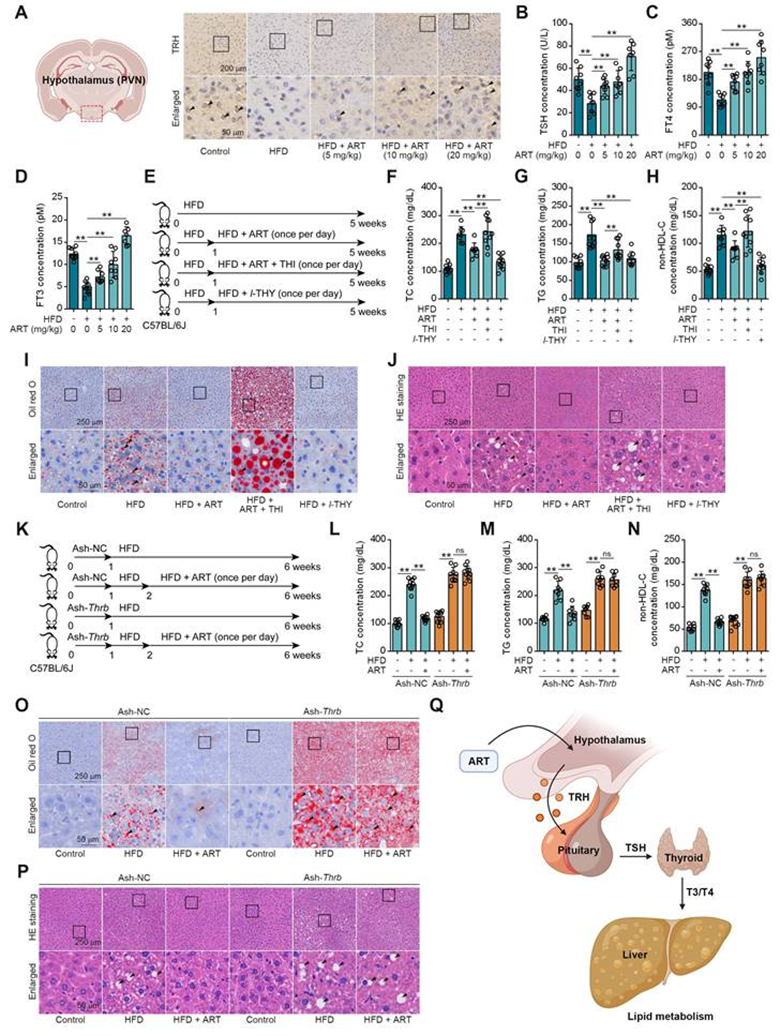
图2:TH介导ART治疗C57BL/6J小鼠HFD喂养的肝脏脂质代谢紊乱
3下丘脑小胶质细胞介导的神经炎症对TRH神经元损伤的神经内分泌控制作用
下丘脑TRH神经元对甲状腺激素水平的中枢调节已被广泛认可。由于小胶质细胞的激活与神经炎症和由此产生的神经元损伤高度相关,作者推测ART可能通过抑制HFD诱导的小胶质细胞激活来保护下丘脑TRH神经元。正如预期的那样,作者在HFD喂养的小鼠下丘脑PVN中观察到高电离钙结合适配器分子1(Iba1)的表达(小胶质细胞的标志物)(图3A),表明脂质代谢紊乱加速了小胶质细胞介导的神经炎症。然而,ART显著降低Iba1的表达并改善了小胶质细胞的形态(图3A)。同时还发现,ART降低了HFD诱导的下丘脑PVN中的小胶质细胞炎症介质(肿瘤坏死因子-α、TNF-α和白细胞介素-6、IL-6)(图3B-3C)。PVN区域的免疫荧光分析显示TNF-α/IL-6与Iba1共定位,表明小胶质细胞主要参与这些炎症因子的产生。此外,作者发现ART显著阻断PA诱导的BV-2和原发性小胶质细胞中一氧化氮(NO)、TNF-α和IL-6的产生(图3D-3F)。
鉴于小胶质细胞在神经炎症诱导的神经元损伤中发挥着重要作用,作者建立了原代神经元-小胶质细胞共培养的实验模型(图3G)。研究结果显示,来源于PA处理小胶质细胞的条件培养基(CM-PA)显著降低来源于PVN神经元的活力,并抑制TRH的表达。值得注意的是,ART直接治疗并没有减轻这种有害影响。然而,如图3H-3I所示,CM-PA治疗降低神经元活力和TRH表达,而PA/ART联合治疗的小胶质细胞衍生条件培养基(CM-ART)显著增加了神经元活力。在体内,作者对PVN中的TRH和Iba1进行免疫荧光染色。观察到活化的小胶质细胞(Iba1阳性)周围的TRH阳性神经元数量显著减少,ART治疗有效改善了这一情况(图3J)。此外,TRH和胶质纤维酸性蛋白(GFAP)的免疫荧光染色显示,ART对TRH和GFAP(星形胶质细胞的标志物)的共同表达没有表现出明显的影响(图S6Q)。总之,这些数据表明,小胶质细胞介导的神经炎症在下丘脑PVN中ART保护的TRH神经元中起着至关重要的作用。
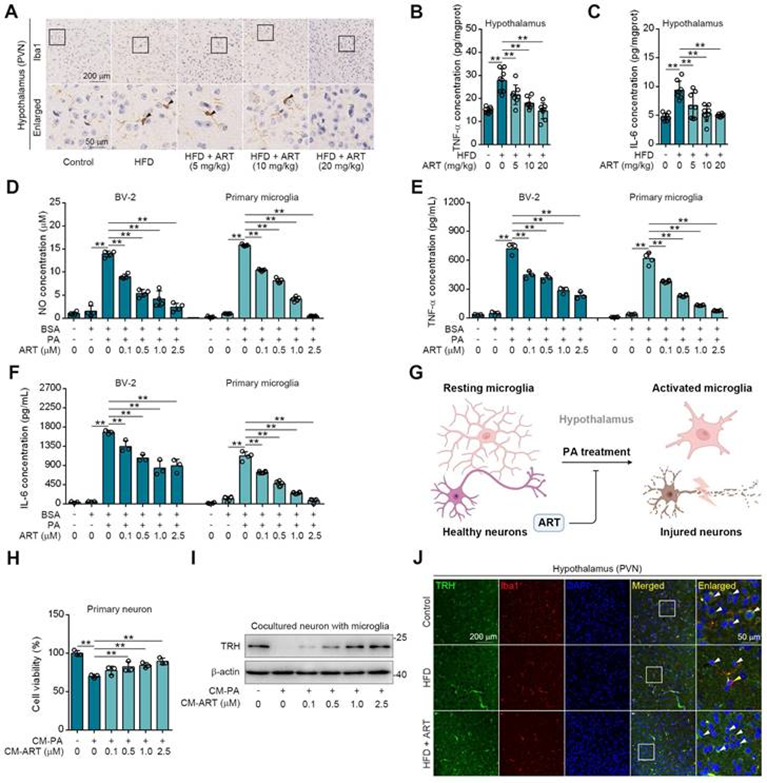
图3:ART保护PVN区神经元免受神经炎症的影响
4 PKCδ作为细胞靶点对抗微胶质细胞活化
为探索小胶质细胞介导的神经炎症靶蛋白,作者进行了热蛋白质组分析(TPP)技术来鉴定ART的细胞靶点。然后,通过高效液相色谱-串联质谱(HPLC-MS/MS)总共鉴定了2292个潜在的ART结合蛋白,根据实验重复性(重/轻,H/L比)和p值确认了其中118个(图4A)。从最初的候选蛋白库中,基于它们对转录表达谱的显著贡献,共选择20种潜在的靶蛋白进行进一步筛选。这一选择过程涉及利用转录组学与连接性图分析相结合。接下来,生物功能注释揭示了三种主要的炎症相关蛋白,包括蛋白激酶Cδ(PKCδ)、Serpinb1a和Serpinb6。特别是,PKC在先前的报告中强调了一种有前景的“可药用性”,暗示ART可能是一种潜在的PKC抑制剂。接下来,用泛PKC抑制剂staurosporine(STAU)进行的NO测定也验证PKC是与神经炎症病理相关的关键靶点(图4B)。
PKC家族成员分为多种亚型,负责不同的生物功能。除了PKCδ,还报道了PKCα、PKCζ和PKCμ与炎症过程高度相关。为探索ART与PKCδ的选择性相互作用,作者合成了生物素标记的ART探针(生物素ART)用于下拉分析。如图4C-4E所示,生物素ART显著降低了PKCδ,而生物素ART被过量的ART阻断。然而,ART与其他PKC没有表现出显著的相互作用,包括PKCα、PKCζ和PKCμ。此外,作者还发现ART在细胞热位移测定(CETSA)实验中显著阻止PKCδ蛋白的降解,但对PKCα、PKCζ和PKCμ没有影响(图4F)。类似地,药物亲和响应靶标稳定性(DARTS)分析表明,ART专门靶向PKCδ,以抑制其对蛋白酶的蛋白水解(图4G)。
PKCδ由一个N端调控结构域、一个C端催化结构域和一个短的“hinge”区组成。调控结构域包含C2样区和C1区,催化结构域包含C3区和C4区。为研究哪一个结构域是ART特别靶向的,作者将PKCδ截短为PKCδ1、PKCδ2、PKCΔ3和PKCδ4(图4H)。下拉分析显示,ART与独特的C1结构域特异性相互作用,但与C2样、C3或C4结构域无关(图4I-4J)。总之,作者的数据表明PKCδ是小胶质细胞中ART的重要细胞靶点。
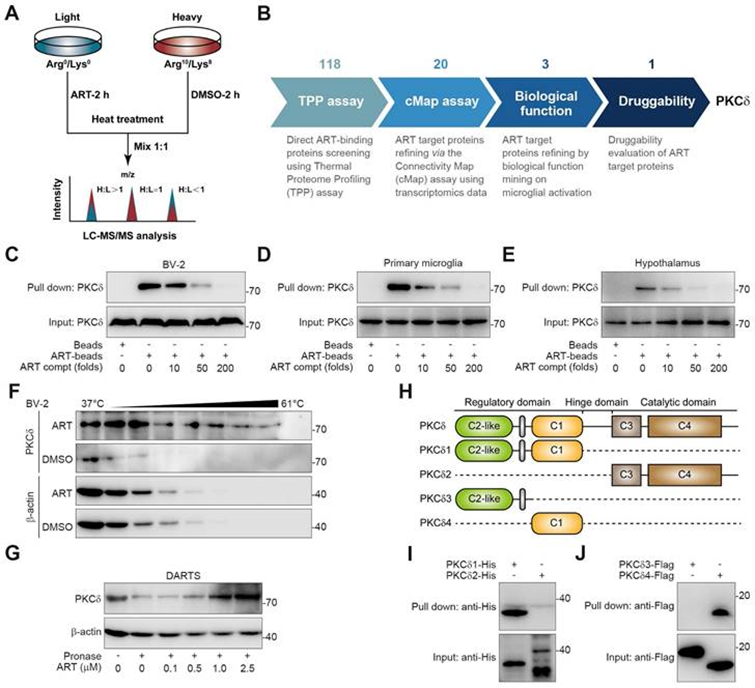
图4:在BV-2细胞中发现PKCδ作为ART的主要靶点
5 棕榈酰化修饰PKCδ对小胶质细胞的激活作用
由于PKCδ激活是神经炎症的关键先决条件,作者随后探讨了ART对PKCδ功能的调节机制。最近的研究表明,蛋白质棕榈酰化在磷酸化调节中起着重要作用,PA与半胱氨酸残基的共价连接(S-棕榈酰化)是蛋白质的广泛修饰。首先,作者观察到PA治疗显著增加了小胶质细胞中PKCδ的磷酸化,这被ART逆转(图5A)。在这里,作者推测PKCδ磷酸化可能通过其先前的棕榈酰化而受到潜在调节。为此,作者进行酰基生物素交换分析,并观察到PA显著增加了小胶质细胞中PKCδ棕榈酰化,这被ART逆转(图5B)。此外,在喂食HFD小鼠的下丘脑中观察到PKCδ棕榈酰化明显增加。特别是,发现下丘脑中的PKCδ棕榈酰化被ART治疗显著阻断。接下来,作者使用2BP,一种蛋白质棕榈酰化阻滞剂,来抑制PA诱导的BV-2细胞中的PKCδ棕榈酰化。如图5C所示,2BP几乎完全消除了ART介导的PKCδ磷酸化抑制。此外,作者观察到2BP治疗显著逆转了ART介导的NO、TNF-α和IL-6释放的抑制作用(图5D-5F),表明PKCδ棕榈酰化在脂质诱导的小胶质细胞活化和神经炎症中起着至关重要的作用。
为研究PKCδ棕榈酰化的分子机制,作者进行了全局蛋白质组学分析,并通过HPLC-MS/MS鉴定ZDHHC5是下丘脑中最重要的棕榈酰转移酶。然后敲低ZDHHC5,发现PA诱导的PKCδ棕榈酰化在敲低ZDHHC5的细胞中显著减弱。同时,ART介导的对PKCδ磷酸化的抑制也被Zdhhc5敲低显著阻断(图5G),表明Zdhhc5依赖的PKCδ棕榈酰化有助于PKCδ磷酸化。Co-IP实验还显示,PKCδ-ZDHHC5相互作用可被ART在药理学上抑制(图5H)。此外,在si-Zdhhc5治疗后,ART失去了对NO、TNF-α和IL-6释放的抑制作用(图5I-5K)。因此,这些结果表明,ZDHHC5依赖性棕榈酰化在小胶质细胞中高度参与PKCδ的激活(图5L)。
接下来作者研究PKCδ依赖性神经炎症信号通路。KEGG通路分析富集了3种主要的炎症信号通路,包括NLRP3、NF-κB和Janus激酶信号转导转录激活剂(Jak-Stat)。接下来,进行蛋白质印迹以研究ART对NLRP3炎症小体途径的影响。PA增加了NLRP3、胱天蛋白酶1、IL-1β和IL-18的水平,这一水平被ART显著逆转。此外,PA组κB激酶β磷酸化抑制剂(pIKKβ)、pNF-κB p65和核因子κBα磷酸化抑制物(pIκBα)的表达显著增加,这被ART抑制。此外,作者观察到PA诱导Jak2、Stat5和Stat3磷酸化水平的增加,这被ART治疗阻断。总之,这些数据表明,PKCδ通过独特的棕榈酰化修饰作为小胶质细胞活化和神经炎症的脂质传感器。
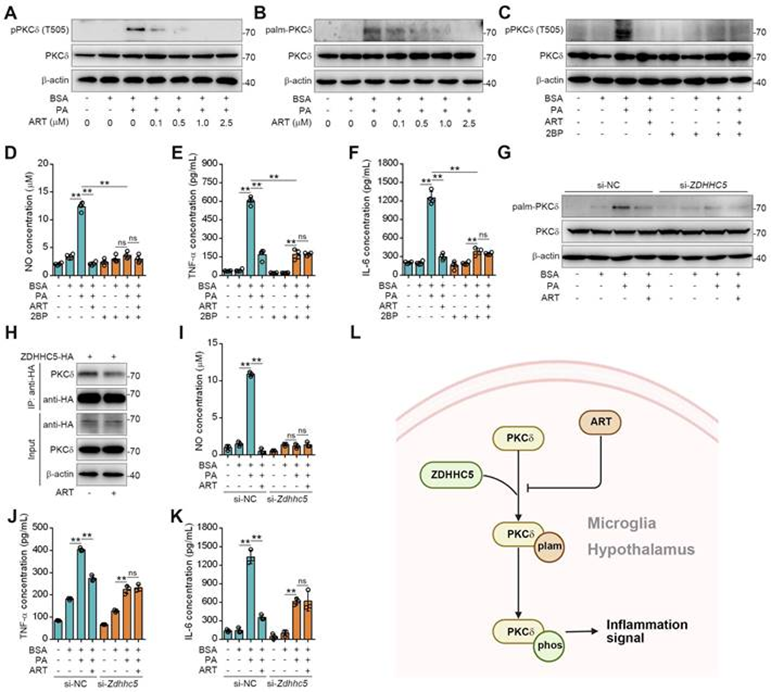
图5:ART通过阻断PKCδ棕榈酰化抑制PKCδ磷酸化以减轻神经炎症
6药理学靶向下丘脑微胶质细胞PKCδ减轻体内肝脏脂质代谢紊乱
首先,作者研究了药物靶向下丘脑PKCδ是否表现出抗神经炎症作用。通过CRISPR/Cas9建立Prkcd+/-小鼠模型。发现ART对HFD喂养的Prkcd+/+小鼠PVN中Iba1的表达产生了明显的抑制作用,这在Prkcd+/-小鼠中显著逆转。此外,ART阻断了HFD喂养的Prkcd+/+小鼠PVN中TNF-α和IL-6的释放,但在Prkcd+/-小鼠中表现出较小的作用。此外,对ART的血脑屏障(BBB)转运的药代动力学分析显示,ART可以通过血脑屏障并在下丘脑中积累(S10H)。这些数据表明,ART可能通过靶向PKCδ在下丘脑发挥抗神经炎症作用。
为进一步证实ART是否通过选择性靶向PVN小胶质细胞中的PKCδ来抑制下丘脑神经炎症,设计了一种小胶质细胞特异性腺相关病毒-5-小分子短发夹RNA-Prkcd(Ash-Prkcd),用于小鼠PVN的立体定向颅内注射(图6A-6B)。Ash-Prkcd注射液的给药有效降低了位于PVN区域小胶质细胞中PKCδ的表达。同样,作者还发现,在Ash阴性对照(Ash-NC)注射组中,ART有效降低了HFD诱导的Iba1产生,而在Ash-Prkcd注射组中ART对其没有明显影响(图6C)。此外,ART显著降低Ash NC注射组的下丘脑炎症介质,包括TNF-α和IL-6,这在Ash Prkcd注射小鼠中得到了有效逆转(图6D-6E)。总之,这些数据表明,ART在体内选择性靶向下丘脑中的小胶质细胞PKCδ,以抑制神经炎症。
然后,作者试图测试药物靶向PKCδ是否具有降脂作用。如图6F-6I所示,ART显著增加NC注射PVN中TRH神经元数量,从而促进甲状腺激素的产生。然而,在注射Ash-Prkcd的小鼠中没有观察到类似的效果。此外,在注射Ash-NC的小鼠中,ART显著改善了HFD诱导的TC、TG和非HDL-C水平,而在注射Ash-Prkcd的小鼠中ART治疗没有显示出类似的治疗效果(图6J-6L)。同时,ART改善了注射Ash-NC的HFD诱导的小鼠肝脏脂肪变性和脂质代谢相关基因的表达;然而,Ash-Prkcd注射逆转了ART依赖性治疗效果(图6M-6O)。此外,ART降低了注射Ash NC小鼠的ALT和AST水平,这在注射Ash Prkcd小鼠中也被消融(图6P-6Q)。为了排除PKCδ对肝细胞脂质代谢的直接影响,作者下调了HepG2和LO2细胞中PKCδ的表达,发现ART对脂质积累没有明显的调节作用。总之,作者的研究结果表明,下丘脑中小胶质细胞PKCδ是缓解体内肝脏脂质紊乱的关键靶点。
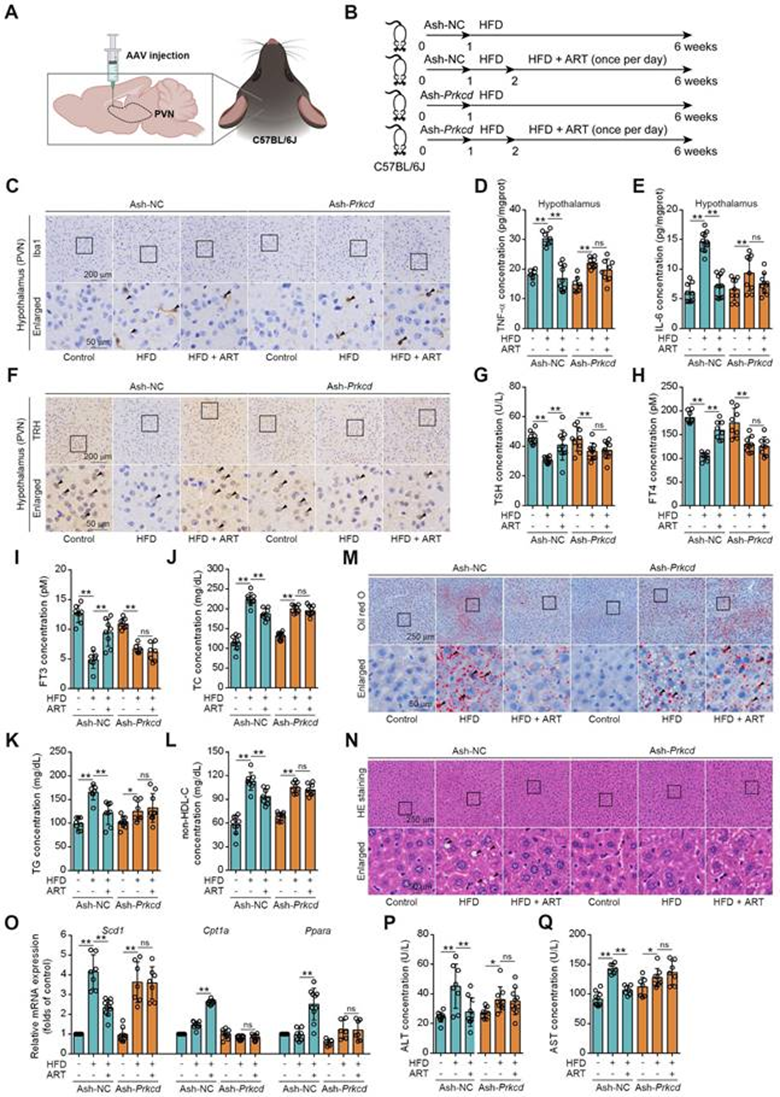
图6:Prkcd敲低PVN区逆转ART对C57BL/6J小鼠HFD喂养的肝脏脂质代谢紊乱的抑制作用
7 PKCδ与高脂血症患者脑内微胶质细胞活化有关
作者从5名对照捐赠者和5名高脂血症患者那里获得了脑组织和血清样本(图7A)。免疫组织化学和蛋白质印迹结果显示,高脂血症患者大脑中的PKCδ、pPKCδ和plam PKCδ水平均较高(图7B-7C)。此外,免疫荧光分析显示,在高脂血症的大脑中,pPKCδ与Iba1的共定位显著增加。这一发现表明PKCδ激活和小胶质细胞激活之间存在正相关(图3D)。同时,作者证实了高脂血症大脑中TRH水平的降低(图7E)。重要的是,作者还观察到一种趋势,但没有统计学意义,因为高脂血症患者的TC、TG和LDL-C水平与Iba1和plam PKCδ表达呈正相关的个体间变异性很高,而且受试者数量有限(图7F)。此外,TRH水平与高脂血症的严重程度呈负相关(图7F)。总之,这些数据表明PKCδ介导的神经炎症可能与脂质代谢紊乱有关。
接下来,作者进行了单核RNA-seq,以表征脑组织中的细胞类型。在对照组和患者之间,小胶质细胞和神经元细胞簇的UMAP图和细胞百分比发生了显著变化。这些数据显示,高脂血症脑小胶质细胞中PKCδ相关炎症信号持续增加,如Toll样受体、NF-κB、丝裂原活化激酶样蛋白(MAPK)、NOD样受体和JAK-STAT通路(图7G)。在神经元中,KEGG通路分析表明,几种常见的神经元存活通路被下调,这些通路与谷氨酸能、胆碱能、GABA能和多巴胺能突触功能高度相关。此外,一些神经元凋亡途径,如活性氧信号级联也被上调。
为进一步对TRH神经元进行详细的转录组学分析,作者在神经元群体中进行了无偏聚类。结果显示了8个神经元簇(图7H)。在这些簇中,神经元SAI高表达TRH基因,高脂血症脑中的细胞百分比显著降低(图7I-7J)。对神经元SAI的进一步KEGG分析显示,TH合成减少,TH信号通路下调,这表明PKCδ介导的小胶质细胞激活可能特别导致高脂血症脑中TRH神经元损伤(图7K)。总之,这些数据表明大脑中小胶质细胞PKCδ激活与外周脂质代谢紊乱的临床关联。
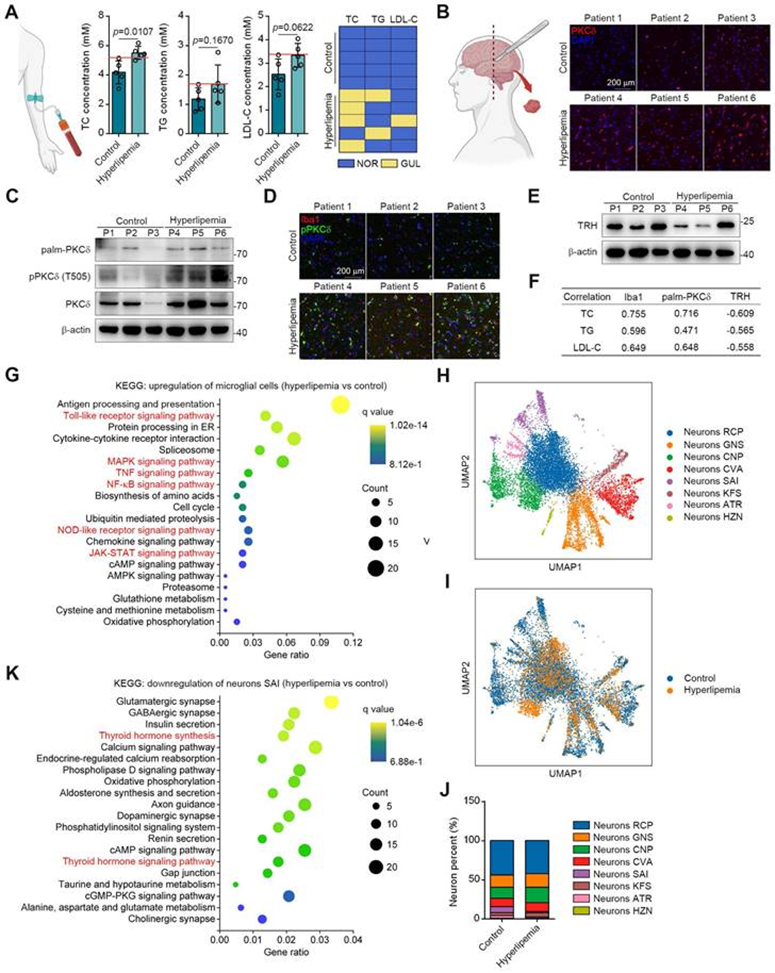
图7:PKCδ表达在脂肪脑中上调并与高脂血症进展相关
结论:
总之,作者提供了概念证据,证明下丘脑中的小胶质细胞PKCδ通过神经内分泌信号调节脂质代谢紊乱。特别是,这些发现表明,靶向小胶质细胞PKCδ可能是治疗脂肪肝的一种有前途的治疗方法,这与目前的治疗策略不同。
实验方法:
细胞培养,油红O染色,血清生化分析,免疫组化,RT-PCR,尼罗红染色,免疫荧光,细胞活力分析,热蛋白质组分析(TPP),单细胞测序,Pull-down,细胞热位移测定(CETSA),Co-IP,siRNA或质粒转染,WB,UPLC-MS/MS
参考文献:
Wang YH, Chen X, Bai YZ, Gao P, Yang Z, Guo Q, Lu YY, Zheng J, Liu D, Yang J, Tu PF, Zeng KW. Palmitoylation of PKCδ by ZDHHC5 in hypothalamic microglia presents as a therapeutic target for fatty liver disease. Theranostics 2024; 14(3):988-1009. doi:10.7150/thno.89602. https://www.thno.org/v14p0988.htm






