蛋白激酶C δ调节单核吞噬细胞并阻碍对癌症免疫治疗的反应
单核吞噬细胞(MPs)在维持组织稳态中起着至关重要的作用,然而MPs也促进肿瘤进展和抵抗免疫检查点阻断(ICB)。靶向MPs可能是提高ICB疗效的有效策略。作者报道了蛋白激酶Cδ (PKCδ),一种丝氨酸/苏氨酸激酶,在人类和小鼠肿瘤的MPs中大量表达。与野生型小鼠相比,PKCδ−/−小鼠的肿瘤进展减少,对抗PD -1的应答增加。来自PKCδ−/−小鼠的肿瘤表现出TH1倾斜的免疫反应,包括抗原呈递和T细胞活化增加。体内去除MPs改变了对照组的肿瘤生长,但对PKCδ - / -小鼠无影响。与PKCδ+/+对照相比,在野生型小鼠中同时注射PKCδ−/− M2样巨噬细胞和癌细胞显著延迟肿瘤生长,并显著增加瘤内T细胞活化。PKCδ缺陷通过激活I型和II型干扰素信号重编程MPs。因此,PKCδ可能靶向重编程MPs以增强ICB的功效。文章于2023年12月发表于《Science advances》,IF:13.6;Q1。
技术路线:
主要实验结果:
1、PKCδ促进小鼠肿瘤生长和免疫抑制
为了探讨蛋白激酶C δ在肿瘤发生中的作用,作者将乳腺癌(E0771),肺癌(LLC)和黑色素瘤(B16F10)同系小鼠癌细胞系移植到Prkcd+/+和Prkcd−/−小鼠中。与Prkcd+/+小鼠相比,Prkcd−/−小鼠在E0771和LLC模型中表现出肿瘤生长的显著延迟(图1A和B),但这一效应在B16F10模型中不显著(图1C)。当作者使用流式细胞术分析这些肿瘤的瘤内免疫细胞含量时,作者发现在C57BL/6J小鼠中,E0771和LLC肿瘤大量被MPs浸润(分别占所有存活细胞的27.85%和35.79%),但B16F10肿瘤没有(1.59%)(图1D),这与之前发表的研究结果一致。在含有较少MPs的B16F10模型中,这种效应的降低表明,PKCδ可能主要调节肿瘤中的MPs。
接下来,作者通过大量RNA-seq和差异表达基因(DEGs)分析,研究了PKCδ缺乏对E0771肿瘤基因调控的影响。GO分析Prkcd−/−中上调的基因揭示了增强的免疫刺激反应(如T细胞活化、IFN-γ信号传导和抗原呈递)(图1E)。此外,与Prkcd+/+肿瘤相比,参与抗原呈递、固有免疫和T细胞活化的基因在Prkcd - / -肿瘤中升高(图1F)。
流式细胞术分析显示,与Prkcd+/+ E0771荷瘤小鼠相比,在Prkcd - / -肿瘤(图1,G和H)和脾脏(图1,G和I)的巨噬细胞和单核细胞/iMCs (Ly6Chi细胞)中,MHCII类主要组织相容性复合体(MHCII)的表达增强,这提示这些细胞的成熟和抗原提呈能力增强。作者还观察到,与Prkcd+/+肿瘤相比,E0771 Prkcd - / -肿瘤中T细胞含量(总CD3+ T细胞以及CD4+和CD8+ T细胞)的绝对数量和频率显著增加(图1,J和K)。在E0771 Prkcd−/−肿瘤中,CD8+ T细胞活化(IFN-γ+ TNFα+)显著增加(图1L)。在Prkcd−/−LLC肿瘤中,与Prkcd+/+肿瘤相比,CD8+ T细胞含量(图1M)和PD-1+ CD8+ T细胞(图1N)显著升高。综上所述,这些结果表明,PKCδ缺陷限制了MPs高度浸润的肿瘤的生长,这表明这种抑制可能与浸润MPs改变有关,而浸润MPs可能影响T细胞反应。
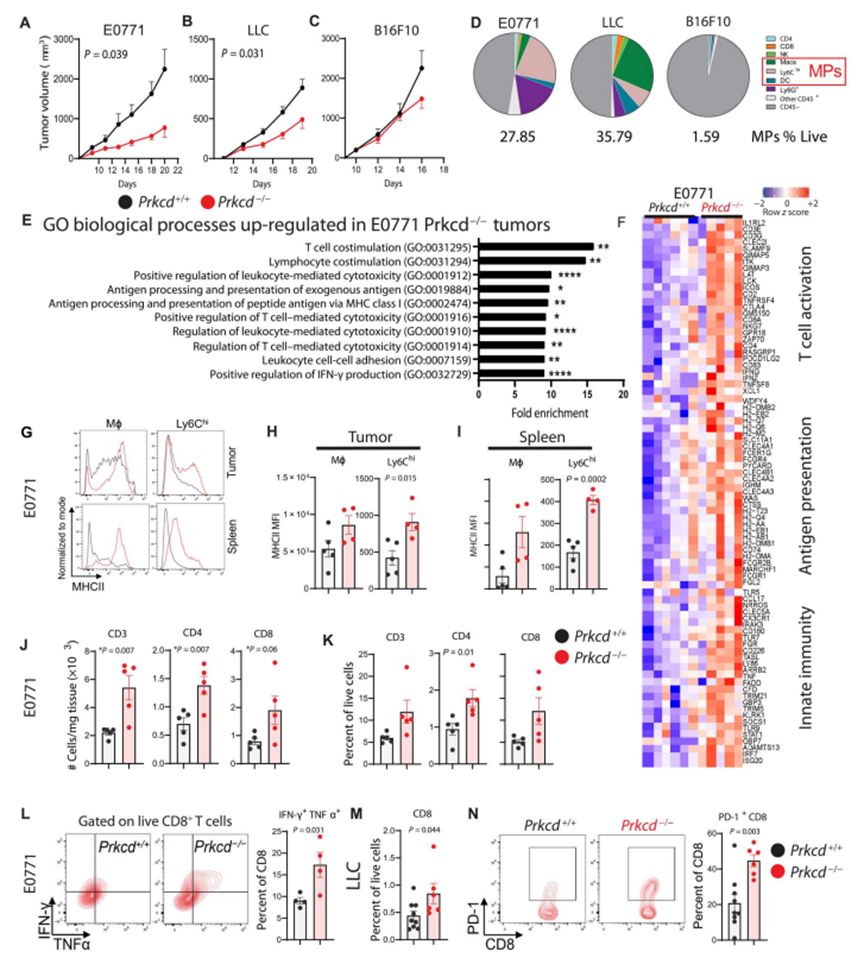
图1 PKCδ促进肿瘤生长和免疫抑制
2、PKCδ在MPs中大量表达
因为在Prkcd - / -小鼠中,肿瘤消退需要免疫应答,因此作者询问哪些细胞不仅在肿瘤中,而且在稳定状态下在器官中表达高水平的PKCδ。首先,作者利用公开数据集的scRNA-seq分析研究了几种人类肿瘤细胞水平上PKCδ的表达。作者发现,在人三阴性乳腺癌(TNBC)(图2, A和B)和黑色素瘤(图2, C和D)中,相对于其他免疫浸润细胞,大量MPs大量表达PRKCD (PKCδ基因)。
接下来,作者使用流式细胞术检测了PKCδ蛋白在E0771荷瘤小鼠脾脏和肿瘤细胞群中的表达。作者发现PKCδ在E0771肿瘤(图2E)中主要由MPs表达。此外,与脾脏相比,来自E0771荷瘤小鼠的MPs在肿瘤中具有显著更高的PKCδ表达(图2F、G)。值得注意的是,来自肿瘤的骨髓细胞比来自脾脏的骨髓细胞更具有免疫抑制作用。PKCδ在T细胞和NK细胞中也中度上调,但在Ly6G+细胞中没有上调(图2G)。因此,PKCδ表达与更多的免疫抑制MPs相关,这暗示了在MPs中促进免疫抑制的潜在作用。接下来,作者检查了PKCδ在M2样(可选激活)极化骨髓源性巨噬细胞(BMDMs)中的表达,已知其具有免疫抑制和肿瘤促进作用。正如预期的那样,M2样BMDMs表达较低水平的M1标记CD86和较高水平的M2标记CD206。作者还发现,与非极化BMDMs相比,PKCδ在M2样BMDMs中的表达明显更高(图2,H和I)。总之,这些发现表明PKCδ可能是MP调节或免疫抑制状态的关键控制器。
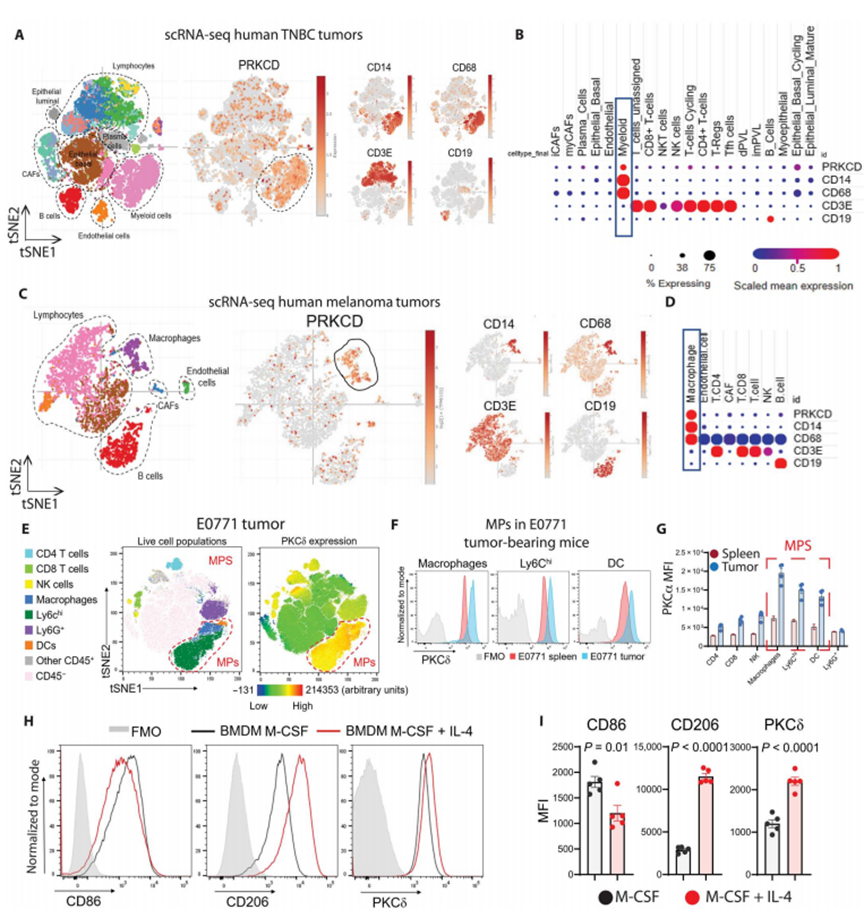
图2 PKCδ在癌症中由MPs大量表达
3、PKCδ缺乏通过MPs损害肿瘤生长和免疫抑制
为了研究肿瘤抑制和T细胞活化是否需要MPs中的PKCδ缺乏,作者首先使用抗ly6c单克隆抗体和氯膦酸脂质体联合去除Prkcd+/+和Prkcd - / - E0771荷瘤小鼠中的MPs(图3A)。根据之前的报道,作者观察到MP消耗显著延迟了野生型小鼠(Prkcd+/+)的肿瘤生长(图3B和D)。相比之下,在Prkcd−/−小鼠中,MP的消耗并没有延迟肿瘤的生长,而是促进了肿瘤的生长,其程度与Prkcd+/+小鼠相当(图3C和D)。这些结果表明,PKCδ缺陷可能将MPs从原肿瘤表型重编程为抗肿瘤表型。
接下来,作者研究了M2样BMDMs中的PKCδ缺乏是否会降低其促进肿瘤和T细胞抑制活性(图3E)。与共注射Prkcd+/+ M2样BMDMs的癌细胞(LLC)相比,共注射Prkcd−/−M2样BMDMs的癌细胞(LLC)的肿瘤生长显著延迟(图3F)。作者观察到,与Prkcd+/+ M2样BMDMs + LLC肿瘤相比,Prkcd - / - M2样BMDMs + LLC肿瘤中CD8+(图3G和H)和CD4+(图3G至I) T细胞的活化(IFN-γ+ TNFα+)显著增加。Prkcd−/−M2样BMDMs与LLC细胞共注射导致了肿瘤生长的延长延迟,这可能归因于BMDMs与TME中其他细胞之间关键的早期相互作用。过继转移的BMDMs可能随着时间的推移被宿主肿瘤相关巨噬细胞(TAMs)稀释,这可能导致肿瘤浸润免疫细胞表型的早期转变,从而导致肿瘤进展延迟但不能完全控制。总之,作者的研究结果表明PKCδ在控制MP诱导的效应T细胞抑制和随后的肿瘤促进中起关键作用。
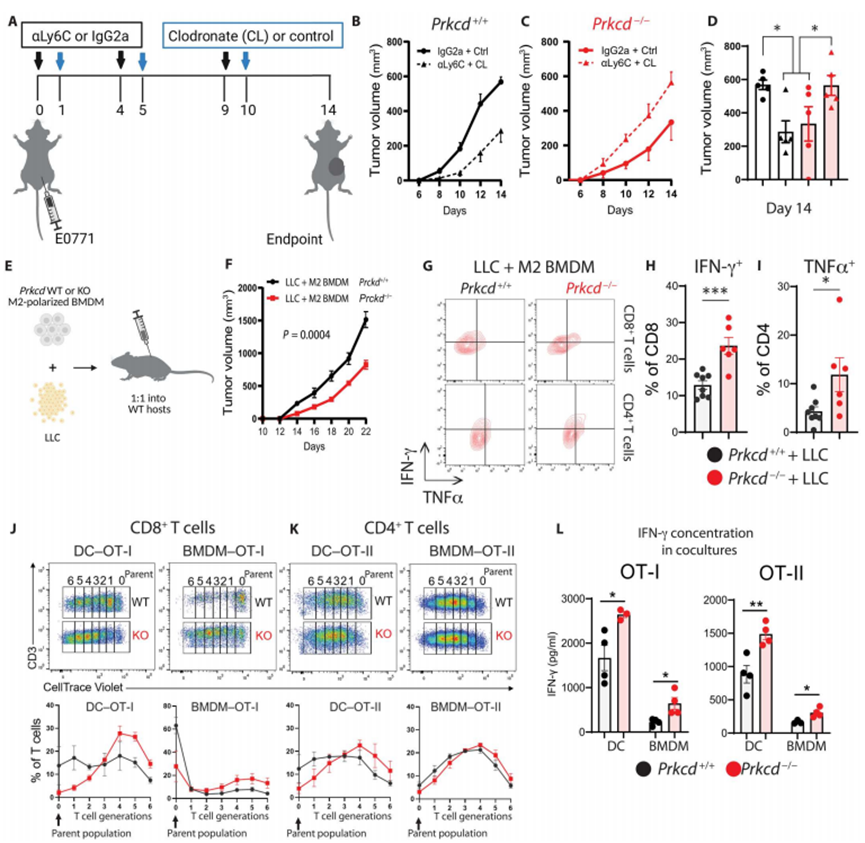
图3 PKCδ的缺失通过MPs损害肿瘤生长和免疫抑制
4、PKCδ缺乏增强MPs的抗原呈递和交叉呈递能力
抗原呈递到CD4+ T细胞和抗原交叉呈递到CD8+ T细胞是抗原呈递细胞(APCs)发起有效抗肿瘤免疫应答的标志性特性。作者用OVA对分离自Prkcd+/+和Prkcd−/−小鼠的BMDMs和DCs进行脉冲处理,然后与H-2Kb-OVA肽特异性T细胞受体(TCR)转基因OT-I CD8+ T细胞或OT-II CD4+ T细胞孵育,并通过分析细胞微量紫(CTV)增殖染料的稀释度来测定T细胞增殖。作者发现,与Prkcd+/+ BMDMs和DCs相比,Prkcd−/−BMDMs和DCs在诱导OT-I CD8+(图3J)和OT-II CD4+(图3K) T细胞增殖方面更优越。此外,通过酶联免疫吸附试验(ELISA)评估,BMDMs和DCs的PKCδ缺乏显著增加OT-I和OT-II共培养上清中IFN-γ的产生(图3L)。研究结果表明,PKCδ在调节MP介导的T细胞活化中至关重要。
5、PKCδ的内在缺失触发MPs中I型和II型IFN信号
为了了解PKCδ如何调节MPs,作者使用来自Prkcd−/−和Prkcd+/+ M1样BMDMs,刺激DC (DCstim), iMCs和整个E0771肿瘤的RNA-seq数据进行转录组分析。作者在Prkcd−/−M1 bmdm、DCstim和iMCs中分别鉴定出552、754和219个基因上调,而在这些细胞中分别鉴定出391、905和186个基因下调(图4A、E和I)。GSEA显示,对IFN-α/γ标志通路的反应在Prkcd−/−M1 bmdm(图4,B至D)、DCstim(图4,F至H)、iMCs(图4,J至L)和E0771肿瘤(图4,M至O)中持续高度富集,这表明在pkc δ缺陷的MPs中触发了I型和II型IFN信号通路。
I型和II型IFNs诱导的基因组有很大的重叠,两者都是诱导T细胞活化和保护性免疫所必需的。因此,作者从对IFN-α(18个基因)的反应(图4P)和对IFN-γ(26个基因)的反应(图4Q)两种标志基因集研究了Prkcd−/−M1 BMDM、DCstim、iMCs和E0771肿瘤之间共同富集的基因。作者在两个IFN基因集之间发现了11个重叠基因(图4R),这些基因可能代表了PKCδ缺陷型MPs中最常见的上调IFN应答基因。总之,作者的研究结果揭示了PKCδ在MPs中促进肿瘤和抗炎途径,同时抑制I型和II型IFN途径的潜在作用。
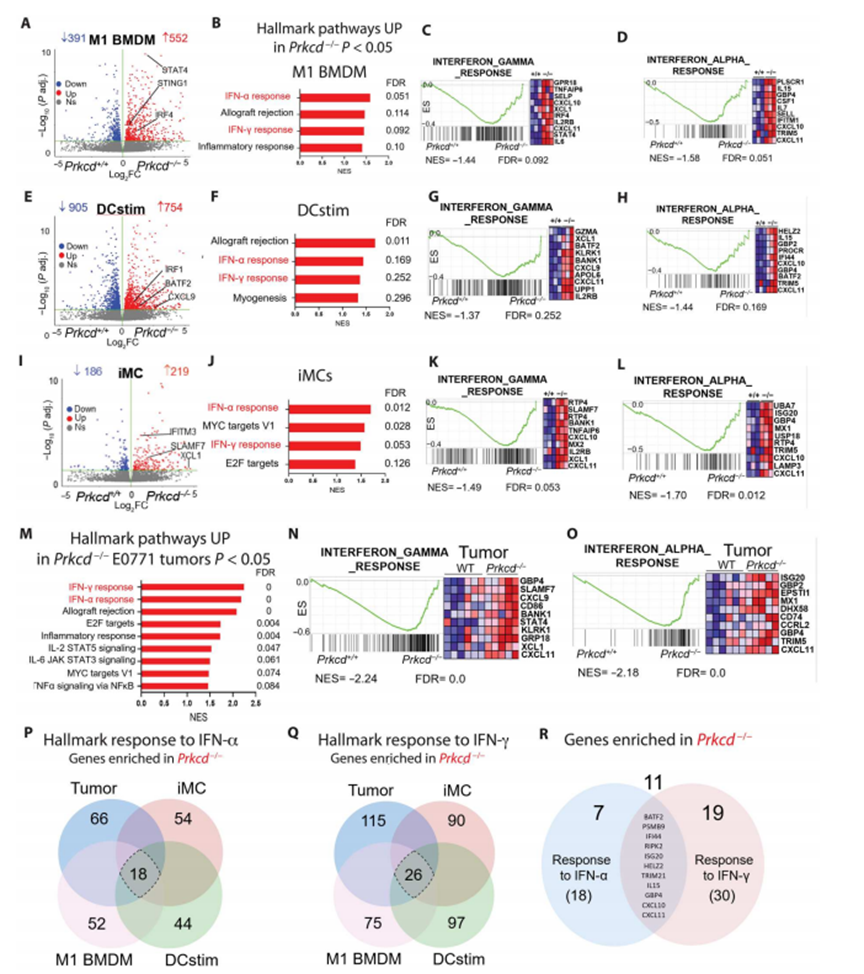
图4 PKCδ的内在缺失触发MPs中I型和II型IFN信号
6、PKCδ缺乏增强抗PD -1治疗
在Prkcd−/−小鼠中观察到的抗肿瘤效应促使作者确定是否PKCδ缺乏可以提高对ICB的反应性。作者选择了先前报道的对ICB相对耐药的LLC肿瘤模型。如图5A所示,作者使用抗PD-1或免疫球蛋白G2a (IgG2a)对照治疗了携带LLC肿瘤的Prkcd+/+和Prkcd−/−小鼠。虽然作者观察到与IgG2a治疗的Prkcd+/+小鼠相比,抗PD-1治疗的Prkcd+/+小鼠的肿瘤生长有中度但显著的减少,但PKCδ缺陷和抗PD-1的联合治疗可协同延缓肿瘤生长(图5B和C)。值得注意的是,与其他组相比,接受抗PD -1治疗的Prkcd - / -小鼠的总生存期显著延长(图5D)。总之,作者的研究结果表明PKCδ可能是改善对ICB反应性的一个有希望的靶标。
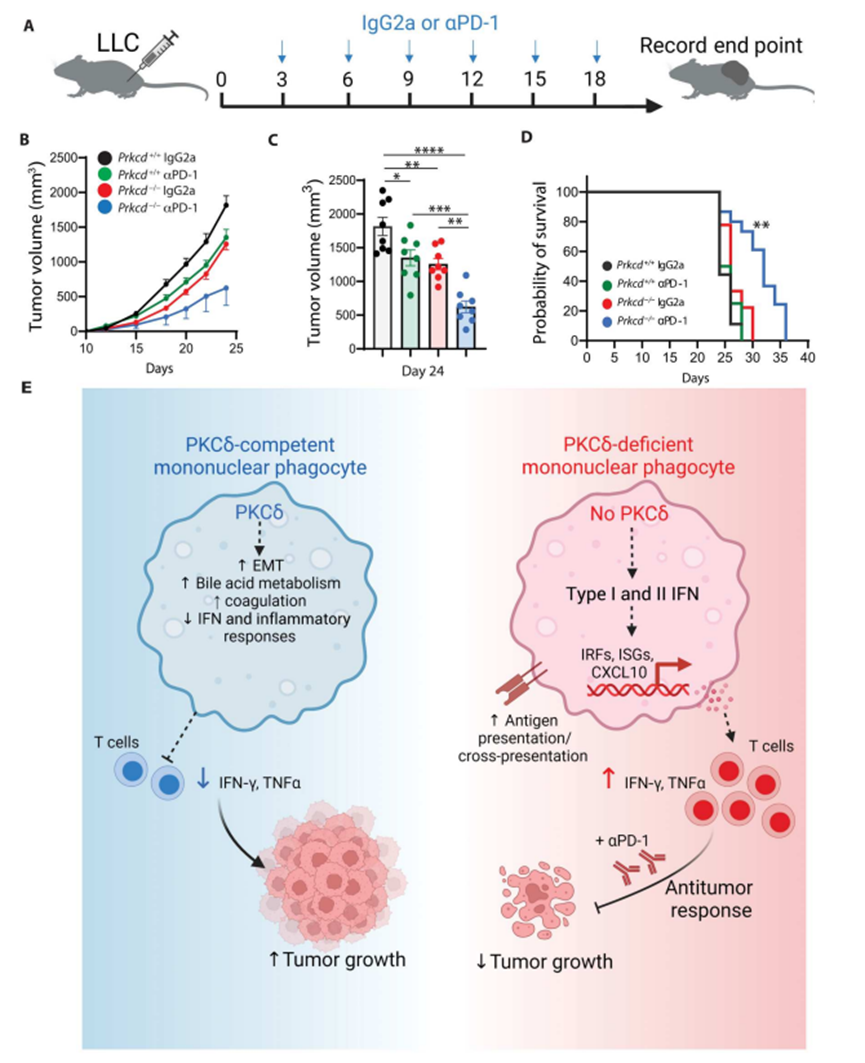
图5 PKCδ缺失可改善对抗PD-1治疗的应答
结论:
这项研究发现了一种免疫逃避机制,MPs通过PKCδ信号抑制抗肿瘤免疫反应。在这种情况下,PKCδ作为先天免疫检查点。研究结果突出了两个关键点:(i) MPs在控制抗肿瘤免疫中的重要性;(ii) PKCδ是TME中MPs表型的关键驱动因素,也是癌症免疫治疗的潜在靶点。数据还表明,T细胞PKCδ可能不是TME的关键,而PKCδ在抗肿瘤免疫的背景下在调节髓细胞活化中发挥更大的作用,PKCδ表达与免疫抑制性TME相关。PKCδ抑制IFN信号的确切分子相互作用将是未来研究的主题。综上所述,这项研究表明PKCδ是TME中MP肿瘤表型的关键驱动因素,揭示了肿瘤免疫治疗的关键靶点。
实验方法:
肿瘤小鼠模型及OT-I T细胞转导;抗PD-1肿瘤研究;体内MP消耗研究;体内巨噬细胞共注射研究;小鼠肿瘤单细胞的分离;流式细胞仪分析;BMDMs、DCs和iMCs的分离和刺激;抗原呈递和交叉呈递实验和ELISA;RNA测序;RNA-seq分析;基因集富集分析;scRNA-seq分析。
参考文献:
Chaib M, Holt JR, Fisher EL, Sipe LM, Bohm MS, Joseph SC, Simmons BW, Eugin Simon S, Yarbro JR, Tanveer U, Halle JL, Carson JA, Hollingsworth TJ, Wei Q, Rathmell JC, Thomas PG, Hayes DN, Makowski L. Protein kinase C delta regulates mononuclear phagocytes and hinders response to immunotherapy in cancer. Sci Adv. 2023 Dec 22;9(51):eadd3231. doi: 10.1126/sciadv.add3231. Epub 2023 Dec 22. PMID: 38134280; PMCID: PMC10745701.






