早期人肺免疫细胞的发育及其在上皮细胞命运中的作用
对人类肺部发育的研究主要集中在上皮细胞和间质细胞的类型和功能上,但对发育中的肺部免疫细胞知之甚少,尽管气道是出生后粘膜免疫的主要部位。一个悬而未决的问题是,组织驻留免疫细胞是否在组织在子宫内发育过程中,在塑造组织方面发挥着重要作用。在这里,我们使用 scRNA-seq、smFISH 和免疫组织化学对人类胚胎和胎儿肺中免疫细胞进行了分析。在胚胎阶段,我们观察到了早期的先天免疫细胞波动,包括先天淋巴细胞、自然杀伤细胞、髓系细胞和谱系祖细胞。在管状阶段,我们检测到表达高水平细胞毒性基因的初始 T 淋巴细胞和成熟 B 淋巴细胞(包括 B-1 细胞)的存在。我们的分析表明,胎儿肺提供了B细胞完全成熟的环境。鉴于发育过程中免疫细胞的存在和多样性,我们还研究了它们对上皮成熟的可能影响。我们发现IL-1β在体外驱动上皮祖细胞自我更新并分化为基底细胞。在体内,在整个肺和上皮尖端附近发现了产生 IL-1β 的髓系细胞,这表明免疫细胞可能指导人肺上皮的发育。
该研究于2023年12月发表在《Science immunology》,IF:24.8。
技术路线:
结果:
1、人类胎儿肺部的免疫细胞随着发育时间变化
在这项研究中,我们检查了正在发育的胎儿期的人类肺部,在细胞和分子水平上分析免疫细胞,并研究免疫细胞信号对上皮分化的影响(图 1A)。我们的单细胞测序数据最初被描述为广泛定义的免疫细胞类型(图 1B)。先天细胞和祖细胞类型在发育早期更为普遍,包括先天淋巴细胞 (ILC)、自然杀伤细胞 (NK) 和髓系细胞。随着发育时间的推移,B和T淋巴细胞的比例逐渐增加。 IHC 显示,CD45+ 免疫细胞在整个早期发育过程中都存在于人胎儿肺部中(图 1C),并且位于所有肺部区域,包括内皮、上皮和间质。全肺组织切片的定量(图 1,C 至 E)显示,免疫细胞比例在 8 pcw 时最高,随后下降,然后在 20 pcw 时上升至小管阶段的 9% 左右。我们得出的结论是,胎儿肺中存在一个复杂且动态变化的免疫区室。
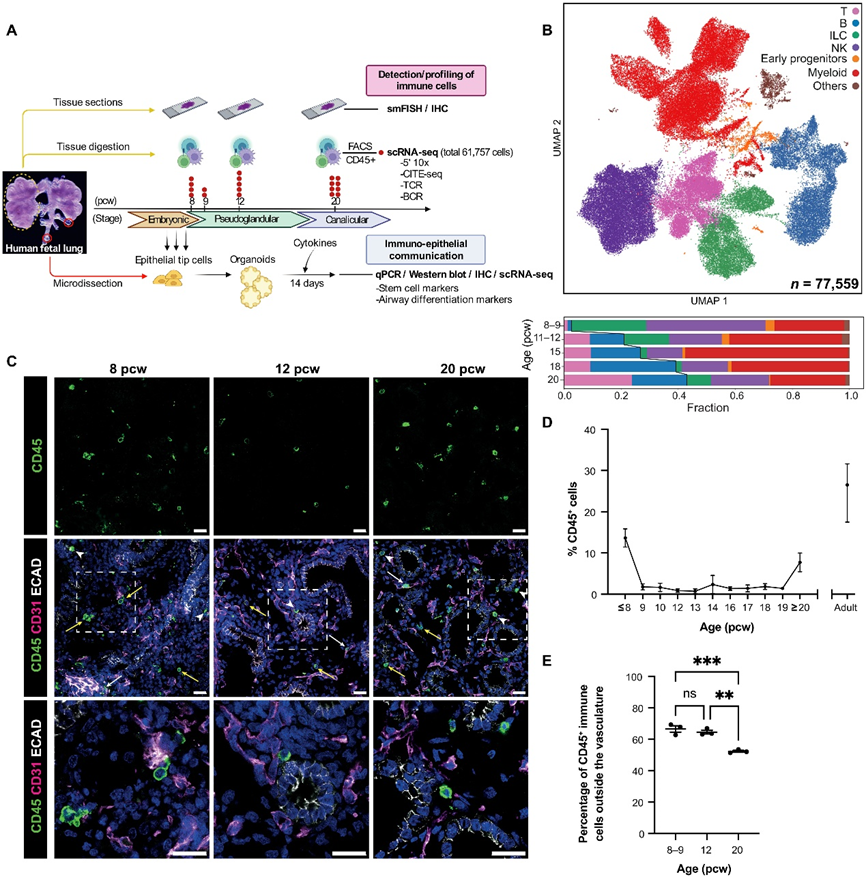
2、使用 scRNA-seq 对免疫细胞进行分子表征
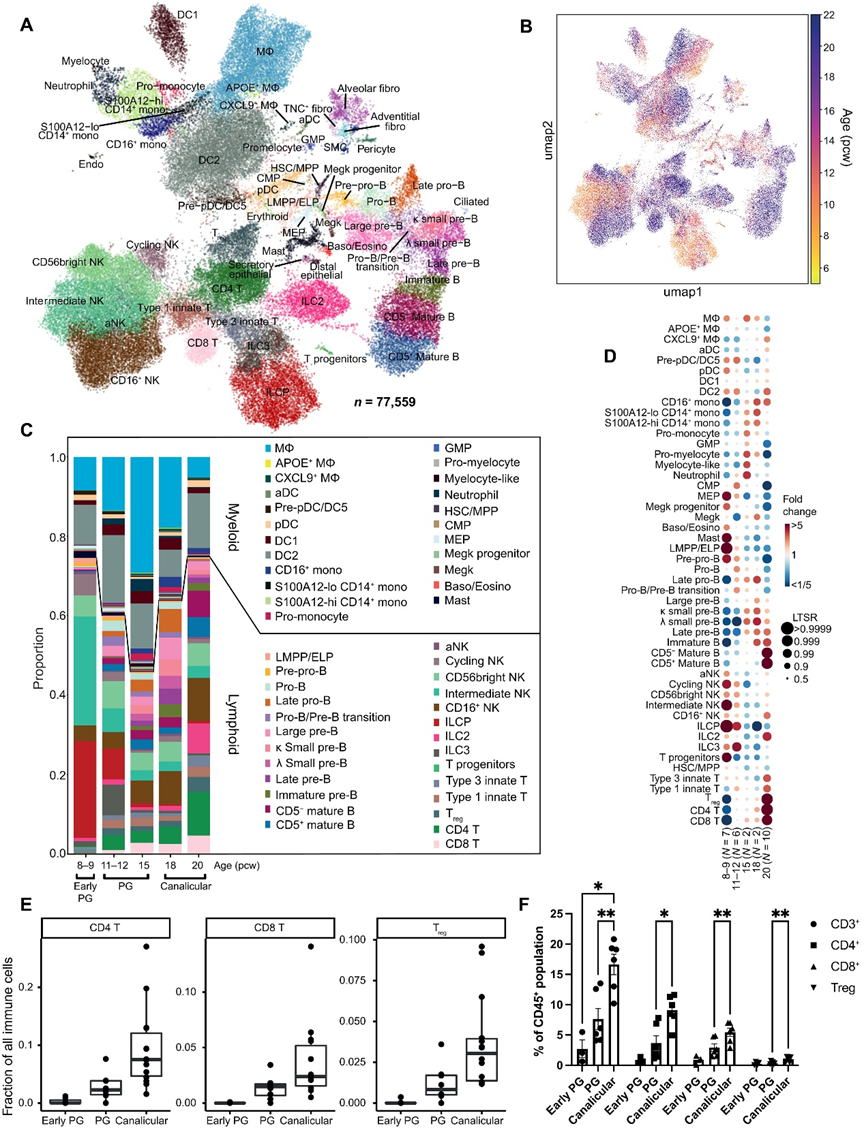
为了全面表征胎儿肺免疫细胞的亚群,我们提取了妊娠8、9、12和20周的整个胎儿肺(n = 19),并在进行单细胞RNA测序(scRNA-seq)之前通过荧光激活细胞分选(FACS)富集CD45+免疫细胞(图1A)。使用10X Chromium 5′ scRNA-seq对胎儿肺免疫细胞进行了分析,其中一部分样本还用于进行CITE-seq蛋白质测量,其质量控制度量见图S2(A和B)。我们对所有样本进行了α/β TCR-seq,并对一部分样本进行了γ/δ TCR和BCR测序。为了最大程度地发现细胞类型和状态,我们将这些数据与我们先前的整个胎儿肺scRNA-seq数据的免疫组分结合起来。经过质量控制和整理,我们获得了总计77,559个高质量的转录组文件,涵盖了所有已知的白细胞系谱,包括B和T淋巴细胞、ILC、NK细胞、髓样细胞以及上述系谱的早期祖细胞(图2A)。还鉴定了非免疫细胞,如上皮细胞、红细胞和基质细胞,这些细胞可能是CD45抗体非特异性结合的细胞,我们将其包含在我们的数据对象中。
我们对所有阶段的单细胞转录组学数据进行了注释和整理,根据标记基因表达(图2A)注释了59个细胞类型/状态的簇。早期祖细胞,包括前前体B细胞、淋巴-多能祖细胞(LMPPs)、ILC祖细胞(ILCPs)、巨核红细胞祖细胞(MEPs)、共同髓系祖细胞(CMPs)、巨核细胞祖细胞和T细胞祖细胞主要存在于较早的阶段(图2,B到D)。
我们的单细胞RNA测序结果以及后续的流式细胞术验证显示,随着发育的进行,总T细胞(CD3+)、CD4+、CD8+和调节性T细胞的丰度显著增加(图2,E和F)。我们还通过IHC在12和20周胚胎时在组织切片中验证了T、NK和B细胞类型的存在。
总体而言,免疫细胞的比例呈双相模式,8周胚胎时较高,20周胚胎时再次升高(图1D)。第二个峰值可能部分归因于血管成熟。因此,我们使用PECAM1作为评估发育中肺血管比例的替代读数。定量PCR(qPCR)显示PECAM1表达在胚胎期、假腺期和管状期都有显著增加。考虑到从12周胚胎后其相对恒定的每细胞表达,该分析表明在管状期,血管细胞的比例确实增加。因此,免疫细胞数量的动态增加与血管组织的增加相一致。
这促使我们检查了来自肺血管与组织驻留的免疫细胞比例。我们使用了整个样本染色和定量免疫组化以及10X Visium数据的组合,以确定血管内与组织驻留免疫细胞的比例(图1E)。我们发现在研究的所有阶段,大多数免疫细胞都是组织驻留的。
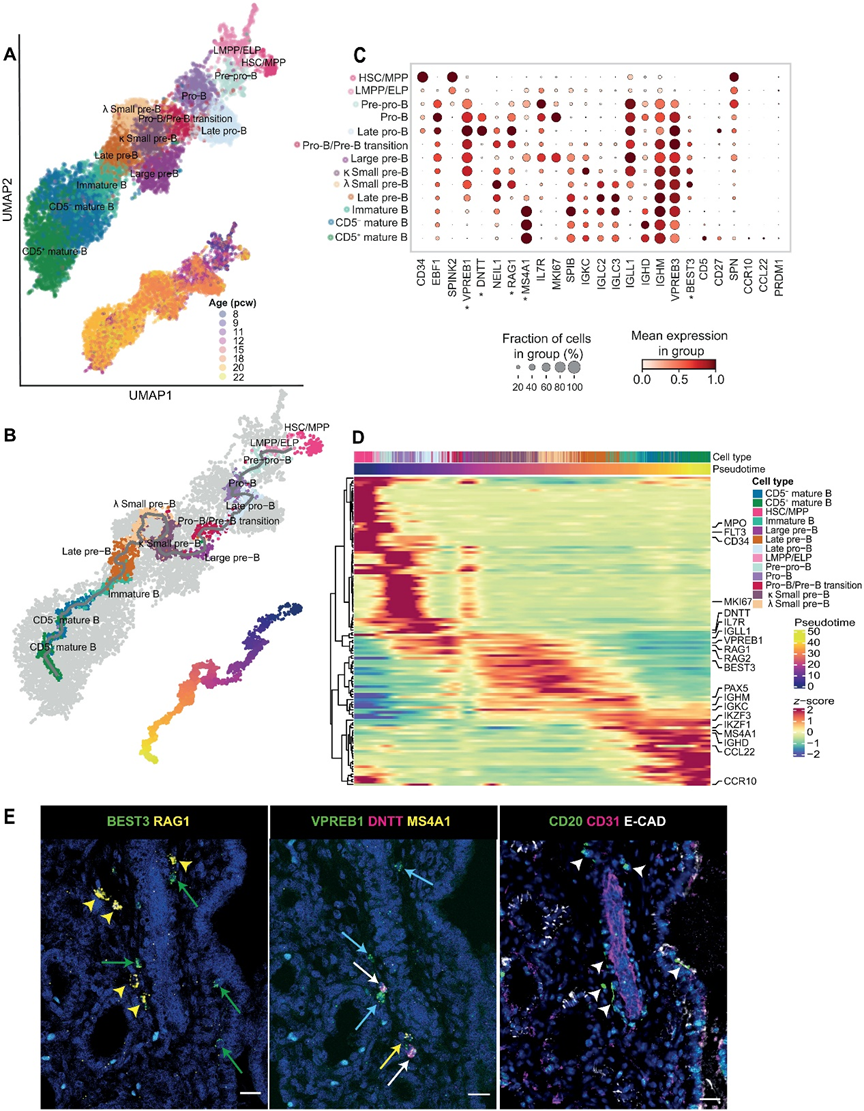
3、人类胎儿肺中的B细胞发育环境
在研究B细胞组分时,我们能够检测到胎儿肺中B细胞的所有发育阶段,包括LMPP/ELP(CD34+EBF1−),前前B细胞(EBF1+SPINK2+VPREB1+),原始B细胞(DNTT+),大前B细胞(IL7R+MS4A1+MKI67+),小前B细胞(IL7R+SPIB+MKI67−),未成熟B细胞(MS4A1+IGHDloIGHMhiVPREB3hi)和成熟B细胞(MS4A1+IGHDhiIGHMhiVPREB3lo)(图3,A到C)。我们根据簇特异性基因定义了更精确的细胞亚型:NEIL1+MKI67−晚期原始B细胞;RAG1+MS4A1+ 原始B细胞/前B细胞转化细胞;表达免疫球蛋白κ(IGKC+)或λ(IGLC2+IGLC3+)轻链基因的小前B细胞簇;表达代用轻链标记IGLL1的MS4A1+晚期前B细胞,IGLL1是前BCR的组成部分;以及CD5−与CD5+成熟B细胞。轨迹分析(图3B)显示了与已知B细胞成熟生物学一致的线性趋势,从前前B细胞到原始B细胞,前B细胞,未成熟B细胞和成熟B细胞阶段的发展(图3C中的细胞标记),关键基因动态变化(图3D)。正如预期的那样,B细胞成熟的后期与MS4A1(CD20)和IgD的出现相一致(图3,C和D)。
最初认为B细胞的成熟主要发生在胎儿骨髓,但最近的研究表明B细胞中间体也可在胎儿皮肤、肾脏和肠道中检测到。在这里,我们展示了代表B细胞发育轨迹的所有群体也可以在胎儿肺中找到。为了了解它们是来自循环系统,可能是从骨髓“渗漏”出来的,还是在现场发育的,我们进行了smFISH和IHC,并观察到不同阶段的发育中的B细胞聚集在一起(图3E)。RNAscope显示VPREB1+DNTT+细胞代表pro-B细胞阶段,RAG1+BEST3+小前B细胞以及MS4A1+成熟B细胞,而CD31、EpCAM和CD20在连续的组织切片上的染色表明这些B细胞系列细胞映射到血管外的空间。综合起来,我们的研究结果强烈证明B细胞在胎儿肺中局部发育,支持最近的观点,即B淋巴细胞的发育可以发生在外周,而不仅限于胎儿骨髓等主要造血器官。
为了进一步表征胎儿肺中的成熟B细胞群体,我们检查了Ig同种型的表达和克隆扩张。PRDM1的转录因子的表达缺失(图3C)证实我们的数据集不包含任何浆细胞,表明在人类胎儿肺中不发生T细胞依赖的B细胞激活和分化。成熟的CD5+细胞的最终阶段以CD5、CD27、SPN(CD43)、CCR10和CCL22标记(图3C)。
4、胎儿肺部的 T、NK 和 ILC 细胞
在进一步研究淋巴细胞系谱的过程中,我们确定了传统和非传统T细胞、ILCs和NK细胞(图4A)。CD4、CD8和调节性T(Treg)细胞表达了既有天然T细胞又有记忆T细胞的特征(图4B)。我们确定了胎儿的“天然”T细胞,它们与成年人中相应的天然T细胞存在差异。胎儿特异的天然T细胞基因一直表达到新生儿结束的时候,表明即使在出生后,天然T细胞仍在不断成熟。
通过表达标记基因(HPN和SCN1B)确定了ILCPs的聚类。一个重要的问题是这些ILCPs是否代表了所有ILC亚型或特定亚型的局部前体。通过主成分分析(PCA)将样本进行了分组(图4C)。在PC1与PC2的图中,ILCPs与ILC3s共定位,而ILC2s主要与NK亚型共定位;没有识别到ILC1群。这表明,在肺部,ILCPs可能只能产生ILC3s而不能产生ILC2s。
为了进一步探索我们的数据,我们将我们的胎儿肺免疫群体与其他发育器官的免疫细胞整合在一起(图4D),从而使我们能够搜索在发育肺中富集的细胞邻域(图4E)。与其他相似发育阶段的胎儿组织相比,ILCs和NK细胞在胎儿肺中显著富集。与其他胎儿器官相比,肺ILCPs和中间NK细胞差异表达与细胞周期正调控相关的基因(图4F),表明这些前体/分化中间体处于增殖状态,并且胎儿肺可能为扩展这些细胞系提供了一个生长环境,与近期在小鼠发育中的发现一致。
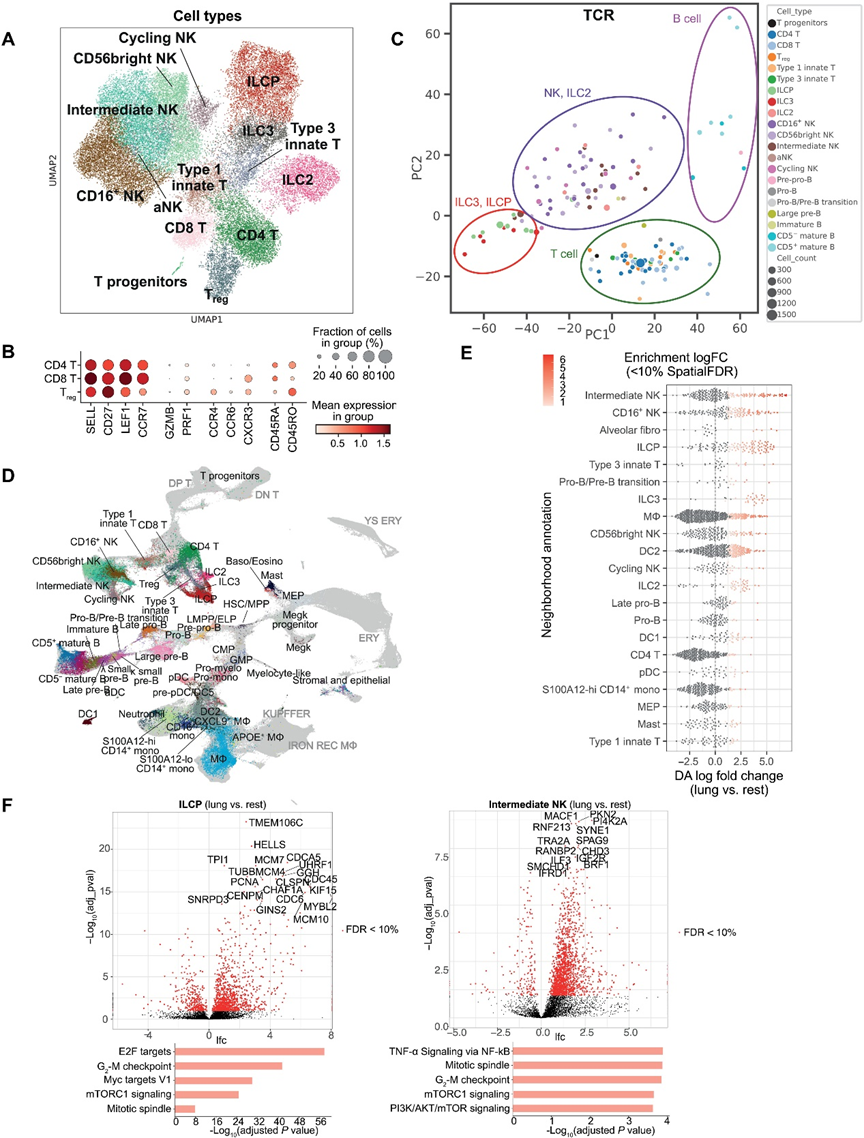
5、胎儿肺部髓系部分的发育
在我们的数据集中,我们分别检查了巨噬细胞(图5,A和B)和树突状细胞发育的轨迹。所有胎龄的细胞都存在于所示的所有粒细胞种群中,反映了持续的粒细胞成熟。基于分区图的图形抽象(PAGA)和RNA速度分析表明,从HSC/MPP到CMPs的分化逐渐进行,经过前单核细胞和单核细胞种群(S100A12hi CD14+、S100A12lo CD14+和CD16+),然后是不断成熟的巨噬细胞(MΦ)细胞类型(CXCL2+巨噬细胞、APOE+巨噬细胞和巨噬细胞)(图5,C和D)。沿发育轨迹的前100个差异表达基因的综合分析揭示了造血和/或分化过程中调节的关键调控基因和标记基因的时间表达模式(图5F)。
在我们的数据集中,我们检测到许多我们使用RNAscope在空间上验证的早期前体细胞。这包括罕见的SMIM24+SPINK2+细胞,可能是HSCs,以及基于它们的典型标记基因表达确定的GMPs、CMPs、前单核细胞、髓细胞、MEPs、巨核细胞前体和巨核细胞等髓系前体细胞(图5,G和H)。根据对IHC图像的手动定量,大多数髓细胞,由其CD68的表达定义,是组织驻留的(图5,I和J)。综合的轨迹分析和成像数据表明,随着发育的推移,髓系细胞继续进入胎儿肺,在那里进一步分化。特别是巨噬细胞相比其他胎儿器官表达更高水平的与细胞周期相关的基因,这表明胎儿肺可能提供了一个增殖的生长环境(图5K)。
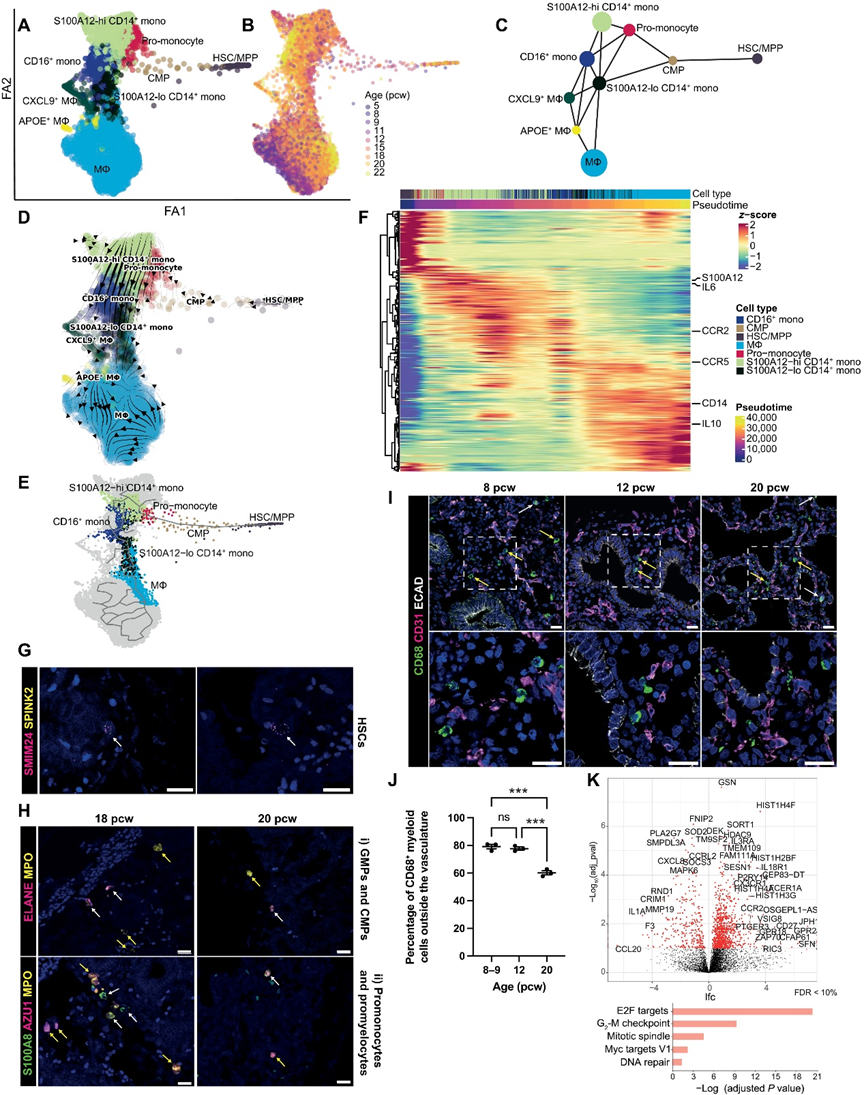
6、IL-1β导致尖端干细胞退出自我更新状态并分化为胎儿肺类器官中的基底细胞
在人类发育中的肺中,远离的上皮尖端由SOX9+的前体细胞组成,它们产生所有肺泡和气道系列细胞。在确定了免疫细胞存在于发育中的整个肺部后,我们探究了哪些免疫细胞位于上皮尖端周围,以及它们可能对上皮成熟,特别是对尖端前体的影响。免疫组织化学(IHC)显示CD45+免疫细胞分布在整个胎儿肺和SOX9+上皮尖端附近(图6A),在8-9和20周孕时,与12周孕时相比,更多的免疫细胞聚集在尖端周围(图6B),这可能反映了我们先前在这些时间点观察到的双峰高峰(图1,C和D)。为了研究免疫-上皮的相互作用,我们使用已发表的大规模RNA测序数据将5-9周孕的肺上皮尖端来源的器官样体与新鲜切取的6-7周孕的尖端进行比较。上皮尖端前体表达了几种细胞因子受体,包括IL-1、IL-4、IL-6、IL-13、IL-17、IL-22、干扰素-γ(IFN-γ)、肿瘤坏死因子(TNF)和转化生长因子-β(TGF-β)的受体(图6C)。我们在新鲜的上皮尖端和器官样体中发现了类似的表达模式。基于表达的受体,我们筛选了相应细胞因子在培养的器官样体中的效应。
远离的上皮尖端细胞在擬腺期(约5到16周孕)始终共表达SOX2和SOX9。我们使用SOX2和SOX9作为标记物来研究我们的细胞因子组对器官样体的影响。最初,器官样体用细胞因子(10 ng/ml)处理7天,之后我们观察到IL-1β和IL-13导致SOX9表达显著下降,而SOX2没有受到显著影响(图6D)。为了更详细地研究免疫-上皮的相互作用,我们主要关注了研究IL-1β信号对器官样体的影响。
首先,我们评估了器官样体表面的IL-1受体1(IL-1R1)的存在。对于IL-1β信号传导,需要IL-1R1和一个辅助蛋白(IL-1RAcP)。整个染色显示器官样体和体内胎儿肺上皮中均表达IL-1R1和IL-1RAcP(图6E),证实了IL-1β信号传导的可能性。鉴于两个受体组分都存在,我们在存在IL-1β的条件下培养器官样体更长的时间。经过14天的IL-1β处理后,我们观察到SOX9显著减少,SOX2增加(图6F),表明IL-1β导致尖端前体从自我更新状态向分化状态撤离。在检查气道分化标记物时,我们发现TP63的表达显著增加,KRT5的增加无显著性差异(两者都是基底细胞的标记物),但在SCGB3A1、SCGB3A2、MUC5AC或纤毛细胞标记物FOXJ1的表达上没有影响(图6G)。
基于我们对IL-13效应的观察(图6D),以及先前的研究表明ILC可以分泌IL-13,以及ILC在胎儿肺中富集(图4E),我们将器官样体用IL-13处理了14天,以比较其对尖端细胞的影响与IL-1β的影响。IL-13处理导致SOX9和SOX2显著减少,TP63和KRT5无显著性增加(图6F和G),表明对气道分化有类似的影响。然而,IL-13和IL-1β对分泌细胞系标记物表达的影响是不同的:IL-13处理导致MUC5AC和MUC5B减少,而IL-1β处理在大多数重复中显著增加了MUC5B(图6G)。IL-1β处理器官样体的效应在蛋白水平上也通过整体染色(图6H)和Western blotting(图6I)得到确认。这些结果表明IL-1β促使尖端前体细胞从自我更新状态中退出,通过下调SOX9和增加SOX2的表达,然后导致肿瘤蛋白P63(TP63)的增加,从而支持向基底细胞的分化。
IL-1β的补充与DSA结合可导致肺器官样体中成熟基底细胞标记物keratin 5(KRT5)显著增加(图6J和K),表明分泌IL-1β的免疫细胞促进成熟基底细胞分化,并可能与分泌TGF-β/BMP-4的间充质细胞共同起作用。为了进一步确认IL-1信号在分化中的作用,我们还测试了IL-1β抑制的效果。通过IL-1受体拦截剂(IL-1Ra)阻断IL-1受体增加了增殖(Ki67+细胞)和器官样体的大小,而IL-1β减小了器官样体的大小和增殖,这表明IL-1信号在决定前体细胞命运中起着重要作用。无论是在干性还是分化中。MAPKKK蛋白激酶TGF-β激活激酶1(TAK1)介导IL-1激活信号通路中c-Jun N-末端激酶和核因子κB的激活。(5Z)-7-Oxozeaenol是TAK1的强效抑制剂,也显著减弱了IL-1β诱导的基底细胞标记物诱导,进一步证实了IL-1信号的关键作用(图6L)。
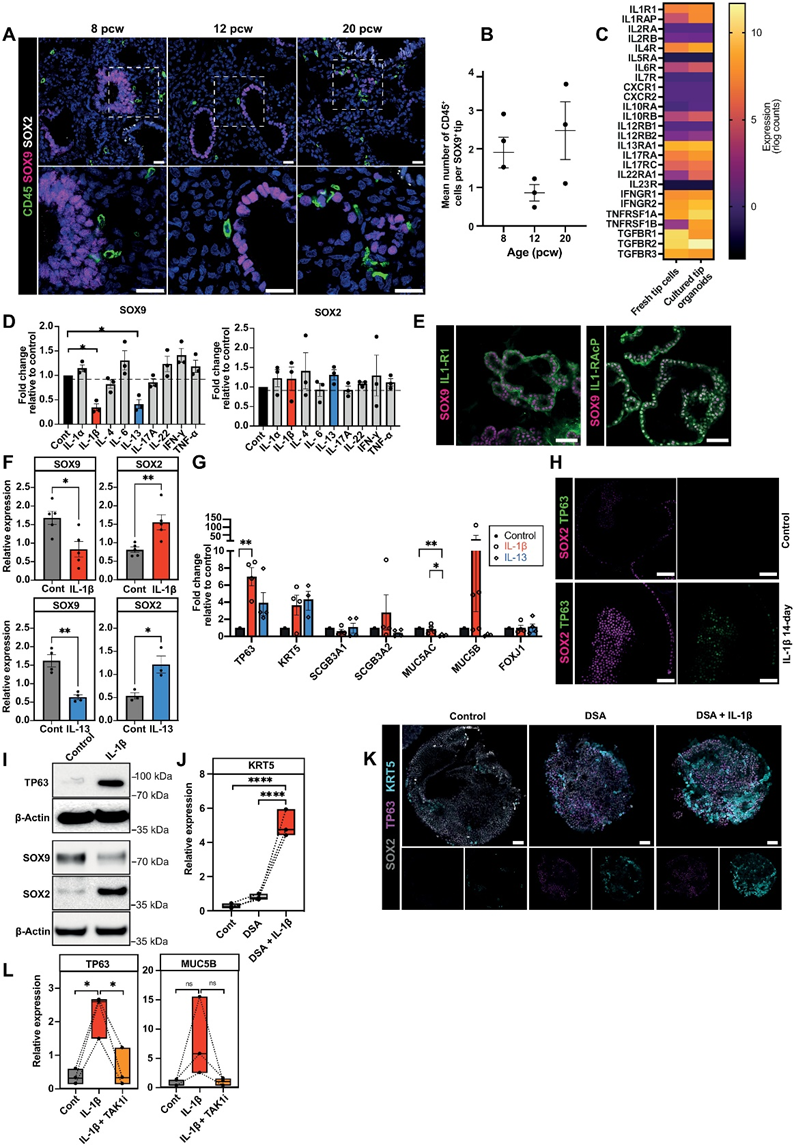
7、胎儿肺部的髓系细胞分泌 IL-1β
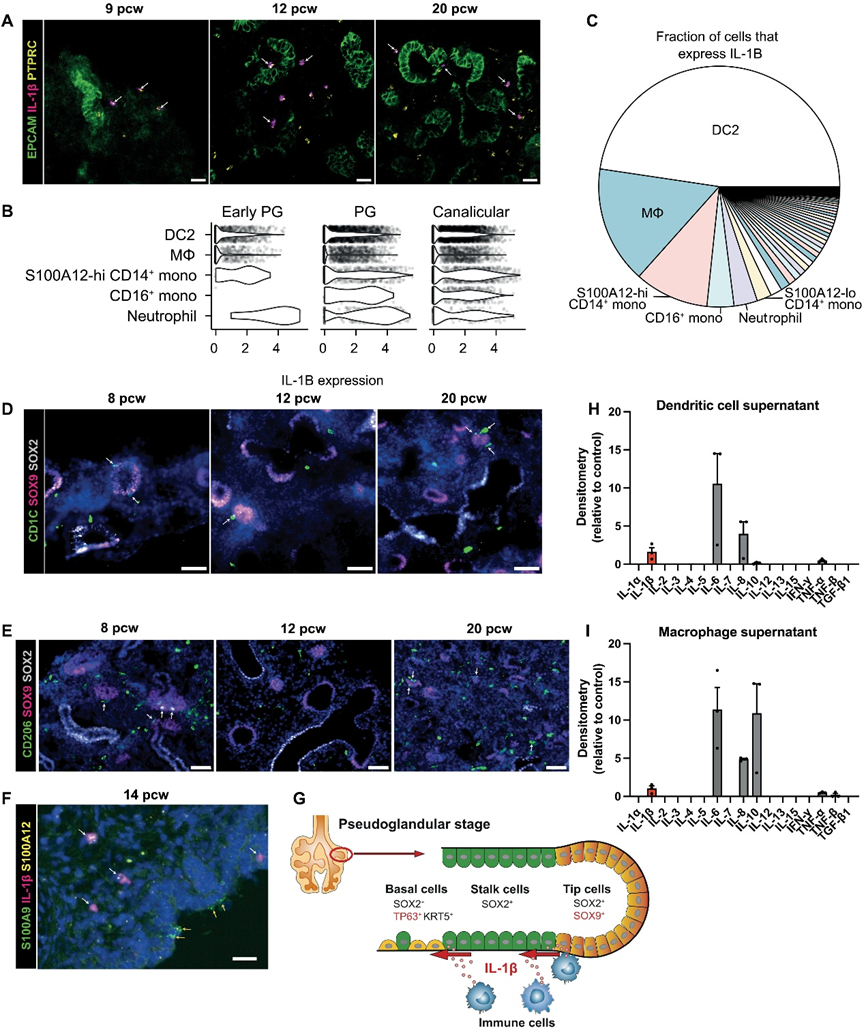
在确立了IL-1β信号具有改变发育中肺上皮细胞命运的能力后,我们试图在体内确定可能是IL-1β来源的免疫细胞。成年人体内IL-1β的主要来源是血液单核细胞、组织巨噬细胞和树突状细胞。我们首先使用RNAscope在体内胎儿肺中确认了IL1B+免疫细胞的存在(图7A)。在我们的单细胞数据集中,前五个表达最高的细胞类型占所有IL1B的75%以上(图7B和C)。胎儿DC2细胞、巨噬细胞、单核细胞和中性粒细胞显示出IL1B最高的表达(图7B和C)。我们更仔细地研究了发育中肺中DC和巨噬细胞的空间和时间分布,使用CD1C作为DC2细胞的标记物,使用巨噬细胞甘露糖受体CD206作为巨噬细胞的标记物(图7D和E)。我们在整个发育过程中在胎儿肺组织中识别了CD1C+ DC2细胞和CD206+巨噬细胞,并发现DC和巨噬细胞直接接触SOX9+上皮尖端前体。此外,我们还观察到单核细胞和/或中性粒细胞靠近发育中的上皮(图7F)。通过体外培养每种细胞类型7天,使用优化条件分析了培养上清液,我们从19到21周胎儿肺中分离了DC和巨噬细胞,并研究了它们的细胞因子分泌,使用Human Cytokine Antibody Array (Abcam)(图7H和I)。两种细胞类型都分泌了几种细胞因子,特别是IL-1β、IL-8、IL-6、IL-10、TNF-α和TNF-β。
这些数据证实了发育中的胎儿肺中存在能够分泌IL-1β的DC和巨噬细胞。IL-6和TNF-α最初通过器官样体处理7天进行了测试(图6D),对SOX9或SOX2的表达没有影响。IL-8通过CXCR1和CXCR2受体信号传导,而这两者在上皮尖端均不表达(图6C),因此IL-8信号传导可能不会直接影响发育中的上皮。IL-10信号需要IL-10受体的两个组分(α和β),但在上皮前体和器官样体中只表达IL-10Rβ(图6C),这表明IL-10也不能直接影响上皮尖端。尽管IL-8和IL-10不能直接对上皮发挥信号作用,但它们可能影响招募和激活发育中胎儿肺中存在的其他免疫细胞,因此可能间接影响上皮。总的来说,我们已经证明了能够分泌IL-1β的免疫细胞驻留在上皮尖端附近,这表明免疫细胞具有引导发育中肺上皮的能力。
实验方法:
IHC、FACS、scRNA-seq、CITE-seq、遗传供体分离、类器官、细胞因子治疗、双 SMAD 激活。
参考文献:
Barnes JL, Yoshida M, He P, et al. Early human lung immune cell development and its role in epithelial cell fate. Sci Immunol. 2023;8(90):eadf9988.






