小胶质细胞中YY1乳酸化通过转录激活介导的FGF2上调促进血管生成
眼部新生血管形成是导致失明的主要原因。视网膜小胶质细胞与缺氧诱导的血管生成和血管病变有关,但其潜在机制尚不完全清楚。乳酸化是一种新型的乳酸衍生翻译后修饰,在多个细胞过程中起关键作用。由于缺血性视网膜病变中的缺氧是视网膜新生血管形成的诱发因素,因此乳酸化很可能参与这一过程。该研究旨在探讨乳酸化在视网膜新生血管形成中的作用,并确定视网膜新生血管疾病的新治疗靶点。集落刺激因子1受体(CSF1R)抑制剂对小胶质细胞耗竭PLX3397抑制氧诱导的视网膜病变中的视网膜新生血管形成。缺氧可增加小胶质细胞中的乳酸化并加速FGF2的表达,从而促进视网膜新生血管形成。作者确定了67个蛋白质的77个位点,在缺氧下乳酸增加的背景下乳酸化增加。结果表明,转录因子非组蛋白阴阳-1(YY1)在赖氨酸183(K183)位点乳酸化,赖氨酸183受p300调控。高乳酸化的YY1直接增强FGF2转录并促进血管生成。K183位点的YY1突变消除了这些影响。p300的过表达增加YY1乳酸化并增强体外血管生成,并且p300抑制剂A485的给药大大抑制了体内和体外的血管形成。该研究结果表明,小胶质细胞中YY1的乳酸化通过上调FGF2的表达在视网膜新生血管形成中发挥重要作用。靶向乳酸/p300/YY1乳酸化/FGF2轴可能为增殖性视网膜病变提供新的治疗靶点。该研究于2023年4月发表于《Genome Biology》上,题为“YY1 lactylation in microglia promotes angiogenesis through transcription activation-mediated upregulation of FGF2”,影响因子12.3。
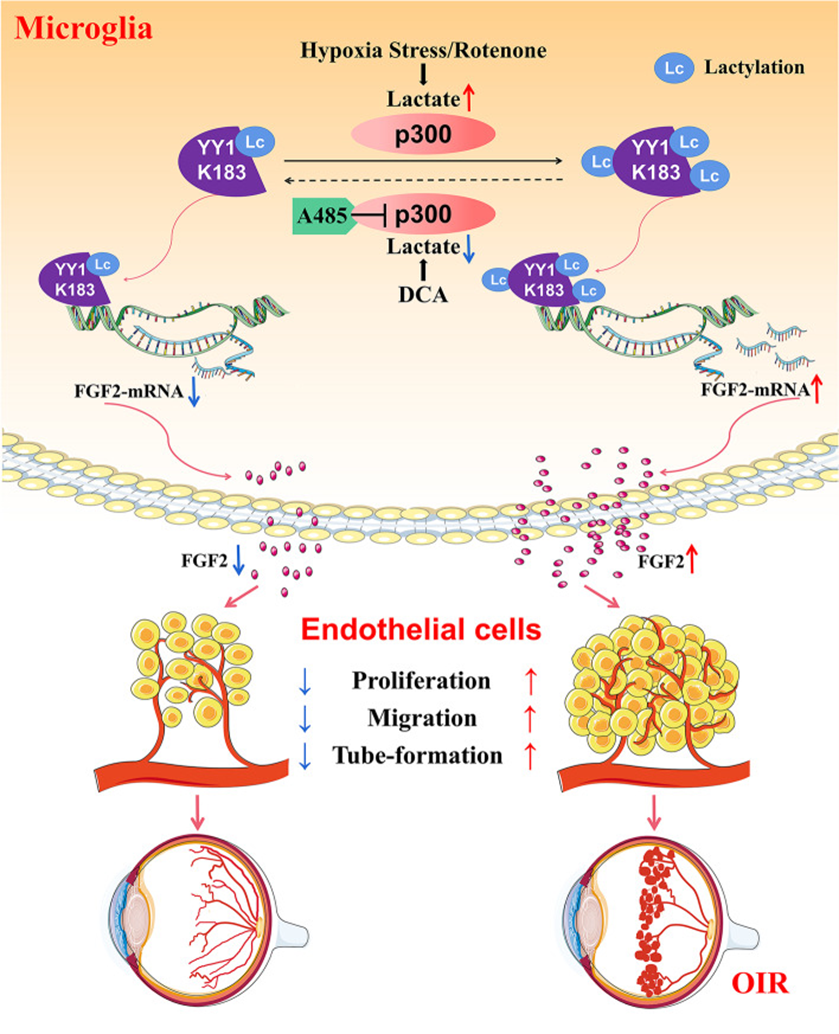
技术路线

研究思路
1. 视网膜小胶质细胞对视网膜新生血管形成至关重要
为了评估小胶质细胞在视网膜病变血管发病机制中的作用,开发了一种广泛使用的OIR小鼠模型,该模型概括了人类增殖性视网膜病变,如ROP,如流程图所示(图1a)。建模后,视网膜小胶质细胞大量增殖并聚集在OIR视网膜新生血管形成部位周围(图1b)。为了评估小胶质细胞耗竭是否会影响OIR的进展,作者使用了CSF1R抑制剂(PLX3397),该抑制剂被证明可诱导明显的小胶质细胞消融。加药流程图如图1c所示(从P10到P17注射)。给药后,作者观察到病理性血管生成随着小胶质细胞的耗竭而受到极大的抑制(图1d)。这些结果证明了小胶质细胞在视网膜新生血管形成中的重要作用。
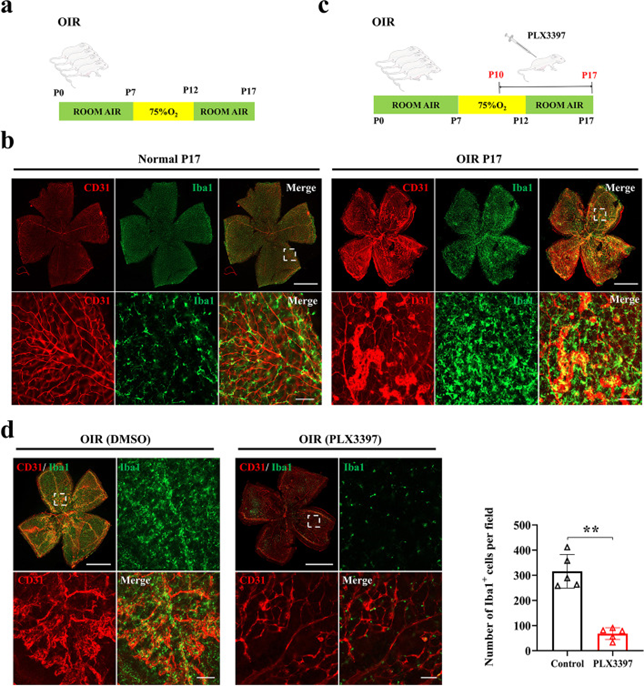
图1 视网膜小胶质细胞对视网膜新生血管形成至关重要
2. 乳酸和乳酸化水平升高与视网膜新生血管形成有关
乳酸化来源于乳酸,参与多种细胞过程。为了确认乳酸和乳酸化是否参与缺氧诱导的增殖性视网膜病变,作者检查了OIR小鼠的乳酸含量和泛赖氨酸乳酸化(Pan-Kla)水平。与年龄匹配的对照组相比,OIR小鼠P17(OIR新生血管形成的峰值)视网膜中的乳酸水平上调(图2a),与临床数据一致,与非ROP婴儿相比,ROP婴儿血液中的乳酸含量显着增加(图2b)。同时,与对照组相比,OIR组的Pan-Kla水平上调(图2c)。然后,作者想知道小胶质细胞的乳酸化是否在视网膜血管疾病中起重要作用。OIR小鼠视网膜小胶质细胞中的乳酸化上调(图2d)。值得注意的是,随着小胶质细胞的耗竭,视网膜中Pan-Kla的水平相对下调(图2e)。
为了研究乳酸化是否有助于视网膜病变的血管发病机制,作者应用了两种化合物进行体内验证实验,即二氯乙酸钠(DCA)和鱼藤酮,它们已被证明可以通过调节乳酸的产生来调节乳酸化。DCA可以通过抑制丙酮酸脱氢酶激酶的活性来减少乳酸的产生,鱼藤酮是线粒体呼吸链复合物的抑制剂,使细胞倾向于进行糖酵解并增加乳酸的含量。复方处理后,作者观察到DCA组的乳酸和乳酸化水平降低,鱼藤酮组的乳酸和乳酸化水平升高(图2f,g),伴有DCA组视网膜新生血管的缓解和鱼藤酮组新生血管的加重(图2h)。这些结果表明乳酸化在视网膜新生血管形成中的重要作用。
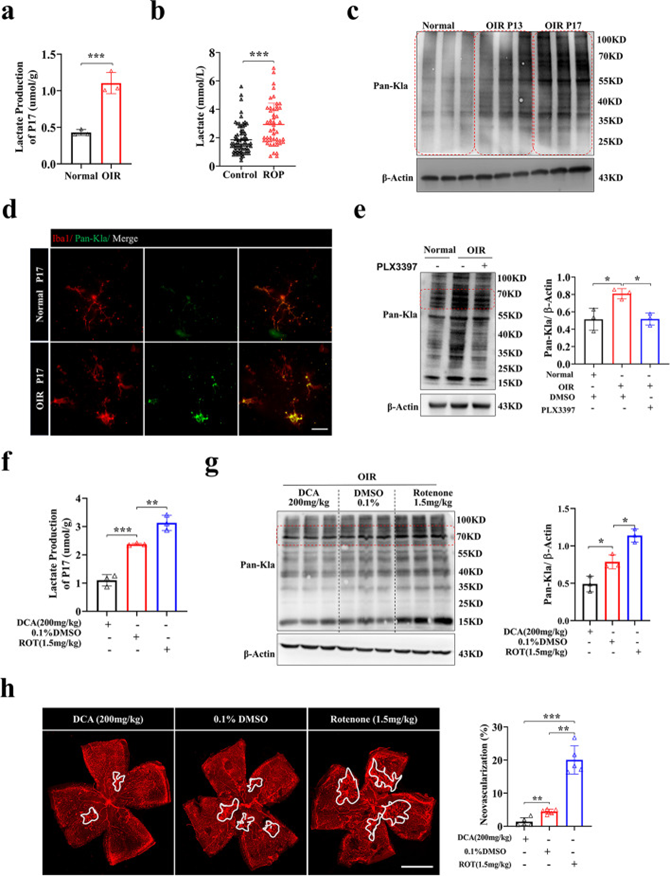
图2 乳酸和乳酸化水平升高与视网膜新生血管形成有关
3. 小胶质细胞的高乳酸化促进体外血管生成
由于缺氧在血管生成过程中很重要,作者将人小胶质细胞克隆3(HMC3)细胞暴露于缺氧下,以探索乳酸化在小胶质细胞中的作用。随着缺氧程度的增加,HMC3小胶质细胞的乳酸含量增加,乳酸化水平也升高,特别是对于55-70 kD范围内的蛋白质(图3a,b)。内皮细胞的增殖和迁移对于血管网络的形成至关重要。为了探究乳酸化增加的小胶质细胞是否会影响内皮细胞的血管生成能力。作者将常氧或缺氧组的HMC3小胶质细胞与人视网膜微血管内皮细胞(HRMECs)共培养。随着HMC3细胞缺氧时间的增加,HRMECs的管形成、球状体萌芽、迁移和增殖的能力增强(图3c-f)。为进一步证实小胶质细胞乳酸/乳酸化水平在血管生成发病机制中的重要作用,采用DCA和鱼藤酮处理HMC3小胶质细胞,检测乳酸/乳酸化水平。DCA组HMC3小胶质细胞的乳酸/乳酸化水平降低,鱼藤酮组升高(图3g,h)。然后,作者将DCA/DMSO/鱼藤酮组的HMC3小胶质细胞与HRMECs共培养,以探索对HRMECs的影响。DCA组与HMC3细胞共培养的HRMECs的管形成、球状芽、迁移和增殖能力减弱,鱼藤酮组增强(图3i-l)。这些结果表明,小胶质细胞中乳酸化升高是促进内皮细胞血管生成能力的原因。
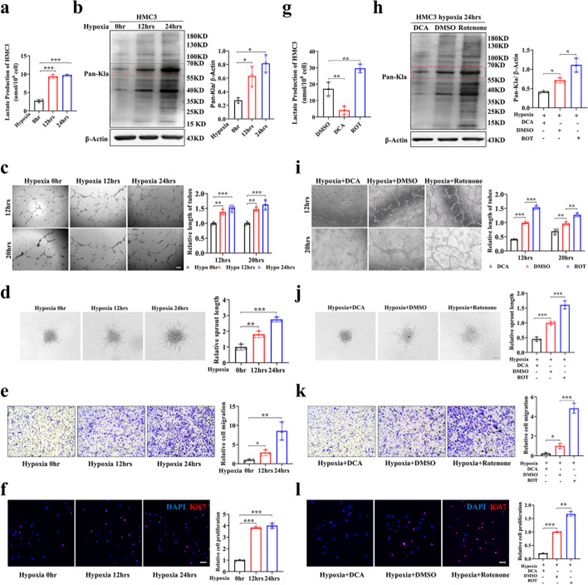
图3 小胶质细胞的高乳酸化在体外促进血管生成
4. YY1在小胶质细胞中的乳酸化在调节血管生成中起着重要作用
为了表征缺氧下小胶质细胞中乳酸化的情况,作者用常氧或缺氧处理HMC3细胞24 h,然后通过4D无标记平台方法进行乳酸组分析以鉴定差异乳酸化蛋白。对于乳酸组数据的详细信息,共鉴定出6021个肽和3071个乳酸化肽。在HMC3细胞中总共鉴定了751个蛋白质中的3093个乳糖化位点,定位概率>0.75,FDR为1%。质量控制表明肽的分布在合理范围。作者在缺氧条件下鉴定了乳酸化增加的67种蛋白质的77个位点和乳酸化降低的162种蛋白质的190个位点作为差异表达的乳酸化蛋白(DELPs)。乳酸化增加或减少的前20种蛋白质的相对定量如图4a所示。对鉴定的DELPs行聚类分析以表征这些乳酸化蛋白的功能。分类分析表明,大多数DELPs在细胞核中发挥作用,并在调节DNA转录中具有潜在作用(图4b)。使用相互作用基因/蛋白质检索检索工具(STRING)数据库,DELPs的蛋白质相互作用网络表明DELPs主要在结合过程中起作用,这与富集途径相对应(图4c)。
在这些DELPs中,YY1的乳酸化水平很大程度上上调(倍数变化3.56),而YY1是一种多功能转录因子,对血管生成有一定的调节作用。此外,观察到的YY1条带大小为68 kD,这与55-70 kD的范围一致,根据作者之前的结果,该范围主要由缺氧或用DCA和鱼藤酮治疗调节。作者在缺氧的HMC3小胶质细胞中观察到YY1和Pan-Kla与双标记免疫荧光的共定位。蛋白质组学分析在YY1(K183)中仅鉴定出一个乳酸化赖氨酸残基,显示出特征性的串联质谱(MS/MS)谱图,包括C端y离子和氨基末端b离子(图4d)。为了验证YY1乳酸化在缺氧条件下是否受到调控,作者使用专门的YY1-K183la抗体来检测YY1乳酸化水平。与测序结果一致,YY1乳酸化在缺氧条件下显著增加,YY1表达水平无差异(图4e)。
接下来,作者将YY1的赖氨酸(K)183突变为精氨酸(R),其模拟蛋白质的脱乳酰化状态,方法是用含有Flag标记的YY1WT或YY1K183R突变体的cDNA的慢病毒转染HMC3小胶质细胞。Flag-YY1在WT和K183R突变体组中均过表达。在K183R突变体缺氧处理的HMC3小胶质细胞中,YY1乳酸化水平降低。与WT组相比,与K183R突变体HMC3小胶质细胞共培养的HRMECs显示出减弱的管形成、球状体萌芽、迁移和增殖能力(图4f-i)。综上所述,这些数据表明小胶质细胞中YY1的乳酸化起着血管生成的调节剂的作用。
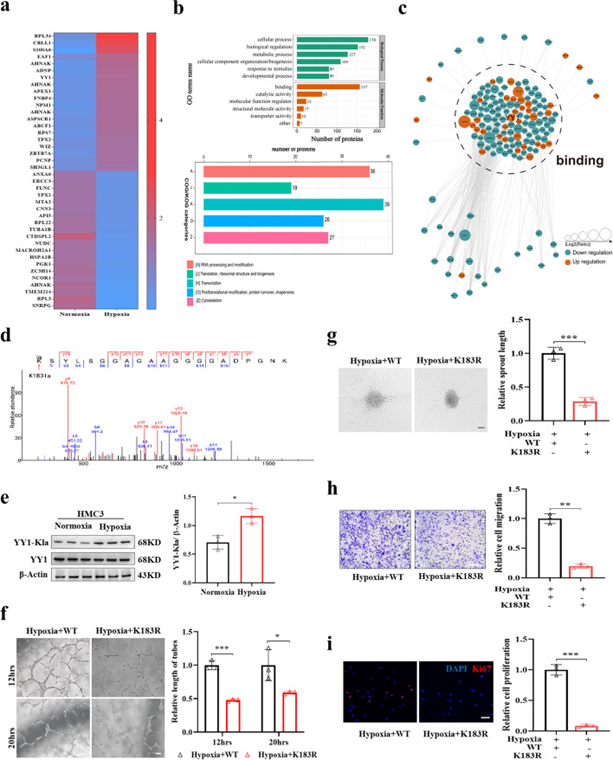
图4 YY1在小胶质细胞中的乳酸化在调节血管生成中起着重要作用
5. YY1乳酸化通过调节FGF2表达促进血管生成
为了确定参与小胶质细胞介导的血管生成的潜在血管生成因子,作者在体外逆转录了从体内常氧、缺氧和小胶质细胞耗竭的视网膜和HMC3小胶质细胞中分离的mRNA,并比较了一些经典血管生成相关基因(VEGFA/FGF2/MMP9/MMP2/ANGPTL6)的表达水平。与对照组相比,OIR小鼠的FGF2和VEGFA mRNA表达水平显著升高,而小胶质细胞耗竭后mRNA和蛋白水平仅FGF2水平显著降低(图5a,c)。同样,缺氧在缺氧暴露后 12 小时内增加FGF2 mRNA 表达,并且在HMC3小胶质细胞中水平保持升高直到24 小时(图5b,d)。FGF2在OIR视网膜小胶质细胞中的表达上调(图5e)。与先前的研究一致,这些结果表明FGF2在小胶质细胞介导的新生血管形成中很重要。DCA和鱼藤酮在体内和体外用于探讨乳酸/乳酸化是否通过调节血管生成因子的表达来影响血管生成。在用DCA和鱼藤酮处理的OIR模型中,DCA组FGF2的表达降低,但鱼藤酮组在P17时增加。在暴露于DCA或鱼藤酮缺氧的HMC3小胶质细胞中也发现了类似的结果。
YY1包含四个C2H2锌指,用于结合位于许多启动子和增强子中的特定DNA序列,促进或抑制转录。在YY1 K183R突变组中,FGF2在mRNA和蛋白水平上的表达均较低,而其他血管生成因子无差异(图5f)。为了探究YY1乳酸化与FGF2表达的机制,作者检索了Cistrome Data Browser数据库,发现YY1可能直接促进FGF2的转录。作者在JASPAR网站上的FGF2启动子中发现了三个预测的YY1结合位点,ChIP-qPCR显示YY1可以结合FGF2转录起始位点上游的−1336至−1172bp区域。为了进一步探索缺氧条件下YY1的靶点,作者用YY1对这些血管生成因子的启动子进行了ChIP-qPCR。值得注意的是,ChIP-qPCR分析显示,缺氧促进了YY1与FGF2启动子的结合,而不是其他血管生成因子(图5g),主要是因为视网膜小胶质细胞不是分泌这种血管生成因子的主要细胞。K183R突变导致YY1与FGF2启动子的结合受损,表明它受YY1乳酸化水平的调节(图5h)。用双荧光素酶报告基因系统验证了YY1在缺氧条件下直接促进FGF2转录,YY1乳酸化位点突变导致转录能力降低的结果(图5i)。同时,作者发现玻璃体内注射重组FGF2可逆转小胶质细胞耗竭抑制的视网膜新生血管形。综上所述,作者的研究结果表明,缺氧小胶质细胞释放的FGF2受YY1乳酸化的调控,并在缺氧诱导的血管生成中起重要作用。
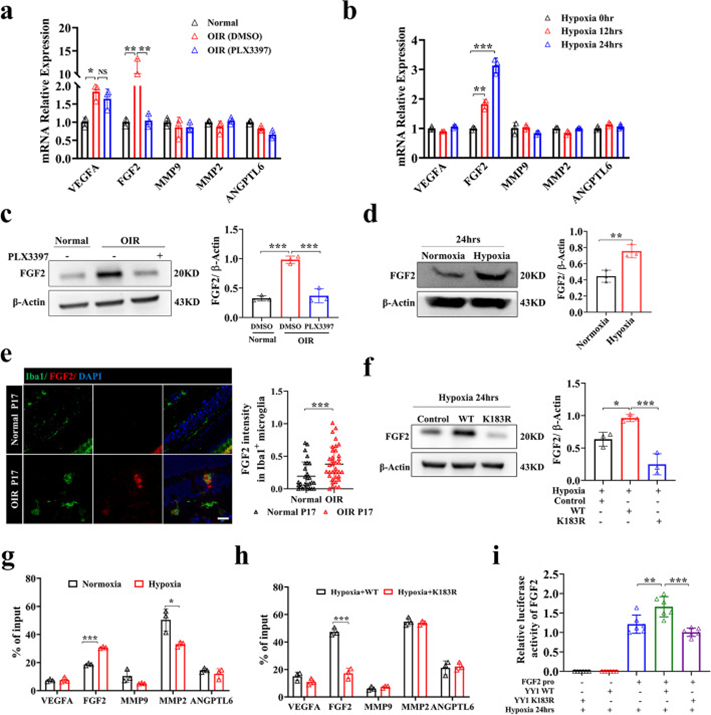
图5 YY1乳酸化通过调节FGF2表达促进血管生成
6. p300影响YY1的乳酸化,进而调节体外血管生成
赖氨酸酰化是一系列普遍且进化上保守的PTM。乳酸化是一种新形式,可能与其他赖氨酸酰化类型共享相似的写入器和橡皮擦。为了确定负责调节乳酸化水平的调节因子,作者在常氧和缺氧条件下检测了已知酰化修饰写入物(Tip60、p300和PCAF)和擦除剂(HDAC6和SIRT1)的表达模式。结果显示,缺氧条件下HMC3小胶质细胞中p300、HDAC6和SIRT1水平显著上调,Tip60水平略有上调(图6a)。值得注意的是,根据Co-IP数据,只有p300与靶蛋白YY1结合,并且p300-YY1之间的相互作用随着缺氧而增加(图6b)。此外,作者还发现p300通过双标记免疫荧光与YY1共定位(图6c)。
为了进一步探讨p300在调节乳酸化水平中的作用,作者在HMC3小胶质细胞中过表达p300,发现乳酸化水平显著升高(图6d)。有趣的是,p300的过表达增加了YY1的乳酸化水平,并伴有FGF2的上调(图6e,f)。为了充分证实p300的作用,在随后的实验中使用了p300抑制剂A-485。A-485被证明是p300的CoA竞争性催化抑制剂,L-乳酰辅酶A是乳酸化所必需的。A-485处理后,YY1的乳酸化显著降低,YY1转录调控的假设靶点FGF2的表达水平也下调(图6g,h)。与p300过表达的HMC3小胶质细胞共培养的HRMECs的管形成、球状芽、迁移和增殖能力增强,但与相应的对照组相比,A-485组减弱。
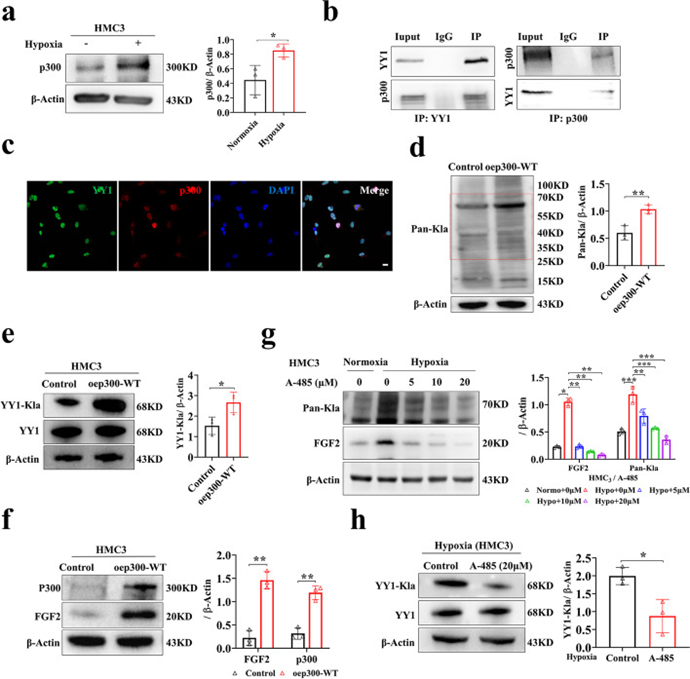
图6 p300影响YY1的乳酸化,然后在体外调节血管生成
7. 抑制p300可减少视网膜小胶质细胞的YY1乳酸化并抑制OIR中的血管生成
了解了p300/YY1乳酸化/FGF2轴在小胶质细胞中的重要促血管生成作用,作者通过体内靶向p300和A485进一步评估了抗血管生成治疗的疗效。作者发现YY1乳酸化和p300的表达在OIR视网膜中上调(图7a)。Iba1和YY1-K183la的双重免疫荧光染色显示OIR小鼠视网膜小胶质细胞中YY1乳酸化上调(图7b)。在P14处进行玻璃体内给药A485处理,服用A485后,Pan-Kla水平降低。有趣的是,A485处理降低了视网膜小胶质细胞中YY1的乳酸化(图7c,d),伴有FGF2表达降低和视网膜新生血管缓解(图7e,f)。小胶质细胞中乳酸化的减少可能与小胶质细胞活化减少有关(图7g)。总体而言,这些结果表明,视网膜小胶质细胞中YY1乳酸化的上调与视网膜新生血管形成有关,表明阻断p300-YY1乳酸化-FGF2信号传导可能为治疗视网膜新生血管疾病提供治疗范式。
由于小鼠出生时没有完整的视网膜血管网络,并且视网膜处于相对缺氧状态,作者想知道YY1乳酸化是否也在视网膜发育血管生成中发挥作用。作者发现YY1在视网膜发育的早期阶段(出生后第5天)出现高乳酸化。YY1乳酸化水平在后期下降,表明YY1也可能在生理性血管生成中发挥作用。需要进一步的研究来深入探索它。
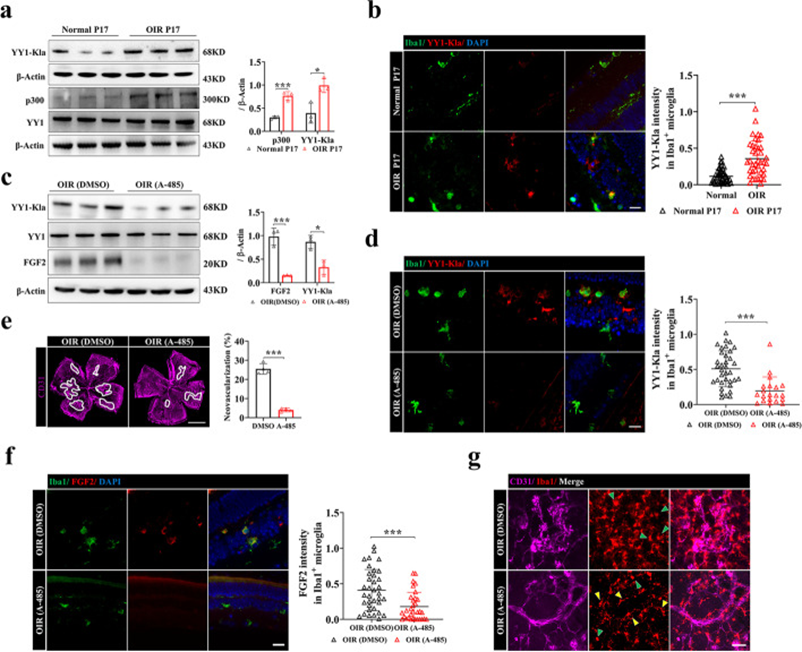
图7 抑制p300可降低YY1的乳酸化并抑制OIR中的血管生成
实验方法
小胶质细胞耗竭;动物建模与给药;细胞培养;乳酸水平定量;免疫荧光染色;实时荧光定量PCR;WB;体外慢病毒感染和质粒转染;基于泛抗体的翻译后修饰富集;LC/MS分析和数据库搜索;免疫共沉淀(Co-IP);ChIP检测;双荧光素酶报告实验;HRMECs管形成实验;基于球状体的萌芽血管生成实验;细胞迁移检测;细胞增殖检测;
参考文献
Wang X, Fan W, Li N, Ma Y, Yao M, Wang G, He S, Li W, Tan J, Lu Q, Hou S. YY1 lactylation in microglia promotes angiogenesis through transcription activation-mediated upregulation of FGF2. Genome Biol. 2023 Apr 21;24(1):87.






