磁迷走神经刺激通过抑制焦亡减轻大鼠心肌缺血再灌注损伤
心肌缺血再灌注(I/R)损伤伴随着心脏自主神经系统失衡,表现为交感神经张力过度激活和迷走神经活性降低。在我们之前的研究中,我们率先开发了磁迷走神经刺激(mVNS)系统。该系统能精确刺激迷走神经,对心肌梗死具有显著的疗效和安全性。然而,mVNS是否可以减轻心肌I/R损伤及其具体的潜在机制仍不确定。本研究采用大鼠心肌I/R损伤模型,探讨mVNS对这类损伤的治疗潜力。我们的研究结果显示,mVNS治疗导致心肌梗死面积减少,心室颤动(VF)发生率降低,炎症细胞因子释放抑制。从机制上讲,mVNS通过M2AChR/OGDHL/ROS轴抑制NLRP3介导的心肌焦亡,对心肌I/R损伤有有益作用。总的来说,这些结果突出了mVNS作为心肌I/R损伤治疗策略的潜力。本文于2023年11月发表于“Journal of Nanobiotechnology”(IF=10.2)上。
技术路线

结果:
1)磁刺激系统和磁迷走神经刺激的建立
我们成功合成了SPIOCS/GP温度敏感水凝胶(图1A)。在动物实验中,我们首先分离SD大鼠右侧迷走神经,然后将SPIO-CS/GP水凝胶涂覆在迷走神经表面,一旦锥体磁铁经过,对右侧迷走神经进行磁刺激(图1B)。图1C显示了mVNS治疗心肌I/R损伤的示意图(图1C)。
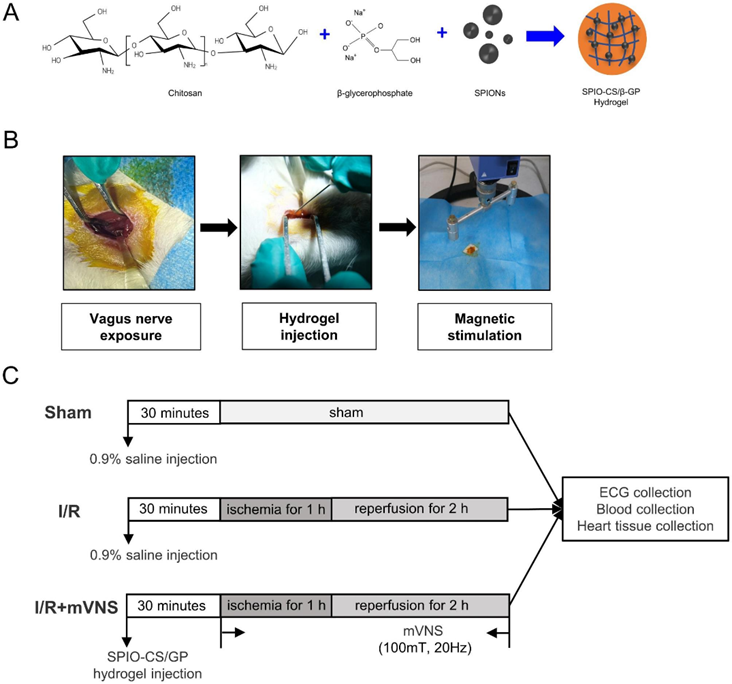
2)mVNS治疗可减轻心肌I/R损伤、心室颤动和炎性细胞因子释放
与I/R组相比,mVNS明显减少了心脏梗死面积,改善了心功能(图2A和B),而mVNS治疗显著降低了I/R损伤引起的血清心肌酶浓度升高(图2C)。采用I/R致室性心律失常模型评估mVNS治疗的抗心律失常效果。再灌注结束时,在程序电刺激后收集心电图数据(图2D)。我们发现mVNS可以显著降低I/R诱导的VF的发生率和持续时间(图2E, F)。结果还显示,与假手术组相比,I/R损伤显著增加了心率,而mVNS明显降低I/R损伤引起的高心率(图2G)。此外,与假手术组相比,I/R大鼠心肌炎症细胞浸润和IL-6表达均显著升高。然而,mVNS治疗减轻了心肌中炎症细胞浸润和IL-6的表达(图2H)。血清中IL-6、TNF-α的表达也出现类似变化。mVNS可逆转I/R诱导的血清IL-6和TNF-α浓度升高(图2I)。
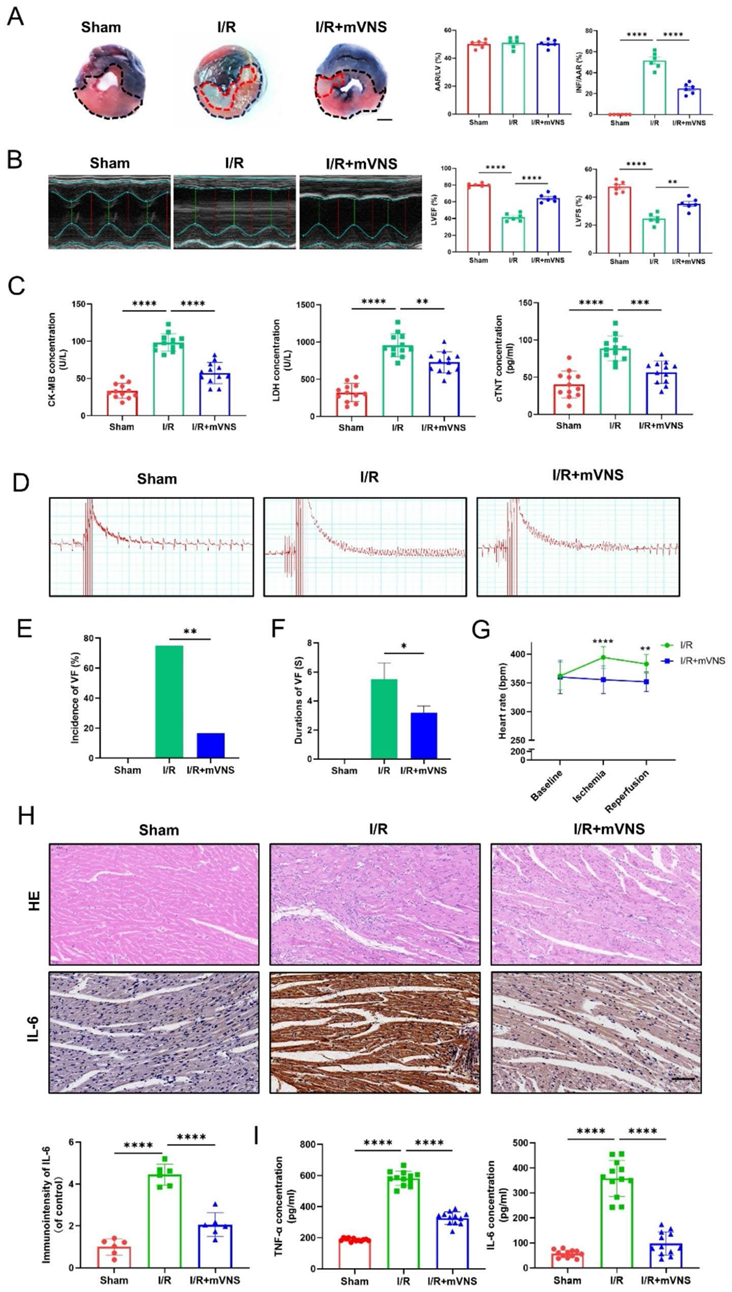
3)mVNS可减轻心肌I/R损伤所致的心肌焦亡
我们测量了心肌中Tunel阳性心肌细胞。结果显示,与I/R组相比,mVSN治疗有效缓解了Tunel阳性心肌细胞(图3A)。随后,我们评估了I/R损伤大鼠心肌组织内的焦亡指标。值得注意的是,与假手术组相比,I/R组NLRP3心肌表达明显升高(图3B-D)。心肌中Cleaved caspase-1和Cleaved N端GSDMD表达升高(图3C和D),I/R组大量炎症因子(IL-1β和IL-18)释放(图3E)。然而,mVNS治疗后心肌组织内的焦亡相关蛋白水平和炎症因子的释放均有所减轻(图3B-E)。提示mVNS具有抑制I/R诱导的焦亡的能力。
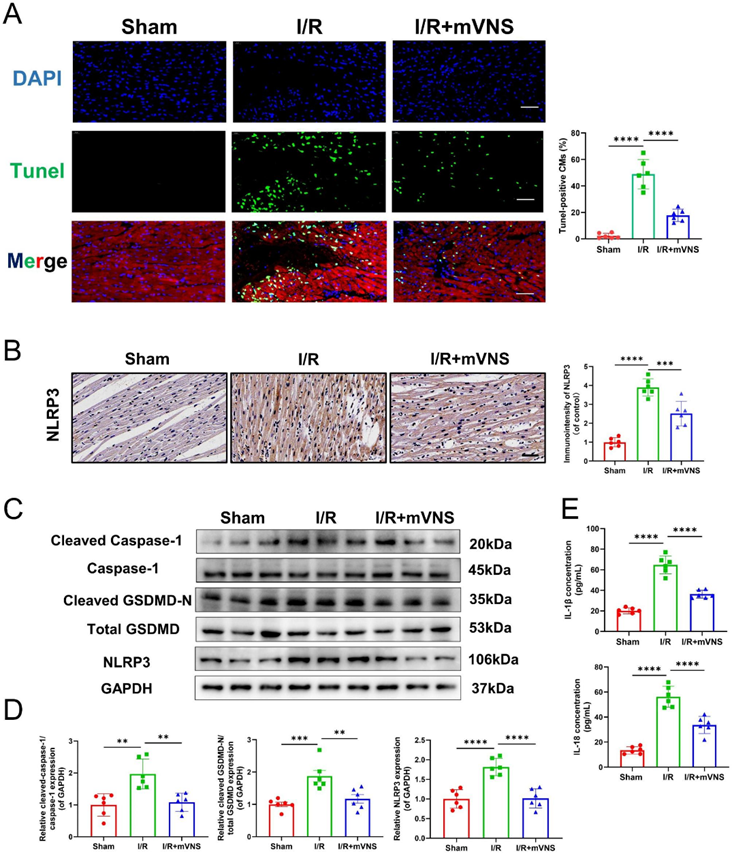
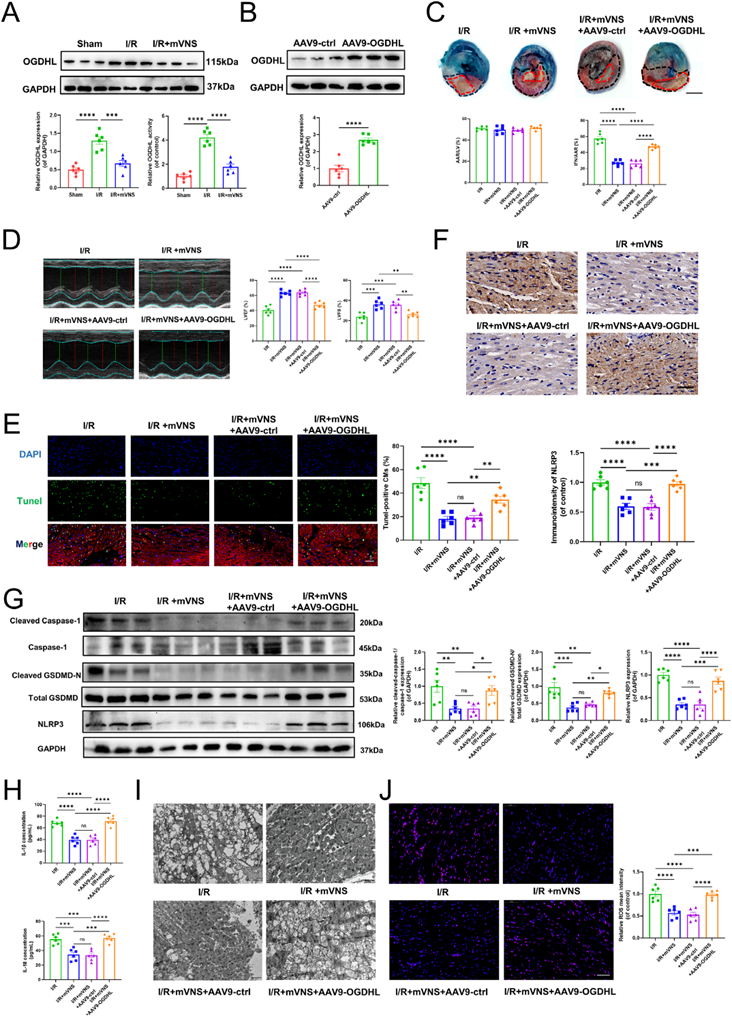
4)mVNS通过抑制OGDHL表达和改善线粒体损伤来调节心肌焦亡
我们初步证实,心肌I/R损伤时OGDHL的表达和活性显著升高,而mVNS可以逆转OGDHL的表达和活性上调(图4A)。为了验证OGDHL在mVNS减轻心肌焦亡中的作用,我们使用AAV9-cTNT-OGDHL在心肌中过表达OGDHL的表达。Western blot结果显示,病毒转染心肌后,OGDHL的表达明显升高(图4B)。Evans Blue/TTC双染色显示,OGDHL过表达减弱了mVNS减小心肌梗死大小的作用(图4C)。超声心动图显示OGDHL过表达削弱了mVNS对心功能的改善(图4D)。同样,提高OGDHL的表达水平也会阻碍mVNS减轻心肌焦亡和炎症细胞因子释放的能力(图4F-4H)。我们进一步检测了心肌组织的线粒体,发现mVNS显著改善心肌I/R损伤引起的线粒体结构损伤和mtROS的产生。然而,OGDHL过表达阻碍了mVNS介导的线粒体损伤改善和心肌中mtROS的产生(图4I, J)。
5)ACh通过逆转OGDHL表达升高和减轻线粒体损伤来减少焦亡
首先,我们证实了体外H/R模型诱导焦亡的有效性和ACh的有效性(图5A)。我们通过OGD和再氧化验证了OGDHL表达和活性的升高,而ACh被发现可以逆转NRCM中OGDHL和活性的上调(图5B)。为了证实OGDHL参与了ACh对焦亡的缓解作用,我们利用Ad-OGDHL上调了NRCM中OGDHL的表达。Western blot分析显示,转染Ad-OGDHL后,NRCM中OGDHL的表达显著增加(图5C)。如图5D所示,ACh处理逆转了H/R存在下裂解的GSDMD-N从细胞质溶质到质膜的移位,而OGDHL过表达减弱了ACh对裂解的GSDMD-N移位的影响(图5D)。此外,我们的研究表明,NRCM中OGDHL的过表达抑制了ACh在减轻焦亡相关蛋白表达方面的有益作用(图5E, F)。此外,我们评估了NRCM的mtROS和线粒体功能。结果表明,OGD和再氧化导致大量mtROS的产生和显著的线粒体损伤,ACh处理抑制ROS的产生,改善线粒体结构,增强ATP的产生。而OGDHL过表达则阻碍了ACh介导的NRCM线粒体损伤和mtROS产生的改善(图5G-5I)。
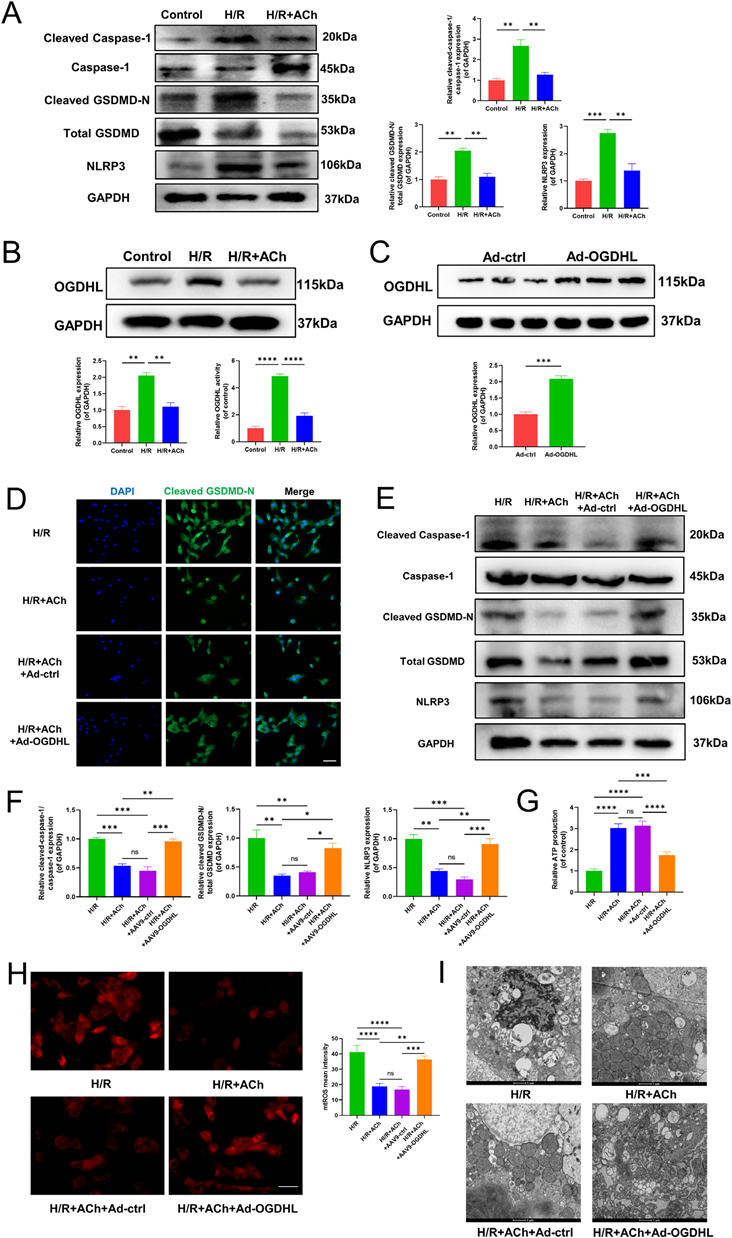
6)mVNS激活M2AChR抑制体内OGDHL的表达和焦亡
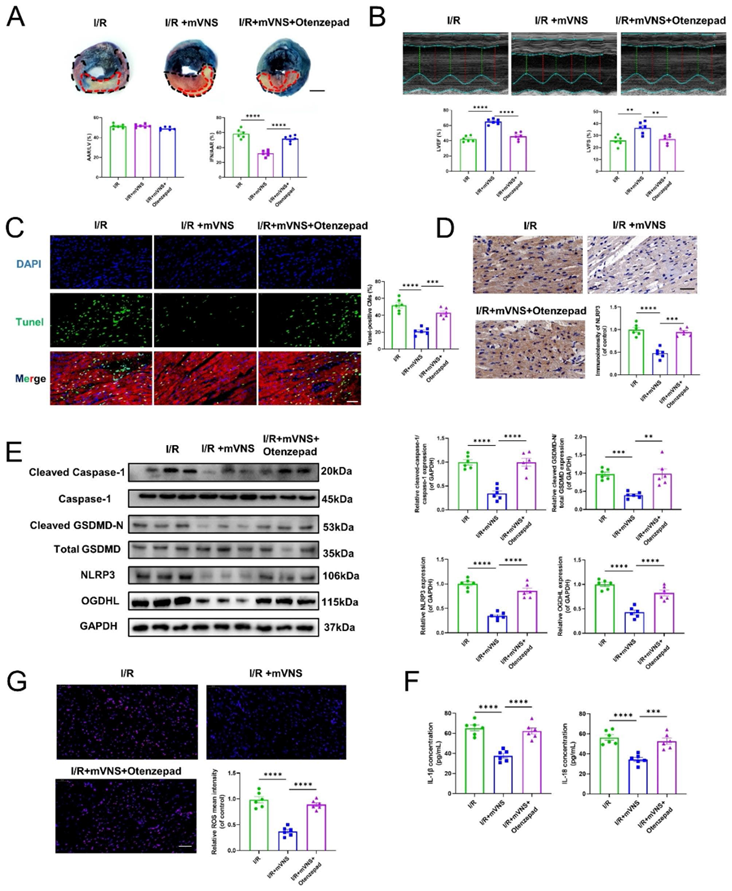
为了进一步研究M2AChR是否参与mVNS的抗焦亡作用,我们利用M2AChR拮抗剂Otenzepad抑制M2AChR的激活。结果显示,M2AChR拮抗剂Otenzepad减弱了mVNS减小心肌梗死大小和改善心功能的作用(图6A和B)。进一步的研究表明,mVNS的抗焦亡作用也通过抑制M2AChR的活性而受到抑制(图6D-F)。同样,我们还观察到M2AChR拮抗剂Otenzepad促进OGDHL表达,随后导致心脏组织中ROS产生的增加(图6E和G)。
7)ACh激活M2AChR抑制OGDHL的表达和活性以对抗焦亡
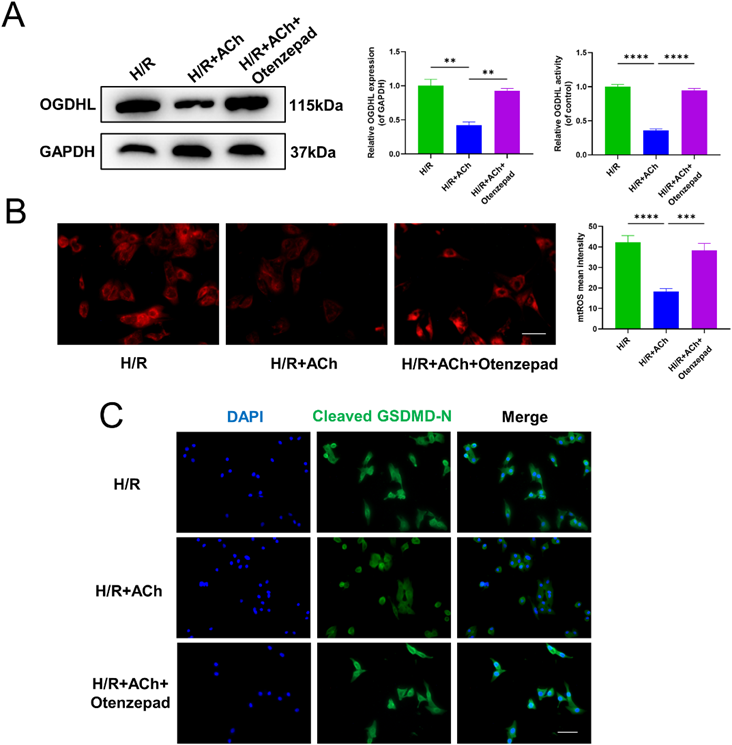
我们还评估了M2AChR拮抗剂Otenzepad对ACh体外抑制作用的影响。结果显示,Otenzepad减弱了ACh对抑制OGDHL表达水平的影响(图7A)。mtROS荧光染色显示,M2AChR拮抗剂Otenzepad降低了ACh抑制过量mtROS生成的作用(图7B)。正如预期的那样,M2AChR拮抗剂Otenzepad也抑制了ACh抑制NRCM中裂解的GSDMD-N易位的作用(图7C)。
结论:
mVNS治疗通过M2AChR/OGDHL/ROS轴抑制心肌焦亡,从而减轻心肌I/R损伤。我们的研究结果强调了mVNS对心肌I/R损伤的治疗潜力,具有重要的临床转化价值。
实验方法:
动物心肌I/R模型,SPIO-CS/GP水凝胶注射和磁迷走神经刺激,梗死面积测定,心功能评估,程控电刺激,心率变异性(HRV)分析,免疫组织化学染色,Elisa检测,Tunel染色,心肌超微结构检查,AAV9-cTNT-OGDHL治疗,细胞培养和处理,ATP测定,免疫荧光,腺病毒构建与细胞感染,免疫印迹分析
参考文献:
Lu Y, Chen K, Zhao W, Hua Y, Bao S, Zhang J, Wu T, Ge G, Yu Y, Sun J, Zhang F. Magnetic vagus nerve stimulation alleviates myocardial ischemia-reperfusion injury by the inhibition of pyroptosis through the M2AChR/OGDHL/ROS axis in rats. J Nanobiotechnology. 2023 Nov 14;21(1):421. doi: 10.1186/s12951-023-02189-3.






