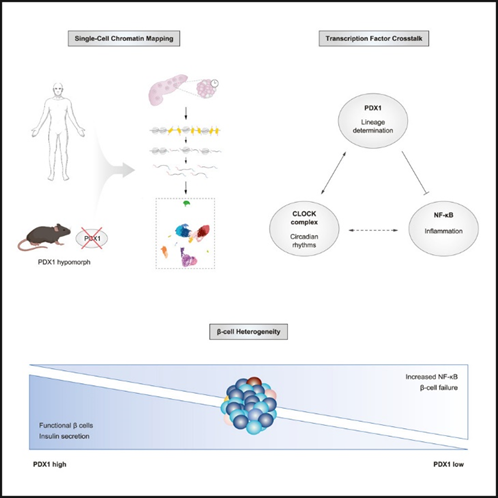
PDX1抑制潜在NF-kB增强子调节β细胞功能异质性
单个细胞在多细胞组织中的身份和功能是由血统决定和活动依赖的转录因子之间的相互作用确定的,其机制尚不完全清楚。通过构建人胰岛内染色质状态的单细胞图谱,作者发现由血统决定因子胰十二指肠家族盒基因1(PDX1)的高或低活性所主导的β细胞亚型。PDX1活性降低的β细胞在潜在的核因子kB(NF-kB)增强子上显示出增加的染色质可及性。Pdx1低活性小鼠在夜间展现了NF-kB的解抑制和葡萄糖耐受力受损。与染色质免疫沉淀测序(ChIP-seq)一起进行的三维分析揭示了PDX1通过涉及SIN3A的长程染色质接触在昼夜和炎症增强子上沉默NF-kB。相反,在β细胞中Bmal1基因敲除破坏了全基因组范围内的PDX1和NF-kB DNA结合。最后,拮抗NF-kB的白细胞介素-1β(IL-1β)受体,改善了Pdx1低活性胰岛的胰岛素分泌。作者的研究揭示了由PDX1活性梯度定义的单个β细胞的功能亚型,并确定NF-kB是胰岛素促分泌疗法的靶点。
该研究于2024年1月发表在《Cell Metab》,IF:29.0。
图形摘要:
技术路线: 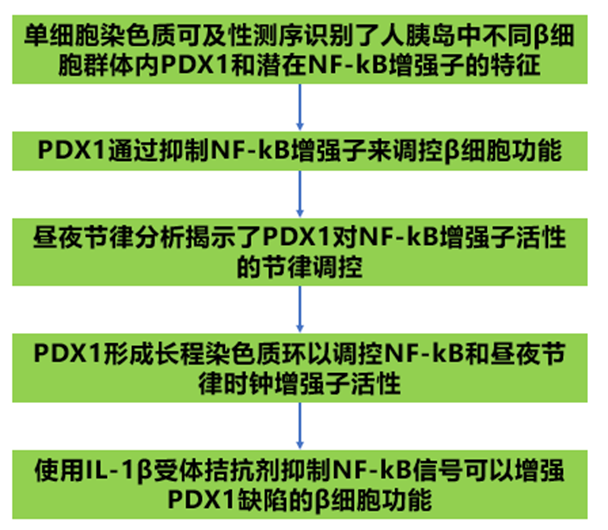
结果:
1、单细胞染色质可及性测序识别了人胰岛中不同β细胞群体内PDX1和潜在NF-kB增强子的特征
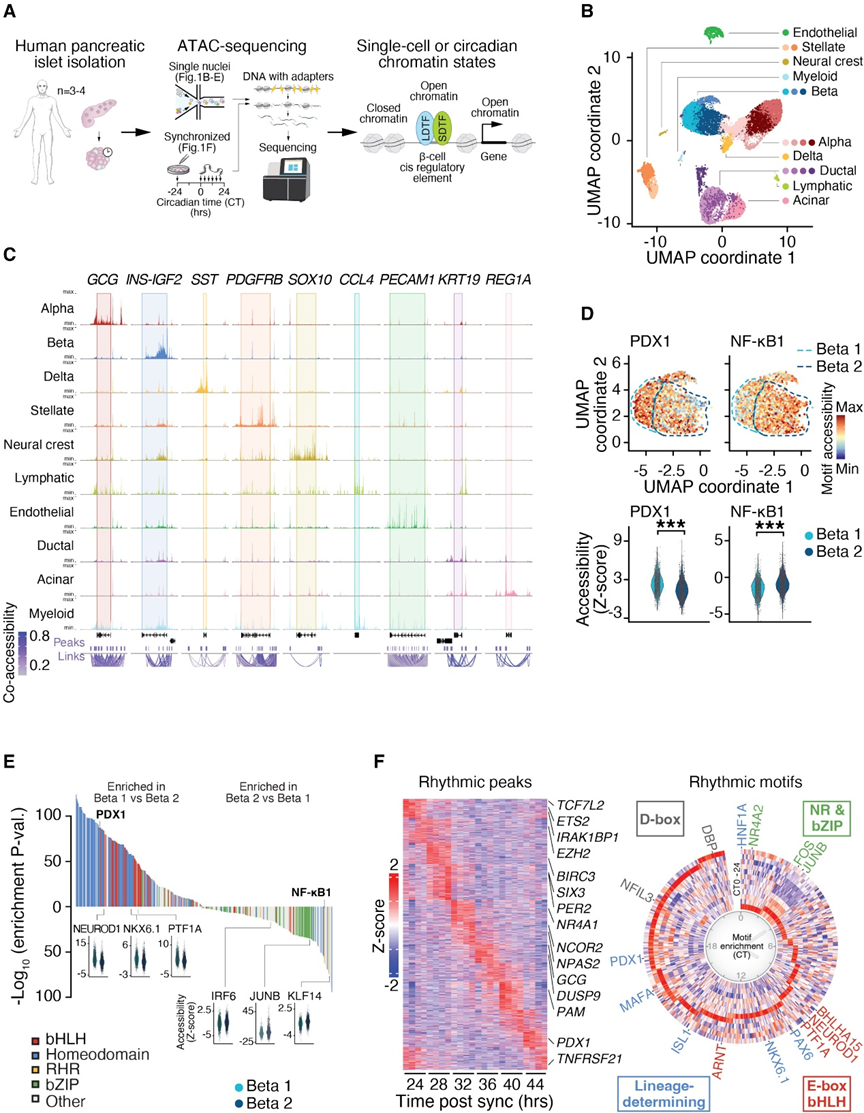
为了阐明血统和活动依赖性转录因子之间的组合相互作用如何决定 β 细胞的异质性和功能,作者使用单核酸可及性测序(snATAC-seq)在从集成胰岛分发计划(IIDP)获得的人类尸体胰岛中进行了染色质可及性和转录因子结合位点的分析(图1A)。作者在20,519个单个胰岛细胞中鉴定了334,116个可及性 CREs,并使用统一流形逼近和投影(UMAP)降维方法将它们分成19个不同的簇。这19个簇包括规范内分泌细胞类型,其中有四个α 细胞簇(a1–4)、三个β 细胞簇(b1–3)和一个δ 细胞簇(图1B),分别以染近编码葡萄糖素(GCG)、胰岛素/胰岛素样生长因子2(INS/ IGF2)和生长抑素(SST)的基因附近的染色质可及性为特征(图1C)。通过在规范细胞标记的可及性确定的其他胰岛相关细胞亚群包括星状细胞(PDGFRB)、神经嵴细胞(SOX10)、淋巴和髓系免疫细胞(CCL4)、内皮细胞(PECAM1)、导管细胞(KRT19)和腺泡细胞(REG1A)(图1B和图1C)。
snATAC-seq相较于单细胞mRNA转录组学分析的一个关键优势在于其能够检测转录因子在基因启动子和远端增强子上的调控活性。为了检查是否差异基因调控潜在地支持了β细胞的异质性,作者首先比较了b1和b2 β细胞亚簇之间的基因活性分数。这两个亚簇分别占总β细胞数量的47.2%和45.1%。作者发现了600个具有显著变异(p < 0.05)的基因,其中包括β细胞定义基因,如INS(6.45e-87)、MAFA(2.25e-50)和GLP1R(2.37e-36),以及炎症基因,如PTGER3(1.471551e-05)、IL2(5.968259e-15)和LPAR1(8.646495e-15)。使用snATAC-seq基因活性分数作为Seurat中的聚类传递锚点,对来自12个非糖尿病人类胰岛的单细胞RNA测序(GEO: GSE114297)进行分析,揭示了β1和β2亚群之间的RNA表达的log2-fold变化与染色质基因活性分数之间存在显著相关性。这些数据揭示了跨细胞类型的单细胞转录丰度和染色质可及性之间的对应关系。
为了阐明影响β细胞异质性的表观遗传机制,作者使用chromVAR识别β1与β2亚群之间的差异TF活性,以测量与TF相关的染色质可及性。比较β1和β2细胞簇之间的motif Z 分数,发现在几个β细胞LDTF(Lineage-Determining Transcription Factor)的motif上存在差异可及性,这与靠近INS基因的可及性增加相对应(图1D)。在已知的LDTF中,PDX1,胰腺发育的主要调控因子之一,是差异富集motif中最显著的之一,同时也是成熟β细胞中表达最高的TF之一(图1D、图1E)。作者进一步发现,在β1和β2细胞之间的差异可及性位点中,有58%的位点包含PDX1的motif,而在背景峰值集合中只有40%。因此,作者将这些β1和β2亚群分别称为PDX1高和PDX1低细胞。在PDX1高细胞中富集的其他TF包括已知在成熟β细胞发育中所需的NEUROD1、NKX6.1和bHLH胰腺转录因子1A(PTF1A),以及其他bHLH TF,其DNA结合motif包含分子时钟的靶标经典E-box motif(图1E)。相反,具有在INS位点低可及性的β2细胞亚簇在可及性上高度富集了可及性NF-kB1、kruppel样因子KLF14、JUNB和干扰素调节因子6(IRF6)的TF motif(padj < 0.001)(图1E),这些TF在应激、免疫应答、细胞增殖和存活期间调控炎症基因的信号诱导表达。总的来说,作者对染色质活性的单细胞测序揭示了人类胰岛内胰岛素产生细胞的双峰分布,其中一个是INS丰富簇,具有高PDX1活性,另一个是INS低簇,具有低PDX1活性,但具有NF-kB TF活性的显著富集。
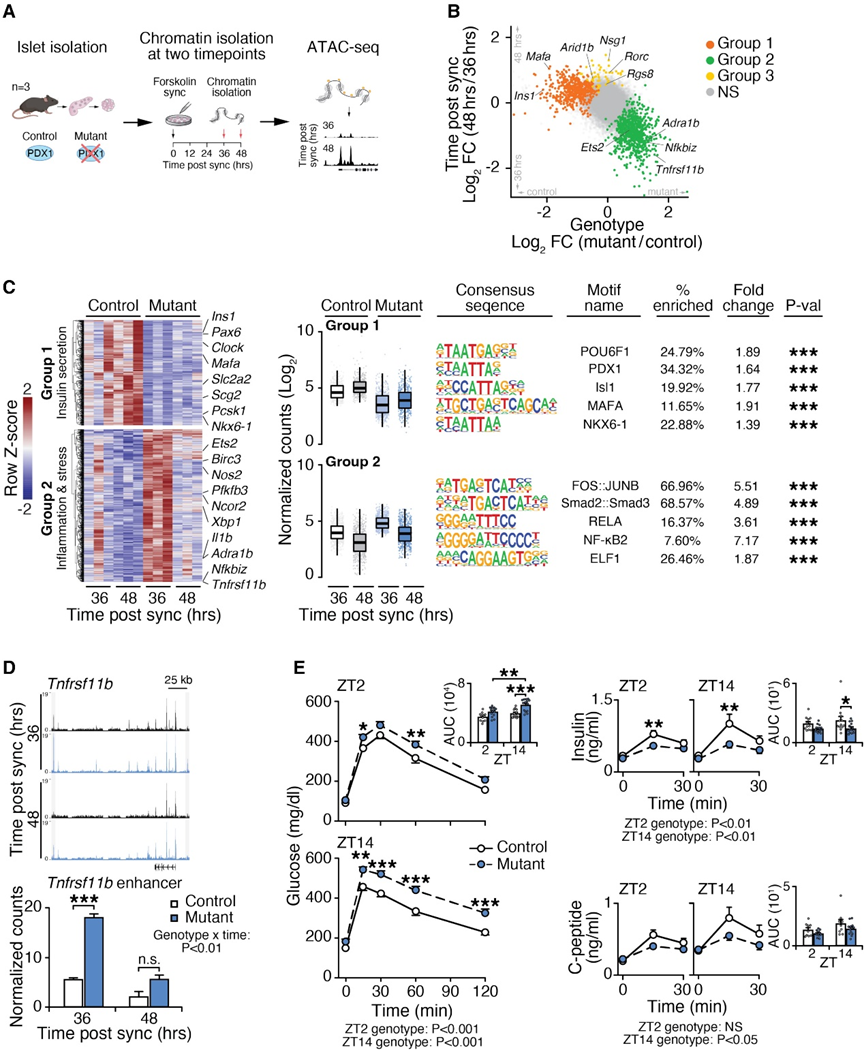
作者的数据表明, PDX1和时钟调控元素在INS丰富簇中共存,支持了PDX1和节律基因表达可能在β细胞功能中发挥作用的可能性。为了检查β细胞身份的转录调控因子是否以昼夜节律方式调控,作者通过在人类胰岛中进行ATAC-seq来评估染色质的24小时节律开放,首先使用1小时的 forskolin 脉冲同步其分子时钟。在forskolin给药后的24小时内,每4小时进行一次基因组分析,远远超过 forskolin 对染色质作用的约1小时半衰期(图1A)。作者在24小时时间序列内生成了每个捐赠者的Z分数,使用标准化的ATAC-seq计数,并使用经验Jonckheere-Terpstra-Kendall算法(eJTK_CYCLE)鉴定了全基因组的3,125个统计学上有节律的ATAC-seq峰值(图1F)。这些有节律的位点位于与胰岛细胞身份(SIX3、PDX1和GCG)、昼夜表达(PER2和NPAS2)以及炎症(ETS2和TNFRSF21)有关的基因的增强子附近。在有节律的ATAC-seq峰值处进行的TF motif富集分析表明,在TFs方面存在显著的富集(例如,PDX1、NEUROD1和PTF1A)(padj < 0.05)(图1F),这些TFs也在PDX1高细胞中富集(图1E)。总体而言,这些研究表明,PDX1和其他TF在一天中的有节奏共同激活染色质可能有助于β细胞的功能。
2、PDX1通过抑制NF-kB增强子来调控β细胞功能
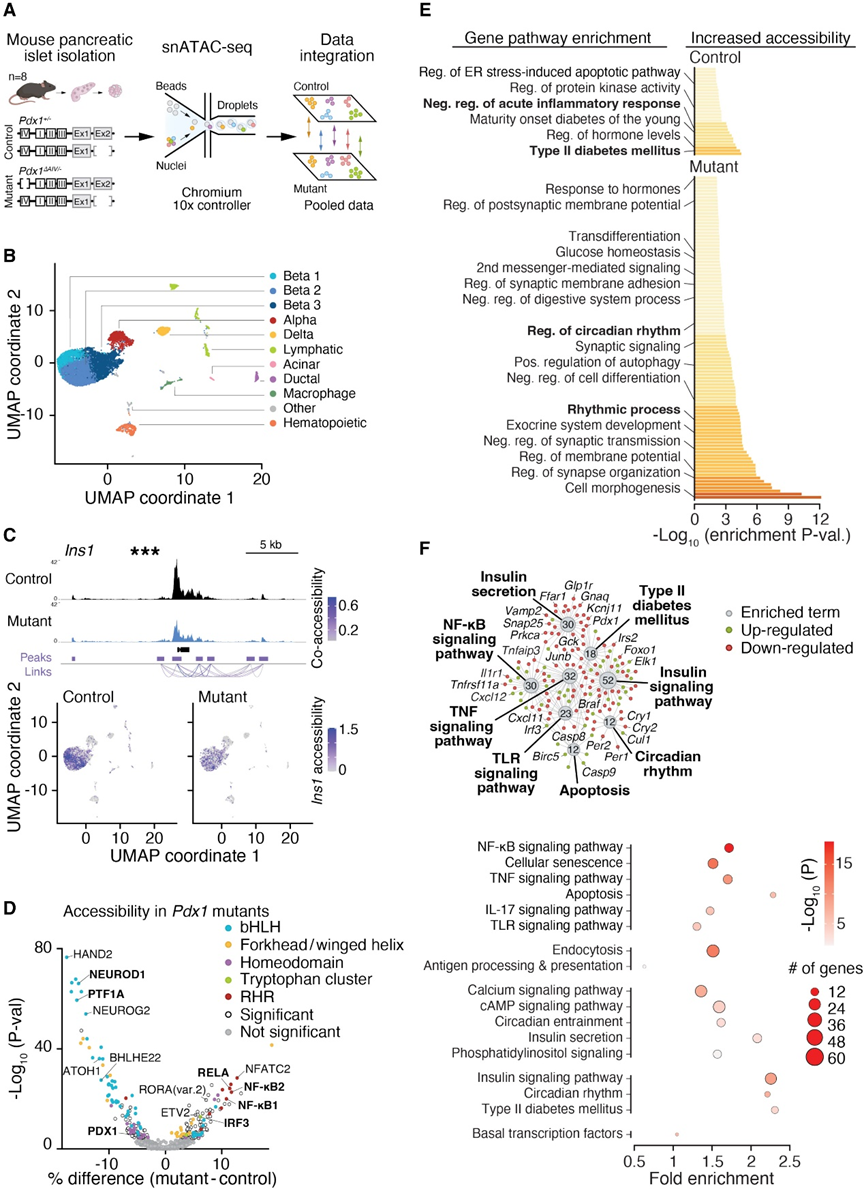
转录因子之间的相互作用在基因组的非编码调控区域内推动内分泌胰腺的身份和功能。基于在展现差异NF-kB和时钟活动模式的不同细胞群中发现PDX1活性特征的发现,作者试图通过对具有PDX1基因遗传缺陷的小鼠胰岛进行snATAC-seq分析(图2A)来剖析PDX1在控制炎症和昼夜基因网络中的功能。由于Pdx1基因敲除导致胚胎致死,作者利用携带Pdx1关键调控增强子(区域IV)内突变的第二等位基因(突变体Pdx1∆AIV/-)的杂合小鼠,其与对照的Pdx1+/-小鼠相比,发育后期表现出低胰岛素血症、葡萄糖耐量受损和减少的β细胞增殖(图2A)。使用从Pdx1∆AIV/-和对照Pdx1+/-小鼠在断奶后(10–18周龄)收集的核酸单体数据,作者鉴定了来自9,480个单个胰岛细胞的187,343个可及性CREs,并将其分为15个独特的胰岛细胞亚群,其中包括三个β细胞亚群(图2B)。这三个小鼠β细胞亚群的PDX1活性变化与作者在人类尸体胰岛中的观察相似(图1B–1E)。比较Pdx1∆AIV/-突变体和Pdx1+/-基因型的所有三个β细胞亚群中染色质可及性的集合,揭示了在1,373个唯一基因上的1,902个染色质峰值的显著改变。Pdx1区域IV增强子区域是最显著的下调非编码CRE,与该增强子的半合子性一致,其次是Ins1启动子(图2C)。来自汇总的β细胞亚群的motif分析显示,在促进β细胞功能的关键转录因子结合位点上,Pdx1∆AIV/-突变小鼠中的染色质可及性减少,包括NEUROD1、NEUROG2、PTF1A和bHLH因子(图2D),这提供了遗传证据,支持作者在人类胰岛中的发现,即PDX1高亚群与与β细胞和昼夜功能相关的转录因子相关(图1E和图1F)。相反,在Pdx1缺陷突变体中染色质可及性增加的位点含有与促炎信号有关的转录因子结合位点,包括NF-kB1、NF-kB2和RELA(图2D)。在Pdx1∆AIV/-缺陷突变体中检测到染色质景观的改变,其中促炎增加,胰岛素分泌网络减少,类似于作者在富含或贫乏PDX1和NF-kB的人类胰岛中观察到的唯一增强子签名(图1E和图1F)。基因本体路径分析进一步指示了PDX1在诱导β细胞中糖应答性胰岛素分泌的基因以及同时抑制促炎调控元件方面的作用(图2E)。
3、昼夜节律分析揭示了PDX1对NF-kB增强子活性的节律调控
观察到来自Pdx1缺陷动物的胰岛在与昼夜节律转录因子结合的增强子内显示致密染色质的现象(图2E),促使作者检查Pdx1缺陷对β细胞增强子的时间调控的影响。为了检查Pdx1∆AIV/-突变体和Pdx1+/-对照小鼠胰岛在内在昼夜周期的两个不同阶段的染色质可及性,作者将胰岛暴露于1小时的 forskolin 脉冲,并在节奏性胰岛素分泌的最低点和最高点收集胰岛(图3A)。作者按照适用于低输入样本的Omni-ATAC-seq协议进行ATAC-seq,并在所有混合样本中鉴定了132,195个唯一的可及性位点(图3A)。似然比检验(LRTs)使用DESeq2中的规范化ATAC-seq计数数据,以确定在与昼夜时间或Pdx1基因型相关方面,有1,207个显著改变的CREs(图3B和图3C)。使用这些数据在这些位点的规范化ATAC-seq计数进行的无偏主成分分析显示了与基因型和昼夜时间相关的染色质开放的不同模式。
为了在这些数据中识别这些数据之间的染色质可及性调控模式,作者进行了k均值聚类,并识别出依赖于昼夜时间和/或基因型的三个不同基因簇。group 1位点在Pdx1缺陷的胰岛中在两个时间点上的可及性减少,但在对照的胰岛中在CT48时更为显著地开放,而group 2位点在CT36时具有特异性的可及性增加,并且在Pdx1缺陷的胰岛中更为可及性增加(图3B和图3C)。group 3位点仅受昼夜时间的调控,而不受基因型的调控。与时钟和PDX1在促进胰岛素分泌方面的协同作用有关,group 1位点富集有PDX1、MAFA和NKX6.1结合位点,包括促进Ins1和Mafa表达的经典PDX1 CREs(padj < 0.001)(图3B和图3C)。相反,在group 2峰集内富集在Pdx1缺陷细胞中发生的ATAC-seq峰,出现在与炎症介质Tnfrsf11b、Nfkbiz、Il-1b以及E26转换特异性(ETS)因子Etv1和Ets2相关的位点(图3B–3D),并在NF-kB、RELA以及即刻早期复合物FOS::JUNB的结合位点中富集(图3C)。这些发现表明,Pdx1的丧失导致炎症和应激反应基因的去抑制和节奏性重编程。在Pdx1缺陷的胰岛中,编码α-细胞富集的肾上腺素受体ADRB1和ADRA1b的基因也表现出增加的昼夜变异性,表明PDX1正常通过可能涉及昼夜因素的机制抑制胰岛α细胞转录(图3B–3F)。值得注意的是,Pdx1∆AIV/-突变体中的淋巴、巨噬细胞和外分泌细胞未显示出差异的PDX1活性,表明group 2基因的增加染色质可及性不能归因于非β细胞类型的信号。最后,与group 1和group 2相反,group 3的染色质可及性仅依赖于昼夜时间(图3B、)。这些位点富集有D盒结合蛋白(DBP)。
为了确定在作者的同步ATAC-seq数据集中确定的差异染色质特征是否对应于整体动物的昼夜胰岛素分泌动力学,作者在Pdx1∆AIV/-突变体和Pdx1+/异型对照小鼠中进行了口服葡萄糖耐量试验(oGTTs),分别在白天(白天 )和夜晚(ZT14)进行。与对照小鼠相比,Pdx1∆AIV/-突变小鼠显示出明显受损的葡萄糖耐量(p < 0.0001),在夜间更为明显(图3E)。通过混合效应建模分析整体葡萄糖曲线,还发现Pdx1基因型、一天中的时间和葡萄糖水平之间存在显著的相互作用。与对照组相比,这些小鼠在两个时间点的胰岛素和C肽水平均显著降低(图3E),而在突变体中,晚上的胰岛素和C肽水平降低的幅度更大。总体而言,这些数据揭示了PDX1在整个白天通过改变分泌和促炎基因网络的控制来调节染色质紧缩、β细胞成熟和葡萄糖稳态的需求。
为了检查分子时钟是否通过控制PDX1染色质结合而对节律胰岛素分泌有贡献,作者在Bmal1敲除(KO)小鼠β细胞系(Beta-TC-6)中进行了PDX1 ChIP-seq。作者发现BMAL1的丧失在β细胞中显著降低了PDX1 DNA结合的全基因组水平,包括在控制与胰岛素分泌调节相关的基因表达的区域,如Ins1、Neurod1和Six2。因此,分子时钟的丧失导致了PDX1调节与β细胞功能相关的基因的互相受损。
4、PDX1形成长程染色质环以调控NF-kB和昼夜节律时钟增强子活性
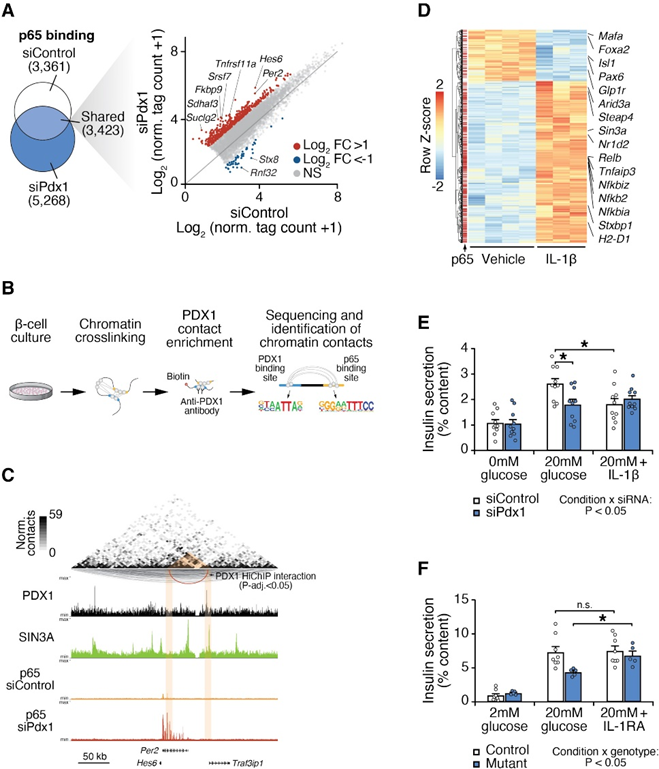
鉴于作者的观察到PDX1和NF-kB调控元素区分了成年β细胞的不同亚群(图1和2),作者试图确定PDX1是否直接全基因组抑制NF-kB。作者首先研究了PDX1耗竭如何影响p65的活性,p65是一个经典的NF-kB亚单位,使用针对PDX1的小干扰RNA(siRNA)和对照siRNA在Beta-TC-6中进行了48小时处理,并使用p65 ChIP-seq进行比较(图4A)。作者观察到PDX1的丧失在5,268个独特位点上增加了p65的全基因组占有率,尽管p65蛋白水平相似(图4A)。这种结合的增加包括NF-kB/炎症靶点,如Tnfrs11a,以及编码昼夜节律抑制子PER2的基因(图4A),与先前的研究一致。发光度分析显示,Pdx1低表达的胰岛表现出缩短的周期长度。因此,β细胞中PDX1的丧失增加了NF-kB的全基因组结合,并改变了核心时钟抑制子的表达,这表明PDX1对NF-kB的抑制反过来改变了时钟功能。
三维染色质分析揭示了LDTFs在广泛分离的基因组区域之间形成联系,以控制β细胞功能,但是是否PDX1通过远程联系来控制SDTFs尚未确定(图4B)。在Pdx1-knockdown β细胞中,p65结合位点富集在距离(>500 bp)PDX1在对照细胞类型中观察到的DNA结合位点较远的位置。因此,作者利用三维染色质构象捕获结合PDX1 ChIP-seq(HiChIP-seq)的方法来映射PDX1与远离的调控元件之间的远程相互作用(图4B)。作者鉴定了4,155个长程(>5 kb)染色质相互作用,涉及PDX1与远离的顺式调控区域之间的相互作用(图4C)。其中包括497个细胞因子诱导的、NF-kB结合位点,这些位点在IL-1b处理的β细胞中被p65 ChIP-seq鉴定为NF-kB靶点。值得注意的是,在这些环中,IL-1b诱导的p65峰值的比例比作者的小鼠胰岛ATAC-seq peak集中所有可访问CREs中NF-kB基序的背景发生率高3倍。在PDX1染色质环中,观察到一个显著的环,位于距离肿瘤坏死因子(TNF)受体相关因子3相互作用蛋白1(Traf3ip1)2.1 kb的PDX1结合位点上游和Per2基因的50 UTR内的NF-kB结合位点之间(图4C)。为了测试PDX1是否通过招募共抑制复合物在这些远离的增强子处抑制NF-kB,作者进行了带有转录共抑制剂SIN3A的染色质免疫沉淀实验,SIN3A与PDX1共同建立β细胞身份。在4,925个SIN3A结合位点中,有41%与PDX1调控的基因共定位,包括Traf3ip1和TNF相关基因,如Tnfsf4和Traf5(图4C)。此外,作者发现PDX1的丧失在全基因组范围内破坏了SIN3A染色质结合,包括在靠近编码Nfkbie的基因附近的IL-1b诱导的NFkB结合位点上降低了SIN3A的结合。
5、使用IL-1β受体拮抗剂抑制NF-kB信号可以增强PDX1缺陷的β细胞功能
人类PDX1低表达和小鼠Pdx1DAIV/缺陷β细胞均表现出在促炎网络和NF-kB靶点(如IL-1b)上增加染色质开放性的特征(图1和2)。IL-1受体(IL-1R)是胰岛β细胞中表达最高的细胞因子受体之一。暴露于IL-1b可重塑β细胞染色质景观,而IL-1b的拮抗在人类中代表了一种成熟的抗炎策略。炎症似乎也通过机制在2型糖尿病的β细胞功能障碍中起作用,尽管具体机制尚不明确。作者发现,IL-1b刺激野生型小鼠的β细胞导致经典NF-kB靶点(包括Nfkbiz和Nfkbia)的表达增加,并抑制了PDX1靶点(包括Mafa、Glp1r和Pdx1本身)的表达(图4D)。IL-1b还抑制了野生型Beta-TC-6细胞的葡萄糖刺激的胰岛素释放(图4E)。相反,使用IL-1b受体拮抗剂(IL-1RA)处理从Pdx1DAIV/缺陷小鼠中分离的胰岛,显著增强了胰岛素分泌(图4G),与通过阻断IL-1b诱导的NF-kB信号来治疗PDX1缺陷的疗效相一致。总体而言,作者的表观基因组和遗传研究表明,在与PDX1和/或时钟功能相关的β细胞失效状态中,阻断NF-kB上游的炎症可能提供一种新型的胰岛素促分泌疗法。
实验方法:
snATAC-seq、RNAscope多重分析、Bulk ATAC-seq、ChIP-seq、HiChIP-seq、RNA-seq、Pdx1 敲低、WB、胰岛素分泌测定、LumiCycle 分析。
参考文献:
Weidemann BJ, Marcheva B, Kobayashi M, et al. Repression of latent NF-κB enhancers by PDX1 regulates β cell functional heterogeneity. Cell Metab. 2024;36(1):90-102.e7.






