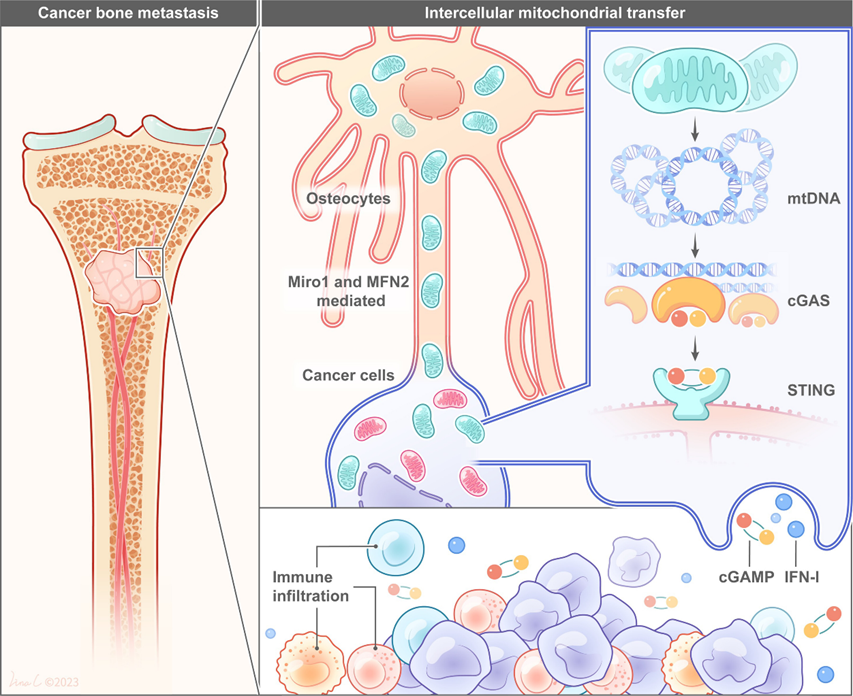
骨细胞线粒体通过STING依赖的抗肿瘤免疫抑制肿瘤发展
骨骼是多种癌症的常见转移部位,包括肺癌、乳腺癌和前列腺癌。癌症一旦转移到骨骼,几乎无法治愈,往往会导致骨骼疾病,包括骨痛、病理性骨折、神经压迫综合征,最终患者死亡。骨骼是一个高度动态的器官,它承载着多种细胞群,包括成骨细胞、破骨细胞和骨细胞。其中,骨细胞是骨中含量最丰富的细胞(>95%),是骨代谢和稳态的主要调节者。然而,骨细胞对转移性癌细胞的影响仍相对不清楚和有争议。肿瘤产生的物理力导致骨细胞的生长促进前列腺癌骨转移。骨细胞连接蛋白43半通道活性抑制乳腺癌生长和骨转移。最近的一项研究表明,骨细胞及其条件培养基(CM)可以通过Lrp5和β-catenin激活Wnt信号通路来抑制肿瘤进展和骨丢失。骨细胞有一个广泛的树突网络,使其自身之间以及与骨微环境中的其他效应细胞之间能够直接沟通。作者之前的研究发现,线粒体通过其树突网络在骨细胞之间转移,以维持骨微环境的稳态。除了作为细胞“动力源”的主要作用外,线粒体最近被视为生物能、生物合成和信号传导的细胞器。越来越多的证据表明,线粒体不仅在细胞内,而且在细胞间的信息转导中起核心作用。细胞间线粒体转移是一种普遍的生物事件,在生理和病理条件下均可发生。多项研究报道,线粒体在肿瘤细胞与其他细胞之间转移,调节肿瘤发生、治疗抵抗、免疫侵袭等。作者提出骨细胞通过其树突状网络通过细胞间线粒体转移与骨微环境中的转移性癌细胞进行交流。该研究发表在《Science Advances》,IF:13.6。
技术路线:

主要研究结果:
1. 骨细胞在骨转移过程中发挥保护作用
为了阐明骨细胞在体内转移性癌症进展中的作用,作者建立了一种转基因小鼠模型,在该模型中,出生后可以通过基于白喉毒素(DT)的细胞消融特异性靶向骨细胞。将DMP1-Cre小鼠与ROSA26-LoxP-DTR(白喉毒素受体)小鼠交配,获得DMP1-Cre iDTR小鼠。牙本质基质蛋白1(DMP1)在骨细胞和成牙本质细胞中高表达,但在成骨细胞中不表达。给DMP1-Cre iDTR小鼠注射DT会导致骨细胞死亡,对骨小梁骨量没有短期影响。为了评估骨细胞在转移性肿瘤生长中的作用,作者将LLC癌细胞注射到DMP1-Cre iDTR突变小鼠及其同窝对照iDTR小鼠(图1A)。在肿瘤植入前,小鼠注射DT以清除骨细胞。在第14天,与对照组相比,骨细胞清除小鼠的转移性肿瘤进展增加(肿瘤体积、重量)。Micro-CT(计算机断层扫描)分析显示,与对照组小鼠相比,Dmp1-Cre iDTR小鼠的骨小梁体积、骨小梁数量降低,骨小梁分离增加(图1D,E)。这些数据表明骨细胞在骨转移微环境中发挥保护作用。
接下来,为了探究骨转移微环境的细胞组成,作者使用了CAG-ZsGreen小鼠模型()。在相同的骨转移肿瘤模型中,LLC癌细胞被注射到CAG-ZsGreen小鼠腹腔内。肿瘤细胞种植后14 d处死小鼠,切除肿瘤并消化。然后,作者通过荧光激活细胞分选从CAG-ZsGreen小鼠的胫骨肿瘤中分离出浸润细胞,并使用液滴介导的单细胞RNA测序平台来分析FACS纯化的活肿瘤浸润细胞。然后作者使用Seurat(STAR方法)进行细胞分类和标记基因鉴定(图1F)。作者根据已知的细胞标志物(单核细胞/巨噬细胞、破骨细胞、中性粒细胞、T/自然杀伤细胞、成纤维细胞、内皮细胞、成骨细胞和成肌细胞),使用T分布随机邻近嵌入(T-SNE)方法识别并可视化了8个主要集群(图1G)。特别是在转移微环境中几乎没有出现骨细胞(图1H)。为了进一步研究骨转移微环境中骨细胞和癌细胞之间的相互作用,作者建立了DMP1-Cre mGmT报告小鼠。使用流式细胞术,作者观察到类似的结果,ZsGreen+浸润细胞占小鼠骨转移癌的16.10±4.55%,而tdTomato+骨细胞未出现在肿瘤中(图1I)。上述结果表明,骨转移微环境中骨细胞不能浸润到肿瘤球体中。
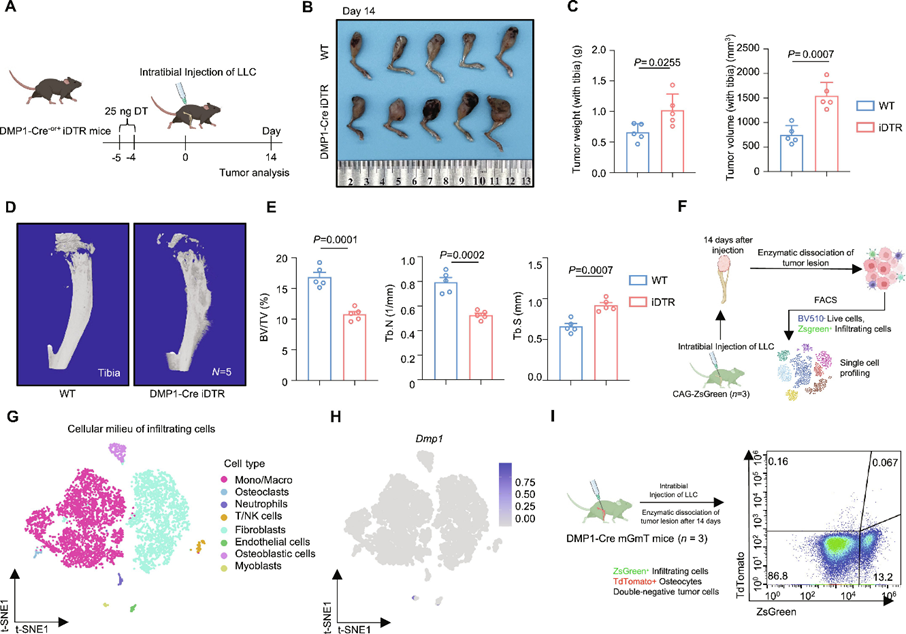
图1 骨细胞在骨转移过程中发挥保护作用
2. 骨转移时骨细胞将线粒体转移到癌细胞
接下来,作者试图探索骨细胞如何在骨转移微环境中调控癌细胞。作者之前的研究证明了骨细胞之间的树突状网络,其中线粒体共享以维持骨微环境的稳态。然后,作者向小鼠引入骨细胞特异性光激活线粒体(DMP1-PhAM),以研究骨细胞是否将线粒体转移到转移性癌细胞。用pLenti-CMV-mCherry-puro慢病毒感染LLC细胞,构建稳定表达mcherry的LLC细胞(LLC- mcherry)。将LLC-mCherry细胞接种于DMP1-PhAM小鼠胫骨或髂动脉,建立骨转移模型。14 d后处死荷瘤小鼠,分离肿瘤进行分析(图2A)。共聚焦成像显示,来自骨细胞的Dendra2+线粒体在两种骨转移模型的LLC-mCherry癌细胞中均存在(图2B),表明线粒体从骨细胞转移到转移癌细胞的细胞间转移。在骨髓中未观察到骨细胞来源的线粒体(图2B)。流式细胞术分析一致显示,肿瘤中存在双阳性细胞(mCherry +和Dendra2 +)(图2E)。此外,作者根据scRNA-seq分析,分选和鉴定了肿瘤中接受骨细胞来源线粒体的细胞(图2C)。利用已知的细胞类型特异性基因标志物,作者使用T-SNE方法显示了5个簇,包括LLC-mCherry、巨噬细胞、单核细胞、T/NK细胞和成纤维细胞。所有表达mCherry序列的簇均被归类为肿瘤细胞,这些肿瘤细胞占骨细胞来源的线粒体接受细胞的78.52%(图2D)。
近年来,人们描述了几种细胞间线粒体转移的途径,包括隧道纳米管(TNTs)、缝隙连接和微囊泡。为避免供体细胞的染料渗漏,作者用噬菌体感染骨细胞系MLO-Y4。MLO-Y4-mtDendra2慢病毒,稳定生产线粒体特异性dendra2标签蛋白(MLO-Y4-mtDendra2)。共聚焦成像显示了MLO-Y4衍生的Dendra2+线粒体在连接癌细胞和骨细胞的纳米管中的共定位(图2F)。共培养24 h后,作者在LLC-mCherry细胞的细胞质中观察到表达dendra2的线粒体(图2G)。共聚焦切片和正交视图也证实了LLC-mCherry细胞中存在表达dendra2的线粒体(图2H)。此外,流式细胞术分析显示,LLC-mCherry与MLO-Y4-mtDendra2共培养24 h后,出现新的双阳性癌细胞(图2I)。此外,作者观察到MLO-Y4细胞中表达dendra2的线粒体向LLC-mCherry细胞动态迁移(图2J)。综上所述,这些数据表明在骨转移微环境中,骨细胞通过TNT将线粒体转移到癌细胞。
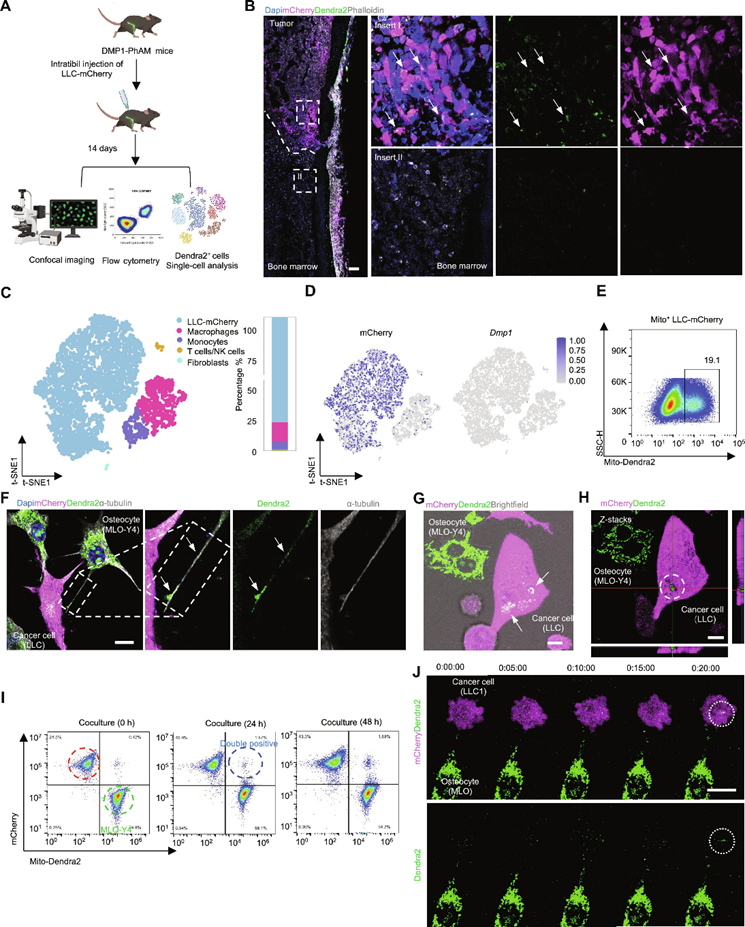
图2 骨转移时骨细胞将线粒体转移到癌细胞
3. Miro1和MFN2调控线粒体从骨细胞转移到癌细胞
据报道,线粒体Rho GTP酶1(Miro1)是TNT介导的细胞间线粒体转移的关键调节因子。此外,作者之前的研究表明,MFN2参与了骨细胞树突过程中线粒体的动态运动。为了确认MFN2和Miro1在骨细胞和癌细胞之间的细胞间线粒体转移中的作用,作者用或特异性的短发卡RNA(shRNA)转染MLO-Y4-mtDendra2细胞。作者观察到,沉默或在MLO-Y4-mtDendra2细胞中降低了向LLC-mCherry细胞的细胞间线粒体转移水平,这是在共培养24小时后通过流式细胞术测定的(图3A,B)。在MLO-Y4-mtDendra2细胞过表达或在MLO-Y4-mtDendra2细胞中观察到线粒体转移显著增加(图3C,D)。
为了研究MFN2或Miro1在体内对骨细胞和癌细胞之间线粒体转移的影响,作者在DMP1-PhAM小鼠的背景下构建了两种骨细胞条条性缺失或在骨细胞中的小鼠模型。作者向8周龄的DMP1-PhAM、DMP1-PhAM和DMP1-PhAM对照小鼠腹腔内注射LLC-mCherry。14 d后处死小鼠,切除肿瘤进行进一步分析。共聚焦成像显示,在条条性去除或后,从骨细胞转移到mcherry标记的LLC癌细胞的dendra2标记的线粒体显著减少(图3E,F)。与这些结果一致,流式细胞术分析显示,在条条性去除或在骨细胞中,双阳性癌细胞显著减少(图3G,H)。这些发现表明MFN2和Miro1参与介导骨细胞和癌细胞之间的线粒体转移。
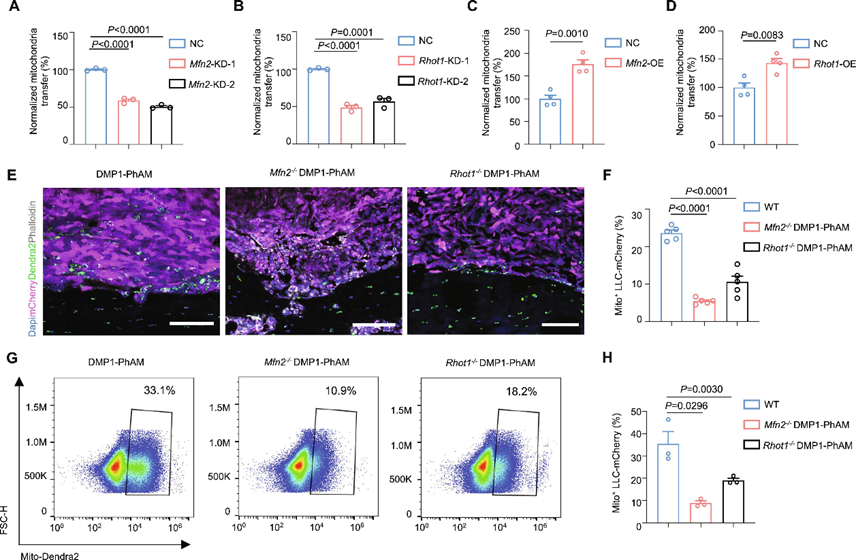
图3 Miro1和MFN2调控线粒体从骨细胞转移到癌细胞
4. 骨细胞线粒体抑制骨转移癌进展
为了研究骨细胞线粒体对体内癌细胞转移的影响,作者将LLC癌细胞注射到8周龄的Dmp1Cre Mfn2−/−、Dmp1Cre Rhot1−/−小鼠和同周龄的野生型对照小鼠体内。如图4A所示,与对照组相比,抑制来自骨细胞的线粒体转移促进了骨转移癌的进展(肿瘤重量、体积,图4b)。与野生型对照相比,肿瘤相关胫骨的Micro-CT分析证实了溶骨性病变的存在,并表明在线粒体转移受到抑制后,骨小梁体积和骨小梁数量减少(图4C,D)。然后,作者用CMV-mCherry-Luc-杀稻菌素慢病毒感染LLC细胞,以建立稳定表达荧光素酶的LLC细胞。将LLC-mCherry-Luc细胞注入10周龄Dmp1Cre Mfn2−/−、Dmp1Cre Rhot1−/−小鼠和同周龄野生型对照小鼠的髂动脉,建立另一种骨转移模型。作者在胫骨内模型中发现了类似的趋势,即与对照野生型小鼠相比,小鼠和小鼠的骨转移进展增加(图4E,F)。
此外,正如免疫印迹所示,MFN2在皮质骨蛋白中的水平随着年龄的增长而下降(图4G)。作者还观察到,与年轻(1月龄)小鼠相比,在老年(18月龄)小鼠的皮质骨中,线粒体运输相关基因的表达降低(图4H)。然后,作者将LLC-mCherry植入年轻(2个月)、成熟(6个月)和老年(18个月)DMP1-PhAM小鼠的胫骨内。转移性肿瘤的共聚焦成像显示,DMP1-PhAM小鼠中,随着年龄的增长,细胞间线粒体从骨细胞转移到癌细胞的数量持续下降(图4I,J)。此外,作者发现,与成熟和年轻小鼠相比,老年小鼠的胫骨内肿瘤进展增加(肿瘤重量、体积)。作者的数据显示,骨细胞线粒体转移到癌细胞抑制骨微环境中的骨转移癌症进展。随着年龄的增长,细胞间线粒体转移水平降低,这可能在骨微环境中参与了骨转移癌的进展。
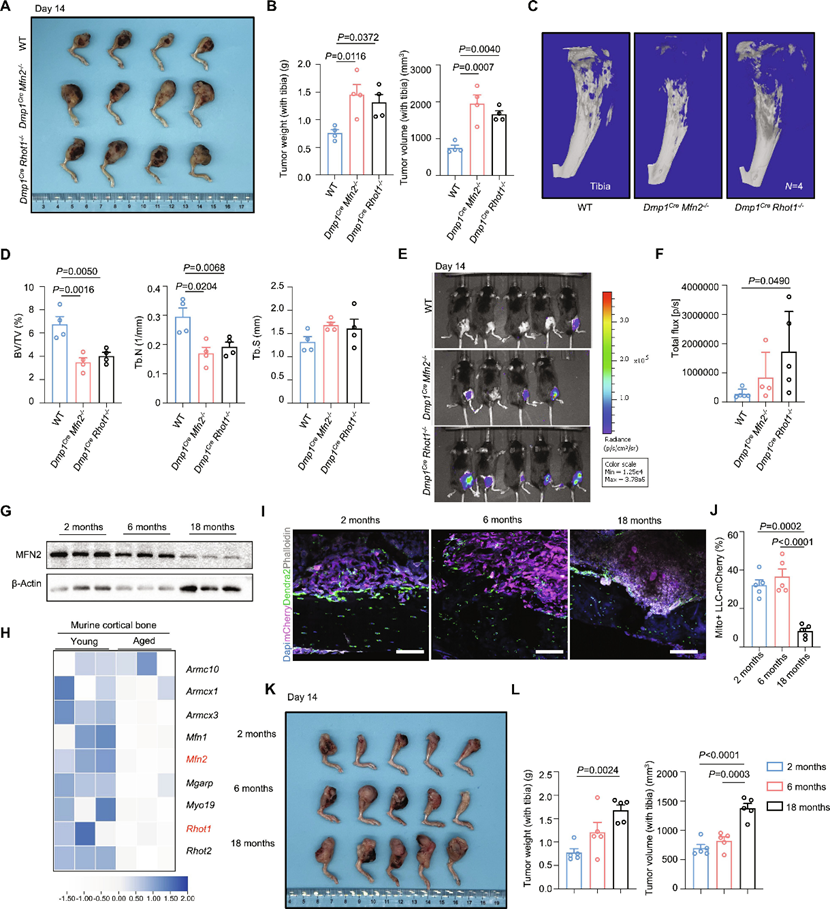
图4 骨细胞线粒体抑制骨转移癌进展
5. 骨细胞线粒体通过cGAS增加癌细胞胞质mtDNA并激活STING通路
线粒体DNA(mtDNA)是一种有效的损伤相关分子模式(DAMP),已被报道可激活cGAS/STING固有免疫通路。为了测试外源性线粒体是否转移到受体细胞,并激活cGAS/STING通路,作者应用MitoCeption人工和定量转移线粒体到癌细胞。
作者将骨细胞线粒体移植到LLC细胞中,24小时后进行亚细胞分离。通过定量聚合酶链反应检测细胞内和细胞核中含有线粒体特异性基因和细胞核特异性基因的DNA相对水平。作者发现,与对照组相比,线粒体移植组线粒体的细胞质mtDNA显著增加(图5A)。共聚焦成像还显示,在接受骨细胞线粒体的细胞中,线粒体外细胞质中的双链DNA信号更显著(图5B)。骨细胞线粒体移植到LLC细胞中导致了cGAS/STING的激活,如pSTING、pTBK1、pIRF3和下游核因子κB(NF-κB)pP65水平显著升高所示(图5C)。与此同时,通过MitoCeption进行线粒体转移后,sting依赖性促炎基因的表达显著上调(图5D)。癌细胞中观察到的STING通路的激活被敲低(KD)消除(图5C,D)。此外,作者从小鼠、小鼠和野生型对照小鼠的髂内动脉模型中分离出癌细胞,并在野生型小鼠中检测到类似的STING依赖性促炎基因表达显著上调的趋势(图5E)。这些结果表明,骨细胞线粒体可以在癌细胞中激活cGAS/STING通路。
根据以往的报道,BAX在调控线粒体释放mtDNA中起着关键作用。因此,作者从KD MLO-Y4细胞中分离线粒体,并将其转移到LLC癌细胞中。作者发现来自KD MLO-Y4细胞的线粒体不能增加细胞质mtDNA癌细胞的水平(图5F)。此外,作者发现,在接受来自KD MLO-Y4细胞线粒体的LLC细胞的线粒体部分中,mtDNA水平显著增加(图5G)。这些结果表明,mtDNA从骨细胞线粒体释放到癌细胞胞浆是依赖于BAX的。
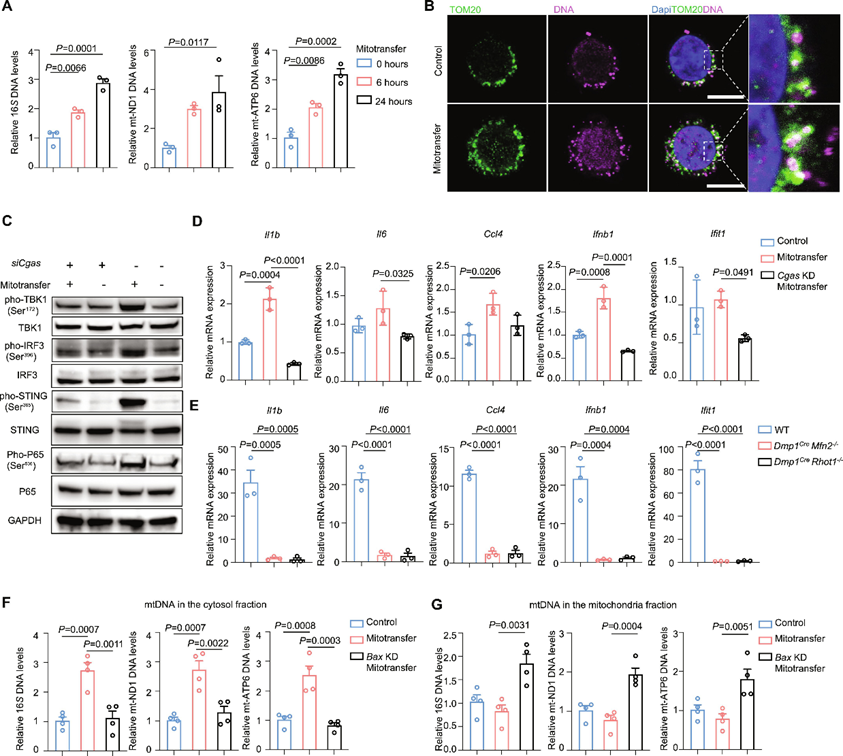
图5 骨细胞线粒体增加癌细胞胞质mtDNA,并通过cGAS激活STING
6. 骨细胞线粒体可提高肿瘤免疫原性,诱导抗肿瘤免疫
最近的研究报道,癌细胞中cGAS/STING的激活导致二核苷酸cGAMP的产生,触发树突状细胞和巨噬细胞中STING通路的激活,进而诱导CD8+ T和NK保护性抗肿瘤免疫。接下来,作者试图探索抑制细胞间线粒体转移后免疫微环境的变化。为了全面了解免疫微环境成分的变化,作者分离了荷瘤Dmp1Cre Mfn2−/−、Dmp1Cre Rhot1−/−小鼠和野生型对照的肿瘤,然后进行了scRNA-seq。在分选出CD45+的免疫细胞后,作者使用T - sne方法,根据已知的细胞标志物,识别并可视化了8个主要簇:T细胞、B细胞、NK细胞、中性粒细胞、DCs、单核细胞、巨噬细胞和细胞(图6A,B)。作者观察到T细胞比例增加。在Dmp1Cre Mfn2−/−和Dmp1Cre Rhot1−/−小鼠中,作者一致地检测到肿瘤浸润免疫细胞显著减少(图6C,E-G)。接下来,作者进行了基于9-plex珠链的检测,以定量骨转移微环境中的炎症介质水平。体内细胞间线粒体转移受到抑制后,几种关键的炎症细胞因子(包括白细胞介素-1α(IL-1α)、IL-1β和IL-18)、生长因子和趋化因子减少(图6I),表明骨转移微环境中的免疫激活较弱。根据经典标志物,作者将髓系细胞重新聚集成12个亚组,包括大多数被鉴定为单核细胞/巨噬细胞(80%~90%)的细胞和少数(<20%)被鉴定为DCs(图6J)。与野生型对照组相比,Dmp1Cre Mfn2−/−、Dmp1Cre Rhot1−/−组的DC亚组,包括常规1型DCs (cDC1),常规2型DCs(cDC2),迁移DCs(mDCs)和浆细胞样DCs(pDCs)的总比例均下降(图6K和L)。通过流式细胞术分析,作者观察到肿瘤浸润DCs的总比例下降(图6D和H)。DCs是一组在肿瘤微环境中刺激淋巴细胞启动抗肿瘤反应的特异性抗原提呈细胞。为了进一步监测这些肿瘤浸润DCs的活化状态,作者发现在Dmp1Cre Mfn2−/−、Dmp1Cre Rhot1−/−组中,一系列DC成熟标志物在cDC1s中均下调(图6M)。综上所述,这些数据表明,抑制细胞间线粒体从骨细胞转移到癌细胞促进骨转移癌的进展和减少免疫浸润,使“热”肿瘤变成“冷”肿瘤。
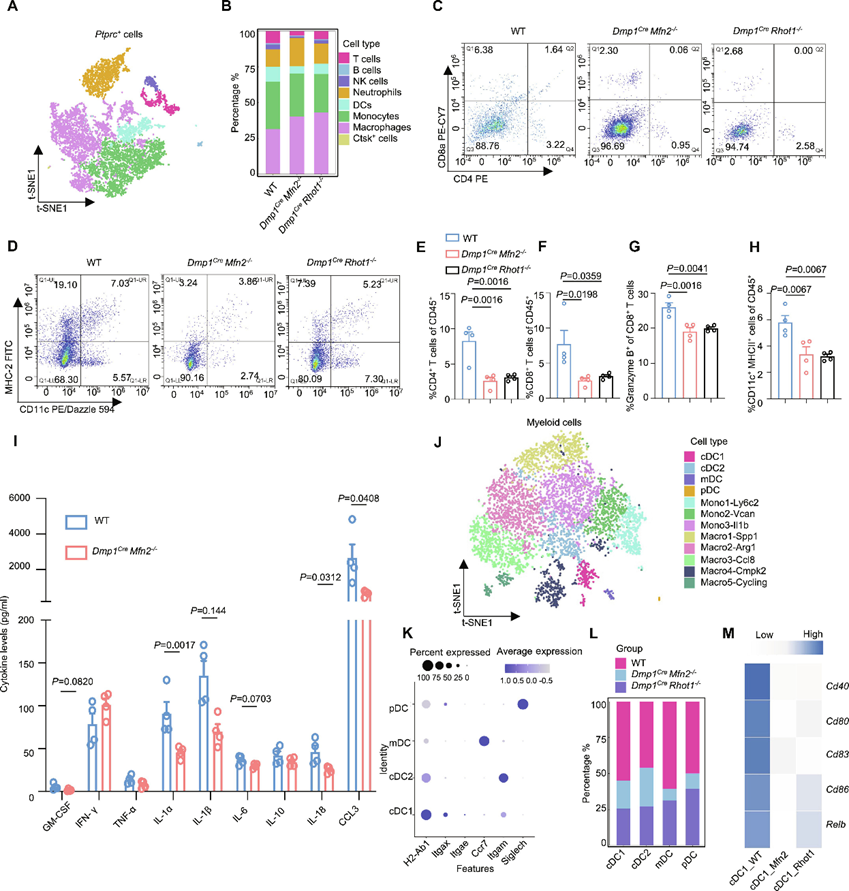
图6 骨细胞线粒体可提高肿瘤免疫原性,诱导抗肿瘤免疫
结论:
该研究提供了一个可能的视角来理解年龄诱导的骨微环境的变化如何影响癌细胞的生物学行为和癌症患者的进一步临床结局。未来的工作将需要研究是否调节骨细胞线粒体可能代表骨转移治疗的治疗靶点。
实验方法:
细胞培养,小鼠实验,骨细胞消融,肿瘤移植,生物荧光成像,细胞转染,线粒体分离和人工转移,线粒体DNA分离和转染,海马耗氧量,亚细胞分离,DNA提取和mtDNA拷贝数分析,流式细胞术和FACS,单细胞RNA测序,原始数据处理、质量控制和下游分析,蛋白质印迹分析,组织病理学,包埋染色,免疫荧光,细胞成像与分析,Micro-CT analysis,RNA提取和实时PCR
参考文献:
Zhou H, Zhang W, Li H, Xu F, Yinwang E, Xue Y, et al. Osteocyte mitochondria inhibit tumor development via STING-dependent antitumor immunity. Sci Adv. 2024 Jan 19;10(3):eadi4298. doi: 10.1126/sciadv.adi4298.






