组蛋白乳酸化增强的ALKBH3通过m1A去甲基化促进肿瘤进展
虽然N1 -甲基腺苷(m1A)RNA修饰是RNA代谢的重要调节因子,但m1A修饰在肿瘤发生中的作用仍不清楚。在本研究中,作者发现组蛋白乳酸化通过去除SP100A的m1A甲基化,增强ALKBH3的表达,同时减少肿瘤抑制性早幼粒细胞白血病蛋白(PML)凝集物的形成,促进癌症的恶性转化。在机制上,YTHDF1负责识别m1A甲基化SP100A转录物,从而提高其RNA稳定性和翻译效率。该研究于2023年12月发表在《NUCLEIC ACIDS RESEARCH》,IF:14.9。
技术路线:
主要研究结果:
1. ALKBH3 在眼部黑色素瘤中的特异性增高与不良预后有关
为了确定m1A修饰在眼部黑色素瘤发病机制中的作用,首先比较了眼部黑色素瘤样本(3个CoM样本和3个UM样本)和4个对照痣样本的总体m1A修饰水平。值得注意的是,眼黑色素瘤样本的m1A水平明显降低,这一点已通过抗m1A点印迹检测得到证实(图1A和B)。此外,去甲基化酶ALKBH3在肿瘤中的蛋白表达也增加了(图1C-E),这与眼黑色素瘤中m1A水平降低的发现一致。此外,ALKBH3的升高与不良预后有关(图1F),这进一步强调了ALKBH3在眼部黑色素瘤癌变过程中的重要性。一致的是,与正常色素细胞(PIG1)相比,大多数黑色素瘤细胞系(MUM2B、OCM1、OMM2.3、OMM1、MEL290、92.1、CRMM1、CRMM2、CM2005.1)的m1A水平显著下降(图1G和H),ALKBH3水平显著升高(图1I-K)。此外,高通量转录组测序进一步证实了ALKBH3在眼黑色素瘤细胞系中的上调(图1L)。重要的是,在这些细胞中,ALKBH3与m1A水平呈显著负相关,表明上调的ALKBH3是m1A水平降低的原因(图1M)。
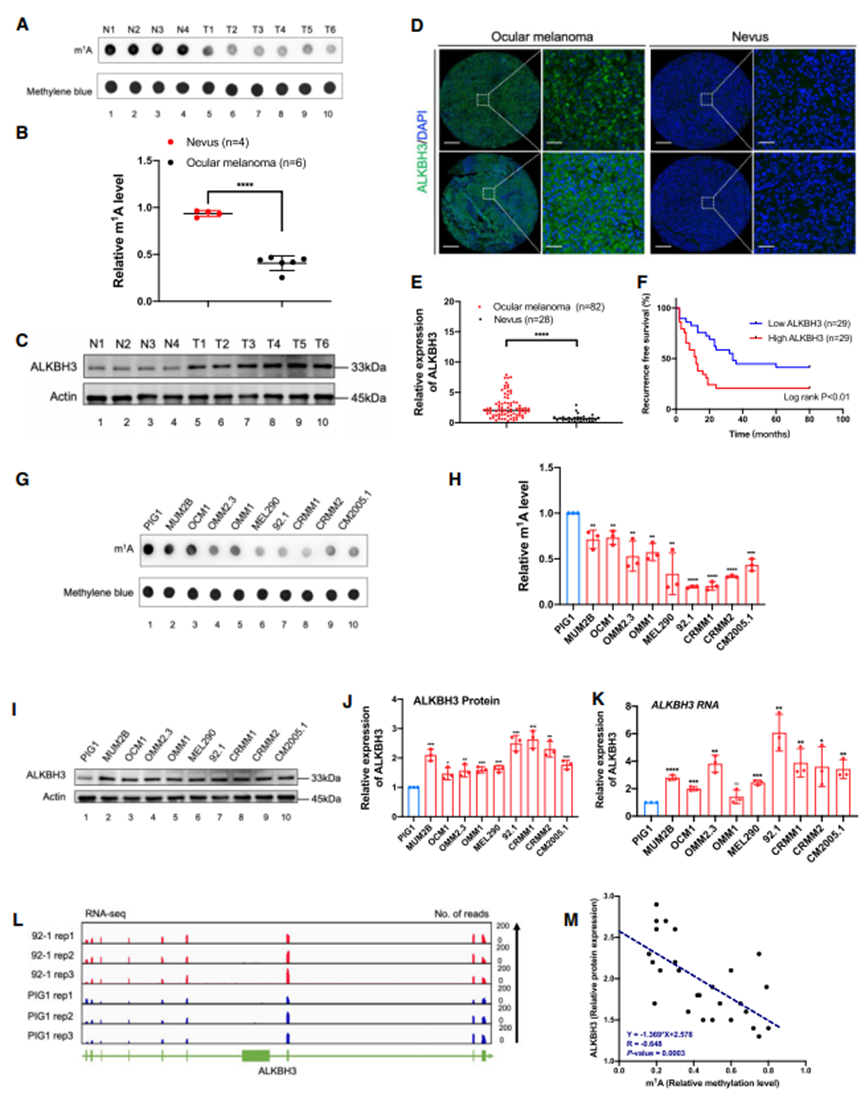
图1. 眼部黑色素瘤的ALKBH3表达增加,m1A水平降低,与存活率低有关
2. ALKBH3 在体外和体内加速眼部黑色素瘤的致癌过程
为了探索 ALKBH3 的致癌功能,使用两种 shRNAs 沉默ALKBH3 的表达(图 2A 和 B)。结果发现,ALKBH3 缺失的细胞中 m1A 水平明显升高(图 2C)。此外,在所有测试的眼黑色素瘤细胞中,ALKBH3沉默导致细胞生长(图2D)和集落形成能力(图2E和F)显著减弱。此外,如 Transwell 试验所示,敲除 ALKBH3 会导致迁移能力下降(图 2G 和 H)。这些数据证明了ALKBH3是眼黑色素瘤体外恶性增殖和转移的必要致癌因子。为了评估它们在体内形成肿瘤的能力,将对照组和ALKBH3沉默的92.1黑色素瘤细胞(荧光素酶标记)注射到裸鼠体内,并在正位异种移植模型中监测肿瘤的生长。生物发光成像显示,ALKBH3缺陷眼黑色素瘤细胞的信号强度比对照细胞弱(图2I)。此外,ALKBH3沉默组的异种移植物平均重量减少了80%(图2J)。总之,这些实验证明了ALKBH3在体外和体内眼黑色素瘤的肿瘤发生过程中起着致癌作用。
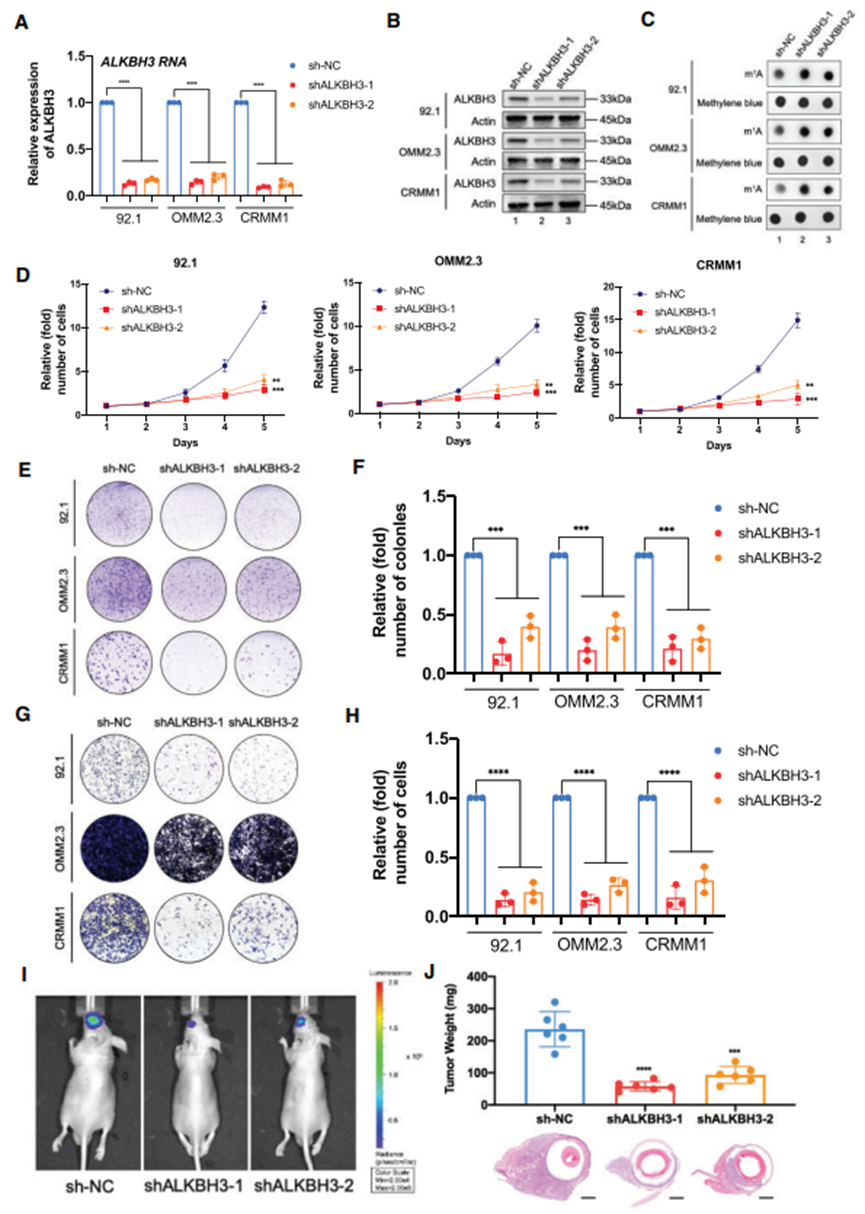
图2. 敲除 ALKBH3 可提高 m1A 水平并抑制眼部黑色素瘤的发生
3. 组蛋白乳酸化可促进 ALKBH3 的过度表达
为了确定ALKBH3表达增加的分子基础,查询TCGA数据库,筛选与ALKBH3表达模式相似的基因。乳酸生成酶LDHA和LDHB与ALKBH3呈显著正相关,表明ALKBH3与乳酸之间存在关联(图3A和B)。然后,验证了眼部黑色素瘤队列中泛乳化和组蛋白乳酸化标记(H3K18la)之间的表达模式,结果显示它们与ALKBH3蛋白的表达呈显著的正相关(图3B和C)。更重要的是,H3K18la的CUT&Tag和ChIP-seq分析都表明,在ALKBH3的启动子区域捕获到了强大的组蛋白乳酸化信号(存于GEO数据库:GSE242019,图3D和E)。此外,组蛋白乳酸化抑制剂(草铵膦酸盐和 2-DG)和 LDHA/B 抑制剂都会导致 ALKBH3 启动子区域的组蛋白乳酸化水平急剧下降(图 3F),进而在所有测试的黑色素瘤细胞中消减 ALKBH3 的 RNA(图 3G)和蛋白水平(图 3H-J)。
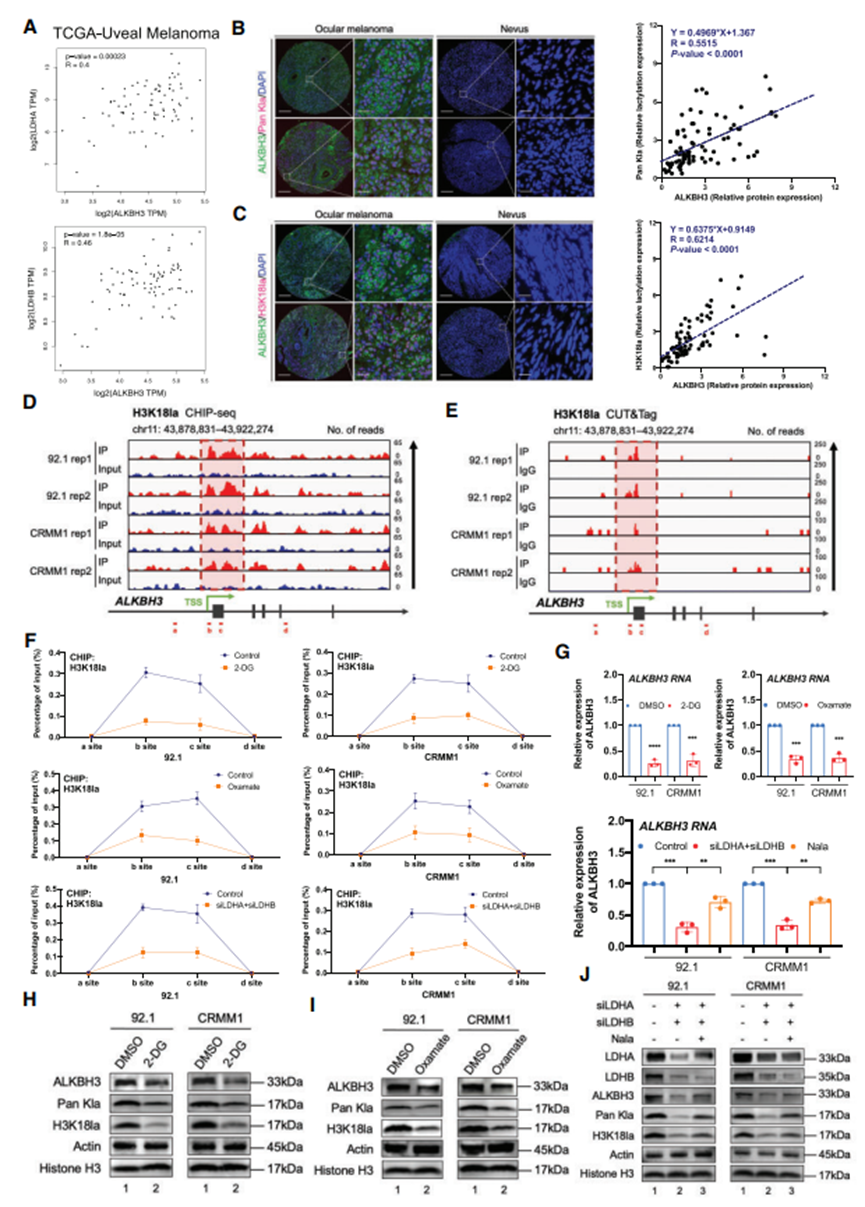
图3. 组蛋白乳化可促进 ALKBH3 的表达
4. 多组学筛选确定 SP100A 为 ALKBH3 的下游候选者
由于ALKBH3负责去除RNA中的m1A修饰,首先对眼部黑色素瘤细胞和正常黑色素细胞进行m1A-MeRIP-seq分析(存于GEO数据库:GSE213748,图4A)。结果,从正常细胞和肿瘤细胞产生的m1A-MeRIP-seq文库中分别鉴定出了平均16 864个和10 212个m1A峰(图4A和B,蓝框)。此外,在沉默 ALKBH3 后,对 92.1 黑色素瘤细胞系进行了一系列全面的高通量筛选,包括 m1A-MeRIP-seq(存入 GEO 数据库:GSE213748,图 4C,棕色框)、RNA-seq(存入 GEO 数据库:GSE213681,图 4D 和 E,绿色框)和蛋白质组分析(iTRAQ,图 4F): 对 92.1 黑色素瘤细胞系进行蛋白质组分析(iTRAQ,图 4F)。同样,m1A修饰位点的变化明显富集于肿瘤相关通路,包括PI3K-Akt信号转导、病灶粘附和蛋白多糖合成(图4C)。此外,沉默 ALKBH3 导致基因表达水平发生了显著变化,上调基因达 199 个,下调基因达 74 个(图 4D 和 E,存于 GEO 数据库:GSE213681)。同样,蛋白质组水平也发生了巨大的全基因组变化(149个蛋白上调,67个蛋白下调,图4F),进一步强调了ALKBH3在眼部黑色素瘤发病机制中的重要性。
有趣的是,结合这些多组学数据注意到,在眼黑色素瘤细胞中沉默ALKBH3后,核自身抗原斑点蛋白100(SP100)在mRNA和蛋白质水平上都上调了,而m1A修饰水平也发生了巨大变化(图4G-M)。值得注意的是,SP100 负责 PML 核体的形成,主要作为各种癌症类型的肿瘤发生抑制因子,包括黑色素瘤、胶质母细胞瘤、细肌肉瘤、乳腺癌和喉癌。这一观察结果与在 ALKBH3 基因缺陷细胞中观察到的抑制效果相吻合。m1A-MeRIP-seq(存入 GEO 数据库:GSE213748,图 4I)和 m1A-MeRIP-qPCR (图 4J)都表明,眼部黑色素瘤细胞中的 m1A 修饰水平在 ALKBH3 抑制后得到恢复。通过 RNA-seq(存于 GEO 数据库:GSE213681,图 4K)和 qPCR(图 4L)验证了抑制 ALKBH3 后 SP100 在 mRNA 水平上显著上调。Western 印迹检测(图 4M)显示,SP100 在 ALKBH3 抑制细胞中的蛋白水平也有所增加。总之,这些数据表明,ALKBH3可能会通过去除其m1A修饰来抑制SP100的表达水平。
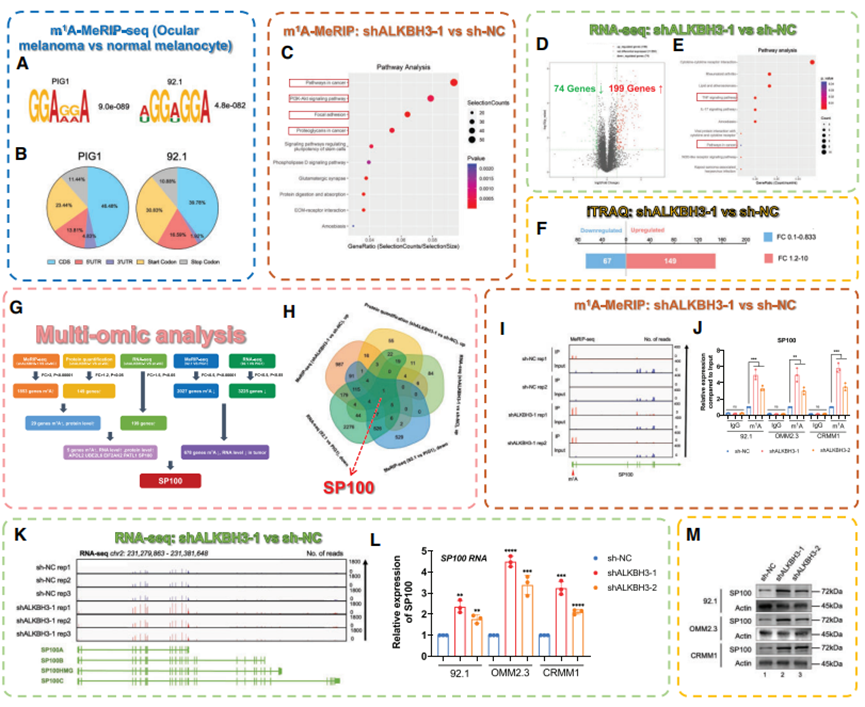
图4. ALKBH3 通过去除 SP100 的 m1A 修饰抑制其表达
5. SP100A 是眼部黑色素瘤的肿瘤抑制因子
从眼部黑色素瘤细胞(92.1)和正常黑色素细胞(PIG1)获得的 RNA-seq 数据显示,SP100A 中的信号很突出,而 SP100A 未包含的外显子中的信号则可以忽略不计(图 5A)。此外,使用各种引物进行了 qPCR。这些引物包括一组专为 SP100A 设计的引物(称为 SP100-P1)和另一组检测 SP100B、SP100C 和 SP100HMG 的引物(称为 SP100-P2)。在眼部黑色素瘤细胞和正常色素细胞中观察到了 SP100A 的 RNA 表达(图 5B)。这些结果表明,SP100A 在实验环境中大量表达,而其他同工酶(SP100B、SP100C 和 SP100HMG)的表达则微乎其微。值得注意的是,通过RNA-seq(图5A)、qPCR(图5B)和Western印迹检测(图5C)发现,与正常色素细胞相比,眼黑色素瘤细胞中SP100A的RNA表达水平也明显下降。为了全面揭示 SP100A 在眼部黑色素瘤中的功能,测定了 SP100A 在眼部黑色素瘤临床样本中的表达。值得注意的是,SP100A在眼部黑色素瘤样本中的表达量明显下降(图5D和E)。更重要的是,在作者队列(图5F)和TCGA队列(图5G)中,SP100A的缺失与不利的预后有关。
过表达 SP100A 后,所有受测的眼黑色素瘤细胞的增殖能力都减弱了(图 5H)。此外,与对照组相比,过表达 SP100A 的黑色素瘤细胞形成的菌落更小更少(图 5I 和 J)。此外,在眼部黑色素瘤细胞中引入 SP100A 后,还观察到癌症转移能力受到明显抑制(图 5K 和 L)。随后评估SP100A过表达细胞中PML的表达情况。结果,外源过表达 SP100A 导致 PML 蛋白水平显著升高(图 5M)。总之,这些功能增益数据揭示了SP100A负责PML核凝聚体的形成,是眼癌的肿瘤抑制因子。
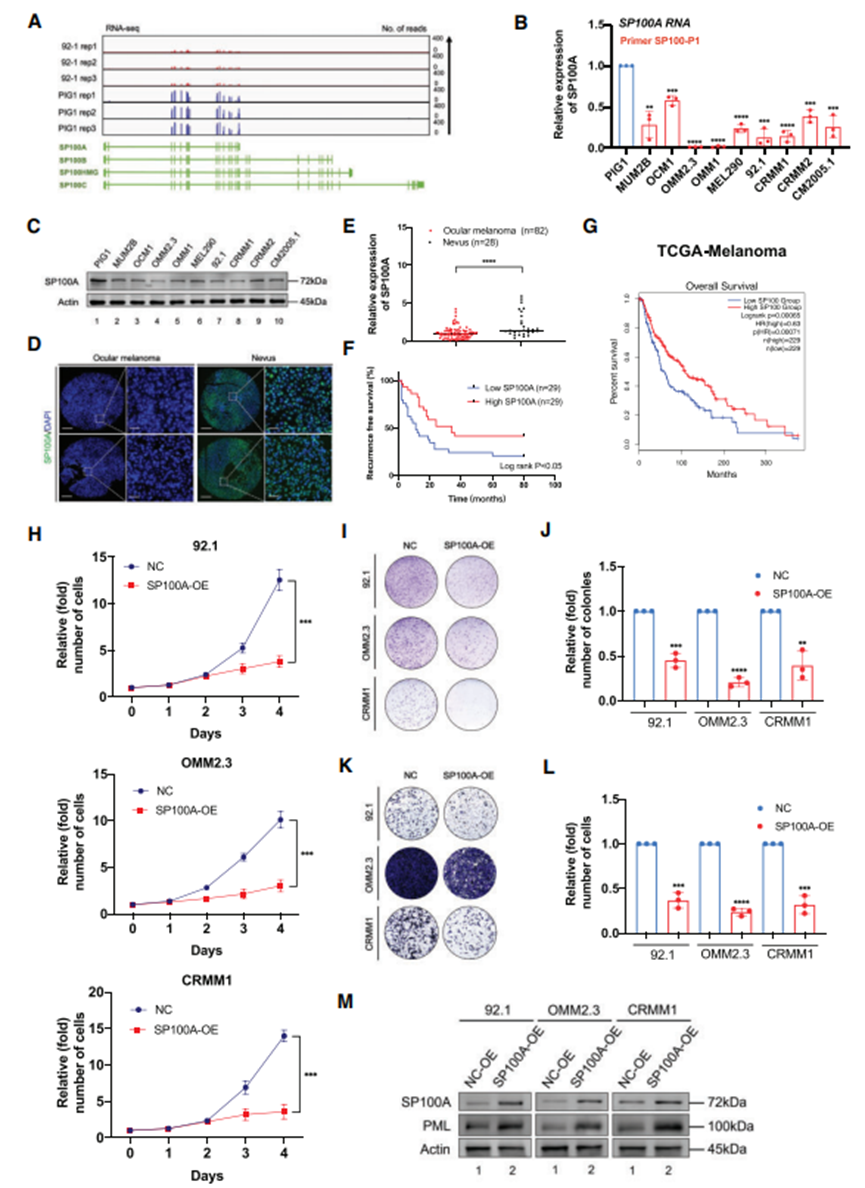
图5. SP100A 在眼部黑色素瘤中发挥肿瘤抑制因子的作用
6.沉默SP100A会部分削弱ALKBH3缺陷细胞的肿瘤抑制效果
转染 SP100A-shRNA 到三个眼黑色素瘤细胞,在细胞生长过程中,SP100A的缺失部分(50%~60%)挽救了ALKBH3抑制作用(图6A,红线),SP100A缺失的细胞对ALKBH3缺失的抵抗力更强(图6A)。同样,SP100A沉默的细胞比对照组出现更多的菌落(图6B,红色和橙色柱)。此外,抑制SP100A可显著增强细胞迁移能力,并影响ALKBH3缺陷黑色素瘤细胞的抑制效果(图6C)。最重要的是,SP100A的敲除进一步挽救了ALKBH3缺失黑色素瘤细胞的正位肿瘤形成(图6D和E)。同样,在野生型(图 6F,泳道 1 和 3)和 ALKBH3 缺失型眼黑色素瘤细胞(图 6F,泳道 2 和 4)中,稳定敲除 SP100A 会导致 PML 表达受损。这些结果表明,ALKBH3 通过减少 SP100A 介导的体内和体外 PML 体来促进眼黑色素瘤。。
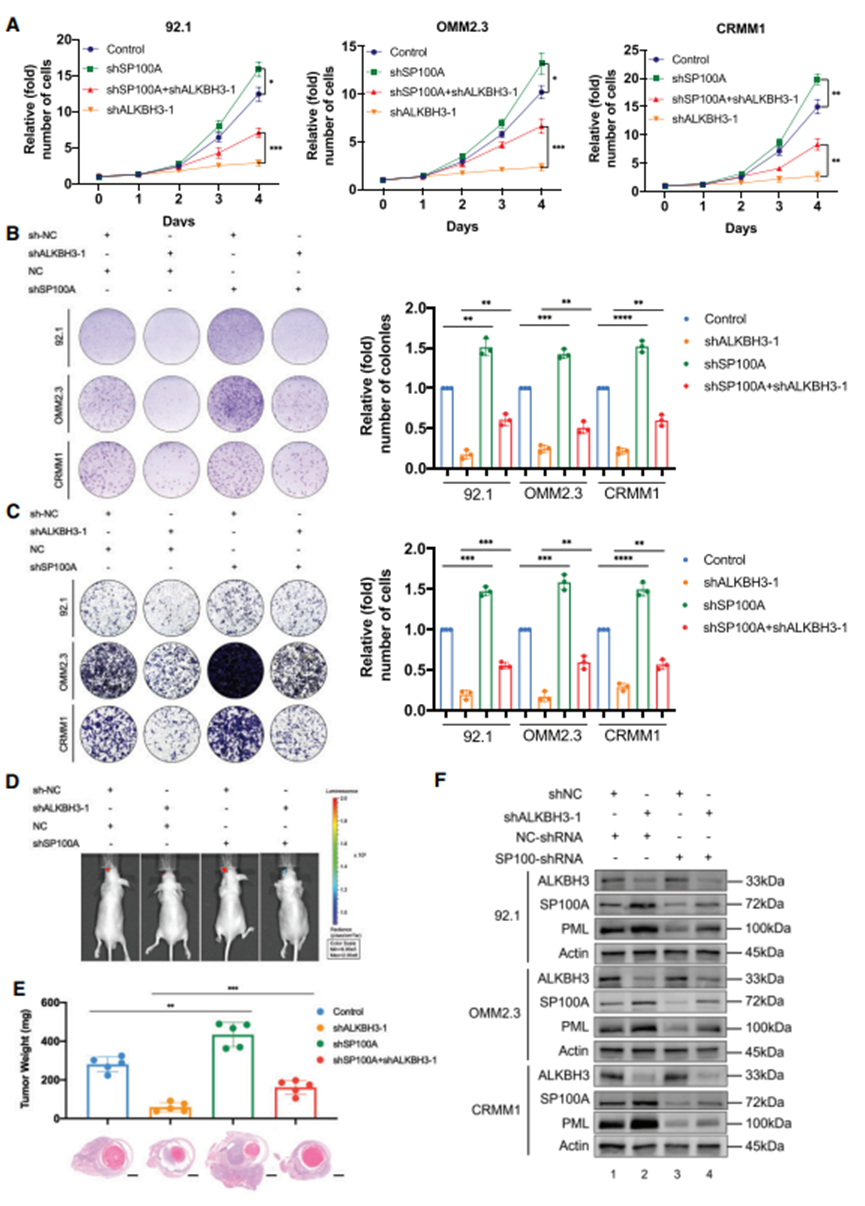
图6. SP100A沉默可部分阻断ALKBH3敲除的抗癌作用
7. SP100A 的 m1A 修饰可增强其 RNA 稳定性和翻译功效
检测SP100A mRNA 与 YTHDF1、YTHDF2 和 YTHDF3 的 RNA 结合情况。RNA免疫沉淀分析表明,YTHDF1能特异性地识别SP100A mRNA;然而,YTHDF2和YTHDF3仅表现出有限的相互作用强度(图7A)。此外,在TCGA队列中,YTHDF1与SP100A的表达呈显著正相关(R = 0.61,P< 0.0001)(图7B),这与YTHDF1是识别SP100A的必要条件这一假设完全吻合。此外,YTHDF1沉默可显著抑制SP100A的表达,并完全挽救ALKBH3沉默介导的SP100A水平升高(图7C和D)。综上所述,这些数据表明 YTHDF1 起着 SP100A 阅读蛋白的作用。
然后,确定SP100A mRNA 的特定 m1A 修饰位点。在 SP100A 的 5′ UTR 中,根据确定的峰值找到了五个潜在的 m1A 位点(图 4I,)[c.44A(TGTGG)、c.54A(AGACG)和 c.67A (TGAGG),以及 c.92A/c.93A (GGAAG)],并将每个 A 突变为一个 A。 A (TGAGG),以及 c. 92A/c. 93A (GGAAG)],并将每个 A 突变为 T。然后我们将相应的野生型和突变的 5′ UTR 克隆到 pmirGLO 载体中(图 7E,上面板)。荧光素酶报告基因检测表明,c.A92T 的信号减弱,而其他突变组的信号保持不变(图 7E)。此外,ALKBH3 缺失的细胞中 SP100A 的 RNA 稳定性增强,这与 ALKBH3 缺失后 SP100A RNA 表达增加的结果一致(图 7F)。重要的是,92.1 细胞中的多聚体分析表明,稳定敲除 ALKBH3 会导致多聚体部分的 SP100A mRNA 丰度明显提高(图 7G),而多聚体部分通常具有有效的翻译能力。总之,这些结果表明,SP100A mRNA 的 m1A RNA 甲基化有助于提高转录后的 RNA 稳定性和翻译能力。
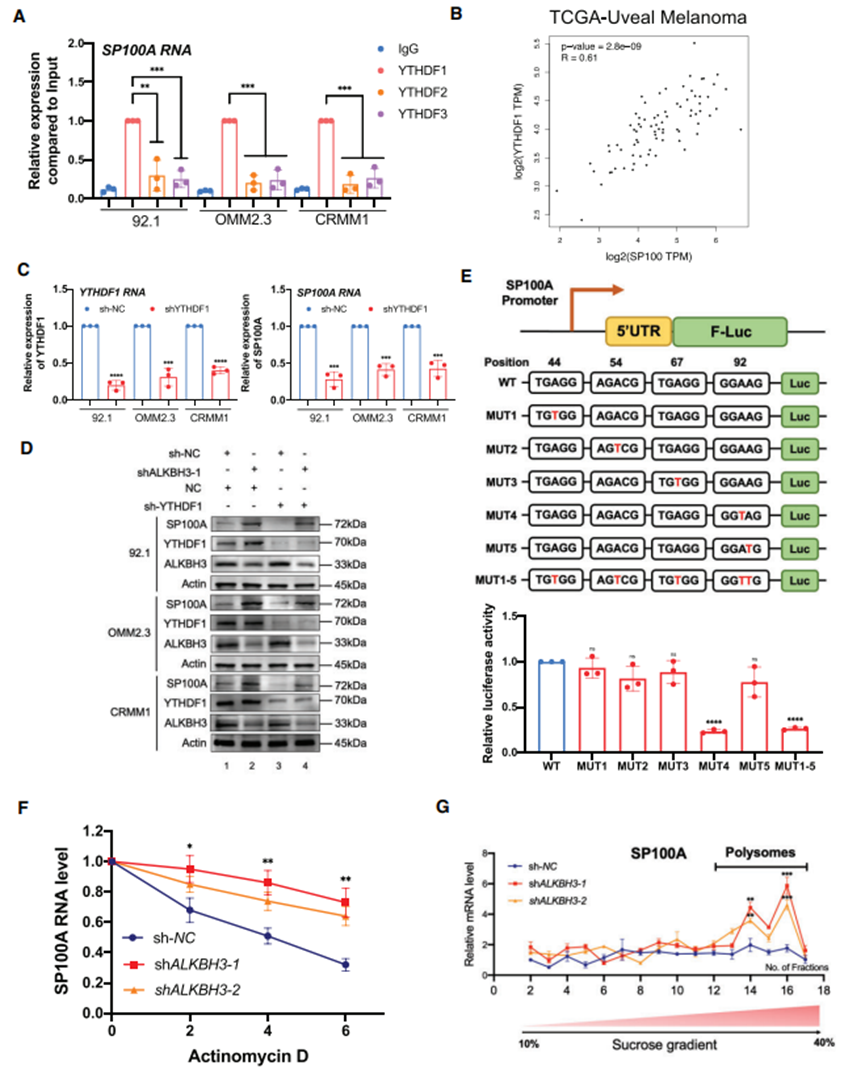
图7. SP100A 的 m1A 修饰增加了其 RNA 的稳定性和翻译效率
结论
综上所述,本研究初步证明了m1A的修饰对于肿瘤抑制基因的表达是必要的,扩展了目前对m1A在肿瘤进展过程中动态功能的理解。此外,这些结果表明,乳酸驱动的ALKBH3对PML核凝聚物的形成是必不可少的,这弥补了我们对m1A修饰,代谢重编程和相分离事件的知识。
实验方法:
细胞培养,点印记,免疫荧光,WB,RNA提取和qRT-PCR,质粒构建,慢病毒的包装和稳定细胞系的产生,细胞增殖,克隆形成,Transwell,异种移植物模型,ChIP-seq,CUT&Tag,MeRIP-seq,RNA-seq,iTRAQ蛋白组学分析,RIP-qPCR,荧光素酶报告实验,多肽体谱
参考文献
Gu X, Zhuang A, Yu J, Yang L, Ge S, Ruan J, Jia R, Fan X, Chai P. Histone lactylation-boosted ALKBH3 potentiates tumor progression and diminished promyelocytic leukemia protein nuclear condensates by m1A demethylation of SP100A. Nucleic Acids Res. 2023 Dec 20: gkad1193. doi: 10.1093/nar/gkad1193. Epub ahead of print. PMID: 38118002.






